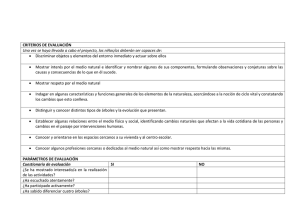
MONOGRAFÍAS DE ESPECIES FORESTALES PARA
Anuncio

MONOGRAFÍAS DE ESPECIES FORESTALES PARA PLANTACIONES COMERCIALES EN CLIMA TROPICAL DE MICHOACÁN H. Jesús Muñoz Flores, J. Trinidad Sáenz Reyes y Agustín Rueda Sánchez Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias Centro de Investigación Regional Pacífico Centro Campo Experimental Uruapan Uruapan, Michoacán Septiembre de 2012 Libro Técnico Núm. 15 ISBN: 978-607-425-862-2 SECRETARÍA DE AGRICULTURA, GANADERÍA, DESARROLLO RURAL, PESCA Y ALIMENTACIÓN Lic. Francisco Javier Mayorga Castañeda Secretario MC. Mariano Ruiz-Funes Macedo Subsecretario de Agricultura Ing. Ignacio Rivera Rodríguez Subsecretario de Desarrollo Rural Ing. Ernesto Fernández Arias Subsecretario de Alimentación y Competitividad MSc. Jesús Antonio Berumen Preciado Oficial Mayor Biol. Esteban Cruzaley Díaz Barriga Delegado Estatal en Michoacán INSTITUTO NACIONAL DE INVESTIGACIONES FORESTALES, AGRÍCOLAS Y PECUARIAS Dr. Pedro Brajcich Gallegos Director General Dr. Salvador Fernández Rivera Coordinador de Investigación, Innovación y Vinculación MSc. Arturo Cruz Vázquez Coordinador de Planeación y Desarrollo Lic. Marcial A. García Morteo Coordinador de Administración y Sistemas Lic. Ricardo Noverón Chávez Director General Adjunto de la Unidad Jurídica CENTRO DE INVESTIGACIÓN REGIONAL PACÍFICO CENTRO Dr. Gerardo Salazar Gutiérrez Encargado de la Dirección Regional del CIRPAC MC. Primitivo Díaz Mederos Director de Planeación y Desarrollo Lic. Miguel Méndez González Director de Administración Dr. Ignacio Vidales Fernández Director de Coordinación y Vinculación en el estado de Michoacán y Jefe del Campo Experimental Uruapan MONOGRAFÍAS DE ESPECIES FORESTALES PARA PLANTACIONES COMERCIALES EN CLIMA TROPICAL DE MICHOACÁN H. Jesús MUÑOZ FLORES Investigador de la Red de Plantaciones y Sistemas Agroforestales. Campo Experimental Uruapan. CIRPAC. INIFAP. J. Trinidad SÁENZ REYES Investigador de la Red de Plantaciones y Sistemas Agroforestales. Campo Experimental Uruapan. CIRPAC. INIFAP. Agustín RUEDA SÁNCHEZ Investigador de la Red de Plantaciones y Sistemas Agroforestales. Campo Experimental Altos de Jalisco. CIRPAC. INIFAP. INSTITUTO NACIONAL DE INVESTIGACIONES FORESTALES, AGRÍCOLAS Y PECUARIAS CENTRO DE INVESTIGACIÓN REGIONAL PACÍFICO CENTRO CAMPO EXPERIMENTAL URUAPAN Libro Técnico Núm. 15 Septiembre de 2012 MONOGRAFÍAS DE ESPECIES FORESTALES PARA PLANTACIONES COMERCIALES EN CLIMA TROPICAL DE MICHOACÁN No está permitida la reproducción total o parcial de esta obra, ni la transmisión de ninguna forma o por cualquier medio, ya sea electrónico, mecánico, por fotografía, copia, por registro u otros métodos, sin la autorización previa y por escrito de los titulares del derecho de autor. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias Progreso 5, Barrio de Santa Catarina Delegación Coyoacán C. P. O4010 México, D. F. Teléfono: (55) 38 71 87 00 www.inifap.gob.mx Correo-e: [email protected] Primera edición: Septiembre de 2012 Impreso en México Printed in México ISBN: 978-607-425-862-2 Libro Técnico Núm. 15 Septiembre de 2012 Código de publicación UNESCO-INIFAP-SAGARPA: MX-0-310605-52-05-27-06-15 Centro de Investigación Regional Pacífico Centro Campo Experimental Uruapan Av. Latinoamericana Núm. 1101, Col. Revolución C. P. 60150 Uruapan, Michoacán. México Tel: (452) 523 7392 Fax: (452) 524 4095 La presente publicación se terminó de imprimir en el mes de Septiembre de 2012 en los talleres de la Comisión Forestal del Estado de Michoacán. Calle Justo Mendoza. Bosque Cuauhtémoc Lote 11, Col. Centro C. P. 58000. Morelia, Mich. Teléfono: (443) 312-30-26 y 3-12-3742, Fax: (443) 3-12-39-06 Su tiraje consta de 500 ejemplares La cita correcta de ésta publicación es: Muñoz F. H. J.; Sáenz R. J. T. y Rueda S. A. 2012. Monografías de especies forestales para plantaciones comerciales en clima tropical de Michoacán. Libro Técnico Núm. 15. SAGARPA-INIFAP-CIRPAC-Campo Experimental Uruapan. Uruapan, Michoacán, México. 202 p. PRESENTACIÓN Michoacán se caracteriza por su riqueza cultural y social, así como por su gran variedad de recursos naturales, resultado de su contrastante orografía y situación geográfica, que se manifiesta en una gran diversidad biológica. Sin embargo, el cambio de uso del suelo, clandestinaje, incendios, plagas y enfermedades, han afectado seriamente las áreas tropicales. Por otro lado, la industria forestal requiere alta demanda de materias primas forestales y la mayoría de las plantaciones forestales se han establecido con fines de restauración. Estos factores establecen la necesidad de implementar estrategias tecnológicas, como las plantaciones comerciales para la obtención de productos maderables, aunque debe destacarse que también incidirían en la protección y conservación de los recursos asociados al bosque. Por las características de suelos y climas en Michoacán, las plantaciones forestales comerciales son una alternativa para aumentar la productividad, recuperar el entorno ecológico, lograr beneficios para los recursos asociados al bosque como la fauna, mantos acuíferos, entre otros, en las que se utilicen diversas especies con objetivos claros, densidades adecuadas y manejo silvícola. Por lo anterior, previamente deberán resolverse problemas de orden técnico, como la recopilación de información sobre especies promisorias para plantaciones forestales comerciales en las condiciones agroecológicas del Estado. En este marco, la Comisión Forestal del Estado de Michoacán (COFOM) y con el apoyo económico de la SEMARNAT a través del Programa de Desarrollo Institucional Ambiental (PDIA), solicitó al Campo Experimental Uruapan del Centro de Investigación Regional Pacífico Centro del INIFAP, la realización de un proyecto para determinar áreas potenciales para el establecimiento de plantaciones forestales comerciales en el estado de Michoacán, en el que se incluyó la revisión bibliográfica de Enterolobium cyclocarpum (Jacq) Griseb., Cedrela odorata Lamb.,Tabebuia rosea (Bertol) DC., Brosimum alicastrum Swarts, Acrocarpus fraxinifolius Wight & Arn y Tectona grandis L. F. En este estudio se realizó una revisión bibliográfica con énfasis en el conocimiento y la tecnología generada en Michoacán y posteriormente a nivel nacional e internacional, para el caso de las especies nativas. Se recomienda que la selección de la (s) especie (s) para plantaciones forestales comerciales, se realice en base a las áreas potenciales, su productividad y rentabilidad, demanda del mercado y valor ecológico. En el caso de las especies exóticas o introducidas, como Acrocarpus fraxinifolius y Tectona grandis, previo al establecimiento de plantaciones masivas, es deseable que se realice ensayos de especies y/o procedencias, considerando los resultados de la evaluación en plantaciones ya establecidas, así como la detección de problemas fitosanitarios. Los autores CONTENIDO Página CAPÍTULO 1. Acrocarpus fraxinifolius Wight & Arn 1 1.1. DESCRIPCIÓN DE LA ESPECIE 2 1.1.1. Nombre común 2 1.1.2. Taxonomía 2 1.1.3. Forma 2 1.1.4. Corteza 2 1.1.5. Ramas 3 1.1.6. Hojas 3 1.1.7. Inflorescencia 3 1.1.8. Flores 3 1.1.9. Fruto 4 1.2. DISTRIBUCIÓN Y HÁBITAT 5 1.2.1. Distribución geográfica 5 1.2.2. Clima 5 1.2.3. Altitud y topografía 6 1.2.4. Suelos 6 1.2.5. Vegetación asociada 6 1.3. SILVICULTURA 7 1.3.1. Bosques naturales 7 1.3.2. Floración y fructificación 7 1.3.3. Producción y diseminación de semilla 7 1.3.4. Tolerancia a factores ambientales 8 1.3.5. Plagas 8 1.3.6. Enfermedades 9 1.3.7. Edad de rotación, turno 10 1.3.8. Regeneración natural 10 1.4. PRÁCTICAS DE VIVERO 10 1.4.1. Manejo y almacenamiento de semillas 10 1.4.2. Germinación 11 1.4.3. Prácticas de cultivo 11 1.5. ESTABLECIMIENTO Y MANEJO DE PLANTACIONES 17 1.5.1. Preparación del sitio de plantación 17 1.5.2. Plantación y espaciamiento 17 1.5.3. Cultivo de las plantaciones 18 1.5.4. Crecimiento y rendimiento volumétrico 19 1.5.5. Plantaciones agrosilvopastoriles 21 1.6. MEJORAMIENTO GENÉTICO 22 1.7. PROPIEDADES Y USOS 24 1.7.1. Propiedades físico-mecánicas de la madera 24 1.7.2. Usos 25 CAPÍTULO 2. Brosimum alicastrum Swarts 28 2.1. DESCRIPCIÓN DE LA ESPECIE 29 2.1.1. Nombre común 29 2.1.2. Taxonomía 29 2.1.3. Especies relacionadas 29 2.1.4. Forma 30 2.1.5. Corteza 30 2.1.6. Hojas 30 2.1.7. Flores 31 2.1.8. Frutos 32 2.2. DISTRIBUCIÓN Y HÁBITAT 32 2.2.1. Distribución geográfica 32 2.2.2. Clima 34 2.2.3. Altitud y topografía 34 2.2.4. Suelos 36 2.2.5. Vegetación asociada 42 2.3. SILVICULTURA 44 2.3.1. Bosques naturales 44 2.3.2. Floración y fructificación 46 2.3.3. Producción y diseminación de semilla 46 2.3.4. Densidad 47 2.3.5. Tolerancia a factores ambientales 47 2.3.6. Plagas 48 2.3.7. Enfermedades 48 2.3.8. Sistemas y prácticas silvícolas 48 2.3.9. Crecimiento y rendimiento volumétrico 50 2.3.10. Regeneración natural 51 2.4. PRÁCTICAS DE VIVERO 51 2.4.1. Recolección y almacenamiento de semillas 51 2.4.2. Germinación 52 2.4.3. Prácticas de cultivo 52 2.5. ESTABLECIMIENTO Y MANEJO DE PLANTACIONES 53 2.5.1. Preparación del sitio de plantación 53 2.5.2. Plantación y espaciamiento 53 2.5.3. Cultivo de las plantaciones 54 2.5.4. Crecimiento y rendimiento volumétrico 55 2.5.5. Plantaciones agrosilvopastoriles 55 2.6. PROPIEDADES Y USOS 57 2.7.1. Propiedades físico-mecánicas de la madera 57 2.7.2. Usos 60 CAPÍTULO 3. Cedrela odorata Lamb. 67 3.1. DESCRIPCIÓN DE LA ESPECIE 68 3.1.1. Nombre común 68 3.1.2. Taxonomía 68 3.1.3. Especies relacionadas 69 3.1.4. Forma 70 3.1.5. Corteza 70 3.1.6. Hojas 70 3.1.7. Flores 71 3.1.8. Frutos 72 3.2. DISTRIBUCIÓN Y HABITAT 73 3.2.1. Distribución geográfica 73 3.2.2. Clima 73 3.2.3. Altitud y topografía 74 3.2.4. Suelos 75 3.2.5. Vegetación asociada 75 3.3. SILVICULTURA 76 3.3.1. Bosques naturales 76 3.3.2. Floración y fructificación 76 3.3.3. Producción y diseminación de semilla 77 3.3.4. Tolerancia a factores ambientales 78 3.3.5. Densidad 78 3.3.6. Plagas 79 3.3.7. Enfermedades 81 3.3.8. Sistemas y prácticas silvícolas 82 3.3.9. Crecimiento y rendimiento volumétrico 82 3.3.10. Edad de rotación, turno 83 3.3.11. Regeneración natural 83 3.4. PRÁCTICAS DE VIVERO 84 3.4.1. Recolección y almacenamiento de semillas 84 3.4.2. Germinación 85 3.4.3. Prácticas de cultivo 86 3.5. ESTABLECIMIENTO Y MANEJO DE PLANTACIONES 88 3.5.1. Preparación del sitio de plantación 88 3.5.2. Plantación y espaciamiento 89 3.5.3. Cultivo de las plantaciones 90 3.5.4. Crecimiento y rendimiento volumétrico 91 3.5.5. Plantaciones agrosilvopastoriles 91 3.6. MEJORAMIENTO GENÉTICO 93 3.7. PROPIEDADES Y USOS 96 3.7.1. Propiedades físico-mecánicas de la madera 96 3.7.2. Usos 96 CAPÍTULO 4. Enterolobium cyclocarpum (Jacq) Griseb. 98 4.1. DESCRIPCIÓN DE LA ESPECIE 99 4.1.1. Nombre común 99 4.1.2. Taxonomía 99 4.1.3. Especies relacionadas 99 4.1.4. Forma 99 4.1.5. Corteza 100 4.1.6. Hojas 100 4.1.7. Flores 100 4.1.8. Frutos 101 4.2. DISTRIBUCIÓN Y HABITAT 102 4.2.1. Distribución geográfica 102 4.2.2. Clima 103 4.2.3. Altitud y topografía 104 4.2.4. Suelos 104 4.2.5. Vegetación asociada 104 4.3. SILVICULTURA 105 4.3.1. Bosques naturales 105 4.3.2. Floración y fructificación 105 4.3.3. Producción y diseminación de semilla 106 4.3.4. Tolerancia a factores ambientales 106 4.3.5. Densidad 106 4.3.6. Enemigos naturales 107 4.3.7. Plagas 107 4.3.8. Enfermedades 109 4.3.9. Sistemas y prácticas silvícolas 109 4.3.10. Crecimiento y rendimiento volumétrico 110 4.3.11. Edad de rotación, turno 110 4.3.12. Regeneración natural 111 4.4. PRÁCTICAS DE VIVERO 111 4.4.1. Recolección y almacenamiento de semillas 111 4.4.2. Germinación 112 4.4.3. Prácticas de cultivo 112 4.5. ESTABLECIMIENTO Y MANEJO DE PLANTACIONES 113 4.5.1. Preparación del sitio de plantación 113 4.5.2. Plantación y espaciamiento 114 4.5.3. Cultivo de las plantaciones 114 4.5.4. Crecimiento y rendimiento volumétrico 114 4.5.5. Plantaciones agroforestales 115 4.6. MEJORAMIENTO GENÉTICO 115 4.7. PROPIEDADES Y USOS 116 4.7.1. Propiedades físico-mecánicas de la madera 116 4.7.2. Usos 116 CAPÍTULO 5. Tabebuia rosea (Bertol) DC. 119 5.1. DESCRIPCIÓN DE LA ESPECIE 120 5.1.1. Nombre común 120 5.1.2. Taxonomía 120 5.1.3. Especies relacionadas 121 5.1.4. Forma 121 5.1.5. Corteza 121 5.1.6. Hojas 122 5.1.7. Flores 122 5.1.8. Frutos 122 5.2. DISTRIBUCIÓN Y HÁBITAT 123 5.2.1. Distribución geográfica 123 5.2.2. Clima 124 5.2.3. Altitud y topografía 124 5.2.4. Suelos 125 5.2.5. Vegetación asociada 125 5.3. SILVICULTURA 126 5.3.1. Bosques naturales 126 5.3.2. Floración y fructificación 126 5.3.3. Producción y diseminación de semilla 126 5.3.4. Tolerancia a factores ambientales 126 5.3.5. Densidad 127 5.3.6. Plagas 127 5.3.7. Enfermedades 127 5.3.8. Sistemas y prácticas silvícolas 128 5.3.9. Crecimiento y rendimiento volumétrico 128 5.3.10. Edad de rotación, turno 128 5.3.11. Regeneración natural 129 5.4. PRÁCTICAS DE VIVERO 129 5.4.1. Manejo y almacenamiento de semillas 129 5.4.2. Germinación 130 5.4.3. Prácticas de cultivo 130 5.5. ESTABLECIMIENTO Y MANEJO DE PLANTACIONES 131 5.5.1. Preparación del sitio de plantación 131 5.5.2. Plantación y espaciamiento 131 5.5.3. Cultivo de las plantaciones 132 5.5.4. Crecimiento y rendimiento volumétrico 133 5.5.5. Plantaciones agroforestales 133 5.6. MEJORAMIENTO GENÉTICO 134 5.7. PROPIEDADES Y USOS 134 5.7.1. Propiedades físico-mecánicas de la madera 134 5.7.2. Usos 135 CAPÍTULO 6. Tectona grandis L. F. 136 6.1. DESCRIPCIÓN DE LA ESPECIE 137 6.1.1. Nombre común 137 6.1.2. Taxonomía 137 6.1.3. Forma 137 6.1.4. Corteza 137 6.1.5. Hojas 137 6.1.6. Flores 138 6.1.7. Frutos 138 6.2. DISTRIBUCIÓN Y HABITAT 139 6.2.1. Distribución geográfica 139 6.2.2. Clima 139 6.2.3. Altitud y topografía 140 6.2.4. Suelos 140 6.3. SILVICULTURA 140 6.3.1. Bosques naturales 140 6.3.2. Floración y fructificación 142 6.3.3. Producción y diseminación de semilla 142 6.3.4. Tolerancia a factores ambientales 142 6.3.5. Plagas 143 6.3.6. Enfermedades 146 6.3.7. Sistemas y prácticas silvícolas 148 6.4. PRÁCTICAS DE VIVERO 149 6.4.1. Recolección y almacenamiento de semillas 149 6.4.2. Germinación 153 6.4.3. Prácticas de cultivo 153 6.5. ESTABLECIMIENTO Y MANEJO DE PLANTACIONES 153 6.5.1. Preparación del sitio de plantación 153 6.5.2. Plantación y espaciamiento 153 6.5.3. Cultivo de las plantaciones 154 6.5.4. Crecimiento y rendimiento volumétrico 157 6.5.5. Plantaciones agrosilvopastoriles 161 6.6. MEJORAMIENTO GENÉTICO 162 6.7. PROPIEDADES Y USOS 165 6.7.1. Propiedades físico-mecánicas de la madera 165 6.7.2. Usos 182 7. LITERATURA CITADA 183 ÍNDICE DE CUADROS Cuadro 1 Página Sintomatología causada por agentes nocivos que afectan a Acrocarpus fraxinifolius 2 10 Resultados de los tratamientos para elevar el porcentaje de germinación de Acrocarpus fraxinifolius 13 3 Comportamiento de Acrocarpus fraxinifolius en Turrialba, Costa Rica 19 4 Comportamiento de Acrocarpus fraxinifolius en Turrialba, Costa Rica 23 5 Propiedades físicas y mecánicas de la madera de Acrocarpus fraxinifolius 24 6 Índices de calidad de pulpa para papel en Acrocarpus fraxinifolius 25 7 Precipitación media anual en los diferentes tipos de selva de México 34 8 Características ecológicas de las zonas con Brosimum alicastrum en la selva mediana subperennifolia de la Costa del Océano Pacífico 9 Características ecológicas de las zonas con Brosimum alicastrum en la selva mediana subcaducifolia de la Costa del Océano Pacífico 10 42 Tipo de vegetación y superficie con presencia de Brosimum alicastrum Sw (densidad) en la Costa del Pacífico Mexicano 15 41 Atributos fisonómico-estructurales de la vegetación y características del medio físico en tipos de selva de la Costa del Pacífico Mexicano 14 40 Características ecológicas de las zonas con Brosimum alicastrum en el palmar de la Costa del Océano Pacífico 13 39 Características ecológicas de las zonas con Brosimum alicastrum en la selva alta subcaducifolia de la Costa del Océano Pacífico 12 38 Características ecológicas de las zonas con Brosimum alicastrum en la selva alta perennifolia de la Costa del Océano Pacífico 11 37 47 Comportamiento de la supervivencia y la altura de especies de las familias Moráceas, Moringáceas y Meliáceas durante 4 años creciendo en condiciones de estrés 56 16 17 Composición química de nutrientes de diferentes especies arbóreas en estado vegetativo 56 Características mecánicas de la madera de Brosimum alicastrum 59 Análisis bromatológico (%) y peso seco de hojas (kg/m2) de las 18 principales especies forrajeras en el ejido Zenzontla, Tuxcacuesco, Jalisco, México 19 62 Análisis bromatológico en frutos por especie forrajera en el ejido Zenzontla, Tuxcacuesco, Jalisco, México 63 20 Análisis químico de la semilla de Brosimum alicastrum 65 21 Análisis bromatológico de Brosimum alicastrum 66 22 Tabla de una entrada para el volumen total con corteza de árboles individuales en plantaciones de Tectona grandis. Vertiente del Pacífico, Costa Rica 23 141 Tabla de doble entrada para el volumen total con corteza de árboles individuales en plantaciones de Tectona grandis. Vertiente del Pacífico, Costa Rica 24 Resultados de tratamientos para callogenésis in vitro de Tectona grandis 25 150 Resultados de tratamientos para establecimiento in vitro de Tectona grandis 27 150 Resultados de tratamientos para enraizamiento in vitro de Tectona grandis 26 142 151 Influencia de los medios de cultivo en el establecimiento de yemas terminales de Tectona grandis. Laboratorio de Biotecnología, UTEQ. Quevedo, 2001 28 151 Evaluación de diferentes niveles de BAP y Kinetina en la multiplicación de brotes de Tectona grandis. Laboratorio de Biotecnología, UTEQ. Quevedo, 2001 29 151 Respuesta del enraizamiento de brotes de Tectona grandis bajo diferentes concentraciones de auxinas. Laboratorio de Biotecnología, UTEQ. Quevedo, 2001 152 30 Proyecciones del diámetro de fuste a diferentes alturas para Tectona grandis en sitios de calidad media y alta, para diferentes turnos 31 157 Valores mínimos y máximos de densidad, diámetro cuadrático, altura promedio y volumen con corteza para parcelas permanentes y temporales establecidas en rodales de Tectona grandis en los Llanos Occidentales de Venezuela 32 Escenarios de planificación desde el establecimiento hasta el aprovechamiento final 33 158 159 Propiedades físicas de la madera de Tectona grandis de 8 años producida con semillas de diferentes procedencias 167 34 Propiedades mecánicas de Tectona grandis de 28 y 17 año 168 35 Propiedades mecánicas de Tectona grandis de 8 años 168 36 Comparación de la resistencia natural de Tectona grandis ante el ataque de organismos marinos 37 169 Comparación de la resistencia natural de Tectona grandis ante el ataque de termitas 169 38 Pérdida de peso en Tectona grandis por degradación por hongos 169 39 Comparación de la resistencia natural de la Tectona grandis ante diferentes tipos de ataque 40 Resultados por densidad de plantación de teca en el porcentaje de duramen 41 170 171 Resultados de la prueba de hipótesis para el total de los datos de cada una de las densidades 171 42 Propiedades físicas y mecánicas de Tectona grandis 172 43 Clasificación de la madera de Tectona grandis 173 44 Propiedades físicas de Tectona grandis 174 45 Propiedades mecánicas de Tectona grandis 174 46 Propiedades mecánicas de Tectona grandis 174 47 Valores promedio de contenido de humedad, densidad y peso específico para madera de Tectona grandis 176 48 Valores promedio de contracciones y punto de saturación de las fibras para madera de Tectona grandis 49 Valores promedio de propiedades mecánicas en estado seco al aire, para madera de Tectona grandis 50 179 Resumen del área libre de defectos por procedencia de madera de Tectona grandis 52 178 Valores promedio de propiedades mecánicas ajustadas al 12 % de contenido de humedad para madera de Tectona grandis 51 177 180 Resumen de remoción en lijado y temperatura en lijado en madera de Tectona grandis 180 53 Composición química de Tectona grandis en distintas zonas del fuste 181 54 Solubilidad de distintas zonas del fuste de Tectona grandis en diferentes solventes 181 55 Composición química global de la Tectona grandis (base seca) 182 56 Composición inorgánica elemental de Tectona grandis 182 ÍNDICE DE FIGURAS Figura 1 Página A) Árbol y ramas. B) Veteado de la madera. C) Corteza. D) Hojas. E) Plantación de Acrocarpus fraxinifolius en el municipio de Múgica, Michoacán 2 A) Árbol. B) Corteza y C) Hojas y frutos de Brosimun alicastrum 3 A) Ramas B) Frutos. C). Ramas. D) Corteza E) Tronco y F) 4 31 Plantación de Cedrela odorata, en el municipio de Múgica, Michoacán 4 72 A) Árbol. B) Ramas C) Tronco. D) Corteza. E) Flores. F) Fruto. G) Hojas de Enterolobium cyclocarpum 102 5 A) Árbol. C) Corteza. D) Flores y D) Frutos de Tabebuia rosea 123 6 A) Árbol. B) Frutos. C) Corteza. D) Hojas y E) Plantación de Tectona grandis en el municipio de Múgica, Michoacán 138 7 Comportamiento del número de árboles de teca a través del tiempo 159 8 Comportamiento del DAP de árboles de teca a través del tiempo 160 9 Comportamiento en altura de árboles de teca a través del tiempo 160 10 Incremento anual de volumen de madera de teca 161 CAPÍTULO 1 Acrocarpus fraxinifolius Wight & Arn. Fotografía tomada por H. Jesús Muñoz Flores. 1 1.1. DESCRIPCIÓN DE LA ESPECIE 1.1.1. Nombre común Acrocarpus fraxinifolius en su lugar de origen es conocido como acrocarpus, árbol guijarra, fresno, lazcar, mundani, mundana (India), cedro tuxteco (Burns et al., 1992 y Niembro 1986). En Inglaterra se le conoce como fresno hindú, cedro de la india y cedro rojo (Menéndez, 1997). En México a nivel nacional se le conoce como cedro rosado o acrocarpus. En el Estado de Yucatán se le llama cedro tuxtelco (Cedeño, 1984). 1.1.2. Taxonomía Familia: Leguminosae Subfamilia: Caesalpiniodaea Género: Acrocarpus Especie: Acrocarpus fraxinifolius Wight & Arn. Sinónimos: Acrocarpus combretifolius T..B; Megoneurum grande Miq. 1.1.3. Forma Árbol grande y deciduo que alcanza en México una altura de 30 m y hasta 60 m en otros lugares del mundo, con diámetros de 0.90 a 2.40 m (Whitmore y Otárola, 1976). Es un árbol de rápido crecimiento, de 30 a 60 m de altura y 2.0 m de diámetro normal en su lugar de origen. Tallo alto y cilíndrico bien conformado (Figura 1), sin contrafuertes, libre de ramas el 50% o más, en ocasiones hasta ¾ partes de la altura total. Presenta una copa ligeramente redondeada. En las zonas tropicales de México se han observado ejemplares de 20 a 25 m de altura (Niembro, 1992). En base a los árboles de la ciudad de Morelia y municipio de Ario de Rosales, se considera que es subperennifolio, sin embargo, Fors (1965) lo registra como caducifolio (Ontiveros y García, 2002). 1.1.4. Corteza Su corteza es fina de color marrón grisácea, con abundantes lenticelas prominentes de 6 a 8 mm de grosor en árboles maduros. En los árboles jóvenes la corteza es lisa, delgada, de color gris claro (Figura 1), con pocas lenticelas y grosor aproximado de 2 a 4 mm (Ontiveros y García, 2002). 2 1.1.5. Ramas Las ramas son relativamente delgadas y se encuentran de la mitad del fuste del árbol hacia arriba, en posición horizontal o ascendente, se observa notoria poda natural de las ramas más viejas y secas (Figura 1). Las ramillas son ligeramente acanaladas en la base, glabras, de coloración verde a ligeramente amarillenta, brillantes con lenticelas longitudinales prominentes. Follaje inmaduro de color amarillento-rojizo, el cual cambia a verde claro. La madera y follaje con fuerte olor similar a la raíz de la ―jícama‖ (Ontiveros y García, 2002). 1.1.6. Hojas Las hojas son compuestas, bipinnadas alternas, sin estípulas de 30 a 70 cm de longitud, con 3 (2 a 4) pares de pinnas; hasta de 30 cm de longitud, con 4 a 7 pares de foliolos glabros de color verde brillante (Figura 1), oblongo-obovados, acuminados, hasta de 15 cm de longitud por 6 cm de ancho, peciolos menores de 5 mm de largo (Ontiveros y García, 2002). 1.1.7. Inflorescencia La inflorescencia es racimosa, axilar y terminal. Racimos simples, erectos hasta 75 cm de longitud. El eje floral es pubescente, de color verde rojizo (Ontiveros y García, 2002). 1.1.8. Flores Las flores son pentámeras, actinomórficas de 3 a 4 cm de longitud. Pedicelo de 4 a 6 mm de largo, pubescente, articulado. Hipantio obcónico de 6 a 7 mm de longitud, pubescente en el exterior, de color verdoso, el interior presenta coloración castaño oscuro, tendiendo a púrpura, persistencia en la fructificación. Cáliz de 5 sépalos, de 4 a 6 mm de longitud, pubescentes, de color verde amarillento. Corola de 5 pétalos, de 8 a 12 mm de largo pubescentes, de color verde amarillento, en posición alterna con los sépalos pronto deciduos después de la antesis. El androceo está constituido por 5 estambres, opuestos a los pétalos, hasta de 25 mm de longitud, de coloración variable y gradual hacia la base, de rojo amarillento hasta verde claro. Las anteras son versátiles, uniformes, dorsifijas, hasta de 4 mm de longitud, dehiscentes por hendiduras longitudinales, de color amarillento, con el lado externo de color púrpura. El pistilo es súpero, unilocular, con numerosos óvulos; estilo filiforme, pubescente de color verde amarillento; estigma espatulado, con ápice curvo, de coloración rojiza, excede ligeramente la longitud de los estambres (Ontiveros y García, 2002). 3 1.1.9. Fruto La vaina es dehiscente, glabra, de 7 a 20 cm de longitud por 1.2 a 2.5 cm de ancho, de color castaño rojizo brillante, forma lanceolada elíptica, agudo y curvo el ápice, valvas delgadas, papiráceas, las suturas ligeramente engrosadas; pedúnculo de 2 a 2.5 cm de longitud. En ocasiones, las vainas presentan pequeñas gotas de goma de color brillante. Las semillas son suborbiculares, ligeramente alargadas de 5 a 7 mm de longitud, de color café y hasta 18 por vaina (Ontiveros y García, 2002). Figura 1. A) Árbol y ramas. B) Veteado de la madera. C) Corteza. D) Hojas. E) Plantación de Acrocarpus fraxinifolius en el municipio de Múgica, Michoacán. 4 1.2. DISTRIBUCIÓN Y HÁBITAT 1.2.1. Distribución geográfica El área de distribución natural de A. fraxinifolius, se extiende desde los 23º a 27º norte, en el occidente de la India, abarca Bangladesh, hasta alcanzar el norte de Birmania. Forma parte de los bosques mixtos siempre verdes y se encuentra en altitudes de 0 hasta 1,500 m. Fuera del área de su distribución natural, ésta especie fue plantada en la India aproximadamente a 18º norte y en regiones altas de Kenia, Uganda, Tanzania y Zimbabwe (Sepatro, 2001). El cedro rosado es originario de las colinas del sur y del este de la India y Birmania, donde se le conoce con el nombre de ―mundani‖ (Sepatro, 2001). También se le señala como nativo del sur y de regiones tropicales de la India y del Archipiélago Malayo (Niembro, 1992). Se ha introducido en Malawi, Nigeria, Rodesia, Zambia, Kenia, Haití, Costa Rica y México (Chavelas, 1984). En la República Mexicana se ha introducido en los estados de Quintana Roo, Chiapas, Campeche, Oaxaca y en la zona tropical de Puebla, en colindancia con Veracruz, como árbol de sombra en cafetales. En el estado de Michoacán se ha cultivado en las zonas calientes del municipio de la Huacana, inclusive en la ciudad de Morelia (Ontiveros y García 2002) y en el Valle de Apatzingán (Figura 1). 1.2.2. Clima Dentro de su área de distribución natural A. fraxinifolius crece en sitios con temperatura media anual de 19 a 28 ºC, mínima de 16 a 22 ºC y máxima de 23 a 35 ºC, con precipitación entre los 500 a 3,000 mm. Se desarrolla mejor en sitios con una precipitación igual o mayor a los 2,000 mm. Se considera sensible a las heladas y no tolera las sequías, aunque parece estar bien adaptado a sitios fríos pero sin heladas, en las tierras altas o en el trópico húmedo con considerable precipitación; también se reporta que se desarrolla en zonas con precipitación pluvial anual de 1,500 a 2,000 mm. Tolera una temperatura máxima absoluta a la sombra de 35 a 42.5 ºC y sequías prolongadas hasta de 5 meses en lugares con alta humedad relativa; estas condiciones lo hacen excelente para cultivarse en el Sureste Mexicano y gran parte de Centroamérica (Burns et al., 1998 y Lamprech, 1989 (a) y Sepatro, 2001). Tiene un extraordinario desarrollo cuando se expone a plena luz solar, (ya que es una especie heliófila), y temperaturas de los 12 a 35 ºC con una humedad del aire que oscile entre 50 y 85%. 5 1.2.3. Altitud y topografía El cedro rosado se encuentra a una altitud de cero a un máximo 1,700 m, con una media de 600 a 1,500 m (Burns et al., 1998). Fue introducido exitosamente en Malawi en terrenos de 600 a 1,800 msnm y en México se ha plantado desde el nivel del mar hasta los 1,400 m. 1.2.4. Suelo A. fraxinifolius se desarrolla en suelo vertisol, profundos a someros, de textura arcillosa, moderadamente drenados a bien drenados, pH de 4 a 7.5. Tolera suelos compactos (Burns et al., 1998 y Lamprech, 1989 a). De acuerdo a Menagro (2001), se desarrolla en suelos rojos y someros o profundos, con abundante materia orgánica y buen drenaje. También se cita que crece en suelos con un pH de 5.5 a 7, preferentemente. Esta especie es apropiada para suelos francos medianamente superficiales o profundos. Sin embargo, también se desarrolla en suelos superficiales y compactados y es preciso señalar que no resiste los encharcamientos, prefiriendo los suelos francos, profundos, con buen drenaje (Sepatro, 2001). Los rendimientos más satisfactorios se tienen en suelos profundos, húmedos pero bien drenados y sin obstáculos, ya que las raíces llegan hasta los 4.5 m de profundidad. En México, se ha reportado en suelo Yaxhom (término Maya), del tipo vertisol con pH de 6.9 a 7.5 (Sepatro, 2001). 1.2.5. Vegetación asociada El cedro rosado se encuentra en los Ghats Occidentales de Kherala, en los bosques perennifolios de la costa occidental de India, donde las especies perennifolias y deciduas dominantes están íntimamente intermezcladas. Las especies asociadas son Arthocarpus hirsuta, Salmatia malabarica, Vitex altissima, Tetrarmeles nudiflora, Hopea parviflora, Laegerstromea lanceolata, Vateria indica, Anthocephalus cadamba, Xilia xylocarpa, Terminalia tomentosa, Cedrela toona, Grewea tiliaefolia, Dalbergia latifolia, Pterospermum rubiginosum, Radermachera xylocarpa, Mesua ferrea, Adina cordifolia, Holoptelea integrifolia, Pterocarpus marsupium y Sterculia guttata (Menagro, 2001). También crece en los bosques tropicales de los Himalayas orientales en Kalimpong, India, donde se tienen individuos dispersos, siendo especie única y dominante en algunas regiones. Otras especies de árboles en estos bosques son: Shorea robusta, Terminalia crenulata y T. myriocarpa, Albizzia marginata, Laegerstromia parviflora, Bombax malabaricum, Cedrela toona, Stereospermum tetragonium, Dillenia pentogyna y Sterculia villosa (Menagro, 2001). 6 1.3. SILVICULTURA 1.3.1. Bosques naturales Se recomiendan frecuentes cuidados silviculturales hasta el cierre de las copas. Está especie tiene una gran capacidad de rebrote. A la edad de 3 a 4 años se realizan los primeros raleos, ya que para lograr un desarrollo óptimo el árbol requiere una copa amplia, hasta que el rodal alcance dimensiones maderables. 1.3.2. Floración y fructificación Comportamiento reproductivo. Los mecanismos de polinización son desconocidos en su hábitat natural, pero se sabe que en México es autógamo (Menagro, 2001). La floración se presenta a partir de los 7 años de vida de los árboles. Se reporta que la floración en México se presenta durante los meses de marzo a junio (REMGEFOR, 2005). Se reporta que en Quintana Roo los árboles comienzan a producir semilla de los 7 a 9 años de edad y florece en el mes de mayo y Agosto (Burns et al., 1998). En el Campo Experimental Forestal (C. E. F.) ―Eduardo Sangri Serrano‖ en Campeche florece en el mes de marzo y se cosecha la semilla en los meses de mayo y junio (Chavelas, 1984). En el C. E. F. ―San Felipe Bacalar‖ fructifica en el mes de abril y las vainas se recolectan cuando presentan un color negro. 1.3.3. Producción y diseminación de semilla En el C. E. F. ―San Felipe Bacalar‖ las semillas se colectan de mayo a agosto, cuando las vainas presentan un color pardo oscuro o negro, lo que indica que se encuentran maduras. Se pueden colectar directamente del árbol o recolectar del suelo. Un kilogramo de semilla contiene un promedio de 32,000. El peso de mil semillas es de aproximadamente 31 a 52 g (19,000 a 39,000 unidades por kilogramo). Comercialmente, se cita que 20,000 plantas se propagan adecuadamente para plantación por cada kg de semilla (Sepatro, 2001). Otros autores citan que el número de semillas por kilogramo es de 19,000 a 31,600. 7 1.3.4. Tolerancia a factores ambientales El cedro rosado puede crecer en áreas degradadas (Rai, 1976 citado por Menagro, 2001). Ha sido introducido a elevaciones bajas en varios países, donde crece rápidamente por unos pocos años, aunque luego su crecimiento se estanca, muriendo la especie al comenzar la sequía (Menagro, 2001). Se reporta que los árboles crecen bien durante los primeros años, pero después en algunas regiones sufren mortalidad de ramas desde la punta del árbol hacia la base. Los autores sugieren que se estudie a fondo la cuestión de la adaptabilidad del cedro rosado al ambiente (Whitmore y Otárola, 1976). Un proceso similar sucede en Campeche y Quintana Roo, México, en regiones bajas de 0-30 msnm, con una precipitación de menos de 1,500 mm. En otras regiones tales como Oaxaca y Chiapas, con precipitaciones de menos de 1,000 mm, pero en elevaciones de 600-1,500 msnm, la especie crece con buenos incrementos (Menagro, 2001). La especie es sensible a las heladas y no tolera las sequías, (Burns et al., 1998). Parece estar bien adaptado a sitios fríos pero sin heladas, en las tierras altas o en el trópico húmedo con considerable precipitación (Anónimo, 1979). 1.3.5. Plagas En Costa Rica, los árboles no tienen enfermedades o plagas, con excepción de las termitas (Whitmore y Otarola, 1976). En África, la especie está libre de plagas y enfermedades, con excepción de ataques de termitas sobre árboles jóvenes. El hongo Armillaria mellea causa un daño ligero a árboles debilitados en las regiones de las sabanas (Menagro, 2001). En México se consideran muy pocas las plagas que afectan el cedro rosado. La hormiga arriera (Atta spp.) defolia a los árboles jóvenes, controlándose con un cebo conocido como patrón (ingrediente activo sulfluramida). Otra plaga importante que construye sus galerías cubiertas sobre la corteza del tronco del árbol son las termitas (Cryptotermes brevis y Nasutitermis corniger), las cuales también atacan la madera sin tratamiento, posiblemente después que han sido infectados por un hongo, aún sin identificación (Combe y Gewald, 1979 citados por Cibrián et al., 1995). Las tuzas o taltuzas (Orthogeomys heterodus) son roedores que causan el mayor daño en el campo forestal, tanto por el consumo de plantas como por la destrucción de raíces de los árboles jóvenes, incluso llegan a roer las raíces de los árboles adultos, provocando su caída; su control es difícil pero puede hacerse con trampas y cebos envenenados. Se considera un árbol resistente a plagas y enfermedades, debido a que son muy pocas las que lo afectan. Los árboles jóvenes son susceptibles a comejenes (Menéndez, 1997; Sepatro, 2001). 8 En el C. E. F. ―El Tormento‖ en Escárcega, Campeche, se observó en sus primeros años, que una plantación fue atacada por hormigas de tipo arriera, donde prácticamente provocó la defoliación total de los árboles, pero sin causar la muerte (Cedeño, 1984). En el Instituto de Investigación Forestal de Dhera Dur en la India, reportan que en ocasiones se ve muy afectado por los barrenadores y la incidencia es alta cuando las plantaciones se hacen en líneas (Forest Research Institute y College Dehra India, 1983 citado por Cedeño, 1984). Otras plagas que construyen galerías cubiertas sobre la corteza del tronco del árbol son las termitas (Cryptotermes brevis y Nasutitermis corniger), las cuales también atacan la madera. 1.3.6. Enfermedades Los organismos patógenos que son más destructivos son aquellos que producen el ahogamiento o secadera en las pequeñas plantas, causadas por hongos, bacterias o virus. El ahogamiento o mal del talluelo, es causado por varios hongos como Rhizoctonia solani, Pythium ultimum, Phytophthora, Bortytis y Verticillum, entre otros. La semilla puede podrirse o bien las plantas se pudren antes que emerjan del sustrato al ser atacadas por el mal del talluelo. Las plántulas pueden desarrollar una pudrición en forma de anillo cerca de la superficie, casi siempre en forma de manchones o círculos. Estas plantas enfermas deben eliminarse y destruirse (Menéndez, 1997). En Costa Rica se ha observado una necrosis progresiva del ápice de árboles jóvenes, continuando hacia la base; es seguido por ataques de comejenes y por la muerte del árbol. Se reportaron micomicetos presentes en la rizósfera del cedro rosado en predios de la Sierra Norte de Puebla, en plantaciones mixtas de café y cedro rosado. En resultados de análisis microbiológicos de suelo, se determinaron 16 géneros de hongos, de los cuales 11 se reportan como patógenos, 5 como saprofitos y una levadura; dentro de las familias Dematiaceae, Melanconiaceae, Monilaceae, Mucoraceae, Spharopsidaceae, Tuburculariaceae y Saccharomycetaceae (Olvera et al., 2005). Se estudió la sintomatología de daños detectados en cedro rosado en la Sierra Norte de Puebla, ya que se ha reportado con un alto potencial, por ser una especie exótica de rápido crecimiento que ha sido introducida y utilizada como sombra en las plantaciones de café, donde se han observado incrementos importantes en diámetro y altura en corto tiempo; sin embargo, poco se conoce acerca de las plagas y enfermedades que afectan al arbolado de estas plantaciones, ni los múltiples beneficios que pueden brindar a los productores de esta zona. Los resultados de la sintomatología causada por diferentes agentes nocivos se muestran en el Cuadro 1 (Reséndiz et al., 2005). 9 Cuadro 1. Sintomatología causada por agentes nocivos que afectan a Acrocarpus fraxinifolius. Tipo de síntoma Agente causal Estrangulamiento y deformación Orificios en tallos Mordedura de hojas Ramas distorsionadas Punta seca Gomosis Corteza manchada Árbol curvado Raíz enrollada Hojas manchadas Hojas enchinadas Raíz dañada Reventamiento de tallo Planta epífita Barrenadores Hormigas Muérdago Desconocido Hongo Hongo Deficiente desarrollo Mal manejo Fumagina Herbicida Tuza Hongo Fuente: Reséndiz et al., 2005. 1.3.7. Edad de rotación, turno En el Estado de Puebla la edad de rotación o turno es de 12 años (Menéndez, 1997). 1.3.8. Regeneración natural La germinación bajo condiciones naturales es errática; la semilla puede permanecer latente por un tiempo largo, por ejemplo, 10 meses (Menagro, 2001). 1.4. PRÁCTICAS DE VIVERO 1.4.1. Manejo y almacenamiento de semillas Época de colecta. La cosecha se realiza una vez que las vainas adquieren un color café oscuro y empiezan a caer del árbol. Cada vaina contiene de 5 a 7 semillas. En México se presenta la maduración de los frutos durante los meses de Mayo a Agosto (REMGEFOR, 2005). Extracción de semilla. Una vez recolectadas las vainas, se clasifican y se depositan en un saco de yute o en cajas de plástico con suficiente ventilación, para su transporte al vivero o al centro de beneficio. De manera inmediata las vainas se extienden sobre pisos de cemento, ameros o estufas de secado, hasta que las vainas abran por la sutura lateral. También se pueden friccionar o restregar las vainas de manera manual, para facilitar la liberación de las semillas, posteriormente se eliminan las impurezas y se exponen al sol durante dos o tres días para completar su secado (REMGEFOR, 2005). 10 Manejo y almacenamiento. La semilla puede almacenarse con contenidos de humedad de 6 a 7% y temperaturas de 0 ºC; tales condiciones permiten mantener la viabilidad por varios años. Generalmente las semillas ortodoxas presentan algún periodo de reposo, particularmente esta especie presenta latencia primaria. Para mantener la viabilidad de las semillas, se pueden almacenar en bolsas de polietileno a temperatura ambiente, también se recomienda guardarlas en sitios fríos. El tiempo de viabilidad estimado bajo condiciones de almacenamiento puede ser más de un año (Lamprech, 1989 a; Burns et al., 1998 y Arriaga et al., 1994). La semilla se puede almacenar en recipientes cerrados en lugares frescos y sombreados y mantener buenos niveles de viabilidad hasta por un año. En condiciones controladas, se almacenan en recipientes cerrados a temperaturas de 4 a 5 ºC, con contenidos de humedad de 8 al 13%. Bajo estas condiciones, las semillas se conservan en buen estado por más de 5 años. No se recomienda almacenar la semilla por mucho tiempo ya que son susceptibles al ataque de insectos (Cedeño, 1984). 1.4.2. Germinación La germinación es epigea, con una capacidad germinativa alta, de tal manera que en lotes de semillas debidamente beneficiados y tratados, se pueden obtener de un 80% a un 90% de emergencia en un periodo de 8 a 15 días (REMGEFOR, 2005). La germinación es a menudo irregular, algunas semillas germinan al cabo de una semana, mientras que otras se tardan hasta casi un año. Por esta razón deben sembrarse en semilleros bien abrigados y en gran densidad. Remover y aflojar el sustrato del semillero cada cierto tiempo favorece la germinación. 1.4.3. Prácticas de cultivo Tratamientos pregerminativos La semilla de A. fraxinifolius presenta una testa impermeable que dificulta la entrada de agua y el consecuente inicio de los procesos de germinación; el poder germinativo es considerado mediano y muy irregular, de acuerdo a Fors (1965), se recomienda almacenar la semilla un año antes de sembrarla en primavera. Las semillas recolectadas y sembradas en los 10 días posteriores a ello llegan a tener una germinación de hasta un 30%, pero la mayoría mantiene una dormancia de hasta 18 meses. Por lo anterior, se han realizado pruebas de tratamientos que incrementen el porcentaje de germinación y que ayuden a acelerarla y uniformizarla, tal como se menciona a continuación (Sepatro, 2001): 11 Ácido sulfúrico. a) Las semillas fueron tratadas con ácido sulfúrico por 5 minutos, lavadas con agua limpia por varios minutos y secadas. Subsecuentemente las semillas fueron puestas a remojar en agua tibia por 16 horas (T1). b) Las semillas fueron tratadas con ácido sulfúrico por 10 minutos, lavadas con agua limpia por varios minutos y secadas. Subsecuentemente las semillas fueron puestas a remojar en agua tibia por 16 horas (T2). (c) 10 ml de ácido sulfúrico concentrado fueron mezclados con 100 ml de agua y se pusieron a remojar en esta solución 300 semillas por 18 horas (T3). Nitrato de amonio. En 100 ml de agua se disolvieron 10 g de nitrato de amonio y 300 semillas fueron puestas a remojar en esta solución por 18 horas. Después las semillas fueron lavadas (T4). Nitrito de sodio. En 200 ml de agua se disolvieron 10 g de nitrito de sodio y 300 semillas fueron puestas a remojar en la solución por 18 horas, después las semillas fueron lavadas (T5). Agua hirviendo. a) 300 semillas se pusieron en agua hirviendo por 10 minutos y después de dejaron remojando por 18 horas (T6). (b) 300 semillas fueron puestas en agua hirviendo e inmediatamente se retiró el recipiente del fuego, dejando las semillas dentro del agua por 18 horas (T7). Agua caliente. Las semillas se remojaron aproximadamente 18 horas, después se pusieron a remojar en diferentes lotes en agua a diferentes temperaturas y nuevamente se pusieron a remojar por otras 18 horas. Las temperaturas fueron de: a) 35, b) 50, c) 70 y d) 100 ºC (T8 a T11). Tratamiento con Ethrel®. (a) 300 semillas se pusieron a remojar en una solución de Ethrel de 1000 ppm por 24 horas y después se lavaron T12. (b) 300 semillas fueron puestas a remojar en una solución de Ethrel® de 3,000 ppm y después se lavaron T13. (c) 300 semillas fueron puestas a remojar en agua tibia por 18 horas T14. Los resultados de los diferentes tratamientos se muestran en el Cuadro 2. Los resultados encontrados muestran que las semillas tratadas con ácido sulfúrico poseen altos porcentajes de germinación (89.15 y 90.67%), sin embargo, después de 10 días las semillas tratadas fueron desechadas debido a que fueron afectadas por hongos, inicialmente las semillas tratadas por 10 minutos dieron resultados aparentemente más saludables que las tratadas por 5 minutos. El uso de agua caliente a diferentes temperaturas arrojó mejores resultados que otros tratamientos, aunque se obtuvo una germinación tardía, comenzando a germinar la mayoría de las plantas hasta después de una semana, por lo que no se muestra la cantidad real de germinación usada con este método en la prueba, aunque cabe mencionar, que este es el procedimiento utilizado por Sepatro (2001), así como el método del corte directo a la semilla. 12 Cuadro 2. Resultados de los tratamientos para elevar el porcentaje de germinación de Acrocarpus fraxinifolius. Tratamiento T1 T2 T3 T4 T5 T6 T7 T8 T9 T10 T11 T12 T13 T14 Cantidad de semillas 1124 1157 300 300 300 300 300 300 300 300 300 300 300 300 Dias 1 5 - 2 4 29 1 1 - 3 800 962 22 8 20 13 59 52 - 4 109 33 5 1 29 3 5 15 12 16 1 5 67 34 1 1 17 1 5 6 - 6 11 2 2 1 1 - 7 5 10 1 1 - 8 6 4 1 1 - 9 4 4 10 4 1 5 2 - 10 X X 3 1 - 11 X X 4 1 1 2 - 12 X X 3 1 4 3 1 - 13 X X 1 3 1 - 14 X X 2 1 1 - Porcentaje de germinación 89.15 90.67 2.67 ---0.67 27.33 18.0 9.67 19.34 30.67 27.33 1.33 0.30 0.30 Fuente: Sepatro, 2001. Se puede concluir que las semillas sembradas sin tratamiento tienen una germinación muy pobre y heterogénea. Para lograr una germinación homogénea se recomienda sumergir la semilla en ácido sulfúrico concentrado por 5 minutos para dejarla después remojando en agua corriente por 12 horas; el otro tratamiento recomendado consistió en introducir la semilla en agua a 80 °C y dejarla dentro del agua, hasta que esta se enfríe, por un periodo de 8 horas (Sepatro, 2001). En un trabajo realizado en el Campo Experimental ―San Felipe Bacalar‖, en Quintana Roo, por Hong y Moreno (1982), encontró que los mejores tratamientos fueron el de escarificación y el de remojo en ácido sulfúrico al 95% durante cinco minutos con una germinación del 80% en sólo ocho días en comparación a condiciones normales en el que se alcanzaba solo el 4% en 60 días (Gómez, 1989). La técnica del agua hirviendo consiste en poner las semillas en agua hirviendo durante unos minutos y después se dejan en agua a temperatura ambiente durante 12 horas y el porcentaje de germinación que se obtiene es del 90.6% con un tiempo necesario para la germinación entre 10 y 90 días, antes de la época de lluvias (Lamprech, 1989 a; Burns et al., 1998). Otra técnica consiste en: 1. 2. 3. 4. 5. 6. Colocar 250 g de semilla en una bolsa de manta Poner 3.5 L de agua a calentar hasta alcanzar 80 ºC Retirar el recipiente con agua del fuego Introducir en el agua caliente, la bolsa con semilla Dejar la semilla dentro del agua hasta que ésta se enfríe, durante 8 horas En una solución de Biozyme® pp (3 m/L de agua), introducir la bolsa con la semilla por un espacio de 20 minutos (opcional) y 7. Proceder a la siembra (Sepatro, 2001). Finalmente, Sepatro (2001) menciona otro método que consiste en hacer un corte de un milímetro con un cortaúñas o navaja a cada semilla por la parte de atrás de la 13 misma y proceder a la siembra directa en aserrín previamente desinfectado, así como mantener húmedo el sustrato regandolo diariamente. En el vivero de la SEMARNAT, en la población de Dr. Miguel Silva, Mpio., de Ario de Rosales, Mich., se han producido plántulas con semillas obtenidas de un árbol de la misma localidad y sin tratamiento. Preparación del sustrato para semillero Se recomienda emplear como sustrato aserrín de grano medio como sustrato: Los pasos a seguir se describen a continuación: 1. 2. 3. 4. 5. 6. 7. 8. 9. Preparar una cama de aserrín de 20 cm de espesor. Tratar el aserrín con 5 g de BASAMID G® por m2. Aplicar suficiente riego para que gasifique el BASAMID G. Cubrir con plástico las tablas para que el BASAMID G® haga efecto. Esperar 10 días. Revolver el aserrín y aplicar riego. Proceder a la siembra. Mantenner una humedad regulada en el semillero regando una vez por día. La profundidad de siembra de la semilla debe ser de 2.5 cm y una distancia de 0.5 cm entre las semillas y 5 cm entre surcos. Al germinar, se pueden hacer aplicaciones con Previcur® a razón de un mililitro por litro de agua, cada 15 días y trasplantar a los 5 cm. Método de siembra En el almácigo las semillas se ponen a germinar en arena húmeda esterilizada y se trasplantan a los envases cuando tienen 10 cm de altura. Se recomienda que esta actividad de realice antes de que aparezcan los primordios foliares, cuando las plántulas presenten no más de tres raíces (Arriaga et al., 1994). Características del sustrato El sustrato de los envases debe presentar consistencia adecuada para mantener la semilla en su sitio, el volumen no debe variar drásticamente con los cambios de humedad, la textura debe de ser media para asegurar un drenaje adecuado y buena capacidad de retención de humedad, con fertilidad adecuada, libre de sales y materia orgánica no mineralizada. Cuando el sustrato es inerte la mezcla 55:35:10 de turba, vermiculita y perlita o agrolita, es adecuada para lograr buenas condiciones de drenaje (Lamprech, 1989 a; Arriaga et al., 1994 y Burns et al., 1998). 14 Tratamiento del sustrato antes de la siembra Se recomienda preparar la mezcla del sustrato con un 80% de tierra negra y 20% de composta (no usar materia orgánica fresca) y aplicación de micorrizas. Se adiciona 1.5 kg de superfosfato de calcio simple por m3 de tierra. Ya que el pH ideal para estas leguminosas es de 6.5, en caso necesario usar la dosis adecuada de cal dolomitizada (Sepatro, 2001). Sistemas de producción en envases Producción en bolsas de polietileno: Se recomienda utilizar bolsas negras de polietileno calibre 400, de 13 a 15 cm de diámetro por 20 a 25 cm largo. Se puede sembrar la semilla en almácigo y después transplantar las plántulas a los contenedores. Sin embargo, se recomienda la siembra directa, para evitar perdidas en transplante y problemas de deformación de la raíz, ya que se desarrolla de manera muy rápida. Con en este sistema, se pueden alcanzar alturas de 40 a 50 cm a los 4 a 5 meses de edad (REMGEFOR, 2005). Además, se debe aplicar Vitavax 200® suspensión acuosa, en una dosis de 10 cc/L de agua para tratar un m 2 de bolsas. Esperar 5 días para sembrar (Sepatro, 2001). Sistema de contenedores: En México se reporta la reproducción de esta especie en contenedores de poliestireno de 77 cavidades (180 ml por cavidad); en el vivero de la organización social ―Tosepan Titatanis‖ ubicado en el municipio de Cutzalan, Puebla, se practica la siembra directa y la siembra en almácigos con transplante a los contenedores, obteniendo plantas de buena calidad, de 40 a 50 cm de altura en un periodo de tres meses. Por la conformación de las hojas y desarrollo de las plantas, se recomienda utilizar contenedores de plástico (tubetes) intercambiables, con el propósito de espaciar las plantas durante su desarrollo, para lograr una adecuada lignificación de los tallos y conformación de las partes aéreas (REMGEFOR, 2005). Deshierbes El deshierbe continuo de los pasillos y al interior de los envases que contienen las plantas, evitará problemas de competencia por luz, agua y nutrientes; además, favorecerá condiciones de sanidad. Es importante tener cuidado con el número de plántulas o estacas que se encuentran en los envases, lo más recomendable es mantener solamente una planta o estaca por envase, la más vigorosa, eliminando las restantes (Sepatro, 2001). 15 Acondicionamiento de la planta previo al transplante Antes de plantar los árboles, es recomendable remover todo el follaje y ramas con excepción de unas pocas hojas del ápice, a veces también es necesario podar las raíces. Por lo menos un mes antes de su traslado al sitio de plantación, se deberá iniciar el proceso de endurecimiento de las plantas, este consiste en suspender la fertilización, exponer las plantas a una mayor insolación y alternar la aplicación de los riegos entre someros y a saturación, además de retirarlos una semana antes previo a la salida de la planta. Esto favorecerá que las plantas presenten crecimiento leñoso en el tallo y ramas. El tiempo requerido para la producción de la planta es de 3 a 4 meses después de la germinación. La duración promedio de la planta en vivero es entre 6 y 8 meses. Cuando los árboles alcanzan una altura de 30 a 50 cm estarán listos para plantarse durante la época de lluvias (Lamprech, 1989 (a); Arriaga et al., 1994 y Burns et al., 1998). Propagación asexual En este tipo de propagación se emplean varetas, acodos, esquejes, estacas e injertos (Whitmore y Otarola, 1976). Elección y preparación de la planta en vivero Se deberán elegir las plantas más vigorosas, libres de plagas y enfermedades. Aunque las características físicas dependerán de la especie, existen criterios generales que indican buena calidad en las plantas. La raíz deberá ocupar por lo menos el 50% del volumen total del envase, el diámetro basal del tallo deberá ser de 0.25 cm, la altura total del vástago no mayor a 30 cm y por lo menos ¼ parte de la longitud total del tallo con tejido leñoso, endurecido. Se recomienda aplicar un riego a saturación un día antes del transporte de las plantas (SIRE, 2005 a). Medio de transporte Se deben utilizar vehículos cerrados y trasladar las plantas debidamente cubiertas, para protegerlas de la pérdida de humedad por efecto del viento e insolación y con ello evitar la deshidratación (Sepatro, 2001). Para optimizar la capacidad de los vehículos y disminuir los costos de transporte, es conveniente construir estructuras sobre la plataforma de carga con la finalidad de acomodar dos o más pisos. Asimismo, con la finalidad de evitar que la planta sufra el menor estrés posible, idealmente el tiempo de transporte no debe exceder a tres horas (Sepatro, 2001). 16 1.5. ESTABLECIMIENTO Y MANEJO DE PLANTACIONES 1.5.1. Preparación del sitio de plantación La preparación incluye la eliminación de las malezas, trazo y apertura de cepas, la cual dependerá del tipo de textura y fertilidad del suelo (Menéndez, 1997). Subsolado. Se emplea solo cuando se presentan capas endurecidas a escasa profundidad, aproximadamente de 15 cm, siempre y cuando los terrenos presenten pendientes menores del 10%. Rastreo. Se recomienda dar un paso superficial de rastra en la época de lluvias antes de la plantación, siempre y cuando el suelo sea profundo y con pendientes menores al 15%. Trazado. Se realiza sobre curvas a nivel con arreglo en tresbolillo. La distancia entre curvas de nivel dependerá de la pendiente del terreno y de la densidad de plantas que se desee establecer (Arriaga et al., 1994). Apertura de cepas. El tamaño de las cepas dependerá de las dimensiones del envase utilizado para la producción de las plantas. Esto implica que las cepas deberán realizarse con 3 a 5 unidades de volumen adicional al tamaño del cepellón de la planta; no obstante, dependiendo de las condiciones del terreno, las dimensiones y tipo de cepas podrán variar en función de las estrategias de conservación de suelo, de las características del suelo y de las condiciones climáticas; pueden ser de 30 x 30 x 30 cm (Menéndez, 1997; Arriaga et al., 1994 y Burns et al., 1998). Deshierbe. Las plantaciones se deben mantener libres de malas hierbas hasta que la copa adquiera su espesor después de dos estaciones de crecimiento. Si el terreno presenta problemas de malezas, se recomienda realizar deshierbes manuales o mecánicos dependiendo de las condiciones del terreno. Si éste presenta pendientes mayores a 12% para evitar la erosión del suelo, se recomienda remover la vegetación solamente en los sitios donde se plantarán los árboles ya sea en franjas o alrededor de las cepas (Laurie, 1974 citado por Menagro, 2001; Lamprech, 1989; Arriaga et al., 1994 y Burns et al., 1998). 1.5.2. Plantación y espaciamiento La disposición depende de la pendiente del terreno, la posibilidad de asociación con otros cultivos y el tipo de producto que se desea obtener, así como la intensidad de fertilización, podas y aclareos (Menéndez, 1997). Se plantan a espacios de 3 x 3 m o a tresbolillo, para la obtención de madera aserrada, de preferencia en áreas que han sido aclareadas y quemadas. En plantaciones adultas es necesario que los espaciamientos sean más grandes, ya que 17 las copas de los árboles se extienden a una distancia considerable. Se recomienda que las copas se mantengan libres para evitar que el crecimiento quede estancado. Los árboles deben plantarse en el campo a los 3 meses después de su germinación cuando éstos alcanzan una altura de 30 a 40 cm y pueden establecerse a 2 m entre ellos con la finalidad de aplicar un aclareo al tercer o cuarto año, en plantaciones puras. Para sombra de café, puede plantarse a una equidistancia de 8 m, aunque tambien se pueden plantar cada 10 m (Sepatro, 2001). El tipo de producto que desea obtener, así como la fertilidad, clase de suelo y la intensidad del manejo, definen el espaciamiento o diseño de plantación a utilizar, por ejemplo, para obtener como producto principal madera se emplea un espaciamiento inicial de 3 x 3 m y aclareos a los 4 y 8 años. En asociación agroforestal el espaciamiento inicial deberá ser de 4 x 4 m y aclareos entre los 4 y 6 años (Menéndez, 1997). También se reporta que se pueden utilizar espaciamientos hasta de 5 x 5 m y en sistema agroforestal para sombra de cafetales y cacao, la distancia de plantación o siembra puede ser de 5 x 10, 7 x 7 o 10 x 10 m, dependiendo del cultivo y de la altura sobre el nivel del mar (Sepatro, 2001). 1.5.3. Cultivo de las plantaciones Deshierbe. Durante los dos primeros años de haber establecido la plantación se recomienda de 2 a 3 deshierbes. Es necesario tener cuidado con los herbicidas pues la especie es muy sensible a ellos (Arriaga et al., 1994, citado por CONAFOR). Es necesario cortar periódicamente el pasto y hierbas alrededor de los arbolitos hasta que éstos dejen de ser plántulas (Lamprech, 1989 a). Podas. Con el fin de mejorar la calidad de las trozas e incrementar la forma de los árboles, se aconseja podar los retoños de crecimiento ortotrópico en los primeros dos años, dejando únicamente un solo fuste y eliminando los futuros segundos o terceros ejes. Preaclareos, aclareos y cortas intermedias. Se recomienda la aplicación de aclareos entre los 5 y 8 años de edad (Burns et al., 1998). Medidas de protección. Es importante establecer brechas contrafuego en el perímetro de la plantación, así como cercarla con la finalidad de prevenir factores de disturbio como el pisoteo y ramoneo del ganado. 18 1.5.4. Crecimiento y rendimiento volumétrico El propósito de las plantaciones forestales es el de obtener en corto plazo y bajo costo, materia prima destinada a satisfacer la demanda de la industria forestal de celulosa y madera aserrada, entre otros, por lo que es fundamental seleccionar las especies más adecuadas a los productos a obtener y a las características de la región, pudiendo ser nativas o introducidas. El uso de especies introducidas ofrece en muchos casos ventajas comparativas en velocidad de crecimiento y turnos de aprovechamiento más cortos, que son básicos para desarrollar proyectos financieramente viables. Por ejemplo, en el trópico con el uso de especies nativas se obtienen incrementos anuales de 5 a 10 m3/ha/año y en turnos mínimos de 15 a 20 años, mientras que con especies introducidas (como el cedro rosado) se obtendrían de 30 a 50 m3/ha/año y los turnos se reducirían de 7 a 10 años (Sepatro, 2001). En ensayos hechos en Malawi, Nigeria, Rhodesia y Zambia, el mundani (cedro rosado) fue la especie leguminosa de crecimiento más rápido; con incrementos en altura de 1.3 a 3.0 m por año en Zambia y Nigeria. En Zambia, árboles excepcionales alcanzaron en 4 años una altura de 15.2 m y un diámetro de 14 cm (Laurie, 1974 citado por Menagro, 2001). En Costa Rica, el cedro rosado a los 7 años de edad, presenta los mejores promedios en altura de 18.19 m y diámetros de 19.78 cm (Witmore y Otarola, 1976) con una forma y crecimiento excelente y un volumen alto por hectárea (Cuadro 3). Los valores para la tasa de crecimiento en Turrialba (9.11, 31.52, 36.43 y 47.52 m3/ha/año) se aproximan a los valores obtenidos en Quintana Roo, de 44.62 m3/ha/año (Whitmore y Otarola, 1976; Chavelas, 1985). Cuadro 3. Comportamiento de Acrocarpus fraxinifolius en Turrialba, Costa Rica. Procedencia No. 3 India No. 4 India No. 5 Kenia No. 6 India Diámetro normal promedio (cm) 10.67 (1.52) 18.17 (2.60) 19.53 (2.79) 19.78 (2.83) Altura total (m) Volumen (m3/ha) Área basal (m2/ha) Supervivencia (%) Troncos rectos (%) 9.29 (1.33) 16.17 (1.33) 18.19 (2.60) 16.28 (2.33) 63.75 (9.11) 255.00 (36.43) 332.67 (47.52) 220.67 (31.52) 11.75 (1.68) 30.67 (4.68) 34.67 (4.95) 24.67 (3.52) 50% 100 Indice de comportamiento 4.00 76% 100 2.50 73% 100 1.25 51 96 2.25 Fuente: Adaptado de Whitmore y Otarola, 1976 NOTA: Los números en paréntesis, indican el incremento medio anual. 19 Los ensayos en condiciones adecuadas de clima, indican que el cedro rosado ha sido una de las especies de crecimiento más rápido, de 3 a 3.50 m por año durante los primeros años y alcanza de 16 a 18 m a los 7 años. La producción de madera varía de 30 a 45 m3/ha/año (Sepatro, 2001). En Nigeria, en condiciones de sabana (1,270 mm/año), llegó a 6.1 m en 4 años, después se estancó y se secó la plantación; en sabanas más húmedas creció 1.3 a 3.0 m/año, durante los primeros 7 años y posteriormente llegó a los 26 m en 23 años. En sitios con precipitación de 1,000 mm y estación seca prolongada ha dado un buen crecimiento inicial, seguido de una mortalidad muy alta. Otra plantación sobre sabana en Nigeria, llegó a una altura de 10.70 m y DAP de 9.5 cm promedio en 4 años. Esta especie presenta un crecimiento tan rápido que puede alcanzar una altura de 15 m en tan solo 4 años. En el Campo Experimental San Felipe Bacalar, Quintana Roo, se reportan incrementos hasta de 44 m3/ha/año. En Huimanguillo, Tabasco se evaluó el crecimiento del cedro rosado, y se encontró que a la edad de 1.5 años alcanzó una altura de 4.15 m y diámetro de 5.0 cm; a los 3 años presentó una altura de 7.40 m, diámetro de 8.2 cm y una sobrevivencia del 98% (Limón, 1989). En la zona de Xicotepec, Puebla, es excepcional en los primeros tres años, alcanzando una altura promedio de 6 m, con DAP de 16 cm, pero en lugares con mejores condiciones de clima y suelo a los 4 años presenta alturas promedio de 18 m. Se tienen datos de algunos sitios en donde el primer año hubo un crecimiento de 7.50 m de altura y un DAP de 11 cm (Menéndez, 1997; Sepatro, 2001). Existen plantaciones de A. fraxinifolius de 0.5 a 12 años de edad en los municipios de Venustiano Carranza, Xicotepec y Zihuateutla en el Estado de Puebla; cubren una superficie de 261.5 ha y se establecieron a diferentes espaciamientos de (3 x 3, 4 x 4, 5 x 5, 5 x 7.5 y 10 x 10 m), principalmente para dar sombra a las plantas de café. Los árboles establecidos han mostrado buenos índices de crecimiento, con fustes casi cilíndricos y ramificaciones por arriba de los 15 m. Esto hace que se puedan aprovechar, procesar y usar industrialmente, sin embargo, se desconocen muchos aspectos técnicos que permitan aplicar un manejo óptimo y un aprovechamiento tecnológico e industrial de su madera (Quintanar, 2002). El Instituto Nacional de Investigaciones Forestales (INIF), a través de su programa de plantaciones forestales, introduce al lazcar o cedro rosado en el año de 1972 en el Campo Experimental ―Ing. Eduardo Sangri Serrano‖, en Escarcega, Campeche con semilla procedente de Dola Hill, Zambia; estableciendo una parcela de 20 árboles; a los 7 años de edad tenían alturas de 10 a 20 m y diámetro normal de 7.6 a 33.4 cm, presentando la mayoría de ellos buena conformación (Chavelas, 1985). Se evaluaron ocho especies de rápido crecimiento (cuatro introducidas y cuatro nativas) en el C. E. ―Eduardo Sangri Serrano‖ en Escárcega, Campeche. Los resultados siguientes en altura, diámetro y sobrevivencia promedios son a la edad de 7 años: Gmelina arborea 10.75 m, 13.7 cm y 90%, Delonix regia con 4.34 m, 8 cm y 77%, Tectona grandis con 2.50 m, 3.90 cm y 20%, Enterolobium cyclocarpum con 20 1.67 m, 2.50 cm y 29% y A. fraxinifolius con 1.47 m, 1.30 cm y 7%, respectivamente. Se concluye que las especies que presentaron un mejor desarrollo fueron G. arborea y D. regia y las que tuvieron una alta mortalidad son T. grandis, E. cyclocarpum y A. fraxinifolius, debido al ataque de Sigmodon hispidus (rata de campo) y Heterogeomys hispidus (tuza) (Gómez, 1989). También se reporta el establecimiento de un ensayo de 9 especies (8 exóticas y una nativa) en el C. E. ―San Felipe Bacalar‖ en Chetumal, Quintana Roo, en una altitud de 10 a 20 m, precipitación de 1,250 mm, una temperatura promedio de 25.5°C y en tres tipos de suelo (litosol, vertisol y gleysol). Los resultados obtenidos a los 5 años con A. fraxinifolius en suelo litosol fueron de 1.68 m en altura, 2.0 cm de DAP y 16% de sobrevivencia promedio (Chavelas, 1984). Se realizó un estudio en cuatro localidades del trópico húmedo de México, en el C.E. de Bacalar, Quintana Roo sobre la adaptación y crecimiento de A. fraxinifolius; los resultados de la plantación a un año y medio en suelo tipo Gleysol, muestran alturas superiores a los 5 m. En el C. E. ―El Tormento‖, en Escárcega, Campeche, a la edad de 12 años presentó alturas de 20 m y diámetros superiores a los 36 cm, con incrementos anuales hasta de 3 cm en diámetro y 1.6 m en altura. En el C. E. de Villahermosa, Tabasco, a la edad de 3 años y medio esta especie presentó un IMAA de 3.0 m y un IMAD de 4.2 cm. En la localidad de Huimanguillo, Tabasco a la edad 2 años el cedro rosado presentó un IMAA de 3.7 m y un IMAD de 3.2 cm. Se concluye que esta especie se adapta bien en términos generales a todas las localidades donde se probó y se podría considerar como una especie promisoria para realizar plantaciones comerciales en el trópico húmedo (Cedeño, 1984). Debido a los buenos resultados obtenidos con esta especie en México, existen plantaciones comerciales importantes en los estados de Puebla, Veracruz, Oaxaca, Chiapas, San Luis Potosí, Colima, Michoacán y Tabasco y de menor importancia en otras regiones del país. 1.5.5. Plantaciones agrosilvopastoriles A. fraxinifolius es apropiado como árbol de sombra para plantaciones de té, café, cacao, etc. En Zambia, en experimentos entre 2 a 4 años de edad se comprobó un incremento anual en altura de 1.3 a 3.0 m y en otra plantación de 23 años, la altura media observada fue de 26 m. En condiciones ambientales favorables se puede contar con incrementos en volumen de 10 m3/ha/año (Sepatro, 2001). En la República Dominicana, el cedro se introdujo por primera vez en 1985 en el área de Zambrana, desde este año han sido plantados en pequeñas parcelas, en hileras y árboles dispersos en cafetales y cacaotales. El crecimiento en general fue excepcionalmente rápido, aunque con variaciones considerables según los sitios. El crecimiento promedio en altura varía a los 12-14 meses entre 1.95 y 5.71 m. A los 23-24 meses entre 2.76 y 5.89 m. El crecimiento de árboles individuales puede alcanzar en los mejores sitios hasta 8.50 m a los 12 meses, con casos frecuentes de 21 5-7 m a los 12 meses. A los 2 años pueden alcanzar 12.75 m de altura y 11.5 cm de DAP. Los árboles con 51 meses alcanzaron hasta 20 m de altura y 21.3 cm de DAP. Se observa un rendimiento de 47.5 m 3/ha/año. El mayor crecimiento se ha registrado en suelos frescos y con buena exposición al sol. En general, la forma de los fustes es excelente, con pocos árboles bifurcados o torcidos (Sepatro, 2001). En lugares donde se emplea el cedro rosado como sombra para café, el fruto ha presentado mejor calidad, ya que tiene mejor tamaño y uniformidad, además de un menor número de granos manchados. También se menciona que por ser una leguminosa que fija el nitrógeno del aire al suelo, el consumo de fertilizantes es menor, disminuyendo los costos para los productores, tanto en fertilizantes como en el control de malezas, evitando además, la erosión del suelo. En un estudio realizado en Cárdenas, Tabasco, se encontró que el cedro rosado y la melina, presentaron los mejores promedios en altura y diámetro, y que pueden ser especies apropiadas para utilizarse como sombra. Mencionan que el cedro rosado a los siete años presentó alturas de 14 m y diámetros de 26.1 cm; sólo fue superado por la melina, sin embargo, debido a que melina pierde las hojas en la época seca, el incremento de la exposición del café a los rayos solares, reduce su potencial como especie para sombra (Llera y Meléndez, 1989). En un estudio se valoró el crecimiento de árboles de cedro rosado a los 3.5 años de edad, en combinación con plantaciones de café a diferentes elevaciones en el Soconusco, Chiapas. En Junio de 2001, se plantaron 45 árboles en 12 parcelas distribuidas entre los 200 y 1,400 msnm. En Diciembre de 2004 se evaluaron los incrementos en diámetro (DAP), altura y la supervivencia; el análisis de varianza indicó que los árboles con los mejores crecimientos se presentaron en las parcelas que se localizan en altitudes de 280 a 750 m, con alturas que variaron de 9 a 13.3 m y diámetros de 17 a 22.2 cm. Se concluye que las condiciones edafoclimáticas de la región del Soconusco, Chiapas, son adecuadas para el desarrollo de un sistema agroforestal café-cedro rosado, ya que esta especie manifiesta buen potencial de crecimiento a las condiciones edáficas y climáticas de esta región (Reyes, 2005). 1.6. MEJORAMIENTO GENÉTICO Experiencias en Turrialba, Costa Rica. Las parcelas de ensayo están localizadas en dos sitios diferentes: Puente Cajón (Procedencia No. 3) y Florencia Sur (Procedencias 4, 5 y 6). El relieve en ambos es de llano a levemente ondulado. Altitud media sobre el nivel del mar es de 602 m; temperatura media mensual de 22.1 ºC y la precipitación de 2,591 mm. El clima de acuerdo a la clasificación de Holdridge corresponde al bosque muy húmedo premontano tropical. Los resultados se presentan en el Cuadro 4. Comparativamente las procedencias 4, 5 y 6, con el desarrollo de la procedencia No. 3 es notoriamente inferior para las variables analizadas ya que tiene tan solo volumen de 63.8 m3/ha para esta primera edad. De igual forma es relevante su poca 22 área basal (11.8 m2/ha) registrada, en contraste con valores de 30.7; 34.7 y 24.7 para las procedencias 4, 5 y 6. En éstas la prueba de ―t de Student‖ no arroja diferencias significativas en cuanto a variables independientes (DAP y altura). La superioridad de estas variables sobre la procedencia 3 se debe al mal drenaje del sitio. Se concluye que las cuatro procedencias tienen árboles con fustes rectos y limpios, ésto hace posible que A. fraxinifolius tenga pocas restricciones en cuanto a su uso (madera aserrada, pulpa para papel). La madera producida en estas plantaciones jóvenes demuestra un peso específico de 0.62 normal para la especie. Cuadro 4. Comportamiento de Acrocarpus fraxinifolius en Turrialba, Costa Rica. Procedencia No. 3 India No. 4 India No. 5 Kenia No. 6 India Procedencia No. 3 India No. 4 India No. 5 Kenia No. 6 India Fecha y lugar de plantación Junio 1968 P. Cajón Julio 1968 F. Sur Julio 1968 F. Sur Julio 1968 F Sur Promedio y límites de variabilidad Promedio DAP (cm) 10.670.77 (1.52) 18.171.44 (2.60) 19.531.64 Altura (m) 9.29 0.53 (1.33) 16.17 0.90 (2.31) 18.19 0.71 Volumen 3 (m /ha) 63.75 (9.11) 255.00 (36.43) 332.67 Área basal 2 (m /ha) 11.75 (1.68) 30.67 (4.38) 34.67 Factor mórfico 19.7810.9 0 (2.83) 16.28 1.08 (2.33) 220.67 (31.52) 24.67 (3.52) 0.52 --- 0.53 --0.19 --0.51 Supervivencia (%) Derechura de fustes Índice de comportamiento 50 --76 --73 51 --- 100 --100 --100 96 --- 4.00 --2.50 --1.25 2.25 --- 1.7. PROPIEDADES Y USOS 1.7.1. Propiedades físico-mecánicas de la madera El peso específico de la madera es de 0.690, con un contenido de humedad del 12%. La albura de la madera es de color blanquecino; el duramen es de color rojo claro o marrón rojizo; es muy empleado como decorativo por su veteado oscuro, contiene una resina gomosa que brota después de la tala, es fácil de impregnar, su dureza y resistencia son medianas, se puede trabajar con facilidad, no presenta problemas para ser torneada, cepillada y pulida (Sepatro, 2001). 23 Las fibras son de 1.35 mm de largo y 31 micrómetros de diámetro, en promedio tiene un grano entrelazado y la textura de la madera es gruesa; la madera se conserva de 2-5 años a la intemperie, sin tratamiento (Menagro, 2001). El cedro rosado pesa en promedio 690 kg/m3 al 12 % de contenido de humedad y se comporta muy bien en el secado (Sharma S.N). Se ha encontrado que a mayor peso específico, mayor es la longitud de las fibras y que a mayor altura en el tronco, disminuye el peso específico de la madera. Se realizó un estudio en la Ciudad de Morelia, Michoacán con la finalidad de determinar las características físicas y mecánicas de la madera de A. fraxinifolius. Se muestrearon 8 árboles con un diámetro de 15-25 cm. En el Cuadro 5, se muestran sus propiedades físicas y mecánicas en la madera (Camarena y Sánchez, 2002). Cuadro 5. Propiedades físicas y mecánicas de la madera de Acrocarpus fraxinifolius. Propiedad Valor promedio Clasificación Densidad Básica Contenido de humedad inicial Contracción Radial Flexión Tangencial Estática Longitudinal Compresión Elp Perpendicular Mor Tensión Paralela Moe Tensión Perpendicular Elp Resistencia a Rajaduras Mor Extracción de Clavos Esfuerzo Máximo Dureza Janka de resistencia Esfuerzo Máximo de resistencia Longitudinal Transversal Longitudinal Transversal 0.49 g/cm3 71,6% 3.75% 7.095 5.07% 678.50 (kg/cm2) 853.18 (kg/cm2) 136,119.6 (kg/cm2) 108.02 (kg/cm2) 705,23 (kg/cm2) 20.72 (kg/cm2) 8.96 (kg/cm2) 142 kg 96 kg 201.16 kg 513 kg Media Baja Media Alta Media Media Fuente: Camarena y Sánchez, 2002. Donde: Elp: Esfuerzo al límite de proporcionalidad Mor: Módulo de ruptura Moe: Módulo de elasticidad De acuerdo a los resultados obtenidos en los diferentes ensayos mecánicos, la madera se clasifica de mediana a baja resistencia, sin embargo, cumple con las características de resistencia para ser usada en estructuras de cimbra, polines, vigas 24 y viguetas no estructurales, marcos, molduras, barandales, puertas, paneles y cajas de empaque, entre otros. Por su estabilidad dimensional (radial-tangencial) se clasifica como media y puede ser utilizada para ebanistería en artículos como muebles o artesanías, aprovechando el veteado que presenta. De acuerdo a los resultados de la descripción macroscópica y microscópica, se menciona que el 90% de la madera en las trozas estaba formada por albura, la cual resultó ser de color blanco a blanco amarillento con jaspeaduras beige anaranjado. El duramen es incipiente y de color rosa a naranja pálido con jaspeaduras más oscuras. Presenta olor a raíz de jícama y sabor ligeramente dulce, textura media, hilo entrecruzado, veteado suave y brillo de medio a alto (García et al., 2002). En cuanto a los índices de calidad de pulpa para papel los resultados se muestran en el Cuadro 6. Cuadro 6. Índices de calidad de pulpa para papel en Acrocarpus fraxinifolius. Indice de calidad Coeficiente de rigidez Coeficiente de flexibilidad Coeficiente de peteri o índice de esbeltez Relación runkel Valor Denominacion 0.27 0.72 51.20 0.37 De pared delgada De pared delgada No existe clasificación Muy bueno Fuente: Sepatro, 2001. Se le ha dado a la madera de cedro rosado un índice de calidad de trabajo de 74, debido a su fácil asierre, secado y labrado (Sepatro, 2001). 1.7.2. Usos La madera es apropiada para acabados interiores finos, para muebles y para chapas. En su área de distribución natural es utilizada para el entablillado de techos, como madera de construcción, para pisos, escaleras, cajas de té, puertas e impregnadas para fabricar durmientes (Lamprech, 1989 (a) y Sepatro, 2001). En la India se usa como materia prima para la elaboración de pulpa para papel y construcciones, donde es apreciada por ser dura y fuerte. También se emplea para muebles y cajas. La sombra ligera lo hace ideal para la producción de madera en cafetales y cacaotales. En Sri Lanka se usa para sombra de té. Es una excelente barrera rompevientos, además de ser melífero. La madera puede aserrarse y trabajarse con facilidad, se obtiene un buen acabado y toma un buen pulido. Se ha usado como sustituto del fresno o nogal en la fabricación de muebles y se usa para entarimados, construcciones en general, tejamanil para 25 techos, etc. (Howar, 1951; Hutchnsos, 1964; National Academy of Sciences 1979 y Streets, 1962 citados por Cedeño, 1984). En los países en donde se cultiva cedro rosado extensamente, existe una gran cantidad de productos que se obtienen de esta madera. Entre los más importantes están los muebles, carpintería, ebanistería, cajas para embalaje, tarimas, además de ser utilizada en construcciones y pulpa para papel (Menéndez, 1997). Por su buena trabajabilidad, dureza media y color claro, lo cual facilita el teñido de la madera con pinturas vinil-acrílicas y con tintes al aceite o al alcohol, se recomienda para artesanías y manualidades. Debido a su constitución homogénea (pues no presenta zonas de crecimiento bien definidas) y dureza media se recomienda para figura tallada y colada. Por su color claro y limpio, su veteado suave, así como la buena trabajabilidad, se recomienda para juguetes y muebles infantiles. La madera de olor y sabor débil y agradable, de densidad media y un color claro, además de ser barata, la hace recomendable para elaborar cajas de empaque para frutas, verduras, dulces y regalos (García et al., 2002). En México se cultiva y su madera se utiliza para fabricar muebles y para construcciones rurales (Niembro, 1986, citado por SIRE, 2005). En Uganda, el cedro rosado ha sido usado para plantaciones de enriquecimiento, con bastante éxito a pesar de la presencia de termitas (Whitmore y Otarola, 1976). Se planta bastante en la India, conjuntamente con la teca y es muy popular en Kenia como sombra de café (Sepatro, 2001). También se utiliza como cortina rompevientos por su excelente resistencia, debido a que su tallo no es quebradizo. Es ideal para cultivos orgánicos, ya que no compite por nutrientes. Por ser melífera, sus flores atraen las abejas favoreciendo la producción de miel. Además el cedro rosado puede sembrarse para conservación de taludes, mejoramiento de suelos, cercas vivas, tutores vivos en el caso de la vainilla, etc. (Sepatro, 2001). El cedro rosado crece como árbol ornamental y de sombra en muchas partes de África, a elevaciones fuera de la sabana (Laurie, 1974 citado por Menagro, 2001) En su lugar de origen se aprovecha el follaje como forraje; se recomienda para el control de la erosión en las riberas de los ríos, así como para estabilizar terrazas. Se está promoviendo para plantaciones forestales de tipo comercial en México (AgroForester Tropical seeds, citado por Cedeño, 1984; Menagro, 2001; Sepatro, 2001). El cedro rosado tiene diversos usos y con un gran potencial para el establecimiento de plantaciones comerciales y agroforestales. Por la abundancia y colorido de sus flores, también se le utiliza como árbol de ornato (REMGEFOR, 2005). 26 Recientemente en México esta especie, esta siendo muy demandada para las regiones cafetaleras de los estados de Veracruz y Puebla, como árbol de doble propósito, es decir, como sombra para café y para producir madera por la rectitud de su fuste y la calidad de sus madera, que puede compararse con la del cedro rojo (REMGEFOR, 2005). 27 CAPÍTULO 2 Brosimum alicastrum Swarts Fotografía tomada por María Leonor Román Miranda. 28 2.1. DESCRIPCIÓN DE LA ESPECIE 2.1.1. Nombre común A la especie Brosimum alicastrum Swarts, se le conoce con los nombres comunes: Berbá, berba y cacique (Panamá); tillo (Ecuador), manchinga o congona (Perú,), muiratinga (Brasil); mare (Colombia); guaimaro, charo, sande (Colombia, Venezuela) capomo (Belice) (Anónimo, 1972; http://www.peruwoodproducts.com/Congona.html; Amazonia, 2005; Pellicer, 2005; Batis et al., 1999; Richter y Dallwitz, 2000; http://ctfs.si.edu/webatlas/spanish/brosal.html). En México se le conoce como ramón (Oaxaca, Campeche, Yucatán, Quintana Roo); ojoche (Oaxaca, sur de Veracruz); ox (lengua Maya - Yucatán, Tabasco); nazareno, samaritano, juan diego (Costa de Oaxaca); capomo, apomo (Sinaloa, Nayarit, Jalisco, Veracruz, Oaxaca); mojú, moho, talcoite, ash, osh (Chiapas); huje, Hují (Michoacán); mojote (Colima); ramón blanco, ramón colorado, ramón de mico (Quintana Roo); oshté, ojosh, oxitle (San Luis Potosí); ojite (Veracruz, Tamaulipas, Oaxaca); a-agl (Iengua Tepehuana – Durango); hairri, hairi-te (Iengua Huichol Jalisco); jauri (Iengua Cora – Nayarit); juksapuo, jushapu (Iengua Totonaca – Veracruz); lan-fe-lá (Iengua Chontal – Oaxaca); mojcuji (Iengua Popoluca – Veracruz); tlatlacotic (Iengua Náhualt); tumuni-taján (Iengua Mixteca - Oaxaca); ujushte, masico, tsutz ax, ax, mo, muju, talcoite (en lengua maya), ajah en Chiapas (Batis, et al., 1999; Huerta y Becerra, 1974; Susano, 1981; Pennington y Sarukhán, 1998 a; Pellicer, 2005; http://148.202.81.1/new/ informacionacademica/coaxican /plts_mex/capomo.htm). 2.1.2. Taxonomía Familia: Moraceae Género: Brosimum Especie: Brosimum alicastrum Swarts (http://148.202.81.1/new/informacionacademica/coaxican/plts_mex/capomo.htm; Pellicer, 2005; http://www.peruwoodproducts.com/Congona.html). 2.1.3. Especies relacionadas B. alicastrum tiene como sinonimia a B. conzatti Standl.; B. gentlei Lundell.; B. terrabanum Pittier; Helicostylis ojoche K. Schum. ex Pittier y Piratinera terrabana (Pittier) Lundell (Batis et al., 1999). 29 2.1.4. Forma Es un árbol monoico que puede alcanzar de 20 a 45 m de altura y diámetro hasta 200 cm, es perennifolio (Figura 2) y crece en los bosques húmedos, aunque en los lugares secos puede comportarse como caducifolio. Copa amplia, redondeada y con follaje denso. El fuste es recto, cilíndrico y con contrafuertes grandes y bien formados, de 1.5 a 4 m de alto, 6 a 10 por tronco, redondeados a ligeramente tubulares, aplanados. Ramas ascendentes (Figura 2) y luego colgantes, copa piramidal con denso follaje. Es un árbol de tronco recto, copa estrecha y raíces bien desarrolladas en la base, las cuales presentan cicatrices horizontales. En los árboles más viejos las raíces se prolongan superficialmente a más de 15 m desde la base del árbol. El desprendimiento de cualquier parte de la planta produce el flujo de un exudado lechoso, el cual se torna marrón-crema momentos después. La corteza interna contiene una sustancia blancuzca que brota al hacer un corte. No se cultiva ni requiere cuidados para crecer sus 40 m de alto, ya que es de naturaleza silvestre (Batis et al., 1999; Pennington y Sarukhán, 1998; CNIC, 2005; Chavelas y Dewall, 1988; http://148.202.81.1/new/ informacionacademica /coaxican/plts_mex/ capomo.htm; Pellicer, 2005; http://ctfs.si. edu/webatlas /spanish/brosal.html). 2.1.5. Corteza El grosor de la corteza es de 7 a 12 mm. La corteza externa es grisácea con tonos amarillentos, áspera, lenticelada redondeadas o más largas que anchas y con fisuras abundantes (Figura 2). La corteza interna es suave, arenosa, fibrosa y de color crema amarillento, fibrosa a granulosa, con abundante exudado lechoso, ligeramente dulce y pegajoso. (http://148.202.81.1/new/informacionacademica/coaxican/plts_mex/ capomo.htm). 2.1.6. Hojas Las hojas son alternas, simples de 4-18 cm de largo y de 2-8 cm de ancho, elípticas a ovado- elípticas a ovaladas-oblongas, con ápice agudo, acuminado o mucronado, bordes enteros, base cuneada o redondeada y con estípulas deciduas, persistentes en los ápices de las ramitas a manera de una yema terminal, lisas, enteras, son coriáceas y presentan una nervadura submarginal muy distintiva a lo largo de los bordes (Figura 2); en plantas juveniles, las hojas son ásperas al tacto, tienen los bordes dentados y el ápice largamente acuminado. La base de las hojas es cuneada u obtusa, márgenes enteros, de color verde oscuro en el haz y en el envés de color verde grisáceo blanquecino, glabro y cortamente pecioladas de 2 a 12 mm. Nerviación conspícua en el envés y pecíolo corto decurrente (http://148.202.81.1/ new/informacionacademica/coaxican/plts_mex/capomo.htm). 30 Figura 2. A) Árbol. B) Corteza y C) Hojas y frutos de Brosimun alicastrum. 2.1.7. Flores La especie presenta flores unisexuales, solitarias y axilares, de color verde o amarillentas, reunidas en cabezuelas globulares, con una o dos flores femeninas rodeadas por menudas flores masculinas. Las flores monoicas y dioicas, solitarias y axilares, con ovario ínfero y un solo lóculo. Las flores femeninas están en cabezuelas oblongas, ovales, con escamas más pequeñas, hundidas en cabezuelas, estilo de 2 a 5 mm, pedúnculo de 1 a 5 mm. Las flores masculinas están reunidas en amentos globosos, compuestos de escamas peltadas, carecen de corola y con 1 estambre. La flor estaminada es amarilla y la pistilada es verde. En Panamá florece y fructifica durante todo el año, principalmente de mayo a octubre (http://148.202. 81.1/new/informacionacademica/coaxican/plts_mex/capomo.htm; http://ctfs.si.edu/ webatlas/spanish/brosal.html). 31 2.1.8. Frutos El fruto es un aquenio o algunos autores lo citan como baya o drupa de 2 a 3 cm de diámetro, globosas con pericarpio carnoso, verde amarillento a anaranjado o rojo en completa madurez, de sabor y olor dulces, cubierta en la superficie de numerosas escamas blancas, con lenticelas blancas en el exterior, tornándose amarillo al madurar, esférico de unos 2 cm de diámetro; pericarpio verdoso o anaranjado, que mide de 15 a 20 cm; carnoso y con escamas de sabor dulce y agradable; mesocarpio poco desarrollado, de sabor dulce. Los frutos contienen de una a tres semillas, testa papirácea amarillenta, endospermo formado por dos cotiledones gruesos y feculentos (Figura 2). La radícula es saliente y encorvada sobre uno de sus cotiledones. Las semillas son de 9 a 13 mm de largo por 16 a 20 mm de ancho, esféricas y aplanadas en ambos extremos, cubiertas de una testa papirácea de color moreno claro, con los cotiledones montados uno sobre el otro, verdes, gruesos y feculentos. La semilla fresca tiene 45 a 55% de humedad (Pennington y Sarukhán, 1998 (a); http://ctfs.si.edu/webatlas/spanish/brosal.html). 2.2. DISTRIBUCIÓN Y HÁBITAT 2.2.1. Distribución geográfica Es una especie nativa de América tropical, su extensión va desde el sur de México a través de Centroamérica hasta la cuenca amazónica en Brasil, Colombia, Perú y Venezuela y en las Islas del Caribe: Cuba, Jamaica y Trinidad. En Panamá crece a bajas y medianas elevaciones, en climas húmedos o muy húmedos. Se encuentra ampliamente distribuida en los bosques del Canal de Panamá, pero es más frecuente en los bosques de la parte central y del Pacífico. En la región amazónica peruana se encuentra en estado silvestre y cultivado, Puede encontrarse en Guatemala y Belice. Se localiza en el Pacífico Noroeste de Costa Rica en el Bosque Tropical Seco y en México crece en las zonas húmedas y cálidas del país, en el Bosque tropical perennifolio (Pellicer, 2005; Batis et al., 1999; Azcárraga y Rabiza, 2001; http://www.acguanacaste.ac.cr/1999/educacion/sectorbs.html; http://ctfs.si.edu/ webatlas/spanish/brosal.html). Habita en las formaciones ecológicas de bosque húmedo tropical y bosque seco tropical prefiriendo terrenos aluviales aunque no desprecia las colinas (http://www.peruwoodproducts.com/Congona.html). Se extiende desde el sur de México a través de Centroamérica, hasta Colombia, Perú, Venezuela y en las islas del Caribe: Cuba, Jamaica y Trinidad (Batis et al., 1999). Se encuentra en el bosque tropical perennifolio, bosque tropical caducifolio, bosque espinoso y matorral xerófilo; desde Sinaloa hasta Chiapas en el litoral pacífico, en el litoral del Golfo de México desde Tamaulipas hasta Quintana Roo; también se le encuentra en la Cuenca del Balsas en Michoacán y Morelos (Batis et al., 1999; Chavelas y Dewall, 1988 y Pennington y Sarukhán, 1998 a). 32 Se distribuye en Nayarit, Sinaloa, Jalisco, Colima, Michoacán, Guerrero, Oaxaca, Chiapas, Tamaulipas, Veracruz, Tabasco Quintana Roo, Campeche y Yucatán (Huerta y Becerra, 1974; Vega et al., 2003). En la vertiente del Golfo se presenta desde el sur de Tamaulipas hasta Quintana Roo y se distribuye a lo largo de la Sierra Madre Oriental y la Sierra de Chiapas hasta una altitud de 600 m, así como en la gran parte de la planicie costera del Golfo hasta la península de Yucatán; en la vertiente del Pacífico se distribuye desde el centro de Sinaloa hasta Chiapas. Abunda en la Costa de Pacífico desde el nivel del mar hasta los 200 m aproximadamente. B. alicastrum es un árbol característico de las zonas tropicales del continente americano y su área de distribución en México va desde el sur de Sinaloa a Chiapas y del sur de Tamaulipas a la Península de Yucatán. Aunque esta especie tiene un amplio espectro ecológico, su mayor abundancia y desarrollo se presenta en las zonas tropicales húmedas. Sus condiciones climáticas y edáficas son notablemente diferentes con respecto a las encontradas en regiones tropicales húmedas del Golfo de México y la Península de Yucatán. En la costa del Océano Pacífico se determinaron 22 zonas ecológicas en una gran variabilidad ambiental en 10 estados (Sinaloa, Durango, Nayarit, Jalisco, Colima, Michoacán, Guerrero, Estado de México, Oaxaca y Chiapas), con presencia y formando parte de selva mediana subperennifolia, selva mediana subcaducifolia, selva alta perennifolia, selva alta subcaducifolia y en palmar, sin embargo, sólo en los tres primeros tipos de vegetación la especie de interés fue relativamente abundante. Se localiza principalmente en aquellos sitios donde las condiciones edáficas ofrecen a las plantas una mayor disponibilidad de agua a lo largo del año. También se presenta en sitios con alta humedad ambiental, como barrancas protegidas o zonas expuestas a la brisa marina. En la selva mediana subperennifolia donde presentó su mayor abundancia y desarrollo. En la selva mediana subcaducifolia, B. alicastrum se considera como una especie arbórea codominante, encontrándose en las zonas más húmedas y en ecotonos con la selva mediana subperennifolia, presenta un menor desarrollo estructural comparado con este último tipo de vegetación e incluso puede tirar su follaje en los sitios más secos, como una adaptación al estrés hídrico (Vega et al., 2003). En Quintana Roo se distribuye tanto en la selva alta subperennifolia como en la selva mediana subperennifolia (http://www.mexicoco.net/Fotografìagrafias/quintanaroo /chetumal/ datos/historia_de_chetumal.html) B. alicastrum prospera en sitios de cañada, de naturaleza caliza, con tiempos cortos de insolación, en llanos o terrenos con declives escarpados, sobre laderas calizas muy inclinadas, aunque desarrolla mejor en los llanos fértiles. 33 2.2.2. Clima En Colombia crece en la Sierra Nevada de Santa Marta y Cordillera Oriental precipitaciones anuales de 1,000 a 2,000 mm y temperaturas de 21.5 a 23.5 ºC. (CNIC, 2005). Los requerimientos de temperatura media anual máxima de 25,1 a 31.1 ºC y temperatura media anual mínima de 18 a 23,2 ºC. En el Pacífico Noroeste de Costa Rica se localiza temperatura promedio de 24 ºC (Von Carlowitz et al., 1991 citados por SIRE, 2005; http://www.acguanacaste.ac.cr/1999/educacion/sectorbs.html). Se localiza en áreas con precipitación media de 1,496.5 mm; promedio máximo de precipitación total de 2,500 a 4,000 mm en el caso de Chiapas y Tabasco; promedio mínimo de 600 mm en Tamaulipas. En el Pacífico Noroeste de Costa Rica es de 1,500 a 2,000 mm, (Von Carlowitz et al., 1991; Batis et al., 1999 citados por SIRE, 2005; http://www.acguanacaste.ac.cr/1999/educacion/sectorbs.html). En la costa del Océano Pacífico en México se ubicó en terrenos con precipitación de 945 a 2,509 mm anuales (Cuadro 7), de acuerdo al tipo de vegetación donde se distribuye B. alicastrum (Vega et al., 2003). Cuadro 7. Precipitación media anual en los diferentes tipos de selva de México. Tipo de selva Caducifolia Subcaducifolia Subperennifolia Perennifolia 945 177 1130 67 1640 55 2509 40 Precipitación (mm) Número de observaciones 2.2.3. Altitud y topografía En Colombia crece en la Sierra Nevada de Santa Marta y Cordillera Oriental, en altitudes de 800 a 1200 m (CNIC, 2005). Aunque puede crecer desde el nivel del mar hasta los 1,000 m de altitud, lo más común es que se le encuentre entre los 221 a 300 msnm, aunque se localiza hasta 650 msnm (Von Carlowitz et al., 1991; Batis et al., 1999 citados por SIRE, 2005; Pellicer, 2005; http://www.acguanacaste.ac.cr/1999/educacion/sectorbs.html). Abunda en la Costa de Pacífico, tanto en las laderas en la Sierra Madre Occidental desde el nivel del mar hasta unos 400 u 800 msnm como en la planicie costera. En la vertiente del Golfo se presenta desde el sur de Tamaulipas hasta Quintana Roo y se distribuye a lo largo de la Sierra Madre Oriental y la Sierra de Chiapas hasta una altitud de 600 m (http://148.202.81.1/new/informacionacademica/coaxican/plts_mex/ capomo.htm). 34 En la costa del Océano Pacífico se registra que del 98.4% de la superficie ocupada por las zonas ecológicas, B. alicastrum se encuentra por abajo de los 400 msnm, con sólo una pequeña superficie por arriba de los 600 msnm. En la selva mediana subperennifolia el 82.2% de la superficie original que ocuparon las zonas ecológicas de B. alicastrum se encontró entre las isoyetas de 600 mm a 1,200 mm anuales, que es el nivel más bajo registrado para esta especie en el país. EL 97.6% de la superficie que ocupa la selva mediana subcaducifolia se encuentra por abajo de los 600 msnm y su límite superior marca la zona de transición entre la zona tropical y templada en la vertiente del Océano Pacifico. Asimismo, el 84,1% de la superficie que ocupan las zonas con B. alicastrum en este tipo de vegetación se encuentra entre las isoyetas de 1,000 mm a 1,400 mm anuales. Es común que algunas de estas zonas ecológicas se encuentren en lugares más lluviosos que las selvas medianas subperennifolias, especialmente en las laderas de sierras expuestas a vientos húmedos provenientes del mar; sin embargo, una mayor precipitación en estos lugares no parece mejorar las condiciones del sitio, ni la abundancia y posible desarrollo de B. alicastrum. Se considera que puede ser consecuencia de que las lluvias, aunque más abundantes, están concentradas en pocos meses y los suelos, por ser delgados y de texturas gruesas, no pueden almacenar suficiente cantidad de agua. Además, debido a que estos lugares se localizan a una mayor altitud, presentan una menor temperatura ambiente, lo cual pudiera también influir en la adaptación y desarrollo de B. alicastrum. La densidad puede considerarse como moderada en la selva alta perennifolia y puede ser más abundante en cerros pedregosos con suelos delgados de origen calcáreo. El 86% de la superficie que ocupa este tipo de vegetación se encuentra localizada entre los 800 y 1,800 msnm, una distribución altitudinal poco común, en virtud de que en esa región la isoterma mínima extrema de 0 °C se encuentra cercana a los 1,700 msnm; sin embargo, las temperaturas media anual y del mes más frío son superiores a los 21,5 °C y 18 °C, respectivamente, situándose dentro del límite climatológico de las zonas tropicales húmedas en México (Vega, 1989 y Rzedowski, 1981). En gran parte de la superficie que ocupa la selva alta subcaducifolia se localiza a menos de 200 msnm, colindando en su límite altitudinal inferior con los manglares y la selva baja caducifolia y caducifolia espinosa y en el superior con la selva alta perennifolia (COTECOCA, 1972 y COTECOCA, 1980). La selva alta subcaducifolia se encuentra en áreas de transición con climas cálido subhúmedos a húmedos, es fisonómicamente similar a la selva alta perennifolia en la época de lluvias y gran parte de sus especies arbóreas son caducifolias en la época seca; prospera principalmente en suelos de buena calidad en la llanura costera, pero estos poseen una baja capacidad de retención de agua debido a su textura arenosa, situación que puede afectar la abundancia de B. alicastrum en este tipo de vegetación. El palmar en la vertiente del Océano Pacífico colinda con el manglar y las selvas baja caducifolia y medianas subcaducifolia y subperennifolia. Gran parte de los palmares se encuentran en planicies y, en menor cantidad en cañadas y lomeríos. Las zonas de palmares con presencia de B. alicastrum tienen una diferenciación de diversidad 35 de especies arbóreas de moderada a alta entre sitios y una baja similitud florística entre los mismos. Así mismo, los palmares mostraron la más baja densidad de individuos de la especie de interés (menos de cuatro árboles por hectárea), ya que por lo general esta especie se encuentra en los ecotonos con las selvas medianas subperennifolia y subcaducifolia (Castro, 2002 y González, 2002 citados por Vega et al., 2003). No obstante que B. alicastrum es, generalmente, una especie componente de selvas húmedas, ésta tiene un amplio espectro ecológico y prospera en sitios que proporcionen un mínimo de satisfactores de crecimiento, principalmente de tipo climático. Esta especie parece ser tolerante a restricciones en el suelo (altos niveles de pedregosidad, rocosidad y carbonato de calcio) y a una escasa apertura del dosel (Pennington y Sarukhán, 1998). La precipitación y la altitud fueron las variables que contribuyeron en mayor medida a la agrupación de sitios con presencia de B. alicastrum en diferentes zonas ecológicas. La costa del Pacífico presenta las condiciones más secas en el país donde prospera la selva mediana subperennifolia con presencia de B. alicastrum, ya que su precipitación promedio es inferior a la media nacional para este tipo de vegetación. En contraste, la costa del Pacífico posee las condiciones más húmedas de México para la selva mediana subcaducifolia donde se encuentra esta especie, debido a que su precipitación promedio en este tipo de vegetación es superior a la media nacional (Vega et al., 2003). En la vertiente del Golfo se desarrolla con marcada preferencia en cerros de topografías cársticas de origen calizo, es dominante en las selvas altas perennifolias, medianas subperennifolias y subcaducifolias, asociadas principalmente con Aphananthe monoica, Bursera simaruba, Manilkara zapota y Carpodiptera ameliae (Pennington y Sarukhán, 1998; Rzedowski, 1983 en http://148.202.81.1/new/ informacionacademica/coaxican/plts_mex/capomo.htm). 2.2.4. Suelos Prospera en suelos someros, no inundables, preferentemente en suelos arcillosos a francos, arcillosos y limosos, de color rojizo a gris oscuro; con buen drenaje, ricos en materia orgánica y de buena fertilidad, pH neutro, de ligeramente ácidos a alcalinos (6.8-8.2), pedregosos con afloramiento rocoso. Crece en suelos del tipo Ultisol, Leptosol, Vertisol, Oxisol y Rendzina; poco profundos, someros con profundidad menor a 50 cm, pobres en nutrientes, disponibilidad de materia orgánica de moderada a rica. Tolera anegamientos temporales y prolongados períodos secos (Batis, et al., 1999; Chavelas y Dewall, 1988 y Von Carlowitz et al., 1991; SIRE, 2005 b). 36 En Colombia se desarrolla en la Sierra Nevada de Santa Marta y Cordillera Oriental en suelos franco arcillosos (CNIC, 2005). En los Cuadros 8 al 12 se presentan las características ecológicas de las zonas con B. alicastrum en la Costa del Océano Pacífico de México, por tipo de vegetación (Vega et al., 2003). Cuadro 8. Características ecológicas de las zonas con Brosimum alicastrum en la selva mediana subperennifolia de la Costa del Océano Pacífico. CARACTERÍSTICA Localización : Entidad y No. De sitio Superficie (ha) Fisiografía Altitud (m) Pendiente (%) Rocosidad (%) Pedregosidad (%) Profundidad del suelo (cm) Capacidad de almacenamiento de agua en el suelo (mm) pH del suelo Precipitación media (mm) Temporada de lluvias (días) Período de crecimiento vegetal (días) Temperatura media (ºC) Especies características Selva mediana subperennifolia Zona 1 Nayarit (9,10) Sinaloa (14-16) 223,137 Planos, dunas y vegas de río 26 - 75 2.0-2.5 0 0-5.5 Zona 2 Michoacán y Colima (1 y 8), Sinaloa (17) Zona 3 Jalisco (5-7), Nayarit (11 y 12) Zona 4 Guerrero (2-4) Zona 5 Oaxaca (13) Zona 6 México (18-20) 57,713 Planos, aluviales, cañadas y cerros 310-525 3-50 1.5-40 0-30 146,423 Planos, valles, cañadas y cerros 102-350 2-40 0-11.5 0-22.5 225,170 Planos, lomeríos y cerros 15,528 Cerros 10 Cañadas 200-300 11.5-45 0-15 0-12.5 650 18 --------- 875-1050 38-55 1.7-15 2.5-70 100 50-100 25-100 75 37.5 25-150 176-436 191-221 87-326 95-175 53 40-251 5.5 1000-1150 6.6-6.7 900-950 6.3-6.6 1500-1750 5.4 1500 121-140 121-160 150-169 5-5.5 11501200 143-174 148 6.6 12001350 152-165 197-365 161-234 194-301 189-208 171 163-293 25-26 25-29 24-26 26-27 22 23-24.5 B. alicastrum E. cyclocarpum Ficus spp. B. alicastrum H. polyandra R. donell smith B. alicastrum E. cyclocarpum H. polyandra A. graveolens B. alicastrum B. simaruba P. acapulcencis C. candissimum B. alicastrum L. arborea F. padifolia 0.53 0.50 0.57 ----- 0.50 38.7 42.4 26.1 ----- 34 31 28 43 19 19 Índice promedio 0.062 de diferenciación de diversidad entre sitios Indice medio de 24 similitud florística entre sitios No. especies 28 arbóreas Fuente: Vega et al., 2003. 37 Cuadro 9. Características ecológicas de las zonas con Brosimum alicastrum en la selva mediana subcaducifolia de la Costa del Océano Pacífico. Características Localización : Entidad y no. De sitio Superficie (ha) Fisiografía Altitud (m) Pendiente (%) Rocosidad (%) Pedregosidad (%) Profundidad del suelo (cm) Capacidad de almacenamiento de agua en el suelo (mm) Ph del suelo Precipitación media (mm) Temporada de lluvias (días) Período de crecimiento vegetal (días) Temperatura media (ºc) Especies características Índice promedio de diferenciación de diversidad entre sitios Indice promedio de similitud florística entre sitios No. De especies arbóreas registradas Selva mediana subcaducifolia Zona 7 Zona 8 Zona 9 Zona 10 Zona 11 Guerrero (4), Jalisco (8), Michoacán y Colima (1 y 2) Guerrero (6 y 7) y Nayarit (14) Guerrero (5), Jalisco (10) y Nayarit (13) Sinaloa (18) 457,616 Planos, lomeríos y cerros 500-600 6.5-40 10-40 0-37.5 12.5-50 946,897 Cerros y cañadas Guerrero (3), Oaxaca (16 y 17), Jalisco (9), Nayarit y Durango(11, 12 y 15) 1’336,527 Planos, lomerío, cañadas y cerros 732,932 Cerros y cañadas 283,878 Cerros 500-700 33.5-37.5 10-20 0-30 25-50 100-600 6.5-31 2-25 7.5-40 25-75 535-650 30-40 12.5-17.5 5-16 12.5-75 100 25 17.5 40 50 44-110 24-37 37-125 62-71.5 69 5.5-6.5 800-1075 5-6.7 1234-1368 5.5-6.8 1200-1496 5.5-6.6 1500-1550 6.7 760 147-152 139-171 128-188 155-171 121 171-195 168-182 157-215 180-199 142 23-26 23-25.5 23-24.7 24-26 25 E. cyclocarpum T. rosea B. simaruba 0.49 C. pentandra L. arborea B. arborea E. cyclocarpum T. crysantha T. rosea A. gravelolens E. cyclocarpum B. alicastrum C. sclerocarpa S. cirrhata 0.57 0.66 0.63 ---- 40.8 28.9 21 22.7 ---- 21 25 43 29 8 Fuente: Vega et al., 2003. 38 Cuadro 10. Características ecológicas de las zonas con Brosimum alicastrum en la selva alta perennifolia de la Costa del Océano Pacífico. Características Localización : Entidad y no. De sitio Superficie (ha) Fisiografía Altitud (m) Pendiente (%) Rocosidad (%) Pedregosidad (%) Profundidad del suelo (cm) Capacidad de almacenamiento de agua en el suelo (mm) Ph del suelo Precipitación media (mm) Temporada de lluvias (días) Período de crecimiento vegetal (días) Temperatura media (ºc) Especies características Índice promedio de diferenciación de diversidad entre sitios Indice promedio de similitud florística entre sitios No. De especies arbóreas registradas Selva alta perennifolia Zona 12 Zona 13 Zona 14 Chiapas (1) Chiapas (2) Chiapas (3) 128,000 Planos costeros 70-140 1-2 2 1 200 456,500 Cerros 200-1500 35-80 16-90 10-25 50 327,900 Cerros 140-1800 30-74 40-60 10 80 144-332 88 112 5.5 3000 5-6.5 1750 5-6.5 4500 200-244 217 233 312 245 265 25.7 T. amazonia V. guatemalensis 23.6-27.7 T. amazonia S. mexicana ----- 21.5 A. zapota B. flamea Z. integerrima ----- ----- ----- ----- ----- 12 17 Fuente: Vega et al., 2003. 39 ----- Cuadro 11. Características ecológicas de las zonas con Brosimum alicastrum en la selva alta subcaducifolia de la Costa del Océano Pacífico. Características Selva alta subcaducifolia Zona 15 Zona 16 Zona 17 Zona 18 Localización : Entidad y No. De sitio Chiapas (1) Chiapas (2) Chiapas (3) Oaxaca (4 y 5) Superficie (ha) Fisiografía 261,000 Planos y vegas de río 20-200 1-5 5 3 200 No determinada Vegas de río No determinada Laderas y barrancas 72,601 Planos y lomeríos 450-700 1-4 2 1 200 500-800 15-75 Menor de 35 Mayor de 15 25 69-105 5-10 5-20 3-35 100-200 126 120 33 140-146 5.3 2100 5-6.5 2000 6.7 800-2294 5.3-7.25 1350 196 186 217 185 233 221 224 205-224 27 25 22.7-24.2 25 E. cyclocarpum L. arborea T. pentaphylla ----- E. cyclocarpum H. courbaril L. arborea ----- C. candidissimum B. persimilis ----- E. cyclocarpum L. arborea H. courbaril 0.15 ----- ----- ----- 72.7 35 34 33 22 Altitud (m) Pendiente (%) Rocosidad (%) Pedregosidad (%) Profundidad del suelo (cm) Capacidad de almacenamiento de agua en el suelo (mm) pH del suelo Precipitación media (mm) Temporada de lluvias (días) Período de crecimiento vegetal (días) Temperatura media (ºC) Especies características Índice promedio de diferenciación de diversidad entre sitios Indice promedio de similitud florística entre sitios No. de especies arbóreas registradas Fuente: Vega et al., 2003. 40 Cuadro 12. Características ecológicas de las zonas con Brosimum alicastrum en el palmar de la Costa del Océano Pacífico. Características Palmar Zona 19 Zona 20 Zona 21 Zona 22 Localización : Entidad y no. De sitio Superficie (ha) Fisiografía Jalisco (5), Guerreo (2), Colima y Michoacán (1) 51,576 Planos Oaxaca (8 y 9) Nayarit (6 y 7 ), Guerrero (4) Guerrero (3) 56,884 Planos 7,514 Planos aluviales Altitud (m) Pendiente (%) Rocosidad (%) Pedregosidad (%) Profundidad del suelo (cm) Capacidad de almacenamiento de agua en el suelo (mm) Ph del suelo Precipitación media (mm) Temporada de lluvias (días) Período de crecimiento vegetal (días) Temperatura media (ºc) Especies 56-100 2-7 0-30 0 50-100 0-150 0-3 0-10 0 100 42,320 Planos, lomeríos y cañadas 0-126 5-15.5 10-30 0-5 75-100 80-160 115-175 98-105 106 6.2-6.8 1000 5.9-7.7 1200-1250 6.6-6.8 1200-1500 6.5 1200 144-156 162-189 163-176 144 180-209 216-220 185-201 193 25.5-26 24-27 24-26 24 O. guacuyule E. cyclocarpum B. simaruba 0.59 O. guacuyule C. pentandra S. mexicana 0.869 O. guacuyule B. simaruba Ficus spp. 0.59 25.5 12.5 25.4 ----- 19 15 21 11 Características Índice promedio de diferenciación de diversidad entre sitios Índice promedio de similitud florística entre sitios No. De especies arbóreas registradas 150 8-10 --------75 O. guacuyule F. glaucescens C. elastica ----- Fuente: Vega et al., 2003 En el Cuadro 13 se presentan los atributos fisonómico-estructurales de la vegetación y características del medio físico en diferentes tipos de selva de la Costa del Pacífico Mexicano (Vega et al., 2003). 41 Cuadro 13. Atributos fisonómico-estructurales de la vegetación y características del medio físico en tipos de selva de la Costa del Pacífico Mexicano. Porcentaje Tipo de selva de Caducifolia Subcaducifolia Subperennifolia Perennifolia árboles Perennifolios 0-25 26-50 51-75 76-100 (época seca) Árboles de B. 0 16.4 64.1 20 Alicastrum/ha Precipitación 1132 c* 1312 b 1313.2 b 3083 a media anual (mm) 47.9 bc 73.1 b 179.2 a 117.2 b Capacidad de almacenamiento de agua en el 143.1 d 182.6 c 223.8 b 277 a suelo (mm) Período de crecimiento vegetal (días) 15 34 35 7 Número de observaciones (n) Fuente: Vega et al., 2003. 2.2.5. Vegetación asociada B. alicastrum se asocia con las especies: Vochisia hondurensis, Inga sp., Robinsonella mirandae, Mirandaceltis monoica, Lonchocarpus sp., Dialium guianense, Spondias sp., Terminalia amazonia, Manilkara zapota, Calophyllum brasiliense, Swietenia macrophylla, Vitex mollis y Dendropanax arboreus. En el Bosque Tropical Seco del Pacífico Noroeste de Costa Rica, se asocia con especies subcaducifolias como corteza amarilla (Tabebuia crysantha), caobilla (Swietenia humilis), guácima (Guazuma ullmifolia) y ceiba (Ceiba pentandra) y con las especies caducifolias como el indio desnudo o chacá (Bursera simarouba), roble sabana (Tabebuia rosea), pochote (Bombacopsis quinatum) y otras especies como el zacate jaragua (Hyparrhenia rufa), el jícaro o guaje (Crecentia alata), (Crecentia cujete) y roble (Quercus oleoides) (http://www.acguanacaste.ac.cr/1999/educacion/ sectorbs. html). En el Parque Nacional Morrocoy en Venezuela, la vertiente sur del cerro Chichiriviche está dominada por bosque perennifolio, constituido por una gran variedad de árboles. Entre ellos, B. alicastrum bolivarense, Talisia princeps, Astronium graveolens y Brownea macrophylla (http://www.birdlife.org/ catazona/sites/?action=SitHTMDetails.asp&sid=14927&m=0). 42 En México en el bosque tropical perennifolio se asocia con especies vegetales como el tanimbuca (Terminalia amazonia), el árbol del chicle (Manilkara zapota), diversas especies de Ficus sp., y varios árboles de maderas preciosas como la caoba (Swietenia macrophylla) y el cedro rojo (Cedrela mexicana). También se encuentra una gran cantidad de plantas, muchas de ellas epífitas, orquídeas y bromelias (Azcárraga y Rabiza, 2001). En la Costa del Pacífico se asocia en la selva mediana subperennifolia con las especies: Enterolobium cyclocarpum, Ficus spp., Hura polyandra, Roseodendron donell smith, A. graveolens, B. simaruba, P. acapulcencis, C. candidissimum, L. arborea y F. padifolia. En la selva mediana subcaducifolia con E. cyclocarpum, Tabebuia rosea, B. simaruba, Cordia pentandra, L. arborea, B. arborea, T. crysantha, A. graveolens, B. alicastrum, C. sclerocarpa y S. cirrhata. En la selva alta perennifolia con T. amazonia, V. guatemalensis, A. zapota, B. flamea, Z. integerrima, T. amazonia y S. mexicana. En la selva alta subcaducifolia con E. cyclocarpum, L. arborea, T. pentaphylla, H. courbaril, C. candidissimum y B. persimilis. En el palmar con O. guacuyule, E. cyclocarpum, B. simaruba, C. pentandra, S. mexicana, Ficus spp., F. glaucescens y C. elastica (Vega et al., 2003). En la Sierra de Manantlán en Jalisco y Colima, en el Bosque tropical subcaducifolio se encuentra asociado con Bumelia cartilaginea, Cedrela odorata, Trophis racemosa, Aphanantes monoica, Coussapoa purpusii, Tabebuia palmeri, Hura polyandra, Guarea glabra, Enterolobium cyclocarpum y Dendropanax arboreus (http://www.ine. gob.mx/ueajei/publicaciones/libros/2/manan.html). La selva alta subperennifolia se constituye por dos o tres estratos arbóreos con alturas de entre 6 y 30 m, entre las especies destacan el chicozapote (Manilkara zapota), el ramón (Brosimun alicastrum), el júcaro (Bucida buceras) y el chechem (Metopium browneii). La selva mediana subperennifolia comprende varios estratos cuyas alturas fluctúan entre los 7 y 25 m, las especies más representativas son: el chacá (Bursera simaruba), el chicozapote (Manilkara zapota), el ramón (Brosimun alicastrum), el guayabillo (Psidium sartorium) y el yaxnic (Vitex gaumeri) (http://www.mexicoco.net/Fotografìagrafias/quintanaroo/chetumal/datos/historia_de_c hetumal.html). En la selva subcaducifolia en la Cuenca la Quebrada, Mpio. de Tomatlán, Jalisco, se asocia con las especies: Hura polyandra, Tabebuia rosea, Bursera simaruba, Luehea speciosa, Sapium pedicellatum, Jacaratia mexicana, Pseudobombax ellipticum, Annona purpurea, Cecropia obtusifolia, Cnidoscolus sp., Enterolobium cyclocarpum, Ficus continifolia, Lysiloma microphylla, Guazuma ulmifolia, Couepia polyandra, Trema micrantha, Sabal mexicana, Spondias purpurea, Ceiba aesculifolia, Acrocomia aculeata, Acacia hindis, Poeppigia procera, Heliocarpus pallidus, Ficus obtusifolia, Lonchocarpus longepedicellatus, Aphananthe monoica, Gyrocarpus jatropholius, Astronium graveolens y Quercus spp. (Gallegos et al., 2001). 43 En la zona centro y sur de Quintana Roo, la vegetación pertenece al tipo de selva mediana subperennifolia y selva baja, en donde se localizan especies maderables tropicales de alto potencial de regeneración natural y artificial, como caoba (Swietenia macrophylla King) y cedro rojo (Cedrela odorata L.) (Villanueva y Cabrera, 1990) y de comunes como tzalam (Lysiloma bahamensis Benth.), chechem negro (Metopium browneii Jacq.), ramón (Brosimun alicastrum Swartz), chicozapote (Manilkara zapota (L.) Van Royer), chacah rojo (Bursera simaruba L.) y granadillo (Platymiscium yucatanum Standl.) y otras especies como ciricote (Cordia dodecandra D. C.), bob (Coccoloba spicata), jabín (Piscidia communis) y chakté (Caesalpinia molis S.W.) (Rebollar et al., 2002). En la selva mediana subperennifolia (Yumka’) en Tabasco, se asocia con Brosimun terrabanum y Cinometra retusa (Franco, 2005). En la Colonia Agrícola-Ganadera ―Progreso‖, Municipio de Matías Romero, Oaxaca, en la selva alta perennifolia, B. alicastrum se asocia con paque (Dialium guianense), gateado blanco (Astronium graveolens), (Luehea speciosa), Caoba (Swietenia macrophylla), cafecillo (Faramea occidentales), volador (Zuelania guidonia), platanillo (Cymbopetalum penduliflorum), tronador (Rinorea guatemalensis), palo colorado (Trichilia hirta), chichón (Astrocaryum mexicanum), vara negra (Mouriri parvifolia) cihuapa (Urera caracasana) y limoncillo (Alibertia edulis) (Chavelas et al., 1982). 2.3. SILVICULTURA 2.3.1. Bosques naturales La especie exhibe un patrón de comportamiento tolerante a la sombra. Constituye parte del dosel superior de la selva. Presenta una abundancia reducida en la comunidad, pero su papel en la dinámica y estructura de la misma puede ser importante. Bajo los árboles masculinos se ha presentado una elevada diversidad de plántulas sin que domine alguna especie. Esto sugiere que B. alicastrum favorece la regeneración de otras especies, facilitando la coexistencia de especies de árboles del dosel. Bajo la cobertura de los árboles femeninos de B. alicastrum se ha encontrado una baja diversidad de plántulas, la mayoría (>80 %) de esta especie. En la región costa de Jalisco, se evaluó el valor de importancia de las especies en la Cuenca La Quebrada, municipio de Tomatlán, Jalisco, ubicada en una altitud que oscila de 100 a 760 msnm, la precipitación anual es de aproximadamente de 1,000 a 1,500 mm y la temperatura promedio es de 24-26 ºC. Los tipos de suelo presentes en este sitio son regosol eútrico, cambisol crómico y litosol. La vegetación se encuentra formada por selvas medias subcaducifolias y ha estado bajo un programa de manejo basado en el aprovechamiento principalmente de especies preciosas. El mayor peso ecológico de las especies arbóreas mayores a 10 cm de DAP se concentra en B. alicastrum y Hura polyandra. Esto se debe, en gran medida, a los aprovechamientos selectivos anteriores, los cuales facilitaron las condiciones para que estas dos 44 especies se manifiesten en la actualidad con mayor abundancia y frecuencia (Gallegos et al., 2001). En el Plan Piloto Forestal que se desarrolló en la zona centro y sur de Quintana Roo, se planteó un programa de reforestación en áreas que hayan resultado afectadas por el aprovechamiento forestal como caminos, brechas de arrastre de árboles, bacadillas (lugar donde se concentra la madera para transportarla). El compromiso fue plantar al menos 15 árboles por cada metro cúbico de las especies aprovechadas o por cedro y caoba, que son nativas y de alto valor económico, además de otras especies de alto valor comercial como ciricote o granadillo, entre otras. Las áreas semilleras se delimitan tanto en los terrenos forestales como en los mapas topográficos para tener un mejor control sobre la recolección de semillas de árboles en pie, de los que se seleccionan los ejemplares rectos, libres de defectos y plagas. Para obtener semillas de calidad óptima que representen un porcentaje adecuado de germinación viable y se pueda producir planta en buenas condiciones, se cosecha de los mismos árboles que se aprovechan y de áreas semilleras que se establecen dentro de la selva. Para el enriquecimiento de las áreas de corta, utilizando los espacios que se abren durante el aprovechamiento, también se reforesta para la recuperación de áreas degradadas a través de plantaciones y para fomentar el rescate de áreas de regeneración natural ya establecida (Rebollar et al., 2002). Los programas de manejo forestal para los ejidos 20 de Noviembre, Nuevo Becal y Ricardo Flores Magón del municipio de Hopelchen en el Estado de Campeche, mencionan que los principales tipos de vegetación arbórea son selva mediana subperennifolia, selva baja subperennifolia y vegetación secundaria (acahuales). Entre las especies más representativas se tiene las siguientes: Swietenia macrophylla (caoba), Manilkara zapota (chicozapote), Bucida buceras (pucté), Cedrela odorata (cedro), Brosimum alicastrum (ramón), Lonchocarpus castilloi (machiche), Bursera simaruba (chacá), Cameraria latifolia (chechén blanco), Haematoxyllum campechianum (palo de tinto) y Cordia dodecandra (ciricote). Los volúmenes de corta se determinaron a partir de la tabla de volumen fuste limpio por hectárea, utilizando el RME (Registro Mínimo Esperado) en la categoría silvícola cortable, la cual se determina bajo la consideración de que el arbolado se encuentra en un estado de madurez óptimo para su aprovechamiento con fines maderables, debido a la gran diversidad de especies y a que cada una de ellas requiere diferentes tiempos para alcanzar esta categoría, con fines prácticos, se utilizó el diámetro normal como principal indicador. De tal manera que para las especies preciosas se considera a partir de 50 cm o más y para el resto de las especies el diámetro considerado es igual o mayor a 35 cm (Medrano, s/f). Las especies que tradicionalmente se han considerado restringidas al aprovechamiento maderable por considerarse de importancia para la alimentación de la fauna silvestre, como el B. alicastrum, Talisia olivaeformis y Manilkara zapota, fueron agrupadas en la categoría de especiales y en base a su distribución y abundancia que presentan en sus diferentes grados de desarrollo silvícola podrían 45 ser consideradas para su aprovechamiento maderable, siempre y cuando exista interés por parte de la industria local y regional. El aprovechamiento de este grupo de especies deberá dirigirse a los individuos sobremaduros y/o enfermos, lo que permitiría con su extracción una mayor apertura de claros y por lo tanto un mayor establecimiento de regeneración de especies con alto valor comercial (Medrano, s/f). 2.3.2. Floración y fructificación En Costa Rica, la mayoría de árboles florecen en la estación seca, pues en esta época no hay competencia por luz porque los árboles están sin hojas y aparentemente se encuentran en estado de latencia. La floración en el bosque tropical seco se da en dos períodos, uno grande a la mitad de la época seca y uno más reducido, inmediatamente después del inicio de la estación seca. El período de maduración de los frutos se distribuye a lo largo de la época seca, período principal en que se da la dispersión de las semillas (http://www.acguanacaste.ac.cr/ 1999/educacion/sectorbs.html). En México florece principalmente de noviembre a febrero, aunque se pueden encontrar flores en otra época (Pennington y Sarukhán, 1998 y Soihet y Méndez, 1997 citados por SIRE, 2005). También se menciona que florece de septiembre a octubre o noviembre a febrero pero se pueden encontrar flores fuera de esta época. En los Tuxtlas, Veracruz, florece de enero a mayo y en Campeche y Quintana Roo, la época de floración es abril-mayo, enero-marzo-junio (Patiño et al., 1983). Los frutos maduran de marzo a mayo, aproximadamente (Niembro, 1986 en http://148.202.81.1/new/informacionacademica/coaxican/plts_ mex/capomo.htm). 2.3.3. Producción y diseminación de semilla Los frutos maduran de febrero-marzo a mayo-junio. En la Península de Yucatán entre abril y septiembre. El desarrollo de los frutos es muy rápido. En Colombia, el fruto se puede colectar en el suelo bajo la copa de los árboles en dos temporadas del año, de diciembre a enero y de julio a agosto (CNIC, 2005). En bosques naturales se registran producciones en plantas de 8 años, de 50-75 kg de frutos por año; en árboles de más de 8 años hasta 58 kg de semilla por árbol y hasta 400 kg de follaje al año. Los frutos maduros fisiológicamente, se desprenden de la planta y caen al suelo. El período de maduración de los frutos se distribuye a lo largo de la época seca, período principal en que se da la dispersión de las semillas (http://www.regionloreto.gob.pe/amazonia/libros/51/5100003.htm; http://www.acgua nacaste.ac.cr/1999/educacion/sectorbs.html;). La fecha de recolección de la semilla es de enero a marzo y un kilogramo tiene 300 a 350 semillas (PRODEFO, 2000). 46 Produce normalmente de 15-20 kg de semilla por año. Sin embargo, árboles cultivados en México rinden de 50-75 kg, aunque campesinos del departamento de Carazo, Nicaragua, afirman recoger fácilmente 75-100 kg por árbol adulto (http://www.ibw.com.ni/~eco/PrVerdur.htm). La forma de dispersión de la semilla es por aves y mamíferos, entre ellos se han registrado a los murciélagos Artibeus jamaicensis, A. Phaeothis, Sturnira udoyice y Corollia perspiciliata; al mono aullador Alouatta palliata, ardillas (Sciurus yucatanensis), mapaches (Procion lotor). En Quintana Roo se observaron las siguientes aves consumiendo y por consecuencia dispersando las semillas: la chachalaca común (Ortalis vetula), el faisán real (Crax rubra). Como dispersores secundarios está el ratón (Heteromys desmarestianus) y el agutí. 2.3.4. Densidad La densidad de B. alicastrum en la costa del Pacífico Mexicano (Cuadro 14) es en la selva mediana subperennifolia de 20 a 147 individuos por hectárea, en la selva mediana subcaducifolia de 4 a 52, en la selva alta perennifolia en promedio 20, en la selva alta subcaducifolia en promedio 4 y en el palmar menos de 4 árboles por hectárea. En la selva mediana subperennifolia poseen una moderada diferenciación de diversidad de especies arbóreas entre sitios y una baja similitud florística entre ellos. Asimismo, la especie de interés presenta su mayor abundancia en este tipo de vegetación, hasta 147 árboles por hectárea fueron registrados en Nayarit y el Estado de México (Vega et al., 2003). Cuadro 14. Tipo de vegetación y superficie con presencia de Brosimum alicastrum (densidad) en la Costa del Pacífico Mexicano. Tipo de vegetación Selva mediana subperennifolia Selva mediana subcaducifolia Selva alta perennifolia Selva alta subcaducifolia Palmar Superficie (ha) 667 981 3 757 850 912 400 333 601 158 294 Total 5 830 126 Árboles de B. alicastrum/ha) 20 - 147 4 – 52 20 4 Menos de 4 Fuente: Vega et al., 2003. 2.3.5. Tolerancia a factores ambientales Las plántulas de B. alicastrum son demandantes de luz; es moderadamente resistente a heladas, tolera heladas cortas en el invierno, es resistente al fuego, al daño por termitas, es tolerante a la sombra en todas las etapas de su crecimiento, aún en juveniles, tolera el rocío, la salinidad, la exposición constante al viento, así 47 como la sequía y suelos muy alcalinos. También es susceptible por otro lado al daño por ramoneo y roedores que afectan a las semillas. 2.3.6. Plagas El B. alicastrum es atacado por insectos que se alimentan de madera dura como son: Xyleborus ferrugineus (F.) y X. morigerus (Blandford) (Cibrián et al., 1995). Los depredadores de semillas son Heteromys desmarestiantus y Dasyprocta punctata. 2.3.7. Enfermedades En Perú, la manchinga o congona (B. alicastrum), de madera blanca amarillenta, es atacada por el hongo que produce la macha azul, debiendo ser tratada después de aserrada (http://www.cideiber.com/infopaises/Peru/Peru-04-02.html). 2.3.8. Sistemas y prácticas silvícolas En una investigación en la Selva Lacandona, Chiapas, con un tipo de vegetación predominante de ―bosque tropical‖ o ―selva alta perennifolia‖, aunque también se encuentra selva mediana perennifolia, se seleccionaron las especies: Ampelocera hottlei (Ulmaceae), B. alicastrum (Moraceae), Calophyllum brasiliense (Guttiferae), Cedrela odorata (Meliaceae), Dendropanax arboreus (Araliaceae), Guarea glabra (Meliaceae) y Pithecellobium arboreum (Leguminosae). El criterio de selección fue que las especies se encontraran de manera natural en el área, que tuvieran un valor comercial y que fueran de uso reconocido y variación ecológica. Las plántulas se extrajeron con cepellón del banco de plántulas de la regeneración natural en la selva madura en áreas vecinas y fueron trasplantadas a bolsas de polietileno negro en un vivero, y posteriormente se realizó la plantación bajo el método de enriquecimiento por grupos. Es evidente que cada especie respondió de manera diferencial a las condiciones de manejo. Las respuestas de las especies a las condiciones sucesionales fueron significativamente diferentes. B. alicastrum mostró las tasas de crecimiento más bajas en cualquier condición ecológica y tratamiento; debido a su palatabilidad la mayoría de los individuos trasplantados de esta especie fueron ramoneados y su crecimiento en diámetro de copa fue bajo e incluso negativo. De acuerdo con su índice de desarrollo, las especies se pueden ubicar en tres grupos en orden decreciente de desarrollo: el primero formado por P. arboreum y D. arboreus, el segundo constituido por C. odorata y C. brasiliense y el tercer grupo por A. hottlei, G. glabra y B. alicastrum. Este pobre desarrollo probablemente responde a una estrategia de traslocar los recursos no a la parte aérea de la plántula sino al sistema radical. Se encontró también, que no respondieron al aclareo, excepto A. 48 hottlei y B. alicastrum en el acahual de cuatro años de edad, pero no significativamente. Es evidente entonces que presentan una tolerancia relativa a un ambiente sombreado y se comportan como especies secundarias tardías (Centeno, 2000). En el Plan Piloto Forestal que se desarrolló en la zona centro y sur de Quintana Roo, se realizaron actividades silviculturales a partir de un plan de manejo aplicado y adaptado a las características fisiográficas de cada uno de los ejidos. La vegetación en que se desarrollo dicho plan corresponde a selva mediana subperennifolia y selva baja, en donde se localizan especies maderables tropicales de alto potencial de regeneración natural y artificial como caoba (Switenia macrophylla King) y cedro rojo (Cedrela odorata L.) (Villanueva y Cabrera, 1990) y de comunes como tzalam (Lysiloma bahamensis Benth.), chechem negro (Metopium browneii Jacq.), ramón (B. alicastrum Swartz), chicozapote (Manilkara zapota (L.) Van Royer), chacá rojo (Bursera simaruba L.) y granadillo (Platymiscium yucatanum Standl.) y otras especies como ciricote (Cordia dodecandra D. C.), bob (Coccoloba spicata), jabín (Piscidia communis) y chakté (Caesalpinia molis S.W.). El diseño del plan de manejo de los ejidos Naranjal y Santa María, se basa en el método de tratamiento de selección de especies para ser aprovechadas con un turno de 75 años con tres ciclos de corta, de 25 años cada uno, considerando crecimientos anuales de 8 mm para las especies preciosas y 4 mm para las maderas comunes tropicales. Para su elaboración se consideró el ciclo de crecimiento de la caoba que tiene tasas de 8 mm por año, lo que significa que se podría alcanzar un diámetro mínimo de 55 cm en 69 años o bien la meta de un diámetro de 60 cm en 75 años. Con los inventarios forestales se han definido volúmenes de aprovechamiento anual de madera con base en los diámetros mínimos de corta de las especies de interés para el mercado. Las especies se dividieron en dos grupos: el grupo I que contempla a las que alcanzan diámetro mayor de 55 cm, incluyendo caoba (S. macrophylla King), cedro (C. odorata L.), chicozapote (Manilkara zapota (L.) v. Royen), amapola (Pseudobombax ellipticum (Kunth) Dugand), ceiba (Ceiba pentandra (L.) Gaertn) y pich (E. cyclocarpum (Jacq.) Griseb); en el grupo II se encuentran las especies que no crecen mucho cuyos diámetro son menores a 55 cm y que representan a la mayoría de las especies comunes. Dentro de la selva se han definido tres estratos o categorías de arbolado: i) cortable, el que se corta en el primer ciclo, ii) reserva, el que se corta en el segundo ciclo y, iii) repoblado, el que se corta en el tercer ciclo, una vez que se alcanzan los diámetros de corta permitidos y suponiendo que después de cada corta se reforestará para sustituir al arbolado recién cortado y restablecer los tres estratos considerados. Se trabaja por áreas de corta anual que representan el 4% del área forestal permanente, la cual se debe reforestar después del aprovechamiento y se deja descansar por 25 años, para volver a su segundo ciclo de corta cuando se aprovechará el arbolado de reserva (Rebollar et al., 2002). 49 Los programas de manejo forestal para los ejidos 20 de Noviembre, Nuevo Becal y Ricardo Flores Magón del municipio de Hopelchen en el Estado de Campeche, con los tipos de vegetación de selva mediana subperennifolia, selva baja subperennifolia y vegetación secundaria (acahuales), plantean el uso del Método de Selección y se refiere a la extracción del arbolado maduro de las especies que actualmente tienen demanda en el mercado, dejando en el monte los individuos con categorías diamétricas menores a las consideradas como cortables (repoblado y reserva) este tratamiento podrá ser en forma individual, para grupos de árboles o en pequeños bosquetes, lo cual está en función de la distribución del arbolado por aprovechar. Asimismo se contempla aprovechar los individuos mal conformados o con problemas sanitarios (enfermos) a fin de provocar condiciones de desarrollo óptimo para las especies deseables. Se propone en forma inicial un ciclo de corta de 25 años, pudiendo variar dicho periodo de acuerdo a la dinámica de la masa forestal en base a siitos permanentes de evaluación silvícola. En un turno de 70 años y con un ciclo de corta de 25, teóricamente la masa forestal tendrá 3 ciclos de corta en su proceso de ordenación. En la aplicación del plan de manejo se plantea aplicar el Método de Beneficio de Monte Alto, es decir, propiciar la regeneración de la selva por medio de la semilla del arbolado residual, sin embargo, esto no excluye que puedan realizarse plantaciones con especies de alto valor comercial (Medrano, s/f). 2.3.9. Crecimiento y rendimiento volumétrico B. alicastrum es una especie de lento crecimiento. Los individuos jóvenes con diámetros de 1 a 8 cm crecen en promedio 1 mm/año; de 8.1 a 16 cm cerca de 3 mm/año y en los de 16.1 a 32 cm cerca de 5 mm/año. Los árboles adultos (>32 cm de diámetro) crecen a velocidades mayores (1.3 cm/año). En Quintana Roo se reporta aproximadamente 3.5 m3 de madera por hectárea (Huerta y Becerra, 1974). Las especies que presentan cualidades altamente forrajeras, como B. alicastrum produce de 20 a 30 toneladas de forraje en tres cortes realizados durante el año con una densidad de cerca de 75 árboles/ha (Susano, 1981). Es una especie de muy larga vida y solamente árboles mayores de 20 m de altura producen flores o frutos; algunos individuos adultos llegan a producir hasta 500 kg de follaje al año. Un árbol puede producir de 16 a 29 kg de semilla seca. En tres sitios (1= Xmatkuil, 2 = Maxcanu y 3 = Temozon Norte) de la zona henequenera del Estado de Yucatán, se evaluó el efecto de las frecuencias de rebrote sobre la producción y calidad del follaje de B. alicastrum Swartz). En los sitios 1 y 2, los árboles se cortaron a una altura de 1.5 m. quedando solamente el tallo principal y en el sitio 3 las plantas se podaron dejando los tallos y ramas principales y secundarias. A los 16 meses, en los sitios 1 y 2 la producción de follaje fue de 1.6 y 3.4 kg de materia seca (MS)/árbol, mientras que en el sitio 3, la producción fue de 36 kg MS/árbol. Se recomiendan períodos de rebrote de entre 12 y 16 meses ya que con este manejo se maximiza la producción de follaje, sin perjudicar el valor nutritivo. 50 El sistema tradicional de poda, dejando tallos y ramas principales y secundarias, fue muy superior a la poda total, es decir, dejar solamente el tallo principal a una altura de 1.5 m (Mendoza et al., 2000). 2.3.10. Regeneración B. alicastrum tiene buena regeneración natural y se menciona que llegan a sobrevivir 5 de cada 125 plántulas. Se regenera rápidamente en sitios perturbados y en terrenos abandonados. En algunos sitios se pueden encontrar hasta 300 plántulas por m2. 2.4. PRÁCTICAS DE VIVERO 2.4.1. Manejo y almacenamiento de semillas La recolección se realiza cuando el fruto cae al suelo, se limpia la pulpa y ya seco está listo para su almacenamiento; es mejor dejarlo con el pegamento que envuelve la semilla y no con todo y la cáscara seca. Los granos puestos en sacos amarrados y en un lugar limpio y seco, se conserva sin problema durante un año (http://www.ibw.com.ni/~eco/ PrVerdur.htm). También, las semillas se recolectan directamente de los árboles, durante la estación en la cual maduran las semillas. El pericarpio del fruto se remueve y las semillas se secan al sol, se almacenan a temperatura ambiente y conservan su viabilidad por 3 meses después de la cosecha. Las semillas almacenadas en fresco, son inmediatamente invadidas por hongos, favorecidos por el alto contenido de humedad de la semilla, por lo que se recomienda el lavado y secado inmediato a fin de garantizar su conservación (http://www.regionloreto.gob.pe/amazonia/libros/51/ 5100003.htm). La semilla a utilizar debe colectarse de árboles sanos, vigorosos y con buena producción de frutos; con esto se pretende asegurar que las plantas obtenidas hereden las características de los progenitores (Arriaga et al., 1994). Lo más común es cosechar el fruto seco con una coloración amarillo rojo, de árboles seleccionados individualmente, los cuales se colocan en sacos o bolsas para evitar su insolación directa y largos periodos de transporte. Los frutos se colocan en agua y se extrae la semilla por maceración de la pulpa. Para mantener la viabilidad por algún tiempo, se recomienda almacenar la semilla con 12% de contenido de humedad, en cámaras a 5 ºC. El tiempo de viabilidad estimado bajo condiciones de almacenamiento es de 12 meses. El número de semillas por kilogramo varía de 900 a 1,200 semillas (Soihet y Méndez, 1997 citados por SIRE, 2005 b). 51 2.4.2. Germinación Es recomendable sembrar la semilla lo más pronto posible y aunque no presenta ningún tipo de latencia, para uniformizar la germinación se recomienda remojarla en agua a temperatura ambiente durante 24 horas. El porcentaje de germinación de semillas recién colectadas varía de 89 a 95%. El tiempo necesario para que inicie la germinación a partir de la siembra es de 8 a 10 días y para que finalice el proceso de emergencia es de 10 a 20 días. La fecha de siembra es en Febrero (Soihet y Méndez, 1997 citados por SIRE, 2005 b; http://www.regionloreto.gob.pe/amazonia/ libros/51/5100003.htm). 2.4.3. Prácticas de cultivo En Yucatán se han realizado estudios de domesticación de esta especie con el objeto de establecer plantaciones comerciales para producir forraje, material genético y madera. El método tradicionalmente utilizado es la propagación por semilla y por estructuras vegetativas, estacas, (Batis et al., 1999). La semilla se siembra en almácigos sombreados, en cajones de 1 x 1 x 0.2 m con un sustrato conformado con la mezcla de arena, tierra negra y materia orgánica descompuesta en la proporción de 1:1:1 o con arena, previamente desinfectados con fungicida. Las semillas se colocan una distancia de 10 x 10 cm. El sustrato debe tener una consistencia adecuada para mantener la semilla en su sitio, el volumen no debe variar drásticamente con los cambios de humedad, textura media para asegurar un drenaje adecuado y buena capacidad de retención de humedad, fertilidad adecuada, libre de sales y materia orgánica no mineralizada. Cuando el sustrato es inerte, una mezcla 55:35:10 de turba, vermiculita y perlita o agrolita es adecuada (Arriaga et al., 1994). El repique o trasplante de las plántulas de los semilleros al envase se realiza cuando éstas alcanzan de 5 a 17 cm de altura o cuando presenten 2 hojas desarrolladas, es el momento oportuno del repique a bolsas plásticas negras de 2 kg de capacidad o de 10 cm de diámetro por 20 cm de largo, conteniendo el mismo sustrato del almácigo. Al momento que las plantas logren un desarrollo de 30-50 cm de altura, se trasplantan al campo definitivo (Soihet y Méndez, 1997 y Chavelas y Dewall, 1988 citados por SIRE, 2005 b; http://www.regionloreto.gob.pe/amazonia/libros/ 51/5100003. htm). Se recomienda un sombreado de un tercio y riegos a saturación cada tres días o cuando sea requerido (Batis et al., 1999 y Chavelas y Dewall, 1988). El deshierbe continuo de los pasillos y al interior de los envases que contienen las plantas, evitará problemas de competencia por luz, agua y nutrientes; además, favorecerá condiciones de sanidad. Es importante tener cuidado con el número de plántulas o estacas que se encuentran en los envases, lo más recomendable es mantener solamente una planta o estaca por envase, la más vigorosa, eliminando las restantes (Arriaga et al., 1994). 52 El acondicionamiento de la planta previo al transplante definitivo, es por lo menos un mes antes de su traslado al sitio de plantación y consiste en iniciar el proceso de endurecimiento de las plantas mediante la suspensión de la fertilización, las plantas deberán estar a insolación total y los riegos se aplicarán alternadamente entre someros y a saturación, además de retirarlos durante uno o dos días. Esto favorecerá que las plantas presenten crecimiento leñoso en el tallo y ramas (Cervantes et al., s/f). El tiempo total para la propagación de la especie es de 4 a 5 meses (Soihet y Méndez, 1997 citados por SIRE, 2005 b). La propagación asexual es mediante varetas, acodos, esquejes o estacas de 1 a 3 m de alto y con 5 a 15 cm de diámetro y se siembran a una distancia de 1 a 3 m, las cuales se obtienen tanto de ramas como de tallos. Cuando B. alicastrum se reproduce por estacas produce frutos en menos de 5 años y a los 5 años cuando procede de semilla (Batis et al., 1999) 2.5. ESTABLECIMIENTO Y MANEJO DE PLANTACIONES 2.5.1. Preparación del sitio de plantación Si el terreno presenta problemas de malezas se recomienda realizar deshierbes manuales o mecánicos dependiendo de las condiciones del terreno. Si el terreno presenta pendientes mayores a 12%, para evitar la erosión del suelo se recomienda remover la vegetación solamente en los sitios donde se plantarán los árboles, ya sea en franjas o alrededor de las cepas. Esta actividad podrá realizarse por medio de chaponeo (Arriaga et al., 1994). El subsoleo aplica solamente cuando se presentan capas endurecidas a escasa profundidad, menor a 15 cm y siempre y cuando los terrenos presenten pendientes menores a 10% (Arriaga et al., 1994). 2.5.2. Plantación y espaciamiento La plantación se realiza cuando las plantas alcanzan un desarrollo de 30-50 cm hasta un metro de altura, estando protegidas por plantas nodrizas, pues sin ésta protección la supervivencia es baja. Pueden plantarse a distancias no menores de 3 x 3 m y hasta 5 x 5 m (http://148.202.81.1/new/informacionacademica/coaxican/ plts_mex/capomo.htm). También se recomienda hacer las cepas sobre curvas a nivel en un arreglo a tresbolillo. Es adecuado trazar el terreno con espaciamientos de 3 x 3 m entre plantas; en el caso de estacas se siembran en distancias de 1 a 3 m (Arriaga et al, 1994 y Batis et al., 1999). 53 El tamaño de las cepas dependerá de las dimensiones del envase utilizado para la producción de las plantas. Esto implica que las cepas deberán hacerse de 3 a 5 unidades de volumen adicional al tamaño del cepellón de la planta; no obstante, dependiendo de las condiciones del terreno las dimensiones y tipo de cepas podrán variar, esto en función de las estrategias de conservación de suelo que se deseen emplear, de las características del suelo y de las condiciones climáticas (Arriaga et al., 1994). Para la plantación se seleccionan las plantas más vigorosas, libres de plagas y enfermedades. Aunque las características físicas dependerán de la especie, existen criterios generales que indican buena calidad en las plantas. La raíz deberá ocupar por lo menos el 50% del volumen total del envase, el diámetro basal del tallo deberá ser mayor o igual a 2.5 cm, la altura total del vástago no mayor a 30 cm y por lo menos ¼ parte de la longitud total del tallo con tejido leñoso. Se recomienda aplicar un riego a saturación un día antes del transporte de las plantas (Cervantes et al., s/f). Para el transporte se deben utilizar vehículos cerrados y trasladar las plantas debidamente cubiertas para protegerlas del viento e insolación y con ello evitar su deshidratación. Para optimizar la capacidad de los vehículos y disminuir los costos de transporte, es conveniente construir estructuras sobre la plataforma de carga con la finalidad de acomodar dos o más pisos. Se debe evitar la ruptura del tallo, aplastamiento de planta, pérdida de sustrato; la planta debe tomarse del cepellón (SIRE, 2005 b). Con la finalidad de evitar que la planta sufra el menor estrés posible, idealmente el tiempo de transporte no debe exceder a 3 horas (Arriaga et al., 1994). 2.5.3. Cultivo de las plantaciones Para proteger la plantación contra factores de disturbio como el pisoteo y ramoneo del ganado, se recomienda colocar una cerca en el perímetro de la plantación (Arriaga et al., 1994). Para prevenir los daños propiciados por el fuego se recomienda hacer brechas corta fuego en el perímetro de la plantación con un ancho de 3 m por cada lado de la cerca (SIRE, 2005 b). Las plantaciones necesitan riegos y deshierbes solamente durante los tres primeros años de establecidas, se recomienda realizar deshierbes en un radio de 20 cm alrededor de la cepa, por lo menos una vez al año o tantas veces como sea necesario, ésto preferentemente una o dos semanas posterior al inicio de la temporada de lluvias (Arriaga et al., 1994; http://148.202.81.1/new /informacionacademica/ coaxican/plts_mex/ capomo.htm; SIRE, 2005 b). Otra recomendación es realizar el primer chaponeo de malezas a los 35 días y después de la plantación cada 60 días. Después del primer año efectuar tres limpias al año. En la temporada de sequía aplicar riegos de auxilio tan frecuentemente como las plantas lo necesiten y aplicar fertilizante durante los tres primeros años o 54 alternados capomo.htm). (http://148.202.81.1/new/informacionacademica/coaxican/plts_mex/ Las plantas cultivadas requieren de poda cuando alcanzan 3 m de altura, por las cuales se obtiene forraje (Batis et al., 1999 y SIRE, 2005 b). También se recomienda aplicar la primera poda de ramas aprovechables al año de la plantación y continuarlas cada cuatro meses aprovechando el forraje. Se ha visto que el poder de recuperación y capacidad para retoñar es muy grande. Los aclareos tienen como finalidad eliminar poco a poco las plantas débiles y dominadas y la meta será que al décimo año queden en pie 625 plantas por hectárea, aproximadamente con espaciamiento de cuatro metros entre planta y planta (http://148.202.81.1/new/informacionacademica/coaxican/plts_mex/capomo. htm). 2.5.4. Crecimiento y rendimiento volumétrico El crecimiento de B. alicastrum es bastante lento, pues empiezan a producir hasta los cinco o seis años de edad (http://148.202.81.1/new/informacionacademica/coaxican/ plts mex/capomo.htm). En plantaciones densas para forraje (4,444 plantas/ha) y manejado con podas a partir de los 20 meses del trasplante, se registraron producciones de forraje verde de 4.9 ton/ha/año. En sistemas intensivos para forraje, se realizan 2-3 podas al follaje por año y las producciones pueden alcanzar de 10-15 ton/ha en cada corte (http://www.regionloreto.gob.pe/amazonia/libros/51/5100003. htm). Asimismo se reporta que es una planta forrajera cuyo aprovechamiento puede iniciarse al segundo o tercer año de establecida la plantación, con las siguientes producciones: en el segundo año 2,129; en el tercer año 3,384; en el cuarto año 8,235; en el quinto año 16,592 y en el sexto año 20,000 kg/ha. La cosecha de forraje verde a partir de los quince años es de 60 ton/ ha/año y se regulariza la cosecha de semilla a 10 ton cada año durante los 100 años de vida productiva (http://148.202.81.1/new/informacionacademica/coaxican/plts_mex/ capomo.htm). 2.5.5. Plantaciones agrosilvopastoriles Los sistemas silvopastoriles constituyen alternativas que conducen a una mayor estabilidad y menor susceptibilidad de los agroecosistemas. Este método es útil para aumentar la calidad de los pastos, lo que es esencial para garantizar la alimentación de ganado bovino. La introducción de árboles y arbustos en los sistemas de producción animal, con el objetivo de estabilizar el ambiente y lograr ahorros de fertilizantes, irrigación y concentrados, constituye una opción que no puede ser desestimada. 55 En un estudio se midió el comportamiento de 36 especies destacadas, creciendo en condiciones estresantes, sin riego ni fertilización y en competencia con otras especies de plantas, pero en un suelo fértil. Los resultados indican que sobresalió un grupo importante de especies excepto B. alicastrum que no logró estabilizar su supervivencia (Cuadro 15). Con relación a su aceptabilidad por los animales, destacaron Albizia lebbekoides, A. lucida, A. caribeae, A. amara, Calliandra haematocephala, Bauhinia acuminata, Peltophorum affricanum, P. dasyrachis, Erytrhrina poeppeginana y B. alicastrum (Febles et al., 1999). Cuadro 15. Comportamiento de la supervivencia y la altura de especies de las familias Moráceas, Moringáceas y Meliáceas durante 4 años creciendo en condiciones de estrés. Especies Muestreos 1 3 5 7 9 11 13 15 13.5 8.1 100 60.0 87.5 60.0 87.5 60.0 Brosimum alicastrum Moringa oleifera Azadirachta indica 91.0 88.0 Supervivencia (%) 59.4 55.5 45.9 45.9 100 92.0 100 76.0 100 68.0 Brosimum alicastrum Moringa oleifera Azadirachta indica - 29.8 47.5 - 57.0 - - 116.5 - 121.0 29.1 158.1 40.7 - 135.0 96.5 - - 145.7 151.8 100 100 68.0 60.0 Altura (cm) Fuente: Febles et al., 1999. Estudios más profundos contribuyeron al conocimiento del aporte nutritivo y las características ruminales del follaje de algunas especies que presentaron diferentes posibilidades de uso en sistemas. En el Cuadro 16 se muestra la composición química de algunos de estos árboles (Febles et al., 1999). Cuadro 16. Composición química de nutrimentos de diferentes especies arbóreas en estado vegetativo. Especies Gliricidia sepium Brosimum alicastrum Enterolobium cyclocarpum Composición química de nutrientes (g/kg M. S.) PB FND FAD Lignina Celulosa Hemicelulosa Ceniza 285.0 166.0 148.0 404.0 415.0 558.0 201.0 298.0 358.0 44.0 58.0 83.0 142.0 225.0 250.0 203.0 117.0 200.0 99.0 - Fuente: Febles et al., 1999. 56 Las estimaciones del consumo (kg MS/día) utilizando los parámetros de fracción soluble (a), fracción degradable (b), velocidad de degradación de la fracción degradable (c) y la suma de las fracciones soluble y degradable (a + b) mediante los modelos propuestos para vacas lecheras; al tener en cuenta el parámetro (a + b), solamente en la ecuación, se obtuvieron los mayores valores de consumo (kg MS/día) en B. alicastrum (8.18 kg MS/día) seguido de G. sepium (7.61 kg MS/día) y E. cyclocarpum (4.92 kg MS/día), mientras que al incluir los demás parámetros (a, b y c) dentro de la ecuación, los valores de consumo (kg MS/día) fueron muy variables en todos los árboles estudiados (Febles et al., 1999). B. alicastrum se adapta en sistemas agroforestales sucesionales, ocupando el estrato alto perenne. La plantación se realiza con un espaciamiento propuesto de 12 x 6 m con las líneas de plantación orientadas en la dirección este-oeste; simultánea o secuencialmente se asocia con cultivos como: arroz (Oryza sativa), maíz (Zea mays), Chiclayo (Vigna spp), yuca (Manihot spp), plátano (Musa spp), huasai (Euterpe oleracea), palta (Persea americana), caoba (Swietenia macrophylla) y tornillo (Cedrelinga catenaeformis). También se asocia con cultivos anuales de temporal y café, es excelente para sombra (http://www.regionloreto.gob.pe/amazonia/libros/ 51/5100003.htm). Durante los primeros años, hasta que la sombra del follaje lo permita, pueden intercalarse cultivos de ciclo corto, como rábanos, ejotes, etc. (http://148.202.81.1/ new/informacionacademica/coaxican/plts_mex/capomo.htm). Otras asociaciones agroforestales son con forrajes y ganado, suministra sombra y forraje, además, sirve como excelente cerco vivo, cortinarompevientos y sombra para el café (http://www.regionloreto.gob, 2005; http://www.ibw.com.ni/~eco/PrVerdur.htm). En Quintana Roo se diseño un sistema agroforestal con especies tropicales como B. alicastrum en asociación con maíz (Sánchez et al, 2000). 2.6. PROPIEDADES Y USOS 2.6.1. Propiedades físico-mecánicas de la madera Un estudio realizado en madera de B. alicastrum reporta los siguientes resultados: Duramen. De color uniforme amarillo blanco o gris. Albura. Color similar al color del duramen. Peso específico básico: 0,6–0,7 g/cm3. Vasos. Madera de porosidad difusa. Vasos agrupados, generalmente en grupos radiales cortos (de 2–3 vasos) con promedio del diámetro tangencial de 40–130 µm, promedio del número de vasos/mm2 de 6–20 y el largo de los 57 elementos vasculares: 220–640 µm. Con punteaduras intervasculares alternas con un promedio del diámetro (vertical) de 5–7 µm. Tílides ausentes. Fibras y traqueidas. Las fibras presentan paredes de espesor medio, con longitud de 940–1,710 µm y septadas. Las punteaduras de las fibras en su mayoría restringidas a las paredes radiales, simples o con areolas minúsculas. Parénquima axial. El parénquima axial presente en serie no en bandas, paratraqueal aliforme a confluente o unilateral. El parénquima aliforme en forma de alas finas. El promedio del número de células por serie de parénquima axial es de 3–4. Radios. El número de radios por mm es de 6–12, multiseriados y cuando son muy pocos tiene de 3 a 4 células de ancho. Están compuestos por dos o más tipos de células. Los radios heterocelulares con células cuadradas y erectas restringidas a hileras marginales de 2 a 4, o más de 4. Estructuras secretoras. Presenta canales intercelulares ausentes. Sustancias minerales. Presenta cristales prismáticos, localizados en células de los radios. Las células cristalíferas de los radios son septadas, erectas y/o cuadradas y procumbentes. Los cristales en las células de los radios procumbentes en cadenas radiales o no en cadenas radiales. El número de cristales por célula o cámara es uno o más de uno, de diferentes tamaños. Pruebas físicas y químicas. El duramen es no fluorescente. El extracto acuoso fluorescente o no fluorescente (azul claro), es básicamente sin color a café o tonalidades de café a tonalidades de amarillo. El extracto en etanol fluorescente o no fluorescente es básicamente sin color a café o tonalidades de café (Richter y Dallwitz, 2000). Otros estudios reportan que las características macroscópicas de la madera son: madera de color amarillo con tintes castaño amarillentos, no muestra diferencia de color entre la albura y el duramen, con brillo, sin olor ni sabor característicos, de textura mediana heterogénea, veteado suave, hilo derecho u oblicuo, y zonas de crecimiento notables. Presenta porosidad difusa, los poros visibles a simple vista, en su mayoría son solitarios, hay algunos en series radiales cortas; el parénquima leñoso visible a simple vista, es paratraqueal aliforme y aliforme confluente; los rayos se observan bien a simple vista. Las características físicas son: madera muy pesada, tiene una relación peso anhidro al volumen verde de 0.69. Se clasifica como de contracción media, la volumétrica total es de 13.24%, la radial total es de 4.82% y la tangencial total es de 8.15%. Se califica como madera dura, la cota de dureza es de 6.11 a un contenido de humedad de 10.45% (Huerta y Becerra, 1974). 58 También se cita que el color de la madera es pardo claro a blanco amarillento, con brillo alto, grano recto, entrecruzado, textura fina, veteado poco pronunciado. Los insectos y los hongos pueden atacar las trozas, por lo tanto, se recomienda acortar el tiempo de almacenamiento en el bosque y aplicarles un tratamiento de fungicida e insecticida, además de un tratamiento profiláctico de preservación o trabajabilidad inmediata a las trozas. Las propiedades físicas son: densidad 0.68 Kg/cm3, contracción volumétrica 12.40 %, relación t/r 1.60, contracción tangencial 8.13%, contracción radial 4.96% y sílice 0.08%. El aserrío es difícil por tener fibra entrecruzada presenta tensiones. Se debe aserrar rotando la troza a 180 grados para liberar tensiones. Requiere por su dificultad al secar un programa muy suave, pues tiende a deformarse pudiendo producirse torceduras, arqueaduras y curvaturas, aun cuando las piezas sean de pequeñas dimensiones. En cuanto a durabilidad, es muy susceptible al ataque de hongos que manchan la madera (http://www.peruwoodproducts.com/Congona.html; Zavala, 1999). En el Cuadro 17 se presentan las características mecánicas de B. alicastrum (Sotomayor, 2005). Cuadro 17. Características mecánicas de la madera de Brosimum alicastrum. Densidad MOE Flex FLE Flex RR Flex 730 137700 639 1193 MOE Com Para 146080 RLE Com Para 308 RR Com Para 515 RLE Com Perp 515 RR Corte Para 515 JK Late JK Trans 790 906 Donde: Ensayo Característica Símbolo Unidades MOE Flex (kg/cm ) Compresión paralela Resistencia al Límite Elástico Resistencia a la Ruptura Dureza Cara Lateral Dureza Cara Transversal Módulo de Elasticidad Resistencia al Límite Elástico RLE Flex RR Flex JK Late JK Trans MOE Com Para RLE Com Para (kg/cm ) 2 (kg/cm ) (kg) (kg) 2 (kg/cm ) 2 (kg/cm ) Compresión perpendicular Cortante Paralela Densidad Resistencia a la Ruptura Resistencia al Límite Elástico Resistencia a la Ruptura Peso-Seco/Volumen-Verde RR Com Para RLE Com Perp RR Corte Para P (kg/cm ) 2 (kg/cm ) 2 (kg/cm ) 2 (kg/cm ) Modulo de elasticidad Flexión Estática Dureza Janka Dureza Janka Fuente: Sotomayor, 2005. 59 2 2 2 2.6.2. Usos B. alicastrum es recomendado para la conservación del suelo, control de la erosión y contrarrestar los efectos de los vientos fuertes, así como para la recuperación de terrenos degradados. Es una especie prometedora para muchas regiones del mundo donde el suelo ha sido degradado a través del desmonte. Se emplea como cerca viva en los agrohábitats, barrera rompevientos, sombra y refugio para la fauna silvestre. Es un árbol de gran porte y densa copa durante todo el año, muy común en solares, parques y avenidas. Se han identificado 39 especies y 10 familias de aves que se alimentan del fruto, la mayoría lo comen entero. Sirve de alimento a los venados y jabalíes. Además la madera se utiliza para elaborar chapa, duela, parquet, cajas para empaques, asientos de silla de montar y mangos para herramientas. Considerando sus características estéticas, de dureza y de estabilidad dimensional, puede usarse para fabricación de muebles (carpintería), implementos agrícolas, lambrín, artículos deportivos (bolos para boliche), palos para escobas y hormas para calzado (Huerta y Becerra, 1974 y http://ctfs.si.edu/webatlas/spanish/brosal.html). También es utilizado en la fabricación de muebles finos, gabinetes, cajas y embalajes, paneles, parquet, chapa, pisos, columnas, artículos torneados, tableros de partículas, sillas de montar, vasijas y construcción en general. Esta madera se recomienda para molduras y pulpa para papel, vigas, viguetas, columnas, tijeras, pisos, durmientes, molduras y en la fabricación de paneles, entarimado, material de artesanías, fabricación de artículos torneados y tiene aptitud para triplay; en Colombia se utiliza como árbol ornamental y como conservacionista (CNIC, 2005; Batis et al., 1999; Chavelas y Dewall, 1988 citados por SIRE, 2005; http://www.peruwoodproducts.com/Congona.html; Zavala, 1999; http://www. regionloreto.gob.pe/amazonia/libros/51/5100003.htm; http://148.202.81.1/new/ informacionacademica/coaxican/plts_mex/capomo.htm y http://ctfs.si.edu/webatlas/ spanish/ brosal.html). Es bastante fácil de trabajar, pero debe ocuparse rápidamente ya que se mancha y se pudre. Ha sido aprobada para su posible utilización en zapatas para el sistema de frenos del Metro. Se emplea como sustituto barato de la "primavera". No es apropiada para uso externo. B. alicastrum presenta cualidades altamente forrajeras con un 16% de proteína digestible en sus hojas y 18% en sus frutos (análisis bromatológico determinado en materia seca), y produce de 20 a 30 toneladas de forraje en tres cortes realizados durante el año (Susano, 1981). Las hojas, tallo joven, fruto y semillas; constituyen un excelente forraje para el ganado bovino, caprino, equino y porcino; en algunos lugares con estación seca muy pronunciada, es la única pastura disponible. Los caballos y los asnos prefieren las hojas secas y el ganado vacuno las come en cualquier estado. 60 Las arboledas de ramón son consideradas como fuente de alimentación animal, igual que las mejores pasturas. Experiencias en animales han demostrado que la ganancia de peso promedio en novillos que recibieron alimento a base de semillas de Capomo fue superior en un 11.3% a la de aquellos que reciben alimento local (consiste en una mezcla de vainas de Acacia pennatula, gallinaza, pasta de semilla de ajonjolí y una solución de urea). En la Universidad de Yucatán se llevaron a cabo pruebas de digestibilidad e índice de consumo voluntario por día con borregos Pelibuey alimentados con forraje fresco de B. alicastrum (Capomo), Leucaena leucocephala (waxín), Cenchrus ciliare (pasto bufel), pulpa y bagazo de Agave fourcroydes (henequén), suplementados con sal y una mezcla rica es fósforo a excepción de la pulpa y bagazo, además, se reforzaron con 25 ml/kg de peso vivo de una solución de 200 gramos de urea al 46%/L. Los resultados demostraron una vez más la eficiencia del Capomo y un índice de consumo voluntario de 5.89 kg por cada 100 kg de peso vivo diariamente para el Capomo, el mayor valor registrado (http://148.202.81.1/new/informacionacademica/ coaxican/plts_mex/capomo.htm; http://www.regionloreto.gob.pe/amazonia/libros/51/ 5100003.htm). Al igual que el látex, la semilla, el fruto y las hojas sirven como galactógeno, por lo que se emplea también como alimento para ganado lechero, mejorándose con una mezcla de caña y hoja de maíz, asimismo, se puede añadir hojas de henequén, el resultado de este proceso es el enriquecimiento de carbohidratos, aminoácidos y enzimas. Las hojas y los frutos son más nutritivos que la alfalfa (http://148.202.81.1/new/ informacionacademica/coaxican/plts_mex/capomo.htm; http://ctfs.si.edu/webatlas/ spanish/brosal.html). En un estudio sobre la calidad y el potencial forrajero de diecinueve especies bosque tropical caducifolio de la Reserva de la Biósfera Sierra de Manantlán, en Jalisco, se indica que de Brosimum alicastrum y Sideroxylon capiri, el ganado consume frutos y hojas. Los análisis bromatológicos mostraron que las tres especies con más alto contenido de proteína cruda (PC) en hojas y ramas tiernas fueron Verbesina greenmanii (27.21%), Leucaena esculenta (25.32%) y Acacia riparia (24.16%), mientras que B. alicastrum tuvo 12.96% (Cuadro 18). 61 Cuadro 18. Análisis bromatológico (%) y peso seco de hojas (Kg/m2) de las principales especies forrajeras en el ejido Zenzontla, Tuxcacuesco, Jalisco, México. Especie Humedad PC Cenizas GC FC ELN CA P Peso seco Acacia cochliacanta A. farnesiana 89.52 16.91 8.09 1.67 20.10 53.23 2.31 0.10 0.204 93.51 21.12 2.36 2.52 34.07 39.93 2.00 0.12 0.363 A. macilenta 91.47 13.98 12.75 2.95 26.10 44.22 2.67 0.14 0.492 A. ripari 93.00 24.16 7.14 1.43 10.93 56.34 ---- ---- 0.278 Albizia tomentosa 93.00 20.46 6.86 6.97 42.67 23.04 1.38 ---- 0.179 Andropogon gayanus Brosimum alicastrum Compositae 85.80 5.10 7.30 1.00 37.25 49.33 1.30 0.22 3.372 91.00 12.96 16.64 2.85 24.07 43.48 3.26 0.15 0.957 87.57 19.20 19.42 0.86 32.92 27.60 4.51 0.09 1.110 Coursetia caribea 92.00 21.24 13.94 2.49 33.08 29.25 3.52 ---- 0.356 Chloris gayana 90.68 5.42 7.86 1.33 40.00 45.39 1.05 0 4.394 Enterolobium cyclocarpum Guazuma ulmifolia Leucaena esculenta Panicum maximum Phithecellobium dulce Prosopis laevigata Sideroxylon capiri 93.00 17.49 9.58 3.30 36.01 33.62 ---- ---- 0.510 92.05 12.50 11.77 0.94 27.47 47.32 2.45 0.13 1.257 93.82 26.38 5.66 0.84 15.86 51.26 0.55 0.34 0.556 87.75 5.40 ---- 1.56 40.45 52.58 ---- ---- 3.170 94.00 22.37 4.01 1.50 23.48 48.64 0.63 0.30 0.041 94.00 12.60 3.95 2.27 23.37 57.79 0.42 0.20 0.652 94.00 13.07 8.98 2.93 26.96 48.08 2.84 0.35 0.931 Verbesina greenmanii Siguiera dentata 86.91 27.21 19.33 1.92 22.66 28.88 3.51 0.12 2.426 94.50 17.25 4.95 1.31 16.88 59.61 0.30 ---- 1.600 Fuente: Carranza et al., 2003. Donde: PC = Proteína cruda GC = Grasa cruda FC = Fibra cruda ELZ = Extracto libre de nitrógeno 62 El más alto contenido de Ca en hojas y ramas tiernas estuvo en una planta de la familia Compositae no determinada (4.51%), Coursetia caribea (3.52%) y Verbesina greenmanii (3.51%). Para los árboles, B. alicastrum tuvo más Ca (3.26%), mientras que Andropogon gayanus fue el pasto que tuvo mayor porcentaje (1.3%). Las especies arbóreas estudiadas están dentro del intervalo de especies con alto contenido (12-30%) de proteína cruda (PC) para árboles forrajeros tropicales. Las cuatro especies con más PC en los frutos (Cuadro 19) fueron Leucaena esculenta (26.37%), Enterolobium cyclocarpum (18.69%), Acacia macilenta (17.98%), y Acacia riparia (17.61%). Las especies con mayor cantidad de Ca en sus frutos fueron Enterolobium cyclocarpum (4.51%), Guazuma ulmifolia (3.52%) y Sideroxylon capiri (3.51%). Cuadro 19. Análisis bromatológico de frutos por especie forrajera en el ejido Zenzontla, Tuxcacuesco, Jalisco, México. Nombre Humedad PC Cenizas GC FC ELN Ca P científico Acacia cochliacanta A. farnesiana 89.52 12.32 7.92 2.82 9.73 67.20 2.31 0.10 93.51 17.21 2.72 1.14 16.79 62.14 2.00 0.12 A. macilenta 92.00 18.05 4.02 1.05 28.37 48.50 0 0 A. ripari 93.00 17.01 6.90 1.26 27.30 47.54 2.32 0.07 Brosimum alicastrum Enterolobium cyclocarpum Guazuma ulmifolia Leucaena esculenta Phithecellobium dulce Prosopis laevigata Sideroxylon Camiri 91.00 8.65 14.70 0.62 2.98 73.08 2.67 0.14 93.00 18.28 9.37 4.21 25.45 42.68 4.51 0.09 92.05 6.44 10.93 2.02 30.87 49.76 3.52 0 92.00 26.43 5.44 0.84 15.89 51.39 0.55 0.34 94.00 14.28 9.08 3.10 13.77 59.37 0.30 0 94.00 12.61 3.73 2.27 23.27 57.80 0.55 0.34 94.00 7.99 8.98 10.19 61.28 15.05 3.51 0.12 Fuente: Carranza et al., 2003. Por lo anterior, se concluye que en la selva baja caducifolia de Zenzontla, Jal., existen especies ricas en proteína (Verbesina greenmanii, Leucaena esculenta, Brosimum alicastrum y Enterolobium cyclocarpum) y especies con un amplio potencial forrajero. Estas selvas tienen un alto potencial como fuentes alternativas 63 para la ganadería de la región con especies nativas que, al mismo tiempo, brindan importantes servicios ambientales (Carranza et al., 2003). Los frutos al igual que las hojas son buenos forrajeros, además sirven de alimento a venados, tepezcuintles y jabalís, como alimento de monos aulladores en la selva mediana subperennifolia y se emplean con ventaja para engorda del ganado, cerdos y aves, alimentándose con una harina mezclada a partes iguales con salvado (http://148.202.81.1/new/informacionacademica/coaxican/plts_mex/capomo.htm; Franco, 2005) El fruto del ramón es dulce y sabroso, pero se aprovecha poco en comparación con la semilla; se comen los frutos cocidos, solos o mezclados miel de abeja o bien se elaboran pasteles, pan de sabor agradable y nutritivo, moliéndolo o mezclándolo con maíz o plátano, puré, mermeladas y tamales (http://148.202.81.1/new/ informacionacademica/coaxican/plts_mex/capomo.htm; http://www.prensalibre.com/ pl/domingo/archivo/revistad/2005/Junio05/050605/dambiente.shtml). En México los indígenas empleaban las semillas mezcladas con maíz para la preparación de tortillas. La manera más sencilla de consumir esta semilla es cruda, pero también puede tostarse ligeramente o quemarse un poco más para molerla y hacer infusiones similares al café. Sin embargo, la manera más beneficiosa para el organismo de consumir esta semilla es cocerla con ceniza o cal. De esa manera se liberan sus proteínas, cuyo porcentaje, por cierto, es superior al del maíz, la leche materna y el huevo (http://www.prensalibre.com/pl/domingo/archivo/revistad/ 2005/Junio05/050605/dambiente.shtml; http://ctfs.si.edu/webatlas/spanish/brosal. html). La pulpa se consume en fresco o se puede utilizar en la preparación de mermelada. Las semillas se consumen asadas o hervidas. Tradicionalmente, se preparan bebidas y platos tanto dulces como salados. Es interesante señalar que la proteína que contienen las semillas de Capomo poseen una cantidad importante de triptofano, uno de los aminoácidos más deficientes en las dietas a base de maíz, que constituye una fuente importante de alimentación para México (http://148.202.81.1/new/ informacionacademica/coaxican/plts_mex/capomo.htm; http://www.regionloreto.gob. pe/ amazonia/libros/51/ 5100003.htm). Las semillas contienen de 12.5 al 20% de proteína, con un alto contenido del aminoácido triptófano y una digestibilidad arriba del 60%. Se prepara una masa o se come como garbanzos. Con el Ojoche se han experimentado varias recetas de pan, tortillas (mitad ojoche y mitad maíz), etc. También se ha utilizado en la alimentación de perros, gatos, gallinas y patos (http://www.ibw.com.ni/~eco/PrVerdur.htm). Las semillas son utilizadas como complemento alimenticio, hervida o tostada asemejándose su sabor al de las castañas y son muy nutritivas se comen solas o con maíz, miel y plátanos. La semilla contiene un aceite esencial, grasa, azúcares y una gran cantidad de triptófano, un aminoácido deficiente en las dietas a base de maíz. Además en algunos lugares las mezclan con café o como sustituto del mismo, existe 64 en el mercado un producto anunciado como café soluble sin cafeína, este producto tiene entre 90 y 95% de harina liofilizada de las semillas del Capomo y un 5 a 10% de café para darle sabor y olor, presentándose como una alternativa de sustituto de café para personas que padecen de alguna afección cardiovascular, sistema nervioso, etc. Homeópatas recomiendan el producto, ya que no quita el sueño, no contiene cafeína y es nutritivo. También se comen en conserva o crudas mezclándolas con maíz para hacer tortillas, son recomendadas para los convalecientes, tostadas o reducidas en polvo (http://148.202.81.1/new/ informacionacademica/coaxican/plts_mex/capomo.htm). Los niveles de proteína cruda que contiene la semilla, son superiores a la leche de vaca, al huevo de gallina, al sorgo y al maíz. A continuación (Cuadro 20) se mencionan resultados de análisis químico de la semilla para uso comercial http://www.regionloreto.gob.pe/amazonia/libros/51/5100003.htm; http://148.202.81.1/ new/ informacionacademica/coaxican/plts_mex/capomo.htm). Cuadro 20. Análisis químico de la semilla de Brosimum alicastrum. Característica Porcentaje Humedad 840% Proteína 2.5% Grasa 0.5% Azúcar 12.1% Calcio 15%(miligramos) Fósforo 36.0% Hierro 0.8% Vitamina A 280.0% Tiamina 0.025% Riboflavina 1.52% Niacina 0.8% Ácido Ascórbico 28.0% Otros resultados de análisis bromatológicos de la semilla de B. alicastrum se anotan en el Cuadro 21. (http://www.regionloreto.gob.pe/amazonia/libros/51/5100003.htm). Cuadro 21. Análisis bromatológico de Brosimum alicastrum. Componentes 100 gramos de semilla 45.0-55.0 g 13.06 g (base seca) 81.13 g (base seca) Humedad Proteína cruda Extracto libre de nitrógeno 65 El látex, es soluble en agua, se emplea en bebidas, tiene sabor y apariencia a la leche vacuna, aunque no tiene su mismo valor nutritivo. El látex que fluye del tronco se emplea para adulterar el chicle. Se usa para controlar el asma, bronquitis y tuberculosis, además es balsámico, antitusivo, diaforético, emenagogo y la infusión de corteza se usa como tónico. Expuesto al aire toma un tinte rosado, con el que se prepara una horchata, que sirve como galactógeno para las mujeres que amamantan a sus hijos o estimulante a glándulas mamarias, rico en carbohidratos, aminoácidos, vitaminas, enzimas, etc. (Batis et al., 1999 y Von Carlowitz et al., 1991; http://www.regionloreto.gob.pe/amazonia/libros/51/5100003.htm; http://ctfs.si.edu/ webatlas/spanish/brosal.html; http://148.202.81.1/new/informacionacademica/ coaxican/plts_mex/capomo. htm). 66 CAPÍTULO 3 Cedrela odorata Lamb. 67 3.1. DESCRIPCIÓN DE LA ESPECIE 3.1.1. Nombre común Cedrela odorata Lamb., es una especie característica de las regiones tropicales, en los lugares donde prospera comúnmente se le conoce como cedro rojo. La madera es considerada como preciosa y junto con la caoba (Swietenia macrophylla) constituyen el pilar de los aprovechamientos forestales de la industria maderera establecida en el trópico (Marroquín y Barrosa, 1994). En México se le conoce con los siguientes nombres comunes: cedro tropical (Chiapas); calcidra (Puebla); cedro rojo, cedro colorado (Oaxaca y Veracruz); cedro real (Veracruz). En lenguas indígenas: ―maya‖ húhche, kújché, kúché, kújeché, kúlché, kúnché, kúyché (Yucatán, Campeche, Quintana Roo); ―náhuatl‖, ticuáhuitl (Veracruz); ―zoque‖, acuy (Chiapas); ―chinanteco‖, mo-ni (Oaxaca); ―mixe‖, pucsnumqui-ui (Oaxaca); ―huasteco‖, icté (San Luis Potosí); ―totonaco‖, puksnúm kiwi (Veracruz); ―tzeltal‖, chujté, chucjté, chujtá (Chiapas) (Manzanilla et al., 2001; CNIC, 2005). Además se le otorgan otros nombres comunes como Cedro (en toda su área de distribución), chujté (Chiapas), icte (Huasteco) y tiocuáhuitl (náhuatl) (Pennington y Sarukhán, 1998). Cedro rojo (Veracruz) y nogal cimarrón (Occidente) (INIREB, 1983). Cedro mexicano, cedro rojo, icté o cedro (en el Estado de México), cedro amargo (Costa Rica) y spanish ceder (Puerto Rico) (Sandoval, 1995; CNIC, 2005). En otros países se le conoce como: cedro cebollo (Panamá), cedro amargo (Venezuela), ceder (Trinidad, Tobago, Jamaica), red ceder (Honduras británicas), acajou roge (Guadalupe y Martinica), cedro macho (Cuba), cedro; cedro cebollo, cedro amargo, cedro caobo, cedro caqueta, cedro rosado y cedro rojo (Colombia) (Guevara, 1988; CNIC, 2005). 3.1.2. Taxonomía Cedrela odorata Lamb., pertenece a la familia Meliaceae, que incluye cerca de 50 géneros y 800 especies distribuidas en las regiones tropicales y subtropicales de América, Asia, África, Australia y Nueva Zelanda. Según Holdridge en 1976, citado por Guevara en 1988, el género Cedrela en América agrupa de 10 a 15 especies, sin embargo, Smith (1960) citado por Guevara (1988), solo reconoce siete especies, de las cuales cuatro se localizan en Colombia: Cedrela odorata, C. angustifolia, C. montana y C. fissilis. C. odorata fue descrita y clasificada por Linnaeus en 1759, desde entonces la especie ha sido descrita con diferentes nombres y se ha dado la misma clasificación a diferentes especies (Guevara, 1988). 68 La taxonomía es confusa, tal es el caso que algunos autores separan a las especies asiáticas del género Cedrela y las asocian a uno llamado Toona. Se menciona que el género Cedrela está circunscrito a la zona tropical y subtropical de América (aproximadamente 49 especies) y de África (1 especie). También se cita que existen dudas sobre si algunas de las especies hasta ahora descritas son verdaderas especies, o bien se trata de sinónimos, subespecies, simples variedades, razas geográficas, procedencias, etc. (Manzanilla et al., 2001). Familia: Meliaceae Género: Cedrela Especie: Cedrela odorata Lamb. 3.1.3. Especies relacionadas Las especies que integran el género Cedrela y el género Toona, tanto el asiático como australiano, están muy estrechamente vinculadas, y por lo tanto, su clasificación es difícil y a menudo no muy confiable. C. balancsae, C. barbata, C. brasiliensis, C. guayanensis, C. huberi, C. macrocarpa, C. regnelii, C. simulans, C. tonduzii, C. verrucosa y C. vittata se encuentran estrechamente vinculadas a Cedrela odorata (Bascopé et al, 1957 citados por Manzanilla et al., 2001). La hibridación ocurre naturalmente entre especies de Cedrela, como por ejemplo. C. odorata x C. angustifolia, C. odorata x C. fissilis, C. odorata x C. cubensis (Lamb, 1968 y Marquetti, 1990 citados por Manzanilla et al., 2001). La amplia distribución de C. odorata y C. fissilis así como del dudoso taxón C. angustifolia (el cual reconoce una especie separada) es debido a que se hibridan libremente y que esto puede ser la explicación a la gran variación fenotípica de este taxa. Además, se señala que no existen evidencias experimentales que acepten o rechacen la hipótesis de la hibridación y que estudios citológicos muestran de que hay por lo menos dos números separados de cromosomas diploides básicos (2n=50 y 56) presentes en C. odorata, esta presencia de diferentes razas cromosomales intraespecíficas parecen estar muy difundidas en las Meliaceae y puede inhibir la hibridación libre (Smith, 1969 citado por Manzanilla et al., 2001; CNIC, 2005). La literatura botánica cita que esta especie puede encontrarse bajo los siguientes sinónimos (WhitMore, 1976 citado por Guevara, 1988; CNIC, 2005): Cedrela guianensis A. Juss Cedrela mexicana Roem Cedrela velloziana Roem Cedrela brownii loefl ex O. Ktze Cedrela occidentalis C.D.C. & Rose Cedrela mexicana ver. Puberula C.D.C. Cedrela yucatana Blake Cedrela longipes Blake 69 1830 1846 1846 1891 1899 1905 1920 1922 3.1.4. Forma C. odorata es un árbol que llega a medir hasta 35 m de altura, con un diámetro de 1.30 m (DAP) hasta de 2.0 m; con el tronco derecho formando a veces pequeños contrafuertes poco prominentes, la copa es amplia; ramas ascendentes y gruesas, copa redonda y frondosa; tiene raíces extendidas y superficiales y la base del fuste con aletones bien desarrollados en suelos poco profundos y raíces profundas de base acanalada en suelos fértiles. (Pennington y Sarukhán, 1998; CNIC, 2005; Sánchez, 1998). También se reporta que los árboles llegan a medir de 20 a 35 m de altura (Figura 3), coincidiendo con los anteriores autores (Niembro, 1986). Se menciona que en casos excepcionales, se pueden encontrar ejemplares que alcanzan hasta 40 m de altura y unos 2 m de diámetro (Betancourt, 1983); se menciona como un árbol grande desciduo que varía mucho en tamaño de acuerdo con las condiciones ambientales, desde un máximo de 30 m en el bosque desciduo subtropical, hasta 40 m o más en el bosque tropical caducifolio y 50 m en condiciones óptimas de los bosques higrofíticos de tierras bajas. El fuste es recto y bastante cilíndrico (Lamb, 1969). 3.1.5. Corteza La corteza muerta es agrietada, desprendible en placas grandes de color gris; la corteza viva es fibrosa, rosada (que oxida a rojo pardo), con exudado escaso, gomoso que brota en puntos aislados (Guevara, 1988); en los árboles jóvenes es de color gris claro (Figura 3) y ligeramente dividida en placas por leves fisuras y que en los ejemplares maduros la corteza se agrieta y las hendiduras van aumentando con la edad del árbol, asimismo, que la corteza de las ramitas es de coloración pardusca y que presentan puntos ligeramente levantados (lenticelas), por último, se cita que la corteza interior es de color rosado o castaño claro, fibrosa y amarga y que los árboles de gran tamaño presentan contrafuertes en la base del tronco (Betancourt, 1983). La corteza externa en árboles grandes es ampliamente fisurada con las costillas escamosas, de color pardo grisácea a morena rojiza y la interna es rosada cambiando a pardo amarillenta, siendo ésta de estructura fibrosa y de sabor amargo de un grosor de 20 mm (Pennington y Sarukhán, 1998 b y Sánchez, 1998). 3.1.6. Hojas Las hojas están dispuestas en espiral, paripinadas o imparipinadas, de 15 a 50 cm incluyendo el pecíolo, compuestas por 5 a 20 foliolos opuestos o alternados y con un olor penetrante a ajo cuando se estrujan, de 4.5 x 2 a 14 x 4.5 cm, lanceolados u oblongos, asimétricos, con el margen entero, ápice acuminado, base muy asimétrica, una mitad redondeada y otra aguda, el color es verde oscuro en la haz (Figura 3) y 70 verde pálido o verde amarillento en el envés (Pennington y Sarukhán, 1998 b; Rojas, 1995 y Sánchez, 1998). 3.1.7. Flores El cedro rojo es una especie monoica, con flores pequeñas y perfumadas, de color blanco, perfectas agrupadas en racimos florales o panículas grandes de 30 a 50 cm, con cáliz irregularmente dentado, masculinas y femeninas en la misma inflorescencia, en panículas terminales de 15 a 30 cm, de largo (Pennington y Sarukhán, 1998 b; CNIC, 2005; Sánchez, 1998), pueden ser hasta 40 cm de largo finamente pubescentes; pedicelos de 1 a 2 mm, de largo; flores suavemente perfumadas, actinomorfitas; cada flor blanca tiene un cáliz en forma de copa de más de 1.6 mm de largo, dentado irregularmente, partido por un lado y liso y sin vello (Manzanilla et al., 2001). En cuanto a las flores masculinas, el cáliz es de color verdoso de 2 a 3 mm de largo, infundibuliforme o anchamente tubular, con 5 dientes agudos pequeños y desiguales, ciliados; corola de color crema verdosa tubular en la prefloración, abriéndose en 5 pétalos, cerca de 7 a 8 mm de largo, con el ápice agudo o redondeado, con una proyección aplanada en la superficie interior cerca de la base, la cual entra en uno de los surcos del ginóforo, imbricados, pubescentes en ambas superficies; con 5 estambres de 2 a 3 mm de largo, insertos cerca de ápice del ginóforo glabros; anteras de 1.5 mm de largo; ovario situado sobre un ginóforo alargado y longitudinalmente surcado, de 3 mm de largo incluyendo el ginofóro, 5- locular, lóculos multiovulares; estilo glabro excediendo apenas a los estambres, glabro; estigma verde y grande truncado (Manzanilla et al., 2001). Las flores femeninas son parecidas al las masculinas, pero estas presentan las anteras abortivas sin polen, delgadas, el estigma es verde, globoso y capitado. La cápsula leñosa es redondeada en ambos extremos y el ovario hinchado. Florece de mayo a Agosto. Cáliz verdoso, de 2-3 mm de largo, con 5 dientes agudos, desiguales, ciliados en el margen; corola de color crema verdoso, con 5 pétalos lineares, de 7-8 mm de largo, pubescentes; androceo con 5 estambres, insertos cerca del ápice del ginóforo, glabros. Pistilodio sobre el ginóforo, estrecho, con 5 lóculos y óvulos rudimentarios; estilo ligeramente excediendo a los estambres; estigma verde, grande, truncado. Flores femeninas parecidas a las masculinas pero con las anteras abortivas, sin polen y el ovario hinchado (http://www.arbolesornamentales.com/Cedrelaodorata.htm; Pennington y Sarukhán, 1998 b; CNIC, 2005). 71 3.1. 8. Frutos Los frutos se desarrollan en infrutescencias hasta de 30 cm, péndulas, es una cápsula con dehiscencia longitudinal septicida, de 2.5 a 5 cm de largo, de 4 a 5 valvadas, elipsoide a oblongas, de color pardo verdosas a morenas (Figura 3) con numerosos grupos de lenticelas pálidas, glabras, con un fuerte olor a ajo y produciendo un exudado blanquecino y acuoso cuando están inmaduras; contienen alrededor de 30 semillas aladas de 2 a 2.5 cm incluyendo el ala, de color morena (Pennington y Sarukhán, 1998 b; CNIC, 2005; Sánchez, 1998). Los frutos son cápsulas de color marrón oscuro y que al madurar se abren en el árbol (Lamprecht, 1990 citado por Rojas, 1995); es una cápsula leñosa, dehiscente, de oblongo-elipsoide a obovoide, de 2,5-5 x 1 cm, colgante, que se abre por 5 valvas y contiene alrededor de 30 a 50 semillas aladas de 2-3.5 cm de largo incluida el ala (http://www.arbolesornamentales.com/ Cedrelaodorata.htm; Sánchez, 1998). Figura 3. A) Ramas B) Frutos. C). Ramas. D) Corteza E) Tronco y F) Plantación de Cedrela odorata, en el municipio de Múgica, Michoacán. 72 3.2. DISTRIBUCIÓN Y HÁBITAT 3.2.1. Distribución geográfica C. odorata está ampliamente distribuida en Latinoamérica, pero en áreas discontinuas y describe que se le ubica desde los 24º Norte hasta los 10º Sur, abarcando México, Centroamérica, las Antillas, el Norte de Sudamérica, hasta alcanzar Perú y Brasil (Rojas, 1995). También se señala que se distribuye en América del Sur y Central, desde México hasta Bolivia y Argentina desde los 27º Sur a 24º Norte, incluidas las islas del Caribe (Webb, 1980; CNIC, 2005). En México se encuentra en la vertiente del Golfo, desde Tamaulipas hasta la Península de Yucatán y en la vertiente del Pacífico, desde Sinaloa hasta Chiapas. Se reporta en los estados de Campeche, Colima, Chiapas, Durango, Guerrero, Hidalgo, Jalisco, Michoacán, Nayarit, Oaxaca, Puebla, Querétaro, Quintana Roo, San Luis Potosí, Sinaloa, Sonora, Tabasco, Tamaulipas, Veracruz y Yucatán (http://www.conabio. gob.mx/conocimiento/info_especies/arboles/doctos/36-melia2m. pdf; Sánchez, 1998). 3.2.2. Clima C. odorata crece bien en climas estacionales con uno o dos periodos secos bien definidos, encuentra sus mejores condiciones de crecimiento y desarrollo en las zonas húmedas de las regiones tropicales y subtropicales y en las zonas más secas, si hay agua disponible (Holdrige, 1976 citado por Melchor y Barrosa, 1994; CNIC, 2005). Se menciona que se desarrolla en forma natural en regiones húmedas (Sandoval, 1995). Las precipitaciones en donde habita la especie varían de 1,200 a 2,000 mm anuales, con una estación seca de tres a cuatro meses (Boscopé et al., 1957; Navarro y Vázquez, 1987 y CNIC, 2005). También se menciona que alcanza sus máximos tamaños e incrementos en zonas con precipitaciones entre 2,500 a 4,000 mm anuales y que en zonas con precipitaciones notablemente menores no se desarrolla tan bien y presenta fustes cortos y frecuentemente torcidos (Pennington y Sarukhán, 1998 b). También se cita que requiere para su desarrollo y crecimiento satisfactorio precipitaciones de 1,600 a 2,500 mm anuales (Webb, 1980). Se refiere que su óptimo desarrollo lo alcanza con precipitaciones entre 1,200 y 2,500 mm anuales (CNIC, 2005). En áreas de precipitaciones tan elevadas como 3,000 mm anuales, el cedro está en el límite extremo de su distribución natural, por lo tanto, su establecimiento ofrece mayores dificultades en estas regiones que entre 2,000 a 2,250 mm anuales (Manzanilla et al, 2001). Según Wadsworth (1960) citado por Manzanilla et al., 73 (2001), el cedro puede sobrevivir en lugares con precipitaciones anuales de inferiores a los 1,000 mm pero crece muy lentamente y con fustes por lo general mal conformados. En Colombia se desarrolla en lugares que presentan precipitaciones de 2,000 a 3,000 mm anuales (Guevara, 1988), sin embargo, en el Estado de Veracruz, México, se presenta en un rango diferente que va de 800 a 3,000 mm anuales (Melchor y Barrosa, 1994). El cedro rojo requiere para su desarrollo y crecimiento temperaturas máximas promedio del mes más cálido de 20 a 32 ºC, con temperaturas mínimas promedio del mes más frío de 11 a 22 ºC y una temperatura promedio anual de 22 a 32 ºC (Webb, 1980; CNIC, 2005). Su óptimo desarrollo lo alcanza en temperaturas medias de 25 ºC (CNIC, 2005). Otras fuentes citan que el cedro rojo puede sobrevivir en lugares con temperaturas promedio durante el mes más caluroso del año de 33 º C y una temperatura mínima de durante el mes más frío del año de 14 ºC, y que crece en selvas tropicales libres de heladas, aunque aclaran que ha sido reportado en latitudes extremas de 24 º al Norte y 28º al Sur en donde ocasionalmente pueden presentarse algunas heladas (Manzanilla et al., 2001). Finalmente, otras referencias mencionan que su óptimo desarrollo lo alcanza a temperaturas medias de 25 ºC (CNIC, 2005). En Cuba se encuentra en las regiones donde las temperaturas oscilan entre 21 ºC (Tope de Collantes) y 26.4 ºC (Santiago de Cuba); aunque a mayor altura sobre el nivel del mar que la de Topes de Collantes, la temperatura media debe ser inferior a la reportada para este lugar; tolera máximas absolutas superiores a 36 ºC y mínimas absolutas por debajo de 5 ºC (Betancourt, 1983). En la isla de Trinidad, donde se cultiva esta especie y que también existe en forma natural, los promedios de temperaturas máximas, en la estación de calor son ligeramente superiores a 32 ºC y los promedios de las mínimas, en la época fresca son de 20 ºC. 3.2.3. Altitud y topografía El cedro rojo se desarrolla en altitudes que varían desde el nivel del mar hasta 800 m, incluso hasta los 1,200 msnm (Webb, 1980; CNIC, 2005), pero en Cuba los árboles de esta especie se localizan desde pocos metros sobre el nivel del mar hasta los 700 a 800 m (Betancourt, 1983) asimismo, en México puede vivir desde la orilla del mar hasta los 800 m que casi coincidiendo con Melchor y Barrosa (1994), al señalar que esta especie prospera en sitios que presenten altitudes 0 a 1,000 m. Se cita que su óptimo desarrollo lo alcanza en altitudes hasta 1,500 m (CNIC, 2005). 74 Otros autores opinan que se desarrolla desde el nivel del mar hasta los 2,400 msnm, en regiones húmedas (Navarro y Vázquez, 1987). 3.2.4. Suelos C. odorata es una especie exigente en suelos fértiles, ricos en materia orgánica, profundos con buen drenaje, con buena disponibilidad de elementos mayores especialmente, fósforo, potasio, calcio y bases intercambiables; algunas referencias mencionan que no tolera las áreas pantanosas, y que la materia orgánica y la cal juegan un papel importante en el comportamiento de los árboles (Betancourt, 1983; Holdrige, 1976 citado por Melchor y Barrosa, 1994; CNIC, 2005; Monroy, 1998). El pH que requiere se encuentre entre 5 y 7, por encima de 7 no es un factor decisivo en el desarrollo de los cedros, pero por debajo de 5, pudiera afectar la presencia de hongos y bacterias favorables al cedro (Roig, 1946 citado por Betancourt, 1983). Los dos requisitos fundamentales son la ausencia de saturación hídrica y abundante suministro de elementos nutritivos (CNIC, 2005). Está especie requiere de suelos con texturas arenosas, franco arenosas o arcillosas, con pH neutro, con buen drenaje y fértiles (Webb, 1980). En suelo de origen volcánico o calizo, con buen drenaje y más o menos profundo, se presentan buenos incrementos en altura y diámetro (Bertoni y Juárez, 1980). En tanto que Manzanilla et al. (2001), describen que los cedros crecen bien en suelos mayormente calcáreos, fértiles, buen drenaje y poca acidez. 3.2.5. Vegetación asociada C. odorata tiene una amplia distribución en ambas vertientes de la República Mexicana, forma parte de la vegetación primaria y secundaria de las selvas altas y medianas perennifolias y subperennifolias (Monroy, 1998; Sánchez, 1998). En el estado sucesional de los bosques intervenidos, está considerada como una especie secundaria tardía por tolerar cierto nivel de sombra en su etapa juvenil, donde es frecuente encontrarla compitiendo con especies tales como: guarumbos (Cecropia spp.), vainillos (Jacaranda spp.), tachuelo (Zantoxylum tachuelo), guamos (Inga spp.), peinemono (Apeiba aspera), Higuerón (Ficus spp.), jagua (Genipa sp.), puntelanza (Vismia sp.), siete cueros (Miconia sp.), árbol de pan (Arthocarpus comunis), etc. (Guevara, 1988). También se asocia con C. fissilis, Carapa guianensis, Cordia elliodora (R. Et pav.) Champ., y Tabebuia rosea (Bertol) DC., entre otras (Navarro y Vázquez, 1987). En Colombia el cedro rojo es una especie dominante en el clímax de los bosques bajos, en donde es frecuente encontrarlo asociado con especies como caoba (Swietenia macrophylla), abarco (Cariniana pyriformis), roble (Tabebuia rosea), sande (Brosimum utile), nuánamo (Virola sp.), ceiba tolúa (Bombacopsis quinatum), 75 quipo (Cavallinesia plantanifolia), caidita (Nectandra sp.), tachuelo (Zantoxylum tachuelo), guino (Carapa guianensis) etc. (Guevara, 1988). 3.3. SILVICULTURA 3.3.1. Bosques naturales El cedro rojo es una especie pionera longeva, encontrándose por ello en el piso superior del bosque natural y se regenera abundantemente en los claros del bosque, en superficies anteriormente cultivadas y también bajo un dosel ralo en condiciones medioambientales favorables. Asimismo, por ser altamente susceptible a Hypsiphylla grandella no se debe de plantar en rodales puros sino en mezclas; se debe tener cuidado de que disponga de suficiente luz desde arriba. Explicó que por sus rápidos crecimientos, los árboles alcanzan en pocos años grandes dimensiones por lo que las limpias y los aclareos se deben de realizar con cuidado para no dañar el sistema radical, el cual es frecuentemente superficial (Lamprecht, 1990 citado por Rojas 1995). 3.3.2. Floración y fructificación La floración del cedro rojo comienza antes de los 10 años, a partir de los cuales se repite anualmente. El inicio de la floración ocurre en la estación lluviosa, usualmente de marzo-abril a junio. Los frutos aparecen en junio y maduran hacia agosto. En la zona cafetera florece de septiembre a diciembre y fructifica de enero a marzo (CNIC, 2005; Sánchez, 1998; Betancourt, 1988). El cedro rojo es una especie con follaje caducifolio y los árboles tiran las hojas cuando han madurado totalmente los frutos de la temporada anterior. En cuanto a la floración, la especie florece de mayo a agosto (octubre). En Los Tuxtlas, Veracruz, florece de marzo a abril. En relación a la fructificación, los frutos maduran en abril y mayo del año siguiente, cuando el árbol ha tirado sus hojas. En Los Tuxtlas, Veracruz, fructifica de enero a abril y de septiembre a octubre (http://www.conabio.gob.mx/conocimiento/info_especies/arboles/doctos/36-melia2m. pdf). En Colombia se realizaron registros fenológicos sobre esta especie teniéndose los resultados siguientes: En Tumaco, la caída del follaje se inicia en septiembre y se extiende hasta diciembre, periodo de menor precipitación; a medida que aumenta la precipitación de enero a mayo se presenta la brotación del follaje e inmediatamente después la fase de floración; en los meses más lluviosos (mayo y junio) aparecen los frutos verdes que maduran en agosto, reiniciándose nuevamente el ciclo (Betancourt, 1988). 76 En Bojoyá-Medio Atrato (Chocó), la caída de follaje se inicia en octubre y se extiende hasta enero y febrero, los meses más secos del año. Inmediatamente se inicia el proceso de rebrote de follaje ocurriendo en abril, mes en que se inicia el periodo más lluvioso del año (Betancourt, 1988). En la zona de Urabá, La floración se inicia en abril y continúa hasta septiembre, mientras que la fructificación comienza en junio para terminar en abril, con la dehiscencia de los frutos y la caída de la semilla, lo que coincide con la defoliación del árbol en la época de seca. En los meses de marzo y abril se inicia la aparición del follaje que continua hasta junio (Betancourt, 1988). En Turrialba Costa Rica, empieza a brotar entre mayo y junio (Logan, 1965 citado por Enríquez, 1985); en México, específicamente en el estado de Campeche, el crecimiento más intenso del cedro es de junio a septiembre (Cedeño, 1975 citado por Enríquez, 1985). 3.3.3. Producción y diseminación de semilla Las plantas de cedro rojo producen abundante semilla con poder germinativo inicial de 80 a 90%, el cual disminuye rápidamente en condiciones climáticas ordinarias (Bascope et al., 1957 citado por Enríquez, 1985). La viabilidad de la semilla disminuye a menos del 50%, cuando se almacena en condiciones naturales por más de cinco meses después de su recolección (Guido, 1993). En Colombia la dispersión de la semilla se genera a través del viento (anemócora) debido a que la semilla es alada. En zonas de llanura donde se presenta una abundante regeneración natural, el principal mecanismo de dispersión son las crecientes y avenidas de los ríos (Guevara, 1988). Cada fruto puede tener de 25 a 40 semillas fértiles, además, señalan que las semillas son aladas y que se desprenden de las cápsulas a medida que éstas abren y con la ayuda del viento viajan a grandes distancias (Manzanilla et al., 2001; Castillo, 1999 a; CNIC, 2005). Se reporta que en un kg de semilla de cedro rojo puede contener desde 45,000 a 60,000 semillas, pudiéndose establecer un promedio de 40,000 semillas que miden de 20 a 25 mm de longitud y representan el 8 al 10% del peso del fruto seco (Manzanilla et al., 2001 y Castillo, 1999 a). Los árboles alcanzan la madurez reproductiva cuando tienen de 10 a 15 años de edad o 30 cm de diámetro a la altura de 1.30 cm. Asimismo, indican que los árboles aislados con poca competencia, son lo que producen mayor cantidad de semilla y aclaran que una vez que fructifica un árbol por primera vez este continúa haciéndolo abundantemente cada año o cada 2 años (Manzanilla et al., 2001). 77 3.3.4. Tolerancia a factores ambientales En un estudio sobre regeneración natural realizado en Venezuela, indica que la ausencia o escaso número de árboles de cedro rojo en el rodal de estudio, probablemente sea por ser una especie intolerante y para su regeneración y desarrollo necesita plena luz (Enríquez, 1985). El cedro rojo es una especie heliófila, es decir, que demanda una gran cantidad de luz para su desarrollo, de rápido crecimiento relativo y el desarrollo posterior de la regeneración, depende considerablemente de la competencia de la vegetación secundaria (acahual), la cual puede llegar a suprimirla, sobreviviendo aquellos individuos que pueden sostener un crecimiento vertical continuo y vigoroso (Melchor y Barrosa, 1994). En el estado sucesional de los bosques intervenidos, el cedro rojo esta considerada como una especie secundaria tardía, por tolerar cierto nivel de sombra en su estado juvenil (Guevara, 1988). El cedro es muy susceptible a la podredumbre de las raíces, lo que generalmente esta asociado a un suelo muy húmedo, y se ha registrado baja supervivencia de árboles en zonas que presentan ciertos niveles de inundación, sobre todo en los meses de mayor precipitación, aunque puede tolerar inundaciones periódicas tales como las que producen los ríos o arroyos (Manzanilla et al., 2001). C. odorata puede sobrevivir largas temporadas de sequías anuales, perdiendo sus hojas y volviendo a retoñar con el retorno de las lluvias. Sin embargo, una humedad adecuada del suelo y de la atmósfera durante la estación de crecimiento se considera esencial (Lamb, 1968 citado por Manzanilla et al., 2001). Por lo tanto, crece muy mal en suelos arenosos y francos de arena fina, debido a que son excesivamente secos (Manzanilla et al., 2001). 3.3.5. Densidad En general resulta muy difícil cuantificar la densidad de esta especie en condiciones naturales, debido fundamentalmente a que ha sido muy codiciada y por lo tanto muy disminuida en los bosques naturales de nuestro país. Al respecto, Cintron (1999) citado por Manzanilla et al (2001), menciona que los bosques naturales en que habita cedro rojo en México (460,000 ha) se tiene una producción anual de 2,000 m3 o sea 0.004 m3/ha, que equivale en promedio, a menos de un árbol por hectárea. Las bajas densidades podría deberse principalmente a los aprovechamientos selectivos de la especie y aunado a su poca o nula regeneración natural. En Cuba la densidad es de 22 árboles por ha en suelos calizos de bosques semidesciduos, en Perú la densidad es de 19 árboles por ha, en Puerto Rico en bosque húmedo disminuyó de 20 a 10 árboles por ha durante un periodo de 24 años (Manzanilla et al., 2001). 78 3.3.6. Plagas En Cedro rojo la plaga principal es el barrenador de la yema apical es el lepidóptero H. grandella (Betancourt, 1983). La Península de Yucatán y en general en la zona tropical del país, han mostrado la posibilidad y rentabilidad de plantaciones con cedro y caoba. Sin embargo, las plantaciones han enfrentado el problema del barrenador de las meliáceas (H. grandella) que ataca el ápice o punta de las ramas provocando la bifurcación de los árboles y el consecuente retraso en el crecimiento y malformación del árbol. Por lo general, los ataques no causan la muerte de los árboles; sin embargo, existen casos en que repetidos ataques han propiciado el debilitamiento del árbol y posteriormente su muerte. El ataque a plantas jóvenes puede darse aún antes de salir del vivero y antes de llegar a la madurez. Sin embargo, los ataques principales y más dañinos ocurren durante los primeros cuatro años de vida de la plantación. Los árboles jóvenes son más afectados debido a la mayor dependencia de crecimiento del meristemo apical (Díaz, 1999 a). El control de H. grandella se lleva a cabo mediante: Control manual. Se practica cuando el ataque del barrenador ya está presente y ha provocado la muerte del brote principal, por tanto, la emisión de dos o más brotes haciéndose necesaria esta operación para corregir los daños que ocasiona la plaga. Consiste en la selección del brote más vigoroso de los existentes y la eliminación de los restantes. Se recomienda hacer la aplicación de esta operación a la mitad de la temporada de lluvias y deberá tenerse el cuidado de dejar una sección de los brotes eliminados de entre 5 y 8 cm, con la finalidad de reducir el efecto de pudriciones al quedar las heridas expuestas al efecto de hongos. Se recomienda utilizar un fungicida para sellar la herida y prevenir las pudriciones. Control silvicultural. Este método aprovecha el efecto protector de otras especies que crecen espontáneamente entre las hileras de plantación de caoba o cedro. De esta manera, al limpiar la plantación para evitar la competencia de maleza, solamente se limpia la calle donde se encuentra la línea de plantación, dejando la vegetación a los lados de la línea de plantas para que formen una barrera que proteja a los árboles. Control químico. Debe provenirse y combatirse con insecticidas–nematicidas de tipo carbámico de contacto, ingestión y sistémico; por ejemplo, el control se realiza aplicando Carbofurán 5%® en dosis de 5 g/planta recién establecida o Carbofurán 50-L® en dosis de 1.5 L/ha durante la época de lluvias (Díaz, 1999 a; Rivera, 1999). 79 Control biológico. Se le puede combatir con aplicaciones mensuales de Beauveria bassiana, hongo que parasita al insecto y que mantiene su población en niveles muy bajos (Sánchez, 1998). El hongo infecta a las larvas del barrenador de brotes (H. grandella) por contacto de las esporas, las cuales germinan y penetran el cuerpo de la larva reduciendo su actividad y provocándoles la muerte. Esto sucede alrededor de los dos o tres días después de la aplicación, posteriormente las larvas cambian de color blanquecino y de aspecto turgente, a color café claro. En el campo, cuando hay suficiente humedad en el ambiente, el hongo crece y aparece en los brotes dañados con un aspecto algodonoso. De esta manera, con el viento las esporas se dispersan para encontrar un nuevo huésped. El hongo se produce sobre un sustrato de arroz y de esta manera se comercializa y para usarlo debe ser fresco y que no se encuentre contaminado, para tener mayor efectividad en campo. Este insecticida biológico se disuelve bien en agua limpia, a razón de 5 g/L y 30 ml del adherente Bionex® o Agral plus® por cada 50 L de la mezcla (INIFAP, 1997 a). Otro tipo de control biológico es el uso de la bacteria Bacillus thuringiensis, que ataca a las larvas de H grandella por ingestión, es decir, cuando la larva empieza a alimentarse de los brotes donde se aplicó la bacteria. Se le conoce comercialmente como Javelin®, Biotrol®, Thuricide®, Dipel®, Agree®, Agritol®, entre otras. Para el control de larvas de H. grandella se utiliza una dosis de 5 g/L de agua y la preparación es igual que para B. bassiana. La aplicación de B. bassiana y B. thuringiensis se realiza directamente a los brotes, follaje y fuste de cada árbol. Para obtener mejores resultados, se recomienda aplicaciones cada mes, con ambos microbios, durante todo el periodo de lluvias, aun cuando al principio no se observe la incidencia de la plaga. Las inspecciones y muestreo en campo deben realizarse periódicamente una vez que ha iniciado la temporada de calor, desde los meses de marzo o abril, para la detección temprana de la plaga. Las dosis usadas y recomendadas no deben tomarse aun como definitivas, ya que aún no se concluye la investigación en este aspecto (INIFAP, 1997 a). También, en el control biológico de H. grandella, en Trinidad, Guayana y Florida, los enemigos naturales encontrados son: Apanteles sp. e Ipobracon sp., las cuales son avispas de la familia Braconidae; Sarcophaga sp., mosca de la familia Sarcophagidae, Microbracon cushmani, avispa de la familia Braconidae; Stenarella brevicaudis Szep., avispa de la familia Ichneumonidae; 2 moscas de la familia Tachinidae, sin determinar el género ni especie; una avispa de la familia Chalcididae y otras avispas de la familia Trichogrammidae, esta última parasitando los huevos. También de hace mención de un hongo, aparentemente del género Cordyceps, como parásito de H. grandella. Existen otros insectos o plagas que atacan al cedro rojo pero el daño que causan es de escasa importancia, comparado con H. grandella (Betancourt, 1983). 80 Otra plaga importante es el barrenador del tronco (Chrysobothris yucatanenses), que ocasiona serios problemas a las plantas de cedro principalmente en las edades tempranas. La larva es deprimida dorsoventralmente, sin patas, con la cabeza pequeña y con los dos o tres primeros segmentos torácicos muy amplios, dando aspecto de martillo, el abdomen es delgado, largo y segmentado. El adulto es un escarabajo de tamaño mediano, generalmente de color oscuro metálico. La larva causa los mayores daños debido a que se alimenta de la corteza y la albura. Por lo general es una plaga secundaria, sin embargo, en las plantaciones de cedro rojo es una plaga primaria, es decir, causa la muerte de árboles sanos. El ataque de las larvas en los árboles además de debilitarlos puede ocasionar su muerte, debido a que abre los vasos leñosos y liberianos. Además, que las galerías dentro del tronco dañan la madera, y también debilitan el sostén del árbol, por lo que los vientos pueden quebrarlos con facilidad. Los árboles como respuesta al ataque de este insecto emite una gran cantidad de gomo-resina que provoca su debilitamiento y por lo tanto el ataque de hongos que ocasionan su muerte. La época de mayor ataque es principalmente en los meses de enero a junio, por lo que se debe tener mayor cuidado en la supervisión de las plantaciones en esta época. Se recomienda la aplicación de insecticidas sistémicos en la base del tallo y el uso del caldo bordelés. Es importante señalar que se debe aplicar principalmente en forma preventiva, ya que de lo contrario la larva puede alcanzar la médula de la planta y disminuir la eficiencia del insecticida (Marín, 1999). Las hormigas son un factor importante en el establecimiento de las plantaciones de cedro rojo y su combate debe iniciarse antes de la remoción de vegetación, procediendo a localizar los hormigueros en una superficie que cubra por lo menos 100 m alrededor del sitio de plantación. Se aplica un insecticida de los organofosforados de contacto (INIFAP, 1997 b). 3.3.7. Enfermedades Una enfermedad del cedro, en Cuba, es la pudrición del corazón, producida por el basidiomiceto Fomes cedrelae (Murr.) Sacc y Trott. (Fulviformes cedrelae Murr.) y cuando avanza en su desarrollo, los árboles se ahuecan interiormente. En estados más avanzados del mal, cuando el corazón está ya bien descompuesto, pero el árbol continua vivo, suelen salir cerca de la base, o en donde exista alguna herida, grandes esporóforos del hongo de 10 a 17 cm de ancho, color amarillento oscuro por arriba y más claro por abajo, conocidos vulgarmente con el nombre de ―orejones‖ y la madera podrida por el hongo es quebradiza (Betancourt, 1983). En la región oriental de Cuba se presentó una enfermedad, no identificada, que afectó a árboles de cedro tanto en bosques naturales como en plantaciones. Los síntomas en la primera fase se observan pequeñas pústulas en la parte externa de la corteza, posteriormente, se produjo la destrucción de los tejidos y se inició la 81 formación de cavidades en las que se acumuló un líquido viscoso. Al progresar la infección se observaron ataques de escolítidos sobre la madera afectada. Por último, las cavidades alcanzan gran desarrollo y la corteza de la parte afectada se hincha y se raja, dando salida a la goma acumulada, la banda dañada muere y se secan las ramas correspondientes a ella (Betancourt, 1983). 3.3.8. Sistemas y prácticas silvícolas Se recomienda aplicar aclareos sucesivos por fajas, porque estas prácticas permiten el desarrollo del cedro bajo condiciones satisfactorias, sin perturbar la estructura normal del suelo forestal (Manzanilla et al, 2001). Estas prácticas suelen ser más efectivas cuando son ligeras y se efectúan en las zonas más secas y que se puede ayudar a la presencia del cedro haciendo plantaciones de enriquecimiento y de cortinas rompevientos, en este ultimo caso se debe de evitar árboles de gran tamaño debido a que causan mucho daño en el momento de la cosecha (Manzanilla et al., 2001). En México la práctica de cortar árboles maduros bajo un sistema de selección, mal aplicado en algunos casos, que sin buscar primeramente favorecer la regeneración natural ha contribuido notablemente a reducir las existencias de C. odorata. La regeneración natural se puede fomentar creando aberturas a sotavento en árboles en edad de producir semilla. El tiempo oportuno para crear tales aberturas es un factor muy significativo, ya que es muy importante que los árboles se regeneren y establezcan sus raíces lo mejor posible antes de que se desarrolle el resto de la vegetación (Manzanilla et al., 2001). Las limpias y los aclareos se deben de realizar con cuidado, para no dañar el sistema radical, el cual es muy superficial. 3.3.9. Crecimiento y rendimiento volumétrico Bajo las condiciones más favorables de crecimiento, la altura de los árboles jóvenes de cedro rojo puede alcanzar 2.3 m/año. En México el promedio del incremento anual en diámetro a una edad promedio de 46 años fue de 14 mm. En suelos calcáreos de Cuba, el promedio del incremento anual del diámetro fue de 3 mm a través en un período de cuatro años. En las llanuras en Perú el área basal fue de 13.2 m 2/ha y el volumen comercial fue de 160 m3/ha (Manzanilla et al., 2001). 3.3.10. Edad de rotación, turno El tiempo de vida de un árbol de cedro es por lo menos de 120 años, la edad de rotación suele ocurrir entre los 30 y 40 años de edad. Sin embargo, si se controlan los ataques del insecto barrenador de brotes se puede cosechar entre 16 a 18 años, si se ha entremezclado con cultivos agrícolas (Manzanilla et al., 2001). 82 3.3.11. Regeneración natural La producción de semilla de cedro rojo es anual, abundante y es dispersada por el viento, sin embargo, la regeneración natural es escasa; en el bosque alto mesofítico, por lo general se limita a sitios próximos a árboles semilleros donde por alguna razón exista algún claro en la cubierta foliar de copas. Asimismo se ha señalado que en los bosques de segundo crecimiento con un dosel ralo, o bien en campos que fueron dedicados a cultivos agrícolas y posteriormente abandonados, se observa mayor cantidad de brinzales que en los bosques altos (Betancourt, 1983). En Honduras Británica (Belice), se encontró que después de un incendio forestal rastrero, se produjo una magnífica regeneración de cedro y caoba de árboles que sobrevivieron al incendio y se cree que se debió a las condiciones de buena luminosidad existente, la reducción de la competencia radical y al incremento de elementos nutritivos disponibles, especialmente el potasio, a causa de la quema de la hojarasca; en Cuba, también se han observado buenas regeneraciones naturales en lugares donde se ha talado el monte y posteriormente se queman los residuos. El cedro rojo es una de las especies de mayor importancia en las zonas tropicales del país, en donde se encuentra más frecuentemente en vegetación secundaria; en los trabajos de regeneración natural se ha tenido poco éxito, debido a que en los bosques tropicales hay escasez de árboles semilleros y a que las plántulas frecuentemente son suprimidas por otras especies de más rápido crecimiento (Enríquez, 1985). Se concluye que con la explotación del bosque tropical basado en el manejo natural intensivo, es sumamente difícil obtener rendimientos aceptables debido a: a). El establecimiento de la regeneración natural en cedro rojo está limitado por la falta de árboles semilleros en suficiente número y bien distribuidos, y que además existen los inconvenientes de la producción irregular de la semilla y los problemas de la diseminación de las mismas. b). Las experiencias en regeneración natural incluso bajo los tratamientos intensivos se ha demostrado que no son factibles. c). Es difícil producir el número de árboles de cedro rojo que se espera en la cosecha final, porque depende del papel de otras especies que intervienen en este aspecto. Esta situación ha llevado a numerosos técnicos a recomendar la repoblación del bosque tropical por medio de plantaciones para incrementar las existencias de maderas preciosas (Enríquez, 1985). Se cita que el establecimiento de la regeneración natural bajo tratamientos intensivos han demostrado que no son factibles económicamente (Enríquez, 1985). 83 3.4. PRÁCTICAS DE VIVERO 3.4.1. Manejo y almacenamiento de semillas La recolección de semilla se realiza, preferentemente en marzo, aunque en algunos sitios o años se adelante desde febrero o se retrasa hasta el mes de abril. Se recomienda que con anticipación a la época de cosecha, se revisen los árboles con semilla para verificar el estado de madurez de los frutos. Para comprobar si las cápsulas están maduras, se abren algunas y se observa el color de las semillas que debe ser castaño claro. Los frutos se recogen a mano sobre los árboles o se cortan con implementos adecuados o bien se sacuden las ramas para que caigan los frutos y recogerlos en el suelo (Betancourt, 1983). Para facilitar la apertura de las cápsulas, se colocan al sol durante 2 a 3 días en capas de poco espesor, sobre mantas de lona o en cajas de madera de base amplia y poca altura. Después de abiertas las cápsulas se utiliza un tamiz apropiado con el fin de eliminar las simientes que no lograron desarrollarse. Cuando las semillas están bien secas, se envasan en vasijas de cierre hermético y se almacenan en cámaras de refrigeración, a temperaturas de 3 a 5 ºC. En Puerto Rico, la semilla es almacenada con un sistema de refrigeración durante 2 meses y que a temperaturas bajas se puede almacenar convenientemente durante 8 meses; aunque se obtiene germinación de la semilla hasta después de 2 años (Betancourt, 1983). La cantidad de semilla se asegura realizando la selección de árboles maduros (mayores de 8 años), sanos, vigorosos, sin ramificaciones repetidas y bifurcaciones, tronco lo más recto posible y de copa mediana a pequeña; para colectar se debe usar una garrocha o pértiga, con una cuchilla en un extremo para cortar las ramillas con frutos, en caso necesario, conviene subirse a los árboles, para obtener la semilla de la parte media y superior de la copa de los árboles. Los frutos se limpian de impurezas, luego sobre una manta se ponen a secar al sol durante dos o tres días, para que abran y se libere la semilla (Melchor y Barrosa, 1994). Se recomienda que la semilla se utilice el mismo año de colecta, debido a que el poder germinativo disminuye rápidamente, el cual es de 80% a los dos meses y hasta el 30% a los seis meses. Sin embargo, se aclara que se puede almacenar hasta un año, empleando para ello frascos o botes cerrados herméticamente a la temperatura de 4 ºC, en lugares secos, frescos y escasa iluminación, tratada con fungicida tales como Captán o Arazán (Melchor y Barrosa, 1994). 3.4.2. Germinación La germinación del cedro es epígea y dura de 2 a 4 semanas, esta se efectúa con éxito colocando las semillas en arena y cubriéndolas con el mismo material hasta una profundidad de 10 a 20 mm, manteniéndolas en la oscuridad a una temperatura de más de 30 ºC. Las semillas también pueden ser sembradas en hileras en suelo 84 arenoso, con buena aereación, cultivado y fértil, luego cubierto con carbón, arena ó aserrín para evitar que sean dispersadas por el viento o el agua; también se siembran en bolsas de polietileno de 127 x 229 mm, con suelo arenoso y corteza de pino descompuesta. Cualquiera que sea el método, es esencial que el suelo sea esterilizado para evitar una infestación de nemátodos y hongos (Manzanilla et al., 2001). Se cita que a los 10 días se obtiene un 75% de germinación (Castillo, 1999 a). El suelo del almácigo deberá ser arenoso, fértil y bien drenado. La germinación de la semilla se inicia entre los 6 a 10 días pudiéndose prolongar hasta 20 a 25 días después de la siembra y si la semilla es fresca la germinación oscila entre 60 y 90%. Para obtener buen desarrollo se deben regar los almácigos diariamente durante los 3 a 4 primeros meses y después aplicarles riegos intensos en días alternos (Betancourt, 1983). Otra fuente cita que la semilla se siembra al voleo, uniformemente en el almácigo y se cubre con una capa de sustrato no mayor de un centímetro y germina de 10 a 12 días después de la siembra; conviene proporcionar media sombra a las plántulas y se recomienda que deben protegerse contra enfermedades aplicando Captán®, en proporción de 1.5 a 2.0 g/L de agua. También conviene deshierbar los almácigos cuando se requiera para evitar competencia con maleza (Melchor y Barrosa, 1994). En Chiapas, México, para lograr la germinación se preparó el almácigo mezclando costera de pino con tierra de monte y arena de río en proporciones iguales, previamente cribadas. Se realizó la siembra al voleo y se cubrió la semilla con una capa de alrededor de 0.5 cm de espesor del mismo sustrato, posteriormente se cubrió el semillero con pasto seco y se aplicó el primer riego. La germinación se inició 13 días después de la siembra y se hizo el trasplante a las camas de crecimiento a los 68 días después de la germinación (Sandoval, 1995 citado por Manzanilla et al., 2001). Para la germinación in vitro de semillas de cedro rojo, se emplearon dos tratamientos: El tratamiento 1 consistió en que los frutos lavados previamente fueron desinfectados en la campana de flujo laminar, mediante su imbibición en una solución con hipoclorito de sodio al 0.8 % con 4 gotas de Tween 20® en 100 ml durante un lapso de 20 minutos. Posteriormente se realizaron 3 enjuagues con agua destilada esterilizada y se extrajo la semilla que fue sembrada posteriormente. El tratamiento 2 consistió en el mismo procedimiento que el tratamiento 1, pero la diferencia fue que a la semilla se le aplicó el mismo método de desinfectación que al fruto. En ambos tratamientos la semilla fue sembrada en frascos con medio MS y colocada en el área de incubación. Se sembraron 10 semillas por frasco con un total de 10 frascos por tratamiento, y se mantuvieron por 35 días a una temperatura de 28 °C ± 1 85 °C, bajo un Fotografìaperiodo de 16 horas luz/8 horas oscuridad, con una intensidad lumínica mínima de 1,500 lux. La germinación se presentó a partir del día 11 en las semillas con el tratamiento 2 (desinfección de frutos y semillas), mientras que con el tratamiento 1 (desinfeccción de frutos) se presentó hasta el día 15. El porcentaje de germinación de las semillas en el tratamiento 2 también fue mayor (54%) que el obtenido para las semillas en el tratamiento 1 (12%) (Andrade y Alonso, 2001). 3.4.3. Prácticas de cultivo en vivero La siembra de cedro rojo se realiza generalmente en almácigos para utilizar los árboles en plantaciones a raíz desnuda o cuando las plántulas alcancen una altura de aproximadamente 10 cm, se deben trasplantar a las camas de crecimiento o a envases. Para esto, se nivela la superficie del almácigo y se abren en éste surcos pequeños con unos 20 cm de separación, donde se colocan 3 o 4 semillas a una distancia de 10 cm y se cubren con 1.5 a 2 cm de tierra. Entre los 30 a 40 días de germinadas, se suprimen las plantas en exceso, dejando la más vigorosa, éstas plantas deberán permanecer un año o más en el vivero antes de ser plantadas en los lugares definitivos (Betancourt, 1983 y Sánchez, 1998). El suelo del almácigo deberá ser arenoso, fértil y bien drenado, pero también se pueden propagar los árboles en envases para plantarlos con cepellón. En cada envase se siembran de 3 a 4 semillas inmediatamente después de la recolección de estas a fines de febrero o marzo, para lograr plantas listas para plantarse a finales de julio o en agosto. Entre los 30 a 45 días de nacidas se eliminan las plantas en exceso, dejando una en cada bolsa y el día que se trasladen del vivero al lugar de la plantación se deben regar intensamente y suprimirles la mayor parte del follaje (Betancourt, 1983). Algunos autores mencionan que la producción de planta en vivero se hace empleando almácigos cuyas dimensiones varían en función de la cantidad de la planta a producir y del área disponible, sin embargo, para el ancho y altura recomiendan que se realicen de 1 x 0.30 m, respectivamente, que permiten la producción necesaria para trasplantar tanto en envase como a raíz desnuda. Respecto al sustrato, se recomienda una mezcla de tierra de monte y arena en la proporción 2:1, a la cual de ser posible se le puede añadir material orgánico completamente descompuesto, tales como rastrojo de frijol, cascarilla de café o gallinaza, en proporción de 2:1:1 (Melchor y Barrosa, 1994). Para desinfectar el sustrato y evitar el ataque de hongos del grupo ―damping off‖, se aplica Formol diluido al 2 ó 3 %, usando una regadera de mano hasta saturar el sustrato; después del riego se debe tapar con plástico, para evitar la evaporación del formol, ya que se gasifica. El tratamiento dura de 24 a 48 horas y después de una semana de aireación, el sustrato estará listo para la siembra (Melchor y Barrosa, 1994). 86 Por otra parte, se indica que la semilla se siembra al voleo o en hileras en el almácigo y se cubre con una capa de sustrato de 0.5 a 1.5 cm y que conviene proporcionar media sombra a las plántulas, recomiendan que debe protegerse contra enfermedades aplicando Captán® en proporción de 1.5 a 2.0 g/L de agua (Melchor y Barrosa, 1994; CNIC, 2005). El sustrato puede ser tierra de monte cernida (Sánchez, 1998) o como otra buena alternativa de producción de plantas de cedro en vivero está el uso de abono orgánico, mismo que presenta mejor calidad y vigor en las plantas, con ello después de 90 días del repique las plantas en el abono lograron un crecimiento superior hasta en un 40% más que las que se transplantaron en el sustrato convencional (Gómez, 1998). En cuanto al trasplante, se recomienda que se haga cuando la planta tenga entre los 5 a 10 cm de altura en envases de polietileno negro de 18 x 30 cm de diámetro y altura, respectivamente, que permita producir planta hasta de 1 m de altura, sin graves daños a la raíz. Se han tenido buenos resultados sembrando 2 o 3 semillas directamente al envase (Melchor y Barrosa, 1994). En relación a la producción de planta a raíz desnuda, la planta se deja desarrollar en el almácigo y se realizan aclareos, para seleccionar las plantas de mayor vigor, sanidad y crecimiento. El establecimiento de la planta en el lugar definitivo, se debe realizar cuando la planta tenga una altura de 60 a 80 cm (Melchor y Barrosa, 1994). En la producción de planta a raíz desnuda, la siembra debe efectuarse de tres a seis meses antes de la fecha de plantación, para tener plantas con el tamaño y las características deseables en la temporada de lluvias. Para efectuar la siembra se preparan pequeños surcos paralelos sobre las platabandas o canteros, separados 15 a 20 cm y con una profundidad de 2 a 3 cm. En los surcos se colocan las semillas y luego se cubren con una capa delgada de tierra. En este tipo de producción de planta es necesario emplear fertilizantes, ya que cada periodo de producción de planta se está cultivando el mismo suelo y por lo tanto, deben reponerse los nutrientes que se extraen para continuar obteniendo plantas de alta calidad. Considerando las características de los suelos, se puede aplicar al voleo 8 g de urea y 20 g de superfosfato triple por m2 de plantabanda. Cuando las plantas alcanzan 20 cm de altura, deben podarse las raíces para iniciar su endurecimiento. Esta operación consiste en una poda inicial relativamente profunda a la raíz principal seguida de dos podas laterales por los cuatro lados; posteriormente una poda final a la raíz principal poco tiempo antes de la extracción de las plantas (un mes antes de su salida al campo). Esta técnica conduce a la obtención de plántulas bien lignificadas y con un corto y denso sistema radical, resistentes a cualquier condición adversa (Díaz, 1999 b). 87 Con la aplicación de auxinas se ha podido reproducir vegetativamente el cedro rojo, utilizando estacas de 20 cm de largo y de 1 a 2 de diámetro, bajo sombra o en invernadero, con alta humedad relativa. Para la propagación por estaca se recomienda el invernadero, con el fin de controlar la humedad relativa, que debe ser de un 90% (CNIC, 2005). El empleo de la propagación in vitro permite aumentar el potencial de propagación vegetativa, en comparación con el método convencional por medio de estacas, ya que la tasa de multiplicación que se puede obtener es de aproximadamente 290 plantas en un año, de un segmento de tallo conteniendo una yema axilar. Se recomienda utilizar la técnica de producir planta de cedro a raíz desnuda en la etapa de vivero, con una densidad de población de 204 plantas/m 2 (Enríquez, 1985). 3.5. ESTABLECIMIENTO Y MANEJO DE PLANTACIONES 3.5.1. Preparación del sitio de plantación La preparación del sitio comprende actividades como la remoción de la vegetación original y la preparación del suelo para recibir a la planta y darle las condiciones adecuadas para su desarrollo. Durante la preparación del suelo se realiza el primer control de maleza en la plantación. Dependiendo del tipo de vegetación y de la topografía del lugar, la limpia podrá hacerse en forma manual o mecánica. La quema después de la limpia facilita las labores de plantación, controla la competencia y libera nutrimentos (INIFAP, 1997 b). La preparación del monte para formar dosel de abrigo supone la corta de la mayor parte de los árboles, dejando los árboles dominantes, que son los de mayor altura y también aquellos de menor altura que sea necesario respetar para que no queden grandes claros en el monte, quedando así una sombra clara por los árboles. El cedro rojo no debe plantarse en lugares con dosel demasiado denso, sino después que haya sido debidamente aclareado. Se recomienda preparar el sitio dentro del bosque natural con la formación de un dosel de abrigo y que el suelo tenga un suelo húmedo pero bien aireado (Betancourt, 1983). En Cuba, se han realizado experiencias de enriquecimiento de montes secundarios con cedro, mediante apertura de dosel de copas, lo que permite a los árboles recibir la luz en su follaje y a la vez, sombra lateral que le proporciona la vegetación circundante. Teniendo en cuenta que el cedro es una especie muy fotófila y que existe estrecha relación entre la cantidad de luz que reciben las plantas y su crecimiento vertical, es necesario protegerlas, oportunamente de la competencia que le dan otras plantas, a fin de que llegue suficiente luz a sus copas (Betancourt, 1983). En suelos muy compactos, el subsoleo es una práctica recomendable y debe hacerse antes de que comience el período de lluvias. Para la preparación del suelo, las operaciones se dividen en primarias y secundarias, son primarias aquellas operaciones realizadas con arados de reja o de disco y con las cuales se voltea el 88 suelo. El laboreo secundario, que debe realizarse posterior al anterior, espaciándolo para permitir que las raíces y las malezas se sequen lo suficiente para morir, se realiza con rastras de dientes y o discos de diferentes tipos y formas de operar, tiene la finalidad de deshacer los terrones grandes, emparejar el suelo y lo más importante, formar una capa de suelo mullido, con la suficiente porosidad y aereación, para permitir captar el agua y constituir un medio adecuado para el desarrollo de los árboles que se van a establecer (SEMARNAP, 1999; INIFAP, 1997 b). 3.5.2. Plantación y espaciamiento El establecimiento de plantaciones compactas de cedro no ocurre con frecuencia, debido a que es muy sensible al ataque del barrenador de la yema terminal; aunque, es posible reducir el problema con un buen manejo (CNIC, 2005). El espaciamiento óptimo para una plantación dependerá del potencial productivo del sitio. Para C. odorata, si se trata de obtener madera aserrada o chapa lo más recomendable son espaciamientos de 2 x 3 m o 3 x 3 m (1,667 y 1,111 plantas por ha, respectivamente). La cepa debe ser adecuada al tamaño de la maceta, o lo suficientemente amplia y profunda como para permitir que las raíces queden bien extendidas, cuando se trata de plantas a raíz desnuda. Si se utiliza este método las cepas deben tener dimensiones de por lo menos 40 x 40 x 40 cm (INIFAP, 1997 b; Rivera, 1999 a). La época óptima para la plantación de C. odorata es cuando el suelo esta húmedo, a principios del temporal de lluvias. En México se descubrió que las plantas que germinan a partir de semillas sembradas directamente eran menos susceptibles al ataque de los insectos de la familia Buprestidae y de los insectos barrenadores de brotes, en comparación con las plántulas trasplantadas. Las semillas se pueden sembrar en surcos a razón de 125 g de semilla por hectárea. También las semillas se pueden dispersar o sembrar en grupos (Manzanilla et al., 2001). La replantación cuando se realiza manualmente, es bastante cara y sólo se justifica cuando la sobrevivencia de la plantación es menor de 80%, debiendo realizarse en un plazo máximo de 30 días después de la plantación (INIFAP, 1997 b). La plantación inicial puede realizarse en espaciamientos que van desde 3 x 2 m hasta 4 x 4 m, con todas las variantes que estos extremos dan, para lograr al momento de la cosecha aproximadamente el 40% de la densidad inicial (Sánchez, 1998). 89 3.5.3. Cultivo de las plantaciones El cedro rojo en su fase inicial de crecimiento es altamente sensible a la competencia de maleza, por lo que esta operación es indispensable hasta la etapa en la que la plantación alcance el crecimiento suficiente y que domine a la vegetación espontánea. Es recomendable que en plantaciones se realicen limpias y cultivo al suelo por lo menos durante los dos primeros años, después del segundo año se hace necesario dar una limpieza anual hasta los cuatro años en que se libera la plantación y este control de las malezas puede ser manual, mecánico, químico o la combinación de ellos (INIFAP, 1997 b). La época de fertilización deberá ser de 15 a 30 días después de la plantación. Las dosis más comunes y con resultados satisfactorios varían de 100 a 150 g/planta de N, P, K; las formulaciones más utilizadas han sido: 17-17-17, 10-34-6; 10-28-6; 1028-6; 5-30-10; 10-30-10 y 5-30-6 (INIFAP, 1997 b). La podas aplicadas con el objetivo de producir madera para aserrío o chapa, sólo deben aplicarse a los árboles que presenten un ritmo grande crecimiento en diámetro, o que con los aclareos mantengan condiciones de crecimiento acelerado. Esto significa que las podas deben ser realizadas en árboles jóvenes. En los aclareos se remueven los árboles excedentes para que se pueda concentrar el potencial productivo de la población en un número de árboles seleccionados. Para el caso de plantaciones, se pueden distinguir dos tipos principales de aclareos: Aclareos sistemáticos. Son aplicados en poblaciones altamente uniformes, donde los árboles aún no se diferencian en clases de copas, lo que implica poblaciones jóvenes no aclaradas anteriormente. Aclareos selectivos. Implican la selección de los individuos según ciertas características previamente establecidas, variables de acuerdo con el propósito a que se destina la producción. Los árboles removidos son siempre los inferiores, dominados o defectuosos. Si se desea producir madera para aserrío, se aplican aclareos a los 6, 10 y 14 años para obtener productos de cortas dimensiones para molduras y torneados y la corta final a los 20 años (Díaz, 1999 c). 3.5.4. Crecimiento y rendimiento volumétrico Cuando el cedro rojo se planta en buenos suelos y se tiene buena iluminación en la copa y a la vez sombra lateral, crece durante los primeros años a un promedio anual de 1.3.a 1.8 m de altura y entre 1.3 a 1.6 cm de diámetro, los cuales a mayor edad el crecimiento en altura disminuye (Betancourt, 1983). 90 En México, se reportan los crecimientos en altura de 9.5 cm y en diámetro de 10.8 cm de una procedencia de Tuxtepec, Oaxaca en una plantación a los 4 años de su establecimiento (Monroy, 1998). La cosecha de cedro rojo en plantaciones puede ser a los 20 años, si se busca madera para aserrío, con un volumen total promedio de 360 m3/ha (Díaz, 1999 c). En Surinam se estimó incremento en diámetro de 1.1 cm/año y que el óptimo se obtiene cuando los árboles tienen entre 15 a 35 cm de diámetro (1.5 cm/año) y que a partir de este diámetro el incremento disminuye considerablemente. Se menciona no prolongar el turno más allá de los 45 cm de diámetro, el cual se alcanzará aproximadamente a los 40 años; el volumen comercial a esa edad es de más o menos de 1.8 m3 por árbol, con un fuste comercial de 15 m. En las plantaciones de enriquecimiento se estima que llegarán al turno entre 100 y 150 árboles por hectárea (Vega, 1974). En estudios realizados en Colombia, el Incremento Medio Anual (IMA) varió poco entre las clases diamétricas; después de un máximo de 2.12 cm/año se estabilizó en 1.8 cm/año a partir de los 30 cm de diámetro. En un 20% de los árboles, los de mayor crecimiento, la curva alcanzó su máximo en la clase de 5 a 10 cm con 3.3 cm/año para luego descender hasta 2.7 cm/año hacia los 35 cm de diámetro. En el mismo estudio se realizaron entresacas simuladas para observar el efecto sobre las curvas de crecimiento diamétrico a los 6.5, 9 y 13 años, en una plantación con densidad inicial de 1,100 árboles/ha. Los resultados obtenidos muestran al cedro rojo como una de las especies tropicales con mayor tasa de crecimiento en diámetro, únicamente superada por especies como Balso, Eucalyptus o Gmelina, que pueden crecer de 2.8 a 5.0 cm/año, aunque ninguna se puede comparar con el cedro en cuanto a la calidad de la madera (Guevara, 1983). 3.5.5. Plantaciones agrosilvopastoriles El cedro rojo es una de las principales especies maderables de los cafetales de Costa Rica, en donde se ve asociado con Inga spp., Eritrina spp., y a una variedad de otras especies productoras de leña, además de Citrus, Mangifera indica y Musa spp. En los cafetales de México, también se mezcla con Inga spuria, Musa spp., y Citrus. Se puede asociar con Borojoa patinoi, Poteria caimito, maíz, mandioca y dasheen como se hizo en Colombia (Manzanilla et al., 2001). Cuando el cedro rojo se asocia con cultivos agrícolas se recomienda plantarlo a espaciamientos de 6 m en las zonas marginales bajas (alrededor de los 1,000 msnm), de 10 a 12 m en las zonas óptimas para el café y 15 m en las zonas marginales altas (por encima de los 1,600 msnm). Entre las combinaciones agroforestales con cedro más frecuentes se encuentran el plátano, la caña de azúcar, el maíz, arroz y café (CNIC, 2005). 91 Las plántulas de cedro rojo se pueden plantar entre hileras de plantaciones de plátanos, inmediatamente después de establecidos estos últimos, para aprovechar su protección contra el viento y su sombra lateral, así como para proteger a los cedros contra el daño producido por el insecto barrenador de brotes. Sin embargo, la cosecha de los plátanos se debe detener durante 5 años o más hasta que los árboles hayan crecido varios metros y hayan formado troncos simples y rectos, aunque se debe tener cuidado de evitar una bifurcación prematura de los árboles de cedro debido a la baja altura de las plantas de plátano. El maíz también puede ser sembrado entre las hileras de los cedros durante los dos años después de establecida la plantación con el sistema Taungya (Manzanilla et al., 2001). En sitios en donde los daños producidos por H. grandella son potencialmente graves se pueden intercalar 400 cedros/ha con cultivos de vegetales comestibles, los que después de aclareos ligeros a los 6 y 12 años pueden lograrse 126 árboles/ha a los 16-18 años. Los cedros se pueden asociar con otros árboles y arbustos para reforzar las riberas y establecer las terrazas a una densidad óptima de 200 a 400 árboles/ha. En Ruanda, por ejemplo, en la cima de las colinas se plantan eucaliptos en tanto que en las laderas se plantan en bandas en contorno especies de Cedrela y Grevillea. Las leguminosas y los pastos son también establecidos entre las bandas, así como siembras de cultivos agrícolas. En México es empleado también como cerco vivo en algunas regiones tropicales (Manzanilla et al., 2001). Para plantaciones agroforestales con cedro rojo en el estado de Yucatán, se recomienda que la época de establecimiento de la plantación y la siembra de maíz se realice en los meses de junio y julio, una vez establecido el temporal, el frijol se establece en Septiembre y las hortalizas como chile y tomate pueden establecerse en la época de seca con el apoyo de riego, otros cultivos de temporal o riego que pueden asociarse son sandía, pepino, calabaza, etc. El espaciamiento óptimo para obtener madera aserrada o chapa es de 2 x 3 m o 3 x 3 m (1,667 y 1,111 plantas/ha, respectivamente) y para maíz se requieren de 10 a 15 kg y para fríjol de 8 a 10 kg de semilla/ha, con sistema de espeque. La época de fertilización deberá ser a los 30 días después de la plantación y las dosis más comunes y con mejores resultados varían de 100 a 150 g/planta de N, P, K en dos aplicaciones y las formulaciones comerciales más utilizadas son: 17-17-17, 10-34-6, 10-28-6, 5-30-10, 10-30-10 y 5-30-10. Para maíz y frijol, se sugiere aplicar la fórmula de fertilización 30-40-00, lo que equivale a 30 kg de nitrógeno y 40 de fósforo por hectárea. Es necesario aplicar la dosis total del fertilizante al momento de la siembra ó 15 días después, cuando el suelo contenga la humedad necesaria para su solubilización (Rivera, 1999 b). En los sistemas agroforestales para conservar el suelo y su productividad en áreas tropicales de ladera se implementaron en el C. E. ―El Palmar‖ del INIFAP, con las siguientes especies: a) Forestales: caoba, cedro y teca, b) frutícolas: naranja valencia, limón persa y plátano; c) especias: canelero; y d) anuales: maíz. Asimismo se establecieron barreras biológicas al contorno con pasto vetiver. Mediante la implementación es factible obtener 2 cosechas de maíz por año, con rendimientos 2 92 t/ha/ciclo; en el caso del cedro rojo, a los 7 años de edad se logró una altura de 8.8 m y diámetro promedio de 8.8 cm y se reduce hasta en un 66% los volúmenes de pérdida de suelo, en comparación con los registrados en el sistema tradicional de roza-tumba-quema. Finalmente se destaca que dicha tecnología, constituye una alternativa eficiente para eliminar las quemas en las áreas explotadas mediante el sistema de roza-tumba-quema y en consecuencia disminuir el riesgo de incendios forestales (Díaz, 1999 d). Existen reportes de que los árboles plantados en combinación con el sistema Taungya reducen el crecimiento, por ejemplo, en Kenya los árboles plantados en suelos desnudos crecen 15% más que en aquellos asociados con maíz y 8% mejor con frijol (Evans, 1982; FAO, 1967 y Mas y Borja, 1974 citados por Manzanilla et al., 2001). Sin embargo, se encontró que el cultivo de maíz entre hileras de plantaciones mezcladas de Swietenia macrophylla, Cedrela mexicana y Cordia alliodora no tuvo efectos desfavorables sobre el crecimiento de la plantación (Mas y Borja, 1974). Se ha observado buen crecimiento de los cedros en algunas ―tumbas‖ de monte, donde se ha extrae la madera y se establecen plantaciones bananeras, pero siempre que el suelo haya conservado su estructura migajosa. También se han observado buenos ejemplares de cedro, mezclados con otros árboles maderables en cafetales (Betancourt, 1983). Una evaluación dasométrica donde el cedro rojo en sistemas agroforestales (cedromaíz) en los Tuxtlas, Veracruz, presentó en un año un promedio de 1.72 m de altura y 4.7 cm de diámetro, en climas favorables y con un nivel intermedio de insumos aplicados a la plantación (Rojas, 1995 citado por Sosa, 1997). 3.6. MEJORAMIENTO GENÉTICO La selección de árboles para obtener semilla de calidad de C. odorata garantizará al menos fenotípicamente los mejores individuos como progenitores de las plántulas para el establecimiento de las plantaciones forestales. El fuste más adecuado de esta especie debe ser largo y de copa estrecha, cuidando que no presente bifurcaciones o daños propiciados por el barrenador de las meliáceas. Los árboles que se seleccionen deben ser, preferentemente de origen natural y no de plantaciones forestales, con la finalidad de garantizar una mayor variabilidad genética y el número de árboles que deben seleccionarse para la colecta de la semilla es de 15 a 25 en promedio, con los cuales se formará un solo lote (Castillo, 1999 b). En la mayoría de los viveros de la Península de Yucatán, usan semilla de cualquier árbol (mayormente de los más cercanos al vivero) y de un número limitado de árboles. Basándose en una encuesta de viveros ejidales y estatales, se encontró que para el cedro existe abundancia de semilla en cada árbol, por lo cual se colecta la semilla, algunas veces, de tan sólo 2 árboles para la producción de 100,000 plántulas. Esta es una de las razones del inició de un programa de mejoramiento genético en Quintana Roo y Campeche. Los objetivos generales del proyecto son los 93 de conservar el germoplasma en ensayos genéticos y lograr la producción de semilla mejorada en huertos semilleros. El objetivo específico de cada ensayo, es buscar genotipos con las mejores características para obtener una buena tasa de crecimiento, así como forma y resistencia al barrenador de la yema. Debido a que existe amplia variación genética en estas especies y la práctica común de colectar semilla de pocos árboles para la producción de cientos o miles de árboles por año, es sumamente importante que se sigan conservando rodales semilleros y que se exija a los viveros el uso de por lo menos 25 árboles madres para la colecta de su semilla. Se pueden obtener ganancias genéticas de crecimiento en altura y diámetro, por ejemplo, en Nigeria varios árboles obtenidos de semillas provenientes de Belice crecieron más de 9 m de altura en 20 meses. Sin embargo, es importante el uso apropiado de sistemas de manejo de silvicultura, tales como plantaciones de enriquecimiento o con mezcla de especies, control biológico de H. grandella, es esencial, si el objetivo es obtener mayores ganancias con el uso de árboles genéticamente mejorados. Los resultados de una prueba de procedencias, indican que algunas son capaces de resistir los ataques de esta plaga, mediante un crecimiento vigoroso de tallo y un alto crecimiento apical que promueve el estableciendo de una nueva rama principal. Las procedencias más prometedoras son las provenientes del Noroeste de Colombia y San Carlos Costa Rica (Manzanilla et al., 2001). La hibridación generalmente se da cada vez que distintas especies de Cedrela crecen demasiado cerca una de la otra. En una plantación cubana, el híbrido natural de C. odorata x C. cubensis alcanzó una altura inicial mayor que cualquiera de las dos especies progenitoras. La primera generación de híbridos y árboles naturalmente resistentes a H. grandella puede ser propagada exitosamente en forma de clon, mediante acodos aéreos, injertos o cultivo de tejidos. Los acodos aéreos se pueden efectuar con fajas de 1.3 a 2.5 cm de ancho colocadas a 25-46 cm de los extremos de los brotes terminales, raspando la albura y aplicando un producto de enraizamiento a base de hormonas (0.5% NAA + 0.5% IBA) (Manzanilla et al., 2001). Los mejores resultados se obtuvieron con injertos de 6 cm de largo, con una superficie de hoja de 100 cm2 sobre los que se había aplicado una solución de metanol con un 0.2% de IBA y posteriormente plantados en arena. Lo mejor es obtener retoños a partir de injertos que no han comenzado a producir las hojas, ya que estos clones son los que brotan más rápido y en gran cantidad. Se deben recoger y establecer cepas de raíces, un año antes de realizar los injertos. Estos deben de ser del mismo diámetro que las cepas de raíces preferiblemente entre 1 y 2 cm de diámetro. Un ensayo prometedor es usar la especie Toona ciliata var. australis para efectuar los injertos de los cedros, lo que les confiere resistencia a H. grandella, aunque la incompatibilidad con el sitio suele ser un serio problema para Toona ciliata cuando se introduce a nuevas regiones (Manzanilla et al., 2001). 94 En Venezuela se han realizado investigaciones sobre la multiplicación de C. odorata, mediante injertos y estacas. Se menciona que los mejores resultados son con los injertos de hendidura, en comparación con los del sistema inglés; los homoplásticos (púa de cedro en patrón de cedro) son mejores que los heteroplásticos (púa de cedro en patrón de caoba); los patrones deben de tener por lo menos 1 cm de diámetro (Manzanilla et al., 2001). En Cuba en 1967, se iniciaron los trabajos de mejoramiento genético de C. odorata, mediante la selección masal, por lo que se seleccionaron 6 rodales semilleros con buenas características fenotípicas. En 1980 se contaba con 19 ha de rodales semilleros, 220 árboles plus, se estudiaron 13 procedencias y se tenían 15 ha de ensayos de progenie. Para multiplicar los árboles de cedro, se han usado los injertos de púa lateral en patrón decapitado y en patrón sin decapitar. Se han injertado las púas de cedro en patrón de la misma especie, obteniéndose más del 80% de prendimiento (Manzanilla et al., 2001). Las pruebas de procedencias permiten suponer que hay muchas razas ecológicas de cedro. En pruebas realizadas en África se observa más claramente las diferencias entre las procedencias, debido a que no están influidas por el efecto del barrenador de las yemas. Los esfuerzos están dirigidos a expandir las pruebas de procedencias incluyendo más fuentes de semillas con tipos promisorios (Manzanilla et al., 2001). En cuanto a la hibridación, se sugiere que la amplia distribución C. odorata y C. fissilis, así como del dudoso taxón C. angustifolia (el cual se reconoce como una especie separada) es debido a que se hibridan libremente y que esto puede ser la explicación a la gran variación fenotípica de esta taxa. Desafortunadamente, no hay aún evidencias experimentales que acepten o rechacen la hipótesis de la hibridación. Estudios citológicos recientes muestran de que hay por lo menos dos números separados de cromosomas diploides básicos (2n = 50 y 56) presentes en C. odorata, esta presencia de diferentes razas cromosomales intraespecíficas parece estar muy difundida en las Meliáceas y puede inhibir la hibridación libre (Manzanilla et al., 2001). En cuanto a cultivo de tejidos, los extremos de los brotes de los cedros pueden ser inducidos a alargarse, colocando cultivos de plántulas de cinco meses de edad en medio para plantas leñosas al cual se le añade BAP® (6-Bencial-amino-Purina), a bajas concentraciones de 0.2 mg/L. Se puede lograr el enraizamiento con una cantidad diluida por la mitad de concentración inicial de BAP®, a la cual se ha añadido IBA en una concentración de 0.5 mg/L y NAA a 0.05 mg/L. En el año de 1999, a través del PRONARE, se seleccionaron rodales semilleros de cedro y caoba en bosques de Campeche, pero como esta semilla no está probada en ensayos genéticos, sólo se puede usar como semilla autorizada y no certificada, según el reglamento técnico para la certificación de semilla. 95 3.7. PROPIEDADES Y USOS 3.7.1. Propiedades físico-mecánicas de la madera La madera es aromática, la albura es de color blanquzco a castaño claro y el duramen de rojo a rojo marrón. Su madera tiene características excelentes en duración y para su trabajabilidad (Rojas, 1995; CNIC, 2005). Es de madera liviana, pero fuerte, de grano recto durable y fácil de trabajar, adquiere un veteado y jaspeado atractivo cuando se pule (Melchor y Barrosa, 1994). Por su parte, Pennington y Sarukhán (1998 b), señalaron que la madera presenta albura de color crema rosado con un olor muy característico y sabor amargo, con vasos grandes dispuestos en anillos concéntricos y bandas conspicuas y de parénquima apotraqueal. La madera es de sabor amargo, olor agradable y persistente, se seca rápidamente sin rajarse ni contraerse, es resistente, fuerte, muy durable y por lo común inmune a los insectos (Betancourt, 1983). La textura de la madera es generalmente mediana y suave al tacto, en algunos árboles de madera más obscura la textura puede ser más gruesa; el grano es recto, algunas veces entrecruzado; anillos visibles y vasos grandes, visibles a simple vista; radios medulares que se pueden ver con el auxilio de una lupa (Betancourt, 1983). El peso específico de la madera varía de 0.42 a 0.63 g/cm 3 con un contenido de humedad del 15%; si es secada al aire, oscila entre 0.37 a 0.75 g/cm3. En cuanto a la densidad en la madera de la albura secada al horno, el valor fue de 0.41 g/cm3 y 0.44 g/cm3 con 14.9% de humedad (Betancourt, 1983). La contracción volumétrica total es de 9.97% y la relación T/R=1.33 es muy baja. En cuanto a las propiedades mecánicas son relativamente altas con relación a su densidad, con excepción de la compresión perpendicular (54 kg/cm 2) que es moderadamente baja (Betancourt, 1983). El promedio de gravedad específica de la madera es de aproximadamente 0.48 con un contenido de humedad del 12%; su peso varía considerablemente dependiendo del sitio, la edad del árbol y la razón de su crecimiento. Con respecto al sitio, se descubrió que el promedio de gravedad básica específica de la madera producida por los cedros rojos que crecen en sitios húmedos fue mayor (0.40) en comparación con los que crecen en sitios secos (0.32) (Manzanilla et al., 2001). La madera verde pesa aproximadamente 0.70 g/cm3, mientras que la madera secada al aire cuyo contenido de humedad varía del 12 al 15%, pesa aproximadamente 0.48 gr/cm3. El peso específico aparente de la albura es de 429 kg/m3, del duramen de 420 kg/m3 y en promedio 423 kg/m3 para el árbol (Manzanilla et al., 2001). 96 3.7.2. Usos Después de la caoba, el cedro rojo es la especie maderable más importante en la industria forestal de México. Por sus características excelentes, es usada para obtener madera aserrada, chapa, madera terciada, madera torneada para diferentes usos, cajas y envolturas de puros, así como para hacer esculturas, artesanías, por su excelente jaspeado el uso más indicado es la fabricación de chapa y madera terciada para exportación (Pennington y Sarukhán, 1998 b; CNIC, 2005). Se usa para la elaboración de muebles finos, decoración de interiores, instrumentos musicales, cubiertas y forros de embarcaciones, lambrín, parquet, triplay, chapa y ebanistería en general (Melchor y Barrosa, 1994; Monroy, 1998). Es considerada como la mejor para la construcción de canoas y lanchas deportivas, instrumentos musicales y también para la ebanistería. La infusión que se obtiene de las hojas, raíz, corteza y madera, se emplea contra bronquitis, vómitos, hemorragias, epilepsias, fiebres y diarreas (Rojas, 1995; CNIC, 2005). Se reporta que la madera de cedro rojo no es conveniente emplearla en la fabricación de escaparates, encofrados o cajas que vayan a contener artículos de cristal o implementos metálicos, ya que el aceite volátil al evaporarse se condensa en las superficies frías. Tampoco se recomienda para empacar licores debido a que el alcohol disuelve la resina y a consecuencia el licor adquiere un sabor amargo (Guevara, 1988). C. odorata es una especie melífera y la producción nectarífera es muy abundante, cuando las condiciones del tiempo son muy favorables y los árboles que se encuentran aislados florecen copiosamente, se emplea como cortina rompevientos, cercas vivas, protección de cultivos y en el control de erosión y conservación de suelos (Betancourt, 1983 y CNIC, 2005). La corteza del cedro se emplea como astringente, febrífugo y mezclada con aguardiente se usa contra dolores internos a consecuencia de golpes o caídas (Betancourt, 1983 y CNIC, 2005). 97 CAPÍTULO 4 Enterolobium cyclocarpum (Jacq.) Griseb Fotografía tomada por H. Jesús Muñoz Flores. 98 4.1. DESCRIPCIÓN DE LA ESPECIE 4.1.1. Nombre común Enterolobium cyclocarpum (Jacq.) Griseb tiene los siguientes nombres comunes en México: Aguacaste, ahuacashle, cuanacaztle, nacashe, nacaste, nacastillo, nacastle, nacaztle (Oaxaca); necaxtle (Veracruz); cascabel, cascabel sonaja (Tamaulipas); cuanacaztli, cuaunacaztli (náhuatl); juana costa (nombre comercial); nacaxtle, orejón (Veracruz); Pich (Yucatán); piche (Tabasco); picho (norte de Chiapas y Tabasco); orejón (San Luis Potosí, Norte de Veracruz y Puebla); cuytátsuic (popoluca, Veracruz); guanacastle, huanacaxtle, huienacaztle, huinacaxtle, huinecaxtli (Sinaloa); lash-matz-zi (chontal, Oaxaca); ma-ta-cua-tze, mo-cua-dzi. mo-ñi-no (chinanteca, Oaxaca); shma-dzi (chontal, Oaxaca); Nacascuahuitl; parota (Michoacán, Jalisco, Guerrero, Oaxaca); tutaján (mixteca, Oaxaca); ya-chibe (zapoteca, Oaxaca); Tiyuhu (huasteca, S. L. P.) (Castro, 1997; Susano, 1981; http://www.conabio.gob.mx/ conocimiento/info_especies/arboles/doctos/41-legum16m.pdf; http://www.semarnat. gob.mx/pfnm2/ fichas/enterolobium_cyclocarpum.htm). 4.1.2. Taxonomía Familia: Fabaceae (Leguminosae) Orden: Fabales (Mimosidae) Género: Enterolobium Especie: Enterolobium cyclocarpum (Jacq.) Griseb (http://www.inbio.ac.cr/bims/k03/p13/c045/o0260/f01610/g007707.htm; http://www. fs.fed.us/global/iitf/Enterolobiumcyclocarpum.pdf; http://www.semarnat.gob.mx/pfnm2 /fichas/enterolobium_cyclocarpum.htm). 4.1.3. Especies relacionadas Se les considera como sinónimos a Albizia longipes Britton & Killip; Feuilleea cyclocarpa (Jacq.) Kuntze; Inga cyclocarpa (Jacq.) Willd. ; Mimosa cyclocarpum (Jack). ; Mimosa cyclocarpa Jacq. ; Mimosa parota Sessé & Moc. ; Pithecellobium cyclocarpum (Jacq.) Mart. ; Prosopis dubia Kunth Enterolobium schomburgkii Benth (Niembro, 1986; CNIC, 2005; http://www.conabio.gob.mx/conocimiento/info_ especies/arboles/doctos/41-legum16m.pdf; http://www.semarnat.gob.mx/pfnm2/fichas /enterolobium_cyclocarpum.htm). 4.1.4. Forma Es un árbol que llega alcanzar de 20 a 50 m de altura y diámetros de 2 a 3 m, con el fuste cilíndrico y a veces con pequeños contrafuertes en la base (Figura 4); copa ancha, extendida y hemisférica, el follaje es abundante dando a la amplia copa una 99 forma más ancha que alta (Figura 4); ramas ascendentes (Huerta, 1983; Niembro, 1986; Castro, 1997; CNIC, 2005; http://www.conabio.gob.mx/conocimiento/info especies/arboles/doctos/41-legum16m. pdf). Las ramas jóvenes de color verde a moreno grisáceas, glabras (Figura 4), con abundantes lenticelas protuberantes, longitudinales y suberificadas (Pennington y Sarukhán, 1968; Martínez, 1979 y Cabrera, 1982 citados por Manzanilla et al., 2001; http://www.semarnat.gob.mx/pfnm2/fichas/enterolobium_cyclocarpum.htm). 4.1.5. Corteza La corteza externa es lisa a granulosa y a veces ligeramente fisurada, de color gris claro a parduzco (Figura 4), con abundantes lenticelas alargadas, suberificadas, dispuestas en hileras longitudinales, con un grosor de 0.5 a 1 cm. La corteza interna es de color crema rosado, granulosa, con exudado pegajoso y dulzón que se coagula al contacto con el aire; el grosor total de la corteza es de 2 a 3 cm (Huerta, 1983; Castro, 1997; CNIC, 2005; http://www.conabio.gob.mx/conocimiento/info_especies/ arboles/doctos/41-legum16m.pdf). 4.1.6. Hojas Las hojas son compuestas, bipinnadas, alternas, dispuestas en espiral, con 4 a 15 pares de pinnas y cada pinna con 15 a 30 pares de hojuelas o foliolos lineales de 8 a 15 mm de largo, ápice agudo, de color verde brillante, glabras, envés verde pálido y haz verde oscuro. Presentan de 15 a 40 cm de largo incluyendo el pecíolo, cada foliolo compuesto por 15 a 35 de foliolos secundarios sésiles de 10 x 3 a 16 x 4 mm, linear-lanceolados, asimétricos, con el margen entero, ápice agudo mucromado, base truncada o asimétrica; generalmente el último par de foliolos secundarios angulados; verde brillante y glabros en el haz y verde grisáceos y pubescentes en las hojas nuevas en el envés (Figura 4); glándulas presentes a la mitad del pecíolo y entre algunos pares de foliolos, raquis primario y secundario pubescentes, los últimos acanalados en el haz (Huerta, 1983; Castro, 1997; CNIC, 2005; http://www. conabio.gob.mx/conocimiento/ infoespecies/arboles/doctos/41-legum16m. pdf; http:// www.fs.fed.us/global/iitf/Enterolobiumcyclocarpum.pdf). 4.1.7. Flores Las flores se presentan en cabezuelas pedunculadas axilares, de 1.5 a 2 cm de diámetro, sobre pedúnculos de 1.5 a 3.5 cm de largo, son actinomorfas, el cáliz es verde, tubular; cáliz de 2.5 mm de largo, densamente pubescente, la corola es tubular de color verde claro con cinco lóbulos, valvados y lanceolados, de 5 a 6 mm de largo; estambres numerosos, glabros, unidos en un tubo en la mitad inferior, filamentos blancos, anteras verdes, ovario súpero, alargado, unilocular y multiovular 100 (Padilla, 1996; CNIC, 2005; http://www.conabio.gob.mx/conocimiento/infoespecies/ arboles/doctos/41-legum16m. pdf). Las flores son pequeñas, sésiles de color blancuzco a verde claro, colocadas en cabezuelas axilares de 1.5 a 2 cm de diámetro sobre pedúnculos escasamente pubescentes de 1.5 a 3.5 cm de largo. Flores actinométricas; cáliz verde de 2.5 a 3 mm de largo, tubular con 5 a 6 dientes ovados muy pequeños, poco pubescentes en la superficie exterior, corola verde de 5 a 6 mm de largo, tubular, expandida en la parte superior de 5 lóbulos valvados, laucolados, agudos, ciliolados, estambres numerosos, de 1 a 12 cm de largo, glabros, unidos en la mitad inferior en el tubo que iguala en largo a la corola; filamentos blancos, anteras verdes; ovario súpero, alargado, unilocular, multiovular, glabro; estilo delgado, glabro, excediendo a los estambres y torcido en la parte superior; estigma simple (Manzanilla et al., 2001; CNIC, 2005; http://www.acguanacaste.ac.cr/bosque_seco_virtual/bs_web_page/ paginas_de_especies/enterolobium_cyclocarpum.html; http://www.fs.fed.us/global/iitf/ Enterolobiumcyclocarpum.pdf). 4.1.8. Frutos El fruto es una vaina circular indehiscente, de 7 a 15 cm de diámetro, aplanada y enroscada, leñosa, de color café claro a oscuro, brillante, de olor y sabor dulce (Figura 4). Contiene de 5 a 20 semillas que son de forma ovoide y aplanadas, de 2.3 x 1.5 cm y brillantes con una línea pálida con la forma del contorno de la misma, rodeada por una pulpa esponjosa y fibrosa de olor y sabor dulce. Presentan una testa extremadamente dura que impide la germinación hasta que una modificación estructural permita la hidratación del embrión. En Nicaragua se encontró que las semillas recolectadas de 132 árboles tenían un largo de 9.8 a 19.8 mm, un ancho de 5.8 a 15.4 mm y un grosor de 2.5 a 12.2 mm (Pennington y Sarukhán, 1998 a; Martínez, 1979; Huerta, 1983; Espejel y Martínez, 1979; http://www.conabio.gob.mx/ conocimiento/infoespecies/arboles/doctos/41-legum16m. pdf; http://www.fs.fed.us/ global/iitf/Enterolobiumcyclocarpum.pdf; CNIC, 2005). 101 Figura 4. A) Árbol. B) Ramas C) Tronco. D) Corteza. E) Flores. F) Fruto. G) Hojas de Enterolobium cyclocarpum. 4.2. DISTRIBUCIÓN Y HÁBITAT 4.2.1. Distribución geográfica E. cyclocarpum es originario de América tropical. Se extiende desde los 23º N en México a través de Centroamérica hasta los 7º N en América del Sur (Venezuela y Brasil). También se le encuentra en Jamaica, Cuba, Trinidad y Guyana. Ha sido introducida a otras regiones tropicales (Espejel y Martínez, 1979; CNIC, 2005; http://www.conabio.gob.mx/conocimiento/infoespecies/arboles/doctos/41-legum16 m. pdf; http://www.fs.fed.us/global/iitf/Enterolobiumcyclocarpum. pdf). En México se distribuye en la vertiente del Golfo, desde el Sur de Tamaulipas hasta la Península de Yucatán y en la vertiente del Pacífico, desde Sinaloa hasta el Estado de Chiapas. Los estados donde se reporta son Campeche, Chiapas, Colima, Guerreo, Jalisco, Estado de México, Michoacán, Morelos, Nayarit, Oaxaca, Puebla, Querétaro, Quintana Roo, San Luis Potosí, Sinaloa, Sonora, Tamaulipas, Veracruz y Yucatán (Pennington y Sarukhán, 1998 a; http://www.conabio.gob.mx/conocimiento/ infoespecies/arboles/doctos/41-legum16m.pdf; http://www.semarnat.gob.mx/pfnm2 fichas/enterolobium_cyclocarpum.htm). 102 La parota es una especie difícil de relacionar con algún tipo de vegetación primaria, pues se le puede encontrar en zonas de vegetación perturbada en selvas altas perennifolias y medianas subperennifolias y aparentemente en asociaciones primarias de selvas medianas subcaducifolias y caducifolias; en Jalisco se distribuye en la zona cálida húmeda en el Occidente de la entidad, dentro de la vertiente del Océano Pacífico y que sus coordenadas geográficas son: 19º 07’ y 20º 55’ de latitud Norte y 104º 15’ a 105º 42’ de longitud Oeste (Huerta, 1983; http://www.semarnat. gob.mx/pfnm2/fichas/enterolobium_cyclocarpum.htm; http://www.conabio.gob.mx/ conocimiento/info_especies/arboles/doctos/41-legum16m.pdf). Se reporta en el bosque de galería, bosque tropical caducifolio, bosque tropical perennifolio, bosque tropical subcaducifolio y bosque tropical subperennifolio (http://www.conabio.gob.mx/conocimiento/info_especies/arboles/doctos/41-legum16 m.pdf; http://www.acguanacaste.ac.cr/bosque_seco_virtual/bs_web_page/paginas_ de_especies/enterolobium_cyclocarpum.html). De todos los factores, el clima, es el principal elemento que influye en la distribución de la vegetación y la parota no es la excepción, por lo que se distribuye en la región de la costa del estado de Jalisco en donde cohabita en el llamado bosque tropical subdeciduo (Huerta, 1983). En base a verificaciones de campo, se pudo localizar en los municipios de: Purificación, Casimiro Castillo, La Huerta, Tomatlán, Tuxpan, Tonila, Pihuamo, Tamazula y Jocotepec. Aunque se sabe que existe en otras localidades y municipios que no se tuvo la oportunidad de visitar y corroborar su presencia (Rueda et al., 2007). 4.2.2. Clima El clima en donde se localiza es cálido húmedo (SEDER, 1996); en Jalisco se desarrolla preferentemente en clima cálido húmedo (Huerta, 1983). El guanacaste es originario de zonas cálidas semihúmedas con estación seca prolongada, aunque crece bien en zonas húmedas. Se presenta en un amplio especto de condiciones climáticas, topográficas y edáficas del trópico mexicano y así se pueden encontrar parotas en lugares con precipitaciones anuales que van desde 750 mm a 2,500 mm con una estación seca mínima de 2 a 6 meses, que puede ser regularmente marcada (Manzanilla et al., 2001; CNIC, 2005; http://www.fs.fed. us/global/iitf/Enterolobiumcyclocarpum.pdf). Las temperaturas promedio anuales en el área de distribución natural del guanacaste se encuentran en el intervalo de 23 a 28 ºC (CNIC, 2005; http://www.fs.fed.us/global/ iitf/Enterolobiumcyclocarpum.pdf). En la Costa de Jalisco donde vegeta en forma natural se registran temperaturas medias anuales superiores a los 22 ºC, libres de heladas y precipitaciones medias anuales superiores a los 1,100 mm con estación seca, que no sobre pase los 6 meses (Manzanilla et al., 2001). 103 4.2.3. Altitud y topografía La especie suele desarrollarse en altitudes que van de 0 a 1,200 m (SEDER, 1996; CNIC, 2005). Otros autores señalan altitudes que varían de 0 a 1,600 m. En el Estado de Jalisco se desarrolla en forma natural desde los 300 a 1,200 msnm, pero el rango en el que se observó que se desarrolla en forma óptima es de 300 a 600 msnm (Huerta, 1983). En Jalisco, la especie se localizó en sitios con altitud que varió de 50 a 1,590 m en la Faja Costera y Zona Sur de la entidad. Los valores de altitud ubicados en la faja costera fueron de 50 a 400 m, y los de la zona sur fue de 820 a 1,590 msnm, pero los mejores ejemplares se observaron en las altitudes menores, aunque en algunos sitios con altitudes mayores de 600 m y con buena humedad, se observaron ejemplares con excelentes crecimientos (Rueda et al., 2007). 4.2.4. Suelos E. cyclocarpum habita sobre suelos profundos, sobre todo en regosoles y cambisoles (Huerta, 1983), con texturas de ligeras a medias, con un pH neutro o ligeramente ácido y con buen drenaje (SEDER, 1996; CNIC, 2005). Presenta su mejor desarrollo en suelo vertisol pélico y vertisol gleyco (http://www.conabio.gob.mx/conocimiento/ info_especies/arboles/doctos/41-legum16m.pdf; http://www.fs.fed.us/global/iitf/Entero lobiumcyclocarpum.pdf). Se desarrolla en terrenos planos o en laderas; preferentemente con abundante contenido de materia orgánica. En la Costa de Jalisco los suelos donde vegeta en forma natural pueden ser someros o profundos y de textura muy variable, desde arcillosa hasta arena casi pura. El contenido de materia orgánica suele ser elevado, al menos en el horizonte en contacto directo con la hojarasca. La acidez medida en valores de pH varía de 4 a 6.5 (Manzanilla et al., 2001; CNIC, 2005; http://www.fs. fed. us/global/iitf/Enterolobiumcyclocarpum.pdf). 4.2.5. Vegetación asociada Las especies con las que más frecuentemente se asocia E. cyclocarpum son: Totoposte (Licania arborea), canelo (Callicophyllum candidissinum), amate (Ficus continifolia), (F. mexicana), cedro rojo (Cedrela odorata), primavera (Roseodendron donnell smithii), ceiba (Ceiba pentandra), Bursera simaruba y Sideroxylon capirit (Padilla, 1996). En el estado de Jalisco muy rara vez llega a formar bosques puros y suele asociarse principalmente en las zonas cálido húmedas con B. alicastrum, Hura polyandra, Tabebuia rosea y Ficus spp. (Huerta, 1983; http://www.conabio.gob.mx /conocimiento/infoespecies/arboles/doctos/41-legum16m. pdf; http://www.fs.fed.us/ global/iitf/Enterolobiumcyclocarpum.pdf). 104 En la selva mediana subperennifolia y subdecidua, se encuentra asociada con B. alicastrum (Ramón), Manilkara sapota (Chicozapote), Astronium graveolens (Palo de culebra), Bernoulia flammea (Palo de calabaza), Bursera arborea (chacá), Bursera simaruba (Guajirote), Astronium graveolens (palo de cera),Calopphyllum brasiliense (Barí), Cordia eleagnoides (Cueramo), Cybistax donell-smithii (primavera), Roseodendron donell smithii (Primavera), Swietenia humilis (Caobilla), Ceiba pentandra (Ceiba), Dendropanax arboreus (mano de León), Hura polyandra (Habillo), Hymeneaea courbril (guapinol), Orbygnia guacuyule (coquito de aceite), Tabebuia rosea (Rosa morada), Andira inermes (Cuautolote), Vitex mollis (Cuyotomate), Licania arborea (Cacahuananche), Pterocarpus acapulcencis (Grado), Ficus tecolutensis (Camichín), Maclura tinctoria (Mora), Nectandra abigens (Laurel), Carpinus caroliniana (Lechoso), Trophys recemosa (Huachal) y Burmelia persimilis (Palo de clavo) (Pennington y Sarukhán, 1998 a; Dirección General de Investigación Nacional Forestal, 1972; Cabrera, 1982; Rzedowsky, 1983; http://www.conabio.gob. mx/conocimiento/info_especies/arboles/doctos/41-legum16m. pdf). 4.3. SILVICULTURA 4.3.1. Bosques naturales E. cyclocarpum es una especie que demanda luz, no es específica de cierto tipo de ambiente, aun en los sitios pobres logra un ritmo de crecimiento aceptable y es uno de los árboles grandes de América Central, que compite con las Ceibas. Las Selvas de la especie (parota) asociada con totoposte (Liana arborea) tienen su mejor desarrollo en las vegas de suelos profundos de la depresión central y en terrenos similares de la planicie Costera del Pacífico. Generalmente no es un árbol dominante por su número en esta clase de selva, pero sus inmensas copas, lo hacen dominante en ocasiones por su masa (Manzanilla et al., 2001). En México se encuentra formando parte de diversas comunidades vegetales; en el estado de Michoacán existen bosques tropicales semideciduos de 25 a 30 m de altura, compuesto de muchos elementos arbóreos, de los cuales ninguno es dominante. El mismo tipo de bosque, se presenta también en algunas barrancas y valles al Norte del Río Tepalcatepec. 4.3.2. Floración y fructificación La parota es un árbol de larga vida y de fructificación tardía, produciendo su semilla a partir de los 8 a 10 años. La floración se presenta de febrero a junio y la fructificación se da en los meses de abril a julio, siendo en mayo y junio cuando las vainas maduran desprendiéndose del árbol con facilidad. Pierden la hoja de febrero a abril (Huerta, 1983; http://www.conabio.gob.mx/conocimiento/info_especies/ arboles/doctos/41-legum16m.pdf; http://www.acguanacaste.ac.cr/bosque_seco-virtual /bs_web_page/paginas_de_especies/enterolobium_cyclocarpum.html). 105 Otros autores opinan que la parota presenta su floración de febrero a marzo, la fructificación se presenta de marzo a junio y que la maduración de los frutos se presenta en los meses de junio a agosto (Arreola, 1995). En Jalisco la mayor actividad fenológica ocurrió principalmente en la época seca del año previo al inicio de las lluvias. La caída del follaje, la floración, fructificación y la dispersión de semillas se presentaron en la época seca, mientras que la aparición del follaje ocurrió durante la temporada de lluvia. La remoción de la capa superficial del suelo favoreció la germinación, el establecimiento y desarrollo inicial de las plántulas de la parota (Mora et al., 2001). 4.3.3. Producción y diseminación de semilla Un árbol de parota produce en promedio alrededor de 225 kg de vainas anualmente (Huerta, 1983) y el número promedio de semillas por kg es de 1,170 (Vega et al, 1981 citados por Padilla, 1996). Las vainas contienen generalmente de 10 a 15 semillas con un peso de 300 a 1,100 mg cada una (gravedad específica de 1.3) y el 60% de su peso seco corresponde a la testa. También se reporta que un kilogramo tiene de 1,100 a 1,800, incluso hasta 5,500 semillas (Arreola, 1995; SEDER, 1996; http://www.conabio.gob.mx/conocimiento/info_especies/arboles/doctos/41-legum16 m.pdf; http://www.fs.fed.us/global/iitf/Enterolobiumcyclocarpum.pdf). Una de las formas de la dispersión de la semilla es a través del ganado vacuno, aunque también podría ser por el viento, pero a menor escala debido a que la semilla no es muy ligera. 4.3.4. Tolerancia a factores ambientales La parota es una especie intolerante en la etapa de plántula, beneficiándose de la sombra leve sólo cuando se encuentra bajo condiciones de estrés por falta de humedad, firme al viento y resistente a daños por insectos de la madera, termitas (madera cosechada), hongos, fuego (árboles adultos) y sequía. Es tolerante a suelos salinos, compactados y exposición constante al viento y soporta algunos excesos de humedad en el suelo. Es susceptible a daños por ramoneo, plagas de semillas (http://www.fs.fed.us/global/iitf/Enterolobiumcyclocarpum.pdf; http://www.conabio.gob. mx/conocimiento/infoespecies/arboles/doctos/41-legum16m.pdf). 106 4.3.5. Densidad Se tiene poca información respecto a la densidad de E. cyclocarpum en forma natural; en estudios realizados en el estado de Jalisco, se menciona que debido a la gruesa capa de hojarasca que se acumula frecuentemente sobre el suelo de las selvas medianas subcaducifolias, a las semillas, especialmente a las pequeñas, se les dificulta alcanzar el suelo mineral y comúnmente tienen problemas para germinar, aunque la semilla de la parota no es tan pequeña, el resultado en ocasiones es muy similar, lo que hace suponer que la densidad de la especie en zonas naturales es muy abundante (Mora et al., 2001). En verificaciones de campo en Jalisco, se observó que la densidad es muy pobre, debido a que es una de las especies codiciadas para el aprovechamiento industrial y fabricación de diversos artículos como puertas, ventanas, muebles, etc. (Rueda et al., 2007). En forma natural las densidades de parota por hectárea son muy bajas, no se encuentran áreas con masas puras sino que se localizan en forma dispersa mezcladas con un gran número de especies. En Jalisco se reporta 73 m3 en rollo de la especie como existencias reales totales en una superficie de 210 ha es decir 0.35 m3/ha, lo que equivale a menos de un árbol por hectárea (Manzanilla et al., 2001). 4.3.6. Enemigos naturales La regeneración de la parota puede ser afectada en algunas regiones no sólo por ser alimento de la fauna silvestre y el ganado, sino porque también sirve de alimento a algunos roedores como el ratón Liomys salvini que habita prácticamente en la misma área de distribución que la parota desde el Noreste de México hasta Costa Rica, por lo que son un verdadero peligro para el establecimiento de la regeneración natural de la parota (Manzanilla et al., 2001). 4.3.7. Plagas El guanacaste no parece presentar ninguna plaga importante, sin embargo, se han reportado algunas las cuales se mencionan a continuación: En Costa Rica, el insecto Stator generalis ataca las semillas en etapa inactiva en el suelo y la fauna silvestre como las cotorras del género Amazona, el roedor Liomys salvini y los pecaríes comen grandes cantidades de semillas (http://www.fs.fed.us/ global/iitf/Enterolobiumcyclocarpum.pdf; http://www.acguanacaste.ac.cr/bosque_ seco_virtual/bs_web_page/paginas_de_especies/enterolobium_cyclocarpum.html). En Panamá las semillas también son atacadas Stator generalis. Este escarabajo deposita sus huevos en la superficie de la semilla, dentro de las vainas en descomposición. Las flores son destruidas por la mosca cecidímica, formadora de agallas y las hojas son consumidas por la larva de la polilla (Coenipita bibitrix). 107 También, las plántulas y tallos jóvenes son atacados por hongos del orden Uredinales (R. havenensis) (http://www.conabio.gob.mx/conocimiento/info_especies /arboles/doctos/41-legum16m.pdf. En Costa Rica, el insecto chupador Umbonia crassicorni ataca al guanacaste en varias localidades; cuando las vainas están completamente formadas y llenas de semillas son atacadas por el escarabajo Mexobuchus columbinus, el cual oviposita sobre la superficie de las vainas. Las larvas penetran las semillas, generalmente es una por semilla, aunque muchas atraviesan las paredes de la vaina. Uno o dos meses después de la oviposición se completa el ciclo y emerge un adulto que cava otro túnel de salida y abandona el árbol (Manzanilla et al., 2001; http://www.fs.fed.us/ global/iitf/Enterolobiumcyclocarpum.pdf). La plaga Xyleborus volvulus tiene como hospedante, entre otros a Enterolobium spp., que es un insecto barrenador que vive en grupos de hasta 500 individuos dentro de sistemas de galerías. Se presentan varias generaciones por año; el tiempo mínimo para completar un ciclo de vida es de un mes. Las hembras penetran a la madera de los árboles por medio de túneles cilíndricos de 1 mm de diámetro. Hacen galerías comunales formadas por varias hembras y tales galerías se ubican en diferentes planos del tronco atacado y pueden ser perpendiculares, paralelas o diagonales al eje principal de la estructura. Desde el principio las hembras van liberando esporas de hongos manchadores que germinan y el micelio crece dentro de la madera (Cibrián et al., 1995). En las áreas tropicales de México es uno de los escarabajos ambrosiales de mayor importancia, debido a su amplia distribución y capacidad para dañar trocería. Están involucrados en la muerte del árbol que se usa como sombra en el cultivo de cacao. Los insectos infestan árboles aparentemente sanos debilitados o recién muertos. También infestan trocería húmeda de diferentes diámetros y tamaños. El daño principal es manchar la madera, así como reducción de la calidad por las horadaciones que producen. En la superficie de los troncos se observa un polvo de color blanquecino constituido por la madera que sacan las hembras. Para su control se recomienda el derribo o destrucción de los arboles atacados por este barrenador, lo que se logra por incineración o bien por la fragmentación de la madera de los troncos atacados; con ello se logra un secado rápido de la madera y desde luego la muerte de los insectos y los hongos asociados. En aprovechamientos forestales se recomienda no dejar la trocería almacenada en el monte por largos periodos de tiempo; lo mismo se recomienda en los patios de almacenamiento en los aserraderos. Cuando se quiera mantener trocería durante largo tiempo, esta se puede proteger con un insecticida de contacto de persistencia moderada mezclado con adherente; la aplicación se debe hacer antes que los insectos ataquen (Cibrián et al., 1995). 108 4.3.8. Enfermedades El guanacaste, al igual que en plagas, no parece presentar ninguna enfermedad importante, sin embargo, se han reportado algunas las cuales se mencionan a continuación: Una enfermedad es causada por un hongo que ha sido identificado como Fusarium oxyosporum var. perniciosum y los síntomas son una exudación copiosa de color amarillo en las fisuras de la corteza en los troncos o ramas infectadas y por consecuencia varios insectos que taladran la madera (insectos bupréstidos, cerambícidos y escolítidos) se ven atraídos a las áreas infectadas. Tarde o temprano, las ramas infectadas de gran tamaño pueden quebrarse repentinamente por su propio peso, constituyendo una amenaza seria por lo que aquellos árboles infectados que presenten peligro deberán ser removidos tan pronto como la condición sea detectada (http://www.fs.fed.us/ global/iitf/Enterolobiumcyclocarpum.pdf). Se ha descrito una enfermedad de las plántulas causada por Ravenelia lagerheimiana Diet. En su área de distribución natural, un gran número de flores se ve destruido por Asphondylia enterolobii, una mosca que causa agallas. La albura del guanacaste cosechado es susceptible a la descomposición y al ataque por los insectos, pero el duramen es resistente http://www.fs.fed.us/global/iitf/ Enterolobiumcyclocarpum.pdf). La CONAFOR cita que en el estado de Colima se realizó el rescate de 1,600 árboles de parota, a los cuales se les diagnosticó estar afectados con el hongo vascular denominado Lasiodiplodia theobromae; el tratamiento consistió en la aplicación de inyecciones de fungicidas a los troncos. 4.3.9. Sistemas y prácticas silvícolas En el estado de Jalisco, específicamente en la costa, se ha venido manejando las selvas nativas con mezcla de parota, de acuerdo con Programas de Manejo Forestal para lograr la sostenibilidad del aprovechamiento de los recursos forestales. Para alcanzar la normalización de las selvas se aplica y recomienda el siguiente proceso: división del terreno en áreas de manejo, ejecución y aplicación de tratamiento, extracción y cuidado del arbolado comercial, reducción de géneros no comerciales, control de residuos, propiciar la regeneración de géneros deseables, apoyo a la regeneración natural, exclusión del pastoreo extensivo de las áreas en proceso de normalización, establecimiento de un sistema de pastoreo, apoyo a las actividades agropecuarias, reconocimiento periódico de los avances y evaluación de las actividades (Curiel y Mora, 1999 citados por Manzanilla et al., 2001). 109 Para regular el rendimiento se aplica el método de ordenación de bosques irregulares, método de beneficio de monte alto (maderables), monte bajo (varas), método de tratamiento de selección individual y selección en grupos, turno de 50 años, ciclo de corta de 10-25 años, diámetro de corta abierto y calidad de sitio (Curiel y Mora, 1999 citados por Manzanilla et al., 2001). 4.3.10. Crecimiento y rendimiento volumétrico E. cyclocarpum antes de los 5 años es un árbol de crecimiento rápido y después de esta edad se reduce el crecimiento en altura, sin embargo, el crecimiento del diámetro continúa a casi un ritmo constante. Generalmente la altura del árbol a un año de edad es de 1 a 2 m con diámetro basal de 1.5 a 3 cm; a 10 años tendría una altura de 8 a 12 m con DAP de 20 cm. En los suelos muy fértiles, el árbol a los diez años de edad puede llegar a tener una altura de 6 m con un diámetro de 10 cm. En ausencia de competencia, desarrolla una copa de dos a más veces a su talla, por lo que es usada para sombra en las zonas agrícolas y ganaderas. Esta especie puede crecer de 2 a 3 m de altura/año y el tronco puede incrementar hasta 10 cm de diámetro/año (Committe, 1985; Rzedowsky, 1978; Pennington y Sarukhán, 1998 a; Manzanilla et al., 2001; http://www.conabio.gob. mx/conocimiento/info_ especies/arboles/doctos/41-legum16m .pdf). Los árboles que crecen en los bosques de Costa Rica, alcanzan un DAP de 190 cm, con fustes sin ramificaciones de hasta 15 m de altura; en árboles como sombra en pastizales y parques, se ha observado un incremento en diámetro de hasta 10 cm anuales y también se reporta que los árboles creciendo a campo abierto en América Central alcanzan 3.0 m en DAP y 40 m de altura http://www.fs.fed.us/global/ iitf/Enterolobiumcyclocarpum.pdf). 4.3.11. Edad de rotación, turno En México, específicamente en el Estado de Jalisco, el turno en prácticas extensivas es de 50 años. El turno puede reducirse a un período de 20 a 30 años y en algunos casos, dependiendo del producto final, hasta los 10 años, principalmente si se le cultiva de una manera intensiva y con base en plantaciones (Manzanilla et al., 2001). Una plantación mixta de 26 años de edad en Puerto Rico tuvo un área basal de 13 m2/ha y se recomendó aclareos en una rotación de 25 a 35 años (http://www.fs.fed. us/global/iitf/Enterolobiumcyclocarpum.pdf). 4.3.12. Regeneración natural La regeneración natural es poco frecuente debido a que las semillas se esparcen más que nada a través de los animales y después de germinar y crecer un poco son casi siempre consumidas por los mismos animales. Mueren también al ser 110 pisoteadas y debido a los incendios, la sombra excesiva, la sequía excesiva y la competencia con las gramíneas; debido a que el guanacaste es un árbol con una copa de gran tamaño, se necesita solamente que sobreviva uno que otro individuo para alcanzar una presencia impresionante en un bosque o una sabana http://www.fs.fed.us/global/iitf/Enterolobiumcyclocarpum.pdf). Aunque debido a la gran facilidad de reproducción, lo agradable de su sombra y la circunstancia de que sus frutos son consumidos por el ganado, muchos árboles son respetados y se han ido difundiendo de tal manera que muchos terrenos de cultivo y sobre todo de pastizal presentan actualmente parotas, las cuales dan fisonomía característica al paisaje, especialmente en las grandes llanuras de la costa (Manzanilla et al., 2001). La fauna silvestre y ganado son en algunos casos de gran ayuda para dispersar la semilla de parota en forma natural, al ser arrojados a través del tracto digestivo ya que los mamíferos, como los caballos y el ganado en general no rompen durante el proceso digestivo la dura capa que protege a las semillas de parota y si en cambio al defecar dejan a la semilla en un medio apropiado para su germinación (Manzanilla et al., 2001). 4.4. PRÁCTICAS DE VIVERO 4.4.1. Manejo y almacenamiento de semillas Las vainas de la parota se deben de cortar cuando presentan un color café oscuro, si al agitarse suenan las semillas, es el mejor momento para cosechar las vainas. Sólo cuando el árbol seleccionado esta completamente aislado, las vainas pueden ser recolectadas del piso, en caso contrario, se realiza la recolección directamente del árbol con un cortador largo (apoyado por escalera). Las vainas de cada árbol, son depositadas de preferencia en una bolsa de papel kraft con datos sobre el lugar y el árbol. Este procedimiento es especialmente recomendable si se desea hacer algunos estudios de procedencia y del posterior comportamiento de las plántulas en diferentes condiciones ecológicas donde sean plantadas (Manzanilla et al., 2001). Posteriormente los frutos se golpean en el piso y se abren liberándose inmediatamente las semillas, se introducen en bolsas de plástico, se colocan en una lata metálica herméticamente cerrada y se almacena en la cámara fría a una temperatura de 5 ºC, para prolongar su viabilidad. En promedio las semillas recolectadas miden 15.5 mm de largo, 9.9 mm de ancho, 6.9 mm de grosor y un peso de 0.75 g equivalente a 1,333 semillas/kg (Manzanilla et al., 2001). Se cita que las semillas sin escarificar pueden conservarse vivas y latentes por al menos 5 años aún sumergidas en agua (http://www.conabio.gob.mx/conocimiento /info_especies/arboles/doctos/41-legum16m.pdf). 111 4.4.2. Germinación Las semillas de E. cyclocarpum tienen una longevidad que oscila entre los 3 y 15 años. Presentan latencia física, impuesta por la presencia de una testa dura, resistente e impermeable. La resistencia de la testa se debe a la presencia de dos tipos de esclereidas; las más externas son alargadas, constituyendo una cubierta de células en empalizada. La capa interna de esclereidas es más gruesa y resistente, formada por células isodiamétricas, fuertemente lignificadas. La latencia impuesta por una testa impermeable es un eficiente mecanismo de control de la germinación y mantenimiento de la viabilidad al reguardar al embrión de los efectos adversos del medio ambiente, durante un período más o menos largo, hasta que se presenta la alteración estructural de la testa (http://www.conabio.gob.mx/conocimiento/ nfo_especies/arboles/doctos/41-legum16m.pdf). La germinación en condiciones normales es muy tardada debido a su testa dura. Con escarificación se logra la germinación en un lapso de 14 a 20 días, con un tiempo promedio de 17 días. El porcentaje de germinación es del 50 a 85%. Si la testa se remueve se logra el 100% de germinación, en condiciones húmedas (http://www.conabio.gob.mx/conocimiento/info_especies/arboles/doctos/41-legum16 m.pdf). 4.4.3. Prácticas de cultivo Para la propagación de la parota se han empleado los siguientes tratamientos pregerminativos (http://www.conabio.gob.mx/conocimiento/info_especies/arboles/ doctos/41-legum16m.pdf): a). La inmersión en agua a 75 ó 100 ºC durante 3 a 6 minutos estimula la germinación (80 a 85%). b). Sumergir las semillas en agua a 100 ºC dejar enfriar, luego hidratar por 24 horas, cambiar el agua 2 veces al día. c). Escarificación mecánica (lija o lima). La germinación es rápida después la escarificación y la hidratación, obteniéndose un 100% de germinación. d). A temperaturas mayores a 28 ºC eliminan la impermeabilidad. e). Cuando se recolecta las semillas en un ambiente árido, el tratamiento de calentamiento en un horno a 45 ºC produce la mayor tasa de germinación. f). Las semillas colocadas en estiércol húmedo dentro de una bolsa, provoca una alta y rápida germinación. g). Ebullición durante 1 minuto (94 ºC), genera 72% de germinación en 16 días. 112 h). Remojo en ácido sulfúrico concentrado durante 10 minutos, propicia 80 a 85% de germinación. Otras variantes de los tratamientos anteriores, son: remojo en ácido sulfúrico (95%) durante 45 minutos o inmersión en agua a 100 ºC hasta que se enfríe, luego sumergir en agua corriente por dos días. La germinación se facilita si se raspa, rompe o se trata la semilla con ácido sulfúrico concentrado y se deja remojar en agua o en suelo húmedo (Chang et al., 1990; Manzanilla et al., 2001; http://www.fs.fed.us/global/iitf/Enterolobiumcyclocarpum.pdf). La parota puede ser producida por medio de semilla en bandejas, semilleros, bolsas (de tres a cuatro meses en el vivero), por seudoestaca o directamente en el campo. Se suguiere sembrar las semillas en turba húmeda o cubrirlas con una capa de suelo húmedo de 1 ó 2 cm (http://www.fs.fed.us/global/iitf/ Enterolobiumcyclocarpum.pdf). El método de propagación por seudoestaca consiste en colocar 1,000 semillas en 1m2 en el vivero, las semillas tratadas podrán germinar en 2 a 3 días (algunas pueden tardar hasta 20 días), se trasplantan luego en bancales con distancia de 20 cm entre plantas. El tamaño de la seudoestaca más adecuado para la plantación es con un cuello de 1.5 a 2 cm de diámetro (Manzanilla et al., 2001). Las plántulas se desarrollan con rapidez, no necesitan de sombra, son resistentes a las sequías y deberán tener 0.5 m de altura al momento de transplantarlas al campo a los 6 meses (http://www.fs.fed.us/global/iitf/Enterolobiumcyclocarpum.pdf). 4.5. ESTABLECIMIENTO Y MANEJO DE PLANTACIONES 4.5.1. Preparación del sitio de plantación La regla más simple para cualquier plantación es que el éxito será mayor en la medida que se prepare el sitio, además de contar con buena calidad de planta para realizar la plantación. En las áreas en que las condiciones del terreno lo permitan y dependiendo de la extensión, es conveniente mejorar las condiciones del suelo empleando medios mecanizados. Debe cuidarse que los suelos no estén anegados, que tengan un buen drenaje y libres de hierbas, arbustos y malezas en general. Las dimensiones y el tipo de cepa deberán de ser de tal forma que el sistema radical de la planta no se dañe ni tenga dificultad de crecer y absorber los nutrientes disponibles en el suelo. Cuando se emplee maquinaria o herramienta debe tenerse cuidado de no compactar demasiado el suelo en general, sobre todo alrededor de la cepa (Manzanilla et al., 2001). 113 5.2. Plantación y espaciamiento Generalmente se emplea una distancia de plantación de 2.5 a 4 m. Un aspecto muy importante a considerar es el de tratar de evitar que en las primeras etapas la parota ramifique demasiado, debido a que tiende a extender sus copas, por lo que se debe provocar su crecimiento en altura conservando una alta densidad de individuos hasta los 5 a 10 años de edad, donde se deberá aplicar aclareos, según el producto final que se quiera obtener (Manzanilla et al., 2001). 4.5.3. Cultivo de plantaciones En general se recomienda una densidad inicial de 625 a 1,600 plantas/ha y la aplicación de aclareos desde los 5 a los 10 años de edad. Por razones de equilibrio ambiental, se recomienda mezclarla con otras especies. En la Costa de Jalisco el INIFAP, de manera experimental, tiene resultados en mezclas con primavera, rosa morada, cedro rojo y otras. Frecuentemente, la parota por el enorme porte de su copa, resulta difícil formar masas puras rentables, ya que unos cuantos ejemplares podrían ocupar grandes extensiones de terreno, sin embargo, en condiciones naturales se encuentran ejemplares con fustes largos, rectos y copas no tan abundantes, como se comprobó en la Costa de Jalisco, seguramente como producto de la poda natural inducida por la competencia en las altas densidades. 4.5.4. Crecimiento y rendimiento volumétrico Una plantación de parota podría estar rindiendo de 15 a 30 m3/ha/año y dependiendo de la densidad y del turno, una plantación de parota podría tener conservadoramente, a los 20 años de edad un volumen total estimado de alrededor de 130 m3/ha (Manzanilla et al., 2001). En Costa Rica, entre 7.5 a 8 años de edad los árboles alcanzaron alturas de 11 a 16 m y DAP de 8 a 11 cm. En el sur de México, a los 8 años de edad promediaron 8 m de altura y 12 cm en DAP; en Puerto Rico en asociación con otras especies en suelos derivados de granito promediaron 6 m de altura a los 5 años y a los 25 años, éstos árboles y otras plantaciones mixtas en suelo calizo tuvieron una altura promedio de 18 m, un DAP de 42 cm, un fuste sin ramificaciones de 7.4 m de altura y una supervivencia del 24% (http://www.fs.fed.us/global/iitf/Enterolobium cyclocarpum. pdf). 114 4.5.5. Plantaciones agrosilvopastoriles E. cyclocarpum es una especie empleada como árbol de sombra en áreas ganaderas o agrícolas, donde se le encuentra en combinación con un buen número de plantas forrajeras. En condiciones naturales crece mezclada con un gran número de especies por lo que se puede mezclar con diferentes propósitos (Manzanilla et al., 2001). En Veracruz se emplea el sistema agroforestal cafetalero de montaña y son frecuentes en Yucatán los huertos familiares mayas. También se asocian árboles dispersos para sombra y ramoneo en áreas ganaderas (potreros) o agrícolas en Costa Rica (http:// www.conabio.gob.mx/conocimiento/info_especies/arboles/doctos/ 41-legum16m.pdf). En los estados de Jalisco y Colima se tiene asociada con otras especies forestales y dos especies de gramíneas forrajeras, esta asociación esta evaluada en forma experimental y los resultados son muy alentadores, en donde se ha observado que los pastos y otras especies forestales se ven beneficiados por el efecto del Nitrógeno que se obtiene de los árboles de la parota, sin embargo, en los pastos solo se ha observado el buen efecto en el crecimiento y desarrollo en épocas en las cuales la parota tira su follaje y se reduce cuando presenta su follaje completo, ésto debido a la gran cobertura de sombra que genera su copa (Rueda et al., 2007). 4.6. MEJORAMIENTO GENÉTICO En Nicaragua se han realizado trabajos de recolección de semilla con fines de establecer ensayos de procedencia, combinado con ensayos de progenie y huerto de conservación, con fines de transformarlo en huerto semillero tomando en cuenta los siguientes criterios: a). Se ha recomendado alta homogeneidad entre semillas del mismo árbol, además, existen árboles que producen semillas de tamaños grandes, mientras otros son productores de semillas pequeñas en cada procedencia. b). Se ha encontrado diferencia significativa en términos de las diferentes medidas de semillas (largo, ancho, grosor, área transversal y peso) entre los árboles dentro de cada procedencia y diferencia en términos de largo, ancho, peso y área transversal entre las procedencias. c). Se recomienda que en la formación del huerto de conservación se seleccionen cuidadosamente a las precedencias que vayan a ser vecinas. d). Los resultados de estudios de procedencias indican la posibilidad de segregación geográfica de Enterolobium, por consiguiente es importante realizar recolección de semillas de rango amplio, esto con el fin de conservar germoplasma para asegurar 115 una colección de amplia variabilidad y que sirva como base para el mejoramiento genético de esta especie (Chang, 1990 citado por Manzanilla et al., 2001). 4.7. PROPIEDADES Y USOS 4.7.1. Propiedades físico-mecánicas de la madera La madera de E. cyclocarpum se seca muy fácil y rápidamente al aire libre, con una ligera tendencia a agrietarse y a combarse, es dura y moderadamente durable, con una gran estabilidad dimensional que perdura a través del tiempo, dentro del agua su durabilidad es muy alta. El duramen de la madera tiene un peso específico de 0.6, de color marrón a marrón rojizo con vetas jaspeadas obscuras y un matiz verdoso, también puede tener un tinte rojizo, es muy resistente al ataque de enfermedades fungosas y termitas de la madera seca. El color de la albura es casi blanco. El grano es típicamente entrelazado, la textura es áspera y la madera es lustrosa (Manzanilla et al., 2001; http://www.acguanacaste.ac.cr/bosque_seco_virtual/bs_web_page/ paginas_de_especies/ enterolobium_cyclocarpum.html; http://www.fs.fed.us/global/ iitf/Enterolobium cyclocarpum.pdf;). La densidad de la madera al 15% de humedad es de 0.35 a 0.60, es fácil de trabajar porque es medianamente dura, elástica y fuerte para su peso específico que es de 463 kg/m3, éste es aparentemente variable ya que se han registrado valores de 340 a 600 kg/m3 (http://www.fs.fed.us/global/iitf/Enterolobiumcyclocarpum.pdf). En cuanto a la trabajabilidad de la madera, es de baja resistencia al aserrío y produce de un ligero a moderado efecto de desafilado sobre las sierras. Se cepilla fácilmente y responde bien al empleo de maquinaria para lograr superficies lisas, pero, son comunes algunos defectos tales como el grano astillado y en relieve debido a la tensión de la madera. Se pueden producir superficies ásperas durante el moldurado. Tiene buenas propiedades al clavado sin necesidad de taladrarse previamente y su respuesta a la aplicación de lustres es en general buena. El aserrín es penetrante muy picante y puede causar irritación de la mucosa y alergia en algunas personas (Manzanilla et al., 2001). 4.7.2. Usos La parota es una especie maderable, se usa en artesanías, juguetes y artículos torneados; los troncos grandes generalmente son usados para fabricar canoas y bebederos de agua (Espejel y Martínez, 1979; Manzanilla et al., 2001; CNIC, 2005; http://www.conabio. gob.mx/conocimiento/info_especies/arboles/doctos/41-legum16 m.pdf; http://www.fs. fed.us/global/iitf/Enterolobiumcyclocarpum.pdf). 116 La madera se usa para la fabricación de canoas, embarcaciones ligeras, barcos y para la construcción. En Nicaragua se emplea para bandeja, tabla para lavar, canoas y pilones. Se considera que para el propósito de construcción la madera de guanacaste es de la misma calidad como la de Cedrela odorata y es resistente al comején y a la humedad (Manzanilla et al., 2001; http://www.conabio.gob.mx/ conocimiento/info_especies/arboles/doctos/41-legum 16m. pdf; http://www.fs. fed.us/ global/iitf/Enterolobiumcyclocarpum.pdf). La madera es usada para obtener tablas y vigas para construcciones rurales, elaboración de utensilios de cocina, bateas y ruedas de carreta. Industrialmente se le usa en la fabricación de duelas y lambrines, en la fabricación de chapa para vistas en madera terciada. Se emplea también en implementos agrícolas, como el centro de mangos y culatas, carretas, carpintería y ebanistería, en la producción de tableros, chapa, decorativa, muebles finos, construcción de interiores, cocinas integrales, salas, molinos, molduras, closet, canceles, plafones, como aislante térmico, salvavidas, boyas, muebles infantiles, pirograbados y triplay (Pennington y Sarukhán, 1998 a; Espejel y Martínez, 1979; Martínez, 1979; Corral, 1985; Cabrera, 1982; Manzanilla et al., 2001; http://www.fs.fed.us/global/iitf/Enterolobiumcyclocarpum.pdf; http://www.conabio.gob. mx/conocimiento/info_especies/arboles/doctos/41-legum16 m.pdf;). El uso principal del guanacaste es la de sombra para el ganado en los pastizales y también como forraje ya que el tallo joven, fruto, semilla y las hojas son un excelente complemento alimenticio para ganado bovino, porcino, caprino y equino. Se aprovecha mediante ramoneo y corte de ramas, ya que debido a la altura del árbol no es muy accesible al ganado vacuno (http://www.fs.fed.us/global/iitf/ Enterolobiumcyclocarpum.pdf; http://www.conabio.gob.mx/conocimiento/infoespecies /arboles/doctos/41-legum16m.pdf; http://www.semarnat.gob.mx/pfnm2/fichas/enterolo bium_cyclocarpum.htm). Los frutos especialmente tiernos, sirven de alimento para el ganado. Las vainas son muy apreciadas para el ganado, ya que sirven para la engorda durante la época de fructificación y las vainas inmaduras son de consumo humano como un vegetal cocido; tanto el fruto como la corteza son ricos en taninos. Los frutos maduros contienen un jugo gomo-resinoso que mezclado con la pulpa del mismo previamente macerada sirve para fabricar aglomerados de carbón. Produce leña muy usada en los hogares e industrias rurales. Tiene un poder calórico de 18,556 kj/kg, lo que la ubica como especie recomendada como fuente energética. En Guatemala la pulpa de las vainas se usa como sustituto de jabón, sobre todo para lavar los textiles (INIREB, 1979; Corral, 1985; Manzanilla et al., 2001 Espejel y Martínez, 1979; http://www.fs.fed.us/global/iitf/Enterolobiumcyclocarpum.pdf; http://www.conabio.gob. mx/conocimiento/info_especies/arboles/doctos/41-legum16m.pdf). En Colima, México se realizó un estudio para evaluar el efecto productivo y económico de la inclusión de harina del fruto de la parota en el desarrollo de ovinos en estabulación. Se compararon niveles de 10, 20 y 30% de inclusión contra una ración testigo que contenía 63% de grano de maíz, 20% de rastrojo de maíz, 15% de 117 pasta de soya y 2% de minerales. Los resultados indicaron que con la incorporación del 20% de harina del fruto de la parota como sustituto de grano y pasta proteica en la ración, se pudo mantener la ganancia diaria y total de peso así como el consumo de la materia seca sin diferencia estadística entre tratamientos, con una disminución significativa en los costos de producción, por lo que La viabilidad económica de la utilización de la parota en la alimentación de rumiantes, refuerza la necesidad de orientar los estudios hacia el aprovechamiento racional de los recursos forrajeros arbóreos no convencionales en la producción animal (Peralta et al., 2006). Las semillas tostadas o cocidas como una legumbre y molidas y mezcladas con harina son comestibles, se reporta que las semillas descascaradas contienen un 35% proteína. La pulpa del fruto se usa en Guatemala como sustituto del jabón, sobre todo en el lavado de ropa. Asimismo, de la pulpa de las vainas maduras se obtiene saponina y la almendra tostada se utiliza en lugar de café (Espejel y Martínez, 1979; http://www.fs.fed.us/global/iitf/Enterolobiumcyclocarpum.pdf; http://www.catie.ac.cr/ bancoconocimiento/C/Coleccionesjardinbotanicoarboldeguanacaste/Coleccionesjardi nbotanicoarboldeguanacaste.asp?CodSeccion=381). La corteza se usa en infusiones o en vainas para curar el salpullido; es depurativa. La goma que exuda el tronco (―goma de caro‖) es empleada como sustituto para la goma arábiga, como remedio para la bronquitis y el resfriado. Los frutos verdes son astringentes y se utilizan en casos de diarrea (http://www.fs.fed.us/global/iitf/ Enterolobiumcyclocarpum.pdf; http://www.conabio. gob.mx/conocimiento/info_ especies/arboles/doctos/41-legum16m.pdf; http://www. catie.ac.cr/bancoconoci miento/C/Coleccionesjardinbotanicoarboldeguanacaste/Coleccionesjardinbotanicoarb oldeguanacaste.asp?CodSeccion=381). Es uno de los árboles más importantes de uso múltiple en agrosistemas tradicionales del Trópico Mexicano. Se encuentra en huertos familiares o solares, en acahuales y en el monte alto manejado. Es un árbol buen productor de biomasa y un buen fijador de nitrógeno atmosférico en el suelo (Manzanilla et al., 2001). Los árboles son muy decorativos por sus enormes copas y elegante follaje. Es un árbol ideal para parques, campos de recreo y bordes de camino; se emplea como barrera rompevientos, cerca viva, sistemas agroforestales, recuperación de terrenos degradados, conservación de suelo y control de la erosión, fijación de nitrógeno, acolchado y cobertura de hojarasca; en América Central se emplea como sombra en cafetales, a pesar de que otras especies se ven usadas con mayor frecuencia (http://www.fs.fed.us/global/iitf/Enterolobiumcyclocarpum.pdf; http://www.conabio.gob. mx/conocimiento/info_especies/arboles/doctos/41-legum16m.pdf). Es una especie susceptible de aprovecharse como futuro recurso alimenticio, ya que la composición de aminoácidos de la semilla es comparable a la de algunas harinas como la de trigo y pescado (la almendra posee 17 aminoácidos), son ricas en proteínas (32 a 41%), contienen hierro, calcio, fósforo y 234 mg de ácido ascórbico (http://www.conabio.gob.mx/conocimiento/info_especies/arboles/doctos/41-legum16 m.pdf). 118 CAPÍTULO 5 Tabebuia rosea (Bertol) DC | Fotografía tomada por H. Jesús Muñoz Flores. 119 5.1. DESCRIPCIÓN DE LA ESPECIE 5.1.1. Nombre común Tabebuia rosea (Bertol) DC. es una especie que en México se le conoce con diferentes nombres comunes como maculís, palo de rosa, rosa morada y dependiendo de la región o entidad donde se localiza: roble (Michoacán), maculís, macuilís (Tabasco y Chiapas), palo de rosa (Tamaulipas, San Luis Potosí, Norte de Puebla y Veracruz), roble y roble blanco (Oaxaca, Guerrero y San Luis Potosí), amapa rosa (Nayarit), macuil (Costa de Oaxaca), amapola (Sinaloa), rosa morada (Campeche y Quintana Roo), cul (Huasteco, S. L. P.), macuelis de bajo (zona Lacandona, Chiapas), hok’ab, kok’ab (maya, Yucatán), li-ma-ña (Chinanteco, Oaxaca), maculishuate, palo blanco, tural (Chiapas), nocoque (San Luis Potosí), palo yugo, primavera (Sinaloa), roble prieto (Norte de Oaxaca), roble de San Luis (S. L. P.), satanicua (Guerrero), yaxté (Tojolobal, Chiapas) y cacahua (Sureste de San Luis Potosí) (Pennington y Sarukhán, 1998 a; http://www.conabio.gob.mx/conocimiento /infoespecies/arboles/doctos/11-bigno7m.pdf;http://www.semarnat.gob. mx/pfnm2/fichas/tabebuia_rosea.htm). En otros países se conoce con los nombres comunes como guayacán rosado, roble morado, guayacán lila, guayacán morado, roble, chicala, roble de río, flor rosado y flor, también como roble blanco (República Dominicana), roble de Guayaquil (Ecuador) y apamate (Venezuela) (Geilfus, 1989; CNIC, 2005; http://www.arbolesornamentales.com/Tabebuiarosea.htm). 5.1.2. Taxonomía Tabebuia rosea (Bertol) DC., es una especie arbórea que presenta varias sinonimias y una amplia cantidad de nombres comunes en América y especialmente en México (Pennington y Sarukhán, 1998 a; Niembro, 1986 y Treviño et al, 1990 citados por Manzanilla et al., 2001). Familia: Bignoniaceae Género: Tabebuia Especie: Tabebuia rosea (Bertol) DC. También se le conoce con los siguientes nombres o sinónimos: Tecoma rosea, Bertol; Tecoma evenia, Donn-Smithii; Tecoma mexicana Mart. ex DC.; Tecoma punctatissima, Kransl; Tabebuia mexicana, Mart. Ex DC; Tabebuia pentaphylla, (L.) Hemsley; Tabebuia punctatissima, (Kransl) Stand; Cauralia rosea (Bertol) DonnSmith; Sparattosperma rosea, (Bertol) Miers (Niembro, 1986), Tabebuia heterophylla y Tabebuia pallida Miers (Webb, 1980; Geilfus, 1989 citado por Martínez, 1997; http://www.conabio.gob.mx/conocimiento/info_especies/arboles/doctos/11-bigno7m. pdf; CNIC, 2005; http://www.arbolesornamentales.com/Tabebuiarosea.htm; http:// 120 darnis.inbio.ac.cr/ubis/FMPro?-DB=UBIpub.fp3&-lay=WebAll&-error=norec.html&Format=detail.html&-Op=eq&id=175&-Find). 5.1.3. Especies relacionadas En México existe una especie muy parecida a T. rosea Bertol y se ha reportado que en la región del Balsas (Gro., Mor., Pue. y Oax.) existe la T. palmeri Rose, comúnmente llamada pata de león o tlayahuale. Esta especie se desarrolla en zonas con precipitación baja (700 mm anuales), temperaturas altas, típica de la selva baja caducifolia; solo alcanza los 8 m de altura y un diámetro no mayor de 20 cm; sus flores y frutos son muy semejantes a los de la rosa morada, su madera es muy dura y de color oscuro, con tonalidades de café amarillento a gris claro, duramen color café rojizo con tonalidades verdosas; localmente su madera es muy apreciada para ebanistería y elaboración de herramientas agrícolas y artículos decorativos (Guizar y Vélez, 1991 citados por Manzanilla et al., 2001). Preferentemente forma parte de comunidades secundarias, también forma parte de selvas altas o medianas subperennifolias y subcaducifolias (Pennington y Sarukhán, 1998 a). 5.1.4. Forma Tabebuia rosea es una especie arbórea caducifolia que tira las hojas de marzo a junio (temporada seca), alcanza alturas de 15 a 30 m, con tronco recto, a veces ligeramente acanalado, con diámetros que llegan alcanzar hasta 1 m (Figura 5). La especie decepciona en su fase inicial de crecimiento por su ramificación dicotómica o simpódica que augura un tronco mal formado. Eventualmente el árbol llega a formar un excelente fuste sobre todo si hay sombra lateral de la misma especie o de un árbol nodriza. Es un árbol con copa redonda y densa, umbelada o en parasol, follaje abierto con ramas grandes cilíndricas y ascendentes (Pennington y Sarukhán, 1998 a; Niembro, 1986; CNIC, 2005; http://www.conabio.gob.mx/conocimiento/info_ especies/arboles/doctos/11-bigno7m.pdf; http://www.conabio.gob.mx/conocimiento/ infoespecies /arboles/doctos/11-bigno7m.pdf). 5.1.5. Corteza La corteza externa es fisurada y suberificada con alguna de las costillas escamosas, de aspecto compacto, con las fisuras longitudinales más o menos superficiales que se entrelazan formando un retículo, su color es café grisáceo oscuro a amarillento (Figura 5). La corteza interna es de color crema claro a crema rosado, en ocasiones con expansiones de parénquima, fibrosa, amarga o agridulce, con un grosor de 16 a 30 cm y suave olor a menta (Pennington y Sarukhán, 1998 a; CNIC, 2005; http://www.conabio.gob.mx/conocimiento/info_especies/arboles/doctos/11-bigno7m. pdf). 121 5.1.6. Hojas Es una especie caducifolia, la cual presenta hojas decusadas, digito compuestas, de 10 a 35 cm de largo, incluyendo el pecíolo y de 8 a 12 cm de ancho, cada hoja se divide en 5 foliolos, de los cuales los 2 inferiores más pequeños de 3 por 1.5 a 8 por 4 cm, el terminal más grande de 7.5 x 4 a 16 x 8 cm, son lanceolados o elípticos, con el margen entero, ápice agudo o acuminado, base cuneada, redondeada o truncada; por el haz son de color verde oscuro y por el envés son de color verde claro y con abundantes y pequeñas escamas en ambas superficies. Los pecíolos son de 4 a 14 cm de largo, pulvinados, escamosos; pecíolos pulvinados, muy cortos en los foliolos basales, hasta de 6 cm de longitud en los otros foliolos de forma escamosa (Pennington y Sarukhán, 1998 a; CNIC, 2005; http://www.conabio.gob.mx/ conocimiento/info_especies/arboles/doctos/11-bigno7m.pdf). 5.1.7. Flores Las flores de T. rosea son hermafroditas, de un llamativo color lila de 5 a 7 cm de largo y 4 a 5 cm de ancho, panículas cortas, en las axilas de hojas abortivas o terminales, hasta de 15 cm de largo y escamosa; pedicelos de 1 a 2 cm de largo; las flores (Figura 5) son zigomórficas; cáliz blanco verdoso o pardo, tubular estrechado en la base, de 2 a 2.5 cm de largo; corola de 7 a 10 cm de largo, tubular en forma de embudo de 2 a 2.5 cm de largo; expandida en la parte superior en un limbo bilabiado; labio superior con 3 grandes lóbulos obovados, obtusos; labio inferior con 2 lóbulos; tubo de la corola blanca; lóbulos de color lila o rosado; corola glabra de 7 a 10 cm de largo en la superficie externa, pubescente en la superficie interna de los lóbulos, populoso en el tubo; estambres 4, didínamos, los dos cortos de 1.5 cm, los largo de 2 cm insertos cerca de la base del tubo en manojos de papilas e incluidos en el tubo de color blanco, además son glabros; anteras ampliamente sagitadas; se presenta también un estaminodio pequeño en forma de un filamento corto; nectario grueso y tubular, rodeando la base del ovario, glabro; ovario alargado, bilocular, lóculos multiovulares, con indumento escamoso; estilo glabro, del mismo largo que los estambres, terminando en un estigma bilabiado (Pennington y Sarukhán, 1998 a; CNIC, 2005; http://www.conabio.gob.mx/conocimiento/info_especies/arboles/doctos /11-bigno7m.pdf). 5.1.8. Frutos Los frutos son cápsulas cilíndrico-lineales, dehiscentes, estrechas, 22 a 38 cm de largo por 0.9 a 1.5 cm de ancho, lisas, con 2 suturas laterales, penduladas, de color verde claro que va variando a verde oscuro cuando madura (Figura 5), cubiertas por numerosas escamas y solo observables con lupa, con el cáliz persistente, con semillas membranosas, aladas y delgadas, color blanquecino y de 2 a 3 cm de largo; las alas hialino-membranáceas, conspicuamente demarcadas del cuerpo de la semilla (Webb, 1984 y Martínez, 1997; CNIC, 2005; http://www. conabio.gob.mx/conocimiento/info_especies/arboles/doctos/11-bigno7m. pdf). 122 Figura 5. A) Árbol. B) Frutos. C) Flores y D) Corteza de Tabebuia rosea. 5.2. DISTRIBUCIÓN Y HÁBITAT 5.2.1. Distribución geográfica T. rosea es originaria de los bosques húmedos desde México y las Antillas hasta el Ecuador (Geilfus, 1989 citado por Martínez, 1997). Se distribuye desde 2º latitud Sur a 20º de latitud Norte, desde México meridional hasta Venezuela y Ecuador, incluso en las Antillas Orientales (Webb, 1984; http://www.conabio.gob.mx/conocimiento/ infoespecies/arboles/doctos/11-bigno7m.pdf; CNIC, 2005). Se reporta que se distribuye en los siguientes tipos de vegetación: Bosque tropical caducifolio, bosque tropical perennifolio, bosque tropical subcaducifolio, bosque tropical subperennifolio y pastizal tipo sabana (http://www.conabio.gob.mx/ conocimiento/infoespecies/arboles/doctos/11-bigno7m.pdf). 123 En México se distribuye en la vertiente del Golfo de México, desde el Sur de Tamaulipas y Norte de Puebla y Veracruz hasta el Norte de Chiapas y Sur de Campeche; en la vertiente del Pacífico se distribuye desde Nayarit y Jalisco hasta Chiapas. Se reporta en los estados de Campeche, Chiapas, Guerrero, Hidalgo, Quintana Roo, San Luis Potosí, Jalisco, Michoacán, Tabasco, Tamaulipas, Veracruz y Yucatán (Pennington y Sarukhán, 1998 a; http://www.conabio.gob.mx/ conocimiento/info_especies/arboles/doctos/11-bigno7m.pdf). En Michoacán se localiza a lo largo de la Vertiente del Pacífico, en la selva mediana subperennifolia, en planicies, cañadas, partes cercanas a los arroyos y abanicos aluviales, también se tiene dentro del Valle de Apatzingán y en la selva mediana subcaducifolia en la zona costera y cañadas húmedas de la zona de "tierra caliente" del estado (http://www.sagarpa.gob.mx/dlg/michoacan/ganaderia/cotecoca/html/ Vegetacion.html). 5.2.2. Clima Requiere de un clima húmedo, con un régimen pluvial uniforme, una estación seca de 0 a 3 meses. Se adapta a climas cálidos húmedos y subhúmedos, es una especie caducifolia, altamente demandante de luz y de día largo. Se reporta que T. rosea se desarrolla en áreas con temperaturas máximas promedio del mes más cálido de 23 a 30 ºC, temperaturas mínimas promedio del mes más frío 17 a 22 ºC, y una temperatura promedio anual de 22 a 32 ºC (Webb, 1984; FAO, 1994). También se reporta que la especie se desarrolla en climas que presentan temperaturas medias de 20 ºC a 27 ºC. Esta última está reportada como el valor óptimo para su buen desarrollo (SEDER, 1996; CNIC, 2005). La especie requiere de un régimen pluvial de 1,250 a 2,500 mm anuales (Webb, 1984; CNIC, 2005). Por su parte la SEDER (1996), reportó que la especie se desarrolla de 700 a 1,800 mm anuales con seis meses secos durante el año. También se reporta que suele desarrollarse en sitios cuya precipitación mínima es de 1,250 mm anuales y 3,000 mm anuales como máxima y media anual de 2,000 mm, esta última considerada como óptima para su buen desarrollo (FAO, 1994). 5.2.3. Altitud y topografía T. rosea prospera en un rango altitudinal desde el nivel del mar hasta los 1,200 m, aunque se reporta que se puede desarrollar a altitudes mayores, como en Colombia que se localiza hasta 1,900 msnm (Webb, 1984; Geilfus, 1989; Martínez, 1997; CNIC, 2005 http://www.conabio.gob.mx/conocimiento/info_especies/arboles/ doctos/11-bigno7m.pdf; http://www.semarnat.gob.mx/pfnm2/fichas/ tabebuia_rosea. htm; http://darnis.inbio.ac.cr/ubis/FMPro?-DB=UBIpub.fp3&-lay=Web All&-error= norec.html&-Format=detail.html&-Op=eq&id=175&-Find). 124 5.2.4. Suelos T. rosea se presenta en suelos de origen calizo, ígneo o aluvial, calcáreos, arcillosos y cenagosos; en general con algunos problemas de drenaje (Pennington y Sarukhán, 1968; CNIC, 2005). Crece bien en suelos pobres, ácidos y en suelos periódicamente inundados (Geilfus, 1989). No es muy exigente y se adapta a suelos con textura arenosa, franco-arenosa y franco-arcillosa, con pH alcalino, neutro o ácido y tolera inundaciones breves (Webb, 1984; CNIC, 2005), aunque se señala que se desarrolla mejor en suelos cuyo pH varía de 6.0 a 8.0, mínimo y máximo, respectivamente y con un valor óptimo de 7.0 (FAO, 1994). Se desarrolla bien en suelo vertisol pélico y vertisol gleyco (http://www.conabio.gob.mx/ conocimiento/info_especies/arboles/ doctos/11-bigno7m. pdf). 5.2.5. Vegetación asociada Esta especie forma parte del estrato arbóreo en comunidades secundarias, también forma parte de las selvas altas y medinas subperennifolias y subcaducifolias, así como en selvas altas perennifolias. En la selva alta perennifolia cohabita con infinidad de especies, entre las cuales se tienen: Swietenia macrophylla, C. odorata, Terminalia amazonia, Simarouba glauca, Ceiba pentandra, Manilkara zapota, Ficus spp., entre otros (Manzanilla, et al., 2001; http://www.conabio.gob.mx/conocimiento/infoespecies/arboles/doctos/11-bigno7m. pdf). En selvas medianas subperennifolias se asocia con B. alicastrum, Calophyllum brasilense, C. odorata, Bursera arborea, Roseodendrum donell-smithii, Cordia alliodora, Guazuma ulmifolia, E. cyclocarpum, Orbygnia guacuyule, Hura polyandra, etc. (Manzanilla, et al., 2001; http://www.conabio.gob.mx/conocimiento/ infoespecies/arboles/doctos/11-bigno7m.pdf). En la selva mediana subcaducifolia se asocia con C. odorata, Bursera simaruba, Swietenia humilis, Manilkara zapota, Vitex mollis, Guazuma ulmifolia, E. cyclocarpum, R. donell-smithii, entre otras (Pennington y Sarukhán, 1998 a; Cabrera, 1982; http://www.conabio.gob.mx/ conocimiento/info_especies/arboles/doctos/11bigno7m. pdf). También se reporta que se asocia con Smilax sp., Hura sp., Lysiloma sp., Acacia sp., Bursera sp, Pithecellobium sp, Liquidambar sp, Panicum maximum, Terminalia sp y Bunchosia sp (http://www.conabio.gob.mx/conocimiento/infoespecies/arboles/doctos/ 11- bigno7m.pdf). 125 5.3. SILVICULTURA 5.3.1. Bosques naturales En forma natural T. rosea no existe en masas puras y se le encuentra asociada con una diversidad de especies. En otros casos, se le encuentra de manera aislada y esporádica, esto es cuando se le deja en terrenos de vocación ganadera y se emplea para la sombra del ganado. Por lo tanto, los aspectos de floración, fructificación, diseminación y colecta de semilla, esta referida al conocimiento y experiencias en la vegetación natural o nativa, es decir, en vegetación que no es producto de las plantaciones hechas por el hombre, aunque existen ejemplares que han sido plantados de manera esporádica en sitios de lindero o como sombreaderos del ganado (Manzanilla et al., 2001). 5.3.2. Floración y fructificación La especie tira sus hojas en los meses de marzo a junio y es la época que se encuentra en el periodo de floración y fructificación (Pennington y Sarukhán, 1968; http://www.conabio.gob.mx/conocimiento/infoespecies/arboles/doctos/11-bigno7m. pdf). También se cita que la época de floración inicia entre febrero y marzo y se prolonga hasta mayo o junio, esto depende de las condiciones específicas de la zona y de la precocidad del arbolado. En Chamela, Jalisco florece de marzo a mayo. La producción de frutos es de marzo a junio y su desarrollo es muy acelerado, dado que desde abril inicia la maduración de los frutos (Chacón, 1994 citado por Martínez, 1997; http://www.conabio.gob.mx/conocimiento/infoespecies/arboles/ doctos/11bigno7m.pdf). 5.3.3. Producción y diseminación de semilla Los árboles de T. rosea inician su producción de semilla a la edad de 3 a 4 años. El número de semillas por kg varía de 40,000 a 72,000, aunque también se reporta de 35,000 a 50,000 semillas por kg. Un fruto de esta especie produce de 150 a 200 semillas y su dispersión es anemócora por la acción del viento, debido a que la semilla es muy liviana y alada; una vez que se dispersa es muy difícil su recolección (Geilfus, 1989 Martínez, 1997; http://www.conabio.gob.mx/ conocimiento/ infoespecies/arboles/doctos/11-bigno7m. pdf). 5.3.4. Tolerancia a factores ambientales T. rosea crece en un amplio rango de condiciones ambientales, desde zonas con baja precipitación pluvial, hasta en zonas muy lluviosas, incluso en suelos inundados, pero no soporta heladas por ser una especie de trópico, es altamente demandante de luz, por lo tanto, no tolera sombra. Se reporta que es resistente al fuego y daños por termitas, tolerante a suelos con mal drenaje o con capa freática muy cercana 126 (Geilfus, 1989; http://www.conabio.gob.mx/ arboles/doctos/11-bigno7m.pdf) conocimiento/infoespecies/ 5.3.5. Densidad En las comunidades naturales de selvas, T. rosea se presenta en densidades variables, pero en México se han hecho pocas evaluaciones al respecto. Se reportan densidades bajas, por ejemplo, en el estado de Tabasco se cuantificó desde uno hasta 10 árboles/ha en sitios poco intervenidos, porque también existen casos en que puede haber áreas de varias hectáreas en que no se encuentra ni un solo ejemplar. En el Estado de Veracruz las densidades de T. rosea son muy bajas, ya que en zonas donde se ha colectado semilla de esta especie se tiene desde 2 a 9 ejemplares/ha (Manzanilla et al., 2001). 5.3.6. Plagas Desde la etapa de vivero, las plantas son atacadas por hormigas de los géneros Formica sp. y Atta sp. (hormiga arriera), que en ocasiones defolian a todo la planta y aunque generalmente no causan la muerte, el daño trae como consecuencia la deformación de la planta. Otras de las plagas son las termitas Neotermes castaneus Bum, este insecto perfora el duramen de la planta muy cerca del suelo y hacen sus galerías en la parte superior de la unión de la rama con el tallo principal. Su control se realiza con Clordano® y Heptacloro®, éstos se aplican en los nidos y la dosis se señala en la etiqueta del producto (Manzanilla et al., 2001). 5.3.7. Enfermedades T. rosea en las Antillas es atacada por la enfermedad denominada ―escoba de bruja‖ y debido a que no es posible su control, en Puerto Rico se recomienda reemplazarla por especies afines. En México específicamente en el Sureste del país, se reporta que la especie es atacada por hongos del Género Sclerotium que causa un manchado negro similar a la que se presenta en el vivero. El Sclerotium presente en plantaciones, se ha encontrado en varios hospederos, ocasionando necrosis en las hojas al igual que en las plántulas en vivero, además, es un causante del ―damping off‖, el cual ocasiona pudriciones en la raíz. Para su control se sugieren las aspersiones a base de Manzate 200®, la dosificación se especifica en la etiqueta del producto, mientras que para el control de nemátodos, se recomienda la aplicación de Furadán® en el suelo (Geilfus, 1989 y Manzanilla et al., 2001). 127 5.3.8. Sistemas y prácticas silvícolas En México, en la mayor parte de los estados donde se desarrollan las selvas y en las cuales cohabita esta especie, el manejo es en base a programas de manejo forestal, se establecen y se adaptan medidas para lograr una producción sostenible de los recursos forestales (Manzanilla et al., 2001). Para regular el rendimiento se basa en algunos métodos que ya se han establecido y que tradicionalmente en México son los que se han aplicado, con algunas modificaciones de acuerdo a las condiciones del medio y según requerimientos que el tipo de vegetación requiere. El método de ordenación aplicado tradicionalmente es el de bosques irregulares, es decir, para comunidades forestales en donde generalmente el arbolado existente es de diversas alturas, diámetros, edades y especies. El método de tratamiento puede ser por selección individual, el cual es el más indicado para especies que se presentan en forma aislada. En general en las áreas de aprovechamiento de las masas forestales nativas con fines comerciales, se busca teóricamente reducir el número de especies no comerciales e incrementar el número y los volúmenes de las especies de interés y/o comerciales. Para el caso de T. rosea, se ha observado que en tierras de cultivo y áreas de pastizal, se dejan ejemplares en pie como árboles semilleros, para sombra o para posteriormente aprovecharlos como madera. También se ha visto que en rodales forestales se dejan árboles en pie y se liberan espacios para fortalecer el establecimiento de la regeneración natural de esta especie. 5.3.9. Crecimiento y rendimiento volumétrico El crecimiento de T. rosea, es muy variable como consecuencia de las diversas calidades de sitio, edad, densidad de plantación y manejo. El ritmo de crecimiento disminuye después del quinto o sexto año de vida (Geilfus, 1989 y Manzanilla et al., 2001). 5.3.10. Edad de rotación, turno El turno es el tiempo que transcurre desde que las semillas germinan o se trasplantan hasta que están en etapa de ser cosechadas. Para el caso de T. rosea el tuno es muy variable, ya que depende de las condiciones ambientales en las cuales se desarrolla, y puede ser desde 40 a 50 años. Los diámetros requeridos para su cosecha, generalmente también dependen de la edad y de las condiciones ecológicas y pueden variar desde 35 a 60 cm. 128 5.3.11. Regeneración natural Debido a la gruesa capa de hojarasca que se acumula frecuentemente sobre el suelo en las selvas medianas subcaducifolias, a las semillas, especialmente a las pequeñas, se les dificulta alcanzar el suelo mineral y comúnmente tienen problemas para anclarse en el suelo. Por lo que para especies como la T. rosea, es recomendable remover la capa de hojarasca para incorporarla al suelo mineral y formar una cama semillera adecuada que favorezca la germinación de la especie, considerando el tamaño pequeño de su semilla (Mora et al., 2001). 5.4. PRÁCTICAS DE VIVERO 5.4.1. Recolección y almacenamiento de semillas Para la colecta de la semilla, se recomienda que cuando los frutos pasan de verde obscuro a claro y si al golpearse en el ápice las cápsulas entre sí se produce un rompimiento de las suturas longitudinales a partir del ápice, son un signo de que la semilla puede recolectarse. En regiones con vientos fuertes y altas temperaturas, los frutos deben recogerse antes de la dehiscencia, porque las semillas se dispersan rápidamente o por la exposición al sol e insectos, pueden perder capacidad germinativa. En el estado de Veracruz, se recomiendan que la colecta de la semilla debe realizarse durante los meses de abril y mayo, dependiendo de las condiciones especificas de la zona y de la precocidad del arbolado. En cuanto a la forma de obtener semilla y beneficio para su uso, consiste principalmente en que los frutos se extiendan sobre una manta y una vez que se abren los frutos, se junta la semilla, se limpia y posteriormente se empaca para su almacenamiento (Manzanilla et al., 2001). Considerando su alta higroscopicidad, se recomienda usar empaques herméticos y/o humedades relativas bajas al ser almacenada la semilla. El mejor contenido de humedad para almacenar la semilla de esta especie es de 7-8% y la temperatura de 20 ºC, en empaque de semipermeables o cámaras secas. En cuanto a los tratamientos para el almacenamiento de la semilla, se reporta que es posible conservarla durante 12 meses, en temperaturas de 20 ºC, a 8.8% de humedad, en bolsas de polietileno calibre 0.08, con lo cual se garantizan germinaciones del 75 a 83%. De los 14 a 17 meses de almacenada la semilla, presenta una disminución o alteración critica de las sustancias de reserva. La variación del 3.6% del contenido de humedad durante 17 meses de almacenamiento, indujo alteraciones enzimáticas y/o bioquímicas irreversibles manifestada por la aparición de plántulas anormales. En contraste, el tiempo de vida de la semilla es corto y pierde rápidamente la viabilidad almacenada a 4 ºC con 26% del contenido de humedad y en empaques herméticos (Manzanilla et al., 2001). 129 Es necesario considerar la estabilización de la humedad durante el almacenamiento, se recomienda que sea alrededor del 7% para que se mantenga un alto poder germinativo de las semillas. En un ensayo se encontró que la humedad a los 30 días fue de 9.2% y comienza a descender por debajo de 7% entre los días 90 a 360 y aumenta un poco (7.2%) durante los 420 a 510 días. Este tratamiento registra la mayor germinación al cabo de 420 días. Los frutos cerrados deben secarse a la sombra y al medio ambiente para que se produzca la dehiscencia, se extrae la semilla que puede contener entre 18 a 32% de humedad. La semilla procesada se empaca en bolsas de tela y se transporta. Antes del almacenamiento se seca a 6-8% de contenido de humedad, se empacan en bolsas de aluminio o polietileno calibre 0.08 y se almacena a 20 ºC (Treviño et al., 1990). 5.4.2. Germinación T. rosea se reproduce por semilla en forma natural, la germinación inicia en la temporada de lluvias y tiene una duración de 2 a 4 semanas (Webb et al., 1984 y Geilfus, 1989 citados por Martínez, 1997). Se ha reportado que se puede reproducir por estaca, pero si la alternativa es por semilla, es recomendable remojarla en agua fría por uno o dos días, luego se siembra en camas de germinación y entre los 12 y 14 días inicia la germinación; como resultado, a los seis meses de edad se tienen alturas de 25 a 49 cm y ya están listas para plantarse en el sitio deseado (Webb et al., 1984 y Geilfus, 1989). También se reporta que es una especie de rápida velocidad de germinación, la cual inicia a los 7 días y termina a los 27 días, obteniéndose un 75% de germinación a los 12 días. Se recomienda como tratamiento pregerminativo, la inmersión de la semilla en agua por 24 horas (http://www.conabio.gob.mx/conocimiento/infoespecies/ arboles/doctos/11-bigno7m.pdf). En Veracruz se ha obtenido una germinación del 95% en tan solo 75 horas, con semilla recien colectada y sembrada en sustrato compuesto por agrolita, peat moss y vermiculita, a una temperatura de 35 a 40 ºC, bajo sistema de malla media sombra, riego abundante y sin escarificación. Estas mismas plántulas, se trasplantan en bolsas de polietileno y a los 6 meses alcanzan más de 40 cm de altura y están listas para su plantación. 5.4.3. Prácticas de cultivo La planta se puede producir directamente en bolsas de polietileno con perforaciones, y con dimensiones de 12.5 x 20 cm; se deposita de 2 o 3 semillas recién cosechada y sin tratamiento pregerminativo por bolsa, teniendo buena humedad y se podría obtener una germinación del 70 a 95% en un período de 7 a 21 días. Cuando se realiza la germinación en almácigo, el transplante a las bolsas se debe realizar cuando la planta tenga de 4 a 5 cm de altura, un mes de edad o tenga solamente la 130 radícula principal, el objetivo de esto es promoverle a la planta suficiente espacio para su desarrollo. La planta en almácigo se debe de proteger bajo la sombra para disminuir la evapotranspiración y evitar la deshidratación. Se recomienda que la planta permanezca en el vivero unos cinco meses, así como también disminuir el riego durante el último mes con el objetivo de llevar a las plantas rustificadas al sitio de su plantación definitiva. 5.5. ESTABLECIMIENTO Y MANEJO DE PLANTACIONES 5.5.1. Preparación del sitio de plantación La preparación del sitio en donde se deberá establecer en forma definitiva la planta en campo, puede ser desde muy austera hasta incluir una serie de acciones como desmonte, barbecho, rastreo, etc. dependiendo de la topografía existente, ondulada o plana. Para terrenos con pendientes mayores al 10% se trazan curvas de nivel, con equisitancias de 2.5 a 3 m, en base a la densidad de la plantación que se desee; si el terreno es plano se deberá considerar lo siguiente: Desmonte y barbecho. Se recomienda que el desmonte del terreno se realice para dar espacio a los nuevos individuos a plantar; en experiencias recientes sólo se dejan especies arbóreas deseables. En cuanto al barbecho, este se debe de realizar con el fin de remover el suelo, de tal manera que las raíces de las plantas prosperen mejor. Rastreo. Esta actividad proporciona uniformidad al suelo y ayuda a que las plantas tengan condiciones propicias para su buen desarrollo, en la práctica dicha actividad aún no se reporta, sin embargo es muy recomendable (Manzanilla et al., 2001). 5.5.2. Plantación y espaciamiento Para establecer la planta en el sitio previamente preparado, se procede a abrir cepas 30 x 20 cm profundidad y ancho, respectivamente, se coloca la planta sin el envase, además, se debe tener cuidado que el cuello de la raíz no quede fuera del suelo, ni muy enterrado, de lo contrario puede causar retraso en su crecimiento. Es recomendable que antes de plantar, se realice una poda de las raíces largas para evitar un enrollamiento de las mismas (Manzanilla et al., 2001). Para el estado de Tabasco se tienen dos épocas definidas de plantación, una al inicio de las lluvias, en los meses de junio y julio y la otra al inicio de los Nortes en los meses de noviembre y diciembre, ésta ultima es la que ha dado los mejores resultados, tal vez debido a que se presentan temperaturas bajas que evitan la deshidratación de las plantas. Generalmente las plantaciones y sobre todo en zonas con menor precipitación, se recomienda realizarlas al inicio de la temporada de 131 lluvias, de esta forma se garantiza un mejor desarrollo del sistema radical y así pueden sobrevivir la época de verano (Manzanilla et al., 2001). Una distancia adecuada puede ser de 2 a 3 m o bien 3 x 3 m para una plantación uniespecífica o asociada con otras especies, esto daría como resultado una densidad de 1,000 a 1,100 plantas/ha, que permite realizar actividades de mantenimiento y es el espacio adecuado para el desarrollo de las plantas. Otra densidad que se recomienda es la de 1,100 a 1,600 plantas/ha y puede asociarse con cultivos agrícolas (Geilfus, 1989; Manzanilla et al., 2001). 5.5.3. Cultivo de las plantaciones Por lo general, en condiciones naturales se encuentran ejemplares de T. rosea con fustes largos rectos, como producto de la poda natural inducida por la competencia a la que se ven sujetos por las altas densidades con otras especies. Algunas plantaciones de tipo experimental en el sureste de México y en Jalisco, parecen confirmar que se pueden tener buenos resultados regulando apropiadamente las densidades y aplicando podas tempranas, es decir, realizando oportunamente una serie de prácticas silvícolas. Se recomienda tener limpia la plantación durante los primeros tres años, esto con el fin de evitar la competencia de especies arbóreas no deseables, ya que éstas restringen la disponibilidad por agua, luz y nutrientes. Realizar chapeos cada tres meses en los primeros dos años de haberse plantado, mientras el árbol forma su cobertura, luego se recomienda limpiar cada seis meses. Si los terrenos tienen pendientes mayores al 15% o más y existe riesgos de erosión, no es muy recomendable usar herbicidas, debido a que también se elevan los costos de producción, es preferible intercalar cultivos agrícolas durante los primeros años para amortizar los costos de plantación (Geilfus, 1989; Manzanilla et al., 2001). Los aclareos se realizan cada tres años; en el Sureste de México se reporta que esta labor se realiza dos veces en el periodo de crecimiento; el primer aclareo se realiza cuando la planta tiene 7 años de edad y una altura de 8 a 9 m, dejando una densidad de 723 árboles/ha. El segundo aclareo se realiza cuando la planta tiene una edad de 12 a 13 años, con una altura de 16 a 18 m, dejando una densidad de 462 árboles/ha. Los aclareos tienen como finalidad eliminar los árboles mal formados, enfermos o muertos y por otra parte, para proporcionarle espacio a los mejores árboles una vez que hayan alcanzado determinado diámetro y altura (Geilfus, 1989; Manzanilla et al., 2001). Se recomienda que las podas se apliquen cada 9 meses con el propósito de darle forma a la planta en su fase de crecimiento, eliminando las ramas innecesarias para que crezca vigorosa y con una buena conformación de fuste, lo que aumentará la calidad comercial de la madera (Geilfus, 1989; Manzanilla et al., 2001). 132 5.5.4. Crecimiento y rendimiento volumétrico El crecimiento de esta especie es muy variable, esto dependerá de la calidad de sitio, edad, densidad de plantación y manejo que se le aplique. En plantaciones con las mejores condiciones climáticas, llega alcanzar hasta 3 m de altura en el primer año. En el Sureste de México el crecimiento anual en altura varía de 1.5 a 2 m y de 1.5 a 2 cm de diámetro. La producción en volumen de madera es de 10 a 20 m3/ha/año y un incremento de 15 a 25 m3/ha/año (Webb et al., 1984; Geilfus, 1989; Manzanilla et al., 2001). También se desarrolla bajo sistema de riego en el municipio de Axutla, Puebla, en altitudes de 1,300 msnm, con riegos cada 15 días sólo en período de estiaje y los árboles de 3 años de edad presentan alturas hasta de 2 m, el crecimiento es menor al que puede alcanzar en plantaciones realizadas en su hábitat natural, donde los crecimientos a la misma edad sobrepasan los 3 m (Martínez, 1997). En plantaciones de los estados de Tabasco, Veracruz y Costa de Jalisco, se tiene un desarrollo más acelerado y por tanto un turno más corto y los diámetros estimados son de 45 a 55 cm los cuales se podrían lograr a los 25 a 30 años de edad. 5.5.5. Plantaciones agrosilvopastoriles En México sobre todo en regiones tropicales se han observado plantaciones y ejemplares de la especie asociada con pastos forrajeros, sirviendo de linderos en potreros, cercos vivos y como árboles de sombra para el ganado. En la zona de la Chontalpa del estado de Tabasco, se plantó T. rosea asociada con Cordia dodecandra y se evaluó la respuesta con plantación mecanizada y manual en dos condiciones ecológicas (dosel protector y campo abierto). Los resultados obtenidos 8 meses después fue la sobrevivencia en campo abierto con plantación manual y planta con cepellón fue de 100%, manual y con planta a raíz desnuda del 91%, mientras que en los tratamientos mecanizado a raíz desnuda y mecanizado con cepellón fue del 97%. En cuanto a los incrementos en diámetro y altura, se encontró que la especie Cordia dodecandra, fue superior en más del doble que T. rosea. De manera general, los métodos mecanizados a raíz desnuda y con cepellón permitieron un mayor incremento de altura que los métodos manuales respectivos. La altura promedio de los métodos mecanizados en campo abierto, alcanzaron incrementos de 22.1 cm, mientras que los métodos manuales solo de 19.1 cm; en la condición bajo dosel protector, se observó que con los métodos mecanizados se logró un incremento en altura de 20.4 cm, mientras que con los manuales, sólo se obtuvo incremento de 12.1 cm (Manzanilla et al., 2001). Este árbol es muy empleado en sistemas agroforestales, principalmente en asociaciones silvopastoriles, como cerca viva o linderos, ya sea bordeando terrenos agrícolas, pastizales, carreteras y caminos (CNIC, 2005). 133 5.6. MEJORAMIENTO GENÉTICO En América son pocas las especies tropicales forestales en las que se tienen avances en su mejoramiento genético; en México aún es más escasa la información al respecto y no se conocen áreas semilleras ni huertos semilleros de T. rosea. En Colombia se tienen plantadas 2,100 ha y huertos semilleros clonales (Treviño y Jara, 1988). 5.7. PROPIEDADES Y USOS 5.7.1. Propiedades físico-mecánicas de la madera La madera de T. rosea tiene albura de color crema amarillento, con algunos vasos grandes y bandas conspicuas y abundantes de parénquima paratraqueal, la densidad de la madera varía de 0.52 a 0.62 g/cm3, presenta una textura mediana a gruesa, con grano recto entrecruzado, olor y sabor no característico. La densidad media básica es de 0.57 g/cm3 y densidad anhidra de 0.61 g/cm 3, con una contracción volumétrica total baja (9.4) y relación de contracciones desfavorables (2.1). La madera seca al aire a una velocidad moderada, resistente a hongos de pudrición, pero poco resistente a taladradores marinos, sin embargo, es fácil de tratar con productos preservantes en albura y duramen. La madera de esta especie es de fácil trabajabilidad (Webb, 1984; Manzanilla et al., 2001; CNIC, 2005; http://www.biologie.uni-hamburg.de/b-online/wood/spanish/ bigtaros.htm). El duramen es de color blanco o gris (marrón rosado claro), de color uniforme y la albura con coloración similar al duramen. Los vasos son de porosidad difusa, agrupados, generalmente en grupos radiales cortos (de 2–3 vasos); el promedio del diámetro tangencial de los vasos es de 85–140 µm y el promedio del número de vasos/mm2 es de 13–22. El promedio del largo de los elementos vasculares es de 332–386 µm. Las punteaduras intervasculares alternas con un promedio del diámetro (vertical) de las intervasculares de 3–6 µm y las radiovasculares con areolas distintas, similares a las punteaduras intervasculares. Las fibras son de paredes de espesor medio, con un promedio del largo de 970–1170 µm. Las punteaduras de las fibras en su mayoría restringidas a las paredes radiales, simples o con areolas minúsculas. El parénquima axial es en bandas, marginales (o aparentemente marginales), finas, hasta 3 células de ancho. El parénquima axial paratraqueal es vasicéntrico, aliforme o confluente. El promedio del número de células por serie del parénquima axial es de 2-4. Los radios son multiseriados y el número por mm es de 18-19, con 2-4 células de ancho, compuestos por células homocelulares procumbentes (http://www. biologie.uni-hamburg.de/b-online/wood/spanish/bigtaros.htm) La madera es de buena estabilidad dimensional, fácil de trabajar, moderada resistencia al ataque de hongos e insectos y fácil de preservar (CNIC, 2005). 134 5.7.2. Usos La madera se utiliza para la fabricación de chapa para madera terciada en las caras de vista; por ello es una especie que podría emplearse con éxito en las plantaciones comerciales. Dado lo excelente de la calidad de su madera, se usa para fabricar muebles finos, ebanistería, artesanías, decoración de interiores y exteriores, puertas, ventanas, marcos, remos, chapa para madera terciada, lambrín, triplay, parquet, ebanistería, armas de fuego, implementos agrícolas e instrumentos musicales Grijalva, 1992; Herrera y Lanuza 1995 citados por Manzanilla et al., 2001; CNIC, 2005; http://www.conabio.gob.mx/conocimiento/infoespecies/arboles/doctos/11-bigno 7m.pdf; http://www.semarnat.gob.mx/pfnm2/fichas/tabebuia_ rosea.htm). Por su bello colorido rosado de sus flores, se utiliza para ornato a la orilla de caminos, jardines, avenidas, parques, etc. También se pueden hacer algunas infusiones de sus hojas para medicina casera como febrífugo, contra parásitos intestinales, diarrea, calentura, disentería, acelera el parto. La corteza cocida sirve para la diabetes, paludismo, tifoidea, parasitosis. La madera producto de los aclareos, ramas y desperdicios puede utilizarse como leña y carbón. La decocción de flores, hojas y raíces se utiliza como antídoto de mordeduras de serpientes, aplicándola como fomento y tomada en cucharadas. Es una especie clasificada como melífera (Webb, 1984; Niembro, 1986; Herrera y Lanuza 1995; Manzanilla et al., 2001; CNIC, 2005; http://www.conabio.gob.mx/conocimiento/infoespecies/ arboles/doctos/11-bigno7m.pdf; http://www.semarnat.gob.mx/pfnm2/fichas /tabebuia_ rosea.htm). Se le ha empleado en acolchados o cobertura de hojarasca, para conservación de suelo y control de la erosión, como ornamental, barrera rompevientos y cerca viva en los agrohábitats (http://www.conabio.gob.mx/conocimiento/info_especies/arboles/ doctos/11-bigno7m.pdf). 135 CAPÍTULO 6 Tectona grandis L. F. Fotografía tomada por H. Jesús Muñoz Flores. 136 6.1. DESCRIPCIÓN DE LA ESPECIE 1.1. Nombre común El nombre común más conocido, es teca. En la India, se le conoce como sehún, sagon, saguan, skhu, toak, slip tru, Indian oak. Otros nombres son: Teck (Francia, India, Inglaterra y Holanda); Iati, Deleg y kulidawa (Indonesia); kyun (Birmania); sak y mai-sak (Laos y Tailandia), teca de Rangún. (Fierros et al., 1999; Lamprecht, 1989 b; Niembro, 1986; Govaere et al., 2005). 6.1.2. Taxonomía Familia: Verbenaceae Género: Tectona Especie: Tectona grandis L. F. (http://www.inbio.ac.cr/bims/k03/p13/c045/o0138/f01348/g009166/s029354.htm) 6.1.3. Forma Tectona grandis es un árbol deciduo de 20 a 30 m que alcanza los 50 m de altura; fustes rectos, con un diámetro mayor de 10 cm y hasta 2.5 m. Tronco recto, especialmente cuando joven (Figura 6), con la tendencia a bifurcarse o ramificarse en exceso si crece aislado. La copa es abanicada; ramillas gruesas, cuadrangulares gris claro o verdosas. Las ramas en árboles adultos son gruesas. Las raíces son grandes profundas y con fuertes raíces laterales (SIRE, 2005 c; Niembro, 1986; Govaere et al., 2005). 6.1.4. Corteza La corteza muerta es de color café grisáceo o castaño claro, escamosa y presenta grietas superficiales; la corteza viva (Figura 6) es blanquecina (SIRE, 2005 c; Niembro, 1986; Govaere et al., 2005). 6.1.5. Hojas Las hojas son simples opuestas, caducas, muy grandes, sésiles o cortopecioladas, elípticas de 40-60 cm de largo por 25-30 cm de ancho, coriáceas (Figura 6), ásperas, ápice y base agudos, oscuras por el haz, amarillentas y con nervaduras prominentes por el envés, dejando cicatrices muy marcadas al caer (SIRE, 2005 c; Niembro, 1986; Govaere et al., 2005). 137 6.1.6. Flores Las flores son actinomorfas, bisexuales, inconspicuas en inflorescencias de color lila y dispuestas en grandes panículas terminales, erectas y ramificadas, cáliz gris con 6 lóbulos campanulados, corola con 6 lóbulos extendidos con sendos estambres epipétalos, ovario de 4 células, estilo delgado, estigma bilobular (SIRE, 2005 c; Niembro, 1986; Govaere et al., 2005). 6.1.7. Frutos El fruto es una drupa cuadrilobulada, de color castaño claro, finamente velloso, con pericarpio afelpado que encierra una semilla bastante dura. Es un fruto seco indehiscente, en drupa esférica (Figura 6) (SIRE, 2005 c; Niembro, 1986; Govaere et al., 2005). Figura 6. A) Árbol. B) Frutos. C) Corteza. D) Hojas municipio de Múgica, Michoacán. 138 y E) Plantación de Tectona grandis en el 6.2. DISTRIBUCIÓN Y HÁBITAT 6.2.1. Distribución geográfica T. grandis es originaria de la India, Birmania, Tailandia, Java e Indonesia (Niembro, 1986; Peña, 1984). En su lugar de origen se distribuye en el Bosque tropical caducifolio y Bosque tropical seco (Fierros et al., 1999 y Lamprecht, 1989 b). No obstante ha sido plantada en las Filipinas, África, Guayana Británica, Puerto Rico, Cuba, Haití, Jamaica, Trinidad, Honduras, Camboya, Laos, Vietnam (Norte y Sur) y en América Latina (Kukachka, 1970). Se distribuye principalmente en el Archipiélago Malayo e India peninsular y crece únicamente dentro de una banda sumamente estrecha alrededor del mundo, ubicada a 20 grados de la línea ecuatorial. Es una especie frondosa nativa de la India, Myanmar (Birmania), la República Democrática Popular Laos y Tailandia, tiene una larga historia de ordenación sistemática. Se introdujo en Indonesia (Java) hace cientos de años y las más antiguas plantaciones de teca en Sri Lanka se han documentado a fines del siglo XVII. Los primeros sistemas intensivos de ordenación de los bosques naturales se desarrollaron hace unos 150 años en Myanmar, desde donde la ordenación activa de la especie pasó a la India y Tailandia durante un período de unos 40 años. En la actualidad se encuentra plantada en América Central, Colombia, Venezuela, Brasil, Costa Rica, Panamá, Ecuador y Guyanas, países con clima tropical y en general con condiciones que se ajustan a los requerimientos de la teca (Govaere et al., 2005; http://www.bosquestropicales.com/html/Espanol/ubicacion.html). En México se han establecido plantaciones de teca en el estado de Michoacán (Figura 6), Nayarit y Jalisco, pero principalmente a nivel experimental en Veracruz y Tabasco (Monroy, 1998). 6.2.2. Clima T. grandis prospera en climas cálido–húmedos con temperatura media de 21 a 28 ºC, con una mínima de 17 a 21.3 y máxima entre 30.2 a 46 ºC, con una marcada estación seca de tres a cinco meses con un máximo de 60 mm de lluvia. Los lugares cuyas condiciones son muy secas usualmente producen un crecimiento atrofiado. En los sitios donde no se presenta esta marcada estación seca, se puede obtener un crecimiento más rápido, pero también producen una madera con una savia más espesa y una calidad general más baja, lo que incluye una densidad promedio menor, un color menos atractivo, una textura inferior y una madera menos fuerte (Von Carlowitz et al., 1991; Lamprecht, 1989 b; Monroy, 1998; Flinta, 1960; Fierros et al., 1999; Somarriba et al., 1999; http://www. bosquestropicales. com/html/Espanol/ubicacion.html). 139 Crece bien en zonas con una precipitación de 1,000 a 3,000 mm/año y una temperatura promedio de 26 ºC, pero también se reporta que la precipitación óptima se encuentra entre 1,250–2,500 mm, con 3 a 5 meses de sequía, con una media de 1,578.7 mm, una mínima entre 625 y 1,200 mm y máxima de 2,291 a 3,000 mm anuales (Peña, 1984; Von Carlowitz et al., 1991; Fierros et al., 1999). 6.2.3. Altitud y topografía T. grandis crece bien en zonas húmedas desde el nivel del mar hasta 1,000 msnm, aunque también se reporta que la altitud media donde se desarrolla es de 378 m, con mínima de 0 a 30 y máxima de 650 a 1,500 m (Von Carlowitz et al., 1991; Fierros et al., 1999; Lamprecht, 1989 b). Los sitios donde mejor se desarrolla son planos o ligeramente ondulados (Monroy, 1998). 6.2.4. Suelos Para lograr un buen crecimiento y una alta calidad, T. grandis requiere de suelos francos, bien drenados a estacionalmente inundados, ricos en calcio, profundos, de textura arcillosa, arenosa a franca, limo-arcillosa, pH de neutro a ligeramente ácido, sales ausentes; los mejores sitios son los suelos aluviales fértiles, bien drenados, con el manto freático profundo (Somarraba et al., 1999; Peña, 1984; Von Carlowitz et al., 1991; Fierros et al., 1999; Monroy, 1998; Govaere et al., 2005; http://www.bosquestropicales.com/html/Espanol/ubicacion. html). 6.3. SILVICULTURA 6.3.1. Bosques naturales Aunque la popularidad de T. grandis está siempre en ascenso, sus bosques naturales se reducen a un ritmo alarmante. La demanda mundial de la teca aumenta año tras año, pero la oferta se ha reducido significativamente en los últimos años. Los grandes bosques de teca restantes en el mundo están ubicados en Burma (Birmania), pero se asume que el gobierno está depredando su bosque de una manera agresiva, por lo que la demanda mundial de teca tendrá que ser satisfecha por las relativamente pocas plantaciones de teca que existen alrededor del mundo. La teca, que ya es un escaso recurso, en forma natural se puede considerar como una especie forestal casi extinta (http://www.bosquestropicales.com/html/Espanol/ ubicacion.html). En la Vertiente del Pacífico de Costa Rica, con plantaciones de teca; se procesaron datos de árboles con el fin de evaluar el crecimiento en altura a través de la técnica de análisis troncales. Se utilizó una muestra compuesta por 19 árboles talados y seccionados a lo largo de las zonas cálidas se generó información de un total de 403 datos con edades comprendidas entre 1 y 40 años de edad, con diámetros a 1.30 m 140 de altura con corteza que oscilan entre 2.38 cm y 47.80 cm y alturas totales que varían desde 2.02 m hasta 34.20 m. De acuerdo a los resultados, se seleccionaron dos modelos que presentaron las ―diferencias absolutas y relativas‖ más pequeñas con respecto al volumen promedio de la muestra. Uno fue el ―Modelo de doble raíz cuadrada‖ (ãv = b0 + b1*dap + b2*ãdap ) con el fin de construir una tabla (Cuadro 22) de una sola entrada a partir del diámetro y el otro fue el ―Modelo de Näslund‖ (v = b1*dap2 + b2*dap2*htotal + b3*dap*htotal2 + b4*htotal2 ) para la elaboración de una tabla de doble entrada (Cuadro 23), utilizando el diámetro y la altura total (Mora y Gómez, 2005). Cuadro 22. Tabla de una entrada para el volumen total con corteza de árboles individuales en plantaciones de Tectona grandis. Vertiente del Pacífico, Costa rica. Clase de DAP (cm) 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 Fuente: Mora y Gómez, (2005). 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 PM (cm) Volumen (m3) 3 5 7 9 11 13 15 17 19 21 23 25 27 29 31 33 35 37 39 41 43 45 47 49 51 0.0029 0.0062 0.0135 0.0259 0.0443 0.0697 0.1025 0.1435 0.1930 0.2514 0.3191 0.3963 0.4835 0.5807 0.6882 0.8063 0.9350 1.0746 1.2252 1.3870 1.5601 1.7446 1.9407 2.1484 2.3678 Donde: VOL = Volumen total con corteza por árbol (m) DAP = Diámetro a la altura del pecho con corteza (cm) PM = Punto medio de la clase de diámetro (cm) 141 Cuadro 23. Tabla de doble entrada para el volumen total con corteza de árboles individuales en plantaciones de Tectona grandis. Vertiente del Pacífico, Costa Rica. Clase DAP (cm) 4.5 9.5 14.5 19.5 24.5 29.5 34.5 39.5 44.5 49.5 Clase de altura (m) 3.5 6.5 9.5 12.5 0.0068 0.0185 0.0162 0.0325 0.0641 0.1109 0.0300 0.0485 0.0882 0.1489 0.2308 0.0480 0.0667 0.1122 0.1846 0.2840 15.5 18.5 21.5 24.5 27.5 30.5 33.5 0.0869 0.1361 0.2180 0.3327 0.4802 0.1091 0.1599 0.2491 0.3769 0.5433 0.7482 0.1835 0.2779 0.4166 0.5433 0.7482 0.2070 0.3043 0.4518 0.6494 0.8971 1.1951 1.5432 0.2305 0.3284 0.4824 0.6923 0.9583 1.2802 1.6580 20919 0.5085 0.7266 1.0105 1.3541 1.7596 2.2268 0.7582 1.0538 1.4170 1.8478 2.3462 Fuente: Fuente: Mora y Gómez, (2005). 6.3.2. Floración y fructificación La floración es inmediata a la caída de los frutos, los cuales maduran y caen de febrero a marzo (Peña, 1984). 6.3.3. Producción y diseminación de semilla Las semillas a utilizar deben provenir de individuos sanos (libres de plagas y enfermedades), vigorosos y con buena producción de frutos. Con esto se pretende asegurar que las plantas obtenidas de esas semillas hereden las características de los progenitores (Arriaga et al., 1994; Fierros et al., 1999). El número promedio de semillas por kilogramo es de 2,000 (Peña, 1984). En México se citan 1,400 semillas/kg y la fecha de recolección de diciembre a marzo (PRODEFO, 2000). 6.3.4. Tolerancia a factores ambientales Los lugares cuyas condiciones son muy secas usualmente producen un crecimiento atrofiado de la teca. En los sitios donde no se da esta marcada estación seca se puede obtener un crecimiento más rápido, pero también producen una madera con una savia más espesa y una calidad general más baja, lo que incluye una densidad promedio menor, un color menos atractivo, una textura inferior y una madera menos fuerte (http://www.bosquestropicales.com/html/Espanol/ubicacion.html). En la India presenta resistencia a las sequías, pero es sensible a las heladas y al fuego (Von Carlowitz et al., 1991). 142 Los incendios son el principal y mayor riesgo que afronta una plantación de teca, principalmente durante los primeros 2 a 3 años. Después del cuarto año de crecimiento, la corteza de los árboles de teca se vuelve sumamente resistente al fuego generado por los incendios. Las hojas adquieren un gran tamaño y se tornan gomosas y sumamente resistentes. La peor amenaza es la primera estación seca anual cuando la hierba o los arbustos altos pueden incendiarse y matar los incipientes árboles de teca. Por consiguiente, durante los primeros años se invertirán considerables cantidades de fondos para mantener la maleza y los arbustos cortados (http://www.bosquestropicales.com/html/Espanol/ubicacion.html). 6.3.5. Plagas T. grandis es una de las especies más empleadas en reforestación en las regiones tropicales. Durante los últimos cinco años, plantaciones comerciales han sido inspeccionadas para la determinación de herbívoros y fitopatógenos asociados a la especie. Solamente en Costa Rica se identificaron 20 especies de insectos (48%), 18 especies de patógenos, dos especies de vertebrados y un muérdago. A continuación se describen los principales problemas fitosanitarios: Hyblaea puera (esqueletizador) En Costa Rica, desde hace aproximadamente 4 años, Hyblaea puera (Hyblaeidae, Lepidóptera), conocido a nivel mundial como el ―esqueletizador de la teca‖, produce defoliaciones durante el período de sequía. Las larvas pliegan y unen con seda un borde de la hoja con la lámina foliar donde se albergan. De allí salen a alimentarse del resto de la lámina foliar dejando únicamente las nervaduras primaria y secundarias. Si el ataque es muy severo, se pueden observar hasta 12 larvas por hoja y defoliaciones totales, partiendo en forma preferencial de las hojas más jóvenes. Las larvas en su último instar, pueden medir aproximadamente 4 cm de largo, el cuerpo tiene una apariencia suave, lisa y opaca, con coloraciones que varían de gris oscuro a negro, con bandas longitudinales de color naranja y laterales blancas. La larva madura usualmente desciende al suelo en un hilo de seda y pupa bajo una delgada capa de hojas secas. Las palomillas son relativamente pequeñas, con una envergadura alar de 3-4 cm y una postura de descanso característica que le oculta el negro y naranja (Arguedas, 2005). Rabdopterus sp. (defoliador) Es una especie polífaga de la familia Chrysomelidae (Orden Coleóptera). Los adultos se alimentan del follaje, produciendo perforaciones características de forma elongada y curva de aproximadamente 1.3 de largo y 0.16 cm de ancho. Los huevos son puestos en grietas en la superficie del suelo. Las larvas son blancas con una línea longitudinal oscura y la cabeza color marrón con mandíbulas bien desarrolladas. Los adultos son escarabajos pequeños (4-5 mm de largo), compactos, robustos, de forma 143 óvalo-alargada, de color verde oscuro a negruzco con brillo metálico; los ángulos anteriores del tórax son finos y dirigidos hacia fuera, las patas son rojizo claro con la tibia media arqueada. Posee hábitos alimenticios nocturnos. Se determinó que el ciclo de vida oscila entre 39 y 52 días. Los ataques están relacionados con la dominancia de gramíneas en el sitio, ya que las larvas se alimentan de las raíces de gramíneas y arándanos (Arguedas, 2005). Walterianella sp. (defoliador) Los adultos se alimentan del follaje produciendo pequeñas raspaduras de la cutícula superior y del parénquima de aproximadamente 10 x 2 mm. Por la cantidad de daños en una sola hoja, ésta puede quedar casi totalmente perforada y morir. Los daños dentro de las plantaciones se concentran en grupos de árboles o focos. Los adultos son pequeñas ―mariquitas‖ (6 mm de longitud) amarillas con secciones en los élitros (alas anteriores) y el par de patas traseras color pardo. Las poblaciones se concentran en uno o dos árboles y cuando son alteradas, brincan y cubren el ambiente como ―nubes‖. Otros defoliadores de menor importancia en cuanto a daños son una especie de Automeryx (Familia Saturniidae, Orden Lepidóptera), tres de Oxidia (Familia Geometridae, Orden Lepidóptera), conocidas como los ―medidores gigantes de la teca‖ y varias especies no identificadas de saltamontes (Orden Saltatoria). Estos últimos también pueden alimentarse de los brotes terminales, lo que hace que las consecuencias de sus daños sean de gran importancia económica. Neoclytus cassicus (barrenador) En trozas almacenadas en patios, provenientes principalmente de aclareos, se han presentado ataques del barrenador Neoclytus cacicus (Cerambycidae, Coleóptera). Las larvas construyen galerías en la albura, sin que externamente se detecten signos del ataque. El ciclo de vida se completa en las galerías y es el adulto el que construye orificios circulares de aproximadamente 5 mm de diámetro por donde emergen. El adulto puede medir hasta 1,5 cm de largo, es de color café claro con cuatro marcas blancas sobre los élitros. Las primeras manchas forman conjuntamente como una ―M‖ y las últimas forman como una ―V‖ invertida. Las antenas son más cortas que el cuerpo. El primer par de patas es más pequeño que los dos otros pares. Los dos últimos pares de patas son más largas que el cuerpo. Este insecto tiene como hospedero nativo a la planta Guiacum officinale (Arguedas, 2005). 144 Phyllophaga spp. Las larvas del género Phyllophaga pueden ser consideradas como las plagas más importantes de suelo que se alimentan de tubérculos y raíces. Los daños son producidos por las larvas en su tercer instar, las cuales son conocidas en la región como ―jogotos‖, ―fogotos‖ o ―gallinas ciegas‖. Los adultos son los conocidos como ―abejones de mayo‖ (Arguedas, 2005). Se destaca esta plaga por el fuerte impacto provocado en plantaciones recién establecidas y en grandes extensiones de plantaciones de hasta tres años, en los meses de septiembre y octubre del 2003 en Panamá. Se encontraron hasta cien o más larvas en algunos individuos afectados y el sistema radical severamente afectado, tanto por ausencia casi total de raicecillas de absorción, como perforaciones en las raíces primarias y secundarias. Esta situación hace que estos árboles sean mucho más propensos a otros problemas fitosanitarios, como los producidos por patógenos de suelo. Consideraciones finales indican que durante los años que se ha llevado a cabo la prospección en las plantaciones de Teca se ha observado un aumento en el número de plagas reportadas, lo cual se puede deber también al aumento en el área reforestada. Sin embargo, la mayor preocupación radica en que muchos de los problemas mencionados han aumentado paulatinamente en su frecuencia y en la severidad de los daños causados. El uso de prácticas de manejo tradicionales, específicamente con el uso de plaguicidas se ve muy limitada en aquellos proyectos que se encuentran certificados. Esto conlleva a buscar otras opciones de manejo mucho más amigables con el ambiente y con la salud ocupacional del personal, en especial de campo. Se destacan nuevamente las actividades de prospección, los controles culturales y mecánicos y el control biológico, mediante las labores que favorezcan el desarrollo y permanencia de enemigos naturales dentro de las plantaciones (Arguedas, 2005). En México, las hormigas del género Atta cephalotes (L.) es una de las principales plagas por lo que es necesario localizar los hormigueros y aplicar un insecticida organofosforado de contacto. El combate de hormigas debe iniciarse antes de la remoción de la cubierta vegetal, localizando los hormigueros en una superficie que cubra por lo menos 100 m alrededor del sitio de plantación (INIFAP, 1997 c; Fierros et al., 1999; Cibrián et al., 1995). La cochinilla rosada (Maconellicoccus hirsutus Green) es una plaga exótica y es posible que encuentre las condiciones favorables para su establecimiento y diseminación, tales como un clima favorable, amplio ámbito de hospedantes, ausencia o pocos enemigos naturales y se convierta en una amenaza importante para los cultivos. Esto causaría un impacto económico significativo en la actividad cafetalera y otros sectores de importancia económica. Es un insecto muy polífago se le ha encontrado alimentándose en 70 familias, 200 géneros y más de 125 especies de plantas, entre ellos cultivos de importancia económica como café, cacao, cocotero, algodón, caña de azúcar y uvas. También en especies forestales como ceiba, neem, madero negro, leucaena, paraíso y teca. En frutales como cítricos, anonáceas, papaya, mango, aguacate, hortalizas, ornamentales y malezas. 145 Los daños producidos en las plantas de este cultivo se manifiestan como debilitamiento de los órganos y en árboles forestales, la saliva tóxica que inyecta provoca malformación de las hojas y yemas apicales. Se considera que el transporte de material vegetativo infestado es un medio de dispersión, así como el comercio internacional de plantas y productos, por lo que una táctica recomendada para su prevención son las medidas cuarentenarias, sin embargo, no siempre son suficientes, por lo que la mejor alternativa para el control parece ser el control biológico, como el escarabajo depredador Cryptolaemus montrouzieri o el parasitoide Anagyrus kamali; en Costa Rica, se introdujo el depredador de la cochinilla aérea del café (P. citri), el cual fue criado en laboratorio y luego liberado en plantaciones de café (Padilla, 2005). 6.3.6. Enfermedades La teca es sumamente resistente a las enfermedades, lo que más preocupa al inicio de la plantación es la afectación de las raíces que son susceptibles a un ataque de hongos. Una vez que ha madurado la raíz base, la infestación por hongos deja de ser un problema significativo (http://www.bosquestropicales.com/html/Espanol/ubicacion. html). Rigidoporus lignosus causa la pudrición de las raíces en terrenos mal drenados y Armillaria mellea causa la pudrición de las raíces; aunque es saprofito, ataca cuando las condiciones son propicias (raíces dañadas y árboles débiles) o que el terreno tenga gran potencial de inóculo (Peña, 1984). Phomopsis sp. (quema de los brotes) Se han observado en focos de hasta 50 árboles de 6 a 24 meses de edad. La infección comienza en el meristemo apical, cuyas hojas inmaduras se tornan pardo oscuro, y después se desvanecen. Aparentemente, en menos de cinco días el hongo desciende por los tejidos corticales del tallo, los cuales inicialmente adquieren una coloración pardo morado, que luego se torna negra. En algunas ocasiones las nervaduras principales de las hojas se encuentran también afectadas y presentan una necrosis color negro. Si en el campo hay períodos prolongados de alta humedad relativa se observan pequeñas estructuras negras y duras que emergen de los tejidos, las cuales son los picnidios o estructuras reproductivas del hongo (Arguedas, 2005). Pseudomonas (malla de la teca) Los árboles afectados presentan un leve amarillamiento y flacidez del follaje, el cual posteriormente comienza a necrosarse desde los bordes, hasta cubrir toda la lámina foliar y matarla. Como son árboles pequeños (menos de 1,5 m de altura), la infección comienza a afectar también los tejidos corticales del tallo, produciendo la muerte de todo el individuo. El sistema radical se encuentra totalmente deteriorado, la corteza 146 se desprende fácilmente de las raicecillas finas y en las más gruesas estos tejidos se encuentran podridos. Esta enfermedad es muy importante, ya que es una bacteria que mata el arbolito y puede contaminar el suelo. Se ha manejado eficientemente eliminando desde la raíz los individuos afectados, los cuales se extraen de la plantación. Los hoyos dejados se asperjan con antibióticos como estreptomicina. Botryosphaeria (cancro múltiple) Cada cancro representa un abultamiento de 3 a 20 cm de largo y de 2 a 23 cm de ancho a lo largo del fuste; la corteza se abre en dichos sitios y se ubican principalmente en los puntos de poda. En un árbol se pueden encontrar hasta 16 cancros (Arguedas, 2005). Nectria nauriticola (cancro nectria) En la base del fuste se observa un área ovalada de la corteza de color oscuro. Esta corteza podrida se puede desprender manualmente y observar los tejidos del xilema expuestos. Se ha nota también que los cancros pueden permanecer mucho tiempo en el árbol, el cual comienza a producir tejidos de defensa como callos y posiblemente corteza subepidérmica, provocando grandes áreas abultadas y deformes principalmente en la base del árbol. En árboles jóvenes el cancro puede ser longitudinal y ampliarse en la base, provocando en algunos casos la muerte del árbol por anillamiento (Arguedas et al., 1995 y Arguedas, 2005). En muchas ocasiones se encontraron árboles de hasta 7 años afectados en las raíces por Fusarium sp, ésta situación podría tener relación con los ataques de N. nauriticola, ya que especies de Fusarium son el estado imperfecto de Nectria. Agrobacterium tumefaciens (corona de agallas) Es una bacteria de la familia Rhyzobiaceae que produce una enfermedad denominada "corona de agallas" (Sinclair et al., 1987 citados por Arguedas, 2005). En teca se forman agallas o tumores, principalmente en la base de los tallos a nivel de la superficie del suelo. Inicialmente forma pequeños crecimientos esféricos con la apariencia de callos, los cuales crecen rápidamente hasta constituirse en grupos de protuberancias fácilmente distinguibles. En árboles de dos a tres años, los tumores pueden llegar a alcanzar diámetros superiores al de su hospedero. Estas agallas son leñosas y mantienen la coloración y la textura del resto de la corteza. Con el tiempo, la superficie se rompe y toma una coloración oscura. Generalmente los árboles adultos logran desarrollarse con la presencia de la enfermedad sin efectos aparentes, sin embargo, otros patógenos de suelo pueden penetrar por las agallas decadentes y producir otras enfermedades (Arguedas, 1994 y Arguedas, 2005). 147 En plantaciones mayores de 7 años, en regiones con precipitaciones anuales superiores a los 4,000 mm, se ha observado un proceso de mortalidad de árboles aislados y en grupos, denominado el ―decline de la teca‖. El proceso de pudrición de las raíces se manifiestan primeramente en las principales pero en las regiones apicales (aproximadamente 1–1.5 cm de diámetro), donde la corteza se desprende fácilmente y los tejidos internos generalmente se encuentran negruzcos, producto de los procesos de oxidación acelerada. Se han establecido varias hipótesis referentes a la causalidad del síndrome, especialmente relacionadas con condiciones de sitio como estructura de suelo inadecuada (suelos pesados), niveles freáticos altos, elevados niveles de lixiviación de bases, acidez y fertilidad de los suelos; así como a manejo silvicultural inadecuado, como densidades altas y obras de drenaje sin mantenimiento. Es muy posible que varios de estos factores actúen conjuntamente y permitan la acción final de patógenos oportunistas. El ―decline de la teca‖ se convierte en uno de los problemas que causan mayor preocupación en las plantaciones ubicadas en regiones con altos niveles de precipitación. Debido a la complejidad de los posibles agentes causales y de las relaciones entre ellos, es que se considera fundamental realizar estudios de carácter interdisciplinario, con proteccionistas, silvicultores, ecólogos y edafólogos (Arguedas, 2005). 6.3.7. Sistemas y prácticas silvícolas Debido a la ausencia de información actualizada sobre el manejo intensivo de la teca en Centroamérica, se realizaron una serie de estudios con el objetivo de desarrollar diferentes escenarios de crecimiento y manejo intensivo para esta especie. Luego de la aplicación de los distintos tratamientos en el ensayo de aclareos, diferencias en DAP empezaron a ser evidentes, aumentando según aumentaba la intensidad del aclareo. El área basal al año 4 varió entre 14.6 y 18.2 m2/ha. Los aclareos de más fuerte intensidad (corta del 60% de los árboles) redujo el área basal en un 48%, disminuyendo de 15,9 a 8,2 m2/ha. Al año 6, cuando los mismos tratamientos se repitieron dos años después, el área basal de los tratamientos varió entre 23 y 26 m2/ha antes del aclareo. Después del aclareo el área basal disminuyó a un rango entre 13,1 y 22,4 m2/ha (el testigo se mantuvo en 26 m2/ha). Se concluye que lo mejor es aclarear al año 4 y remover 40% de los árboles, o bien, aclarear al año 4 y al año 5 y remover 25% de los árboles originales en cada año (Pérez y Kanninen, 2005). 148 6.4. PRÁCTICAS DE VIVERO 6.4.1. Manejo y almacenamiento de semillas Las semillas pueden almacenarse con contenido de humedad del 6 a 7% y temperaturas de 0 ºC; tales condiciones permiten mantener la viabilidad por varios años. Generalmente las semillas ortodoxas presentan algún tipo de latencia (Arriaga et al., 1994). Si se almacenan en sacos que se cuelgan en lugares frescos las semillas germinan mejor, después de dos años (Peña, 1984). 6.4.2. Germinación El tiempo necesario para la germinación de las semillas es de 20 a 30 días (Peña, 1984). 6.4.3. Prácticas de cultivo El sustrato debe tener una consistencia adecuada para mantener la semilla en su sitio, el volumen no debe variar drásticamente con los cambios de humedad, textura media para asegurar un drenaje adecuado y buena capacidad de retención de humedad, fertilidad, libre de sales y materia orgánica no mineralizada. Cuando el sustrato es inerte se recomienda una mezcla (55:35:10) de turba, vermiculita y perlita o agrolita. El deshierbe continuo de los pasillos y al interior de los envases que contienen las plantas evitará problemas de competencia por luz, agua y nutrientes; además, favorecerá condiciones de sanidad. Es importante tener cuidado con el número de plántulas o estacas que se encuentran en los envases, lo más recomendable es mantener solamente una planta o estaca por envase, la más vigorosa, eliminando las restantes (Arriaga et al., 1994). El tiempo total para la producción de la teca es de cinco a ocho meses, obteniéndose plántulas de 1 a 3 cm de diámetro (Peña, 1984). Para la producción de planta a raíz desnuda de teca, se recomienda realizar la siembra de la semilla en canteros o áreas de crecimiento que deben ser de un metro de ancho y de longitud variable. La siembra debe efectuarse de tres a seis meses antes de la fecha de plantación, en surcos con separación de 15 a 20 cm y con una profundidad de 2 a 3 cm. La densidad de siembra que se sugiere es de 20 a 25 plantas por m2. La densidad de siembra alta es recomendable cuando la viabilidad de la semilla es baja, siempre y cuando se obtenga el espaciamiento correcto antes que las plantas compitan entre sí; esto es, cuando alcanza una altura aproximada de 10 cm. La fertilización se realiza con 8 g de urea y 20 g de superfosfato triple/m2 de platabanda, distribuyéndolo al voleo. Cuando las plantas alcanzan 20 cm de altura, deben podarse las raíces para iniciar su endurecimiento y la extracción de las plantas se inicia en la época de plantación con selección de árboles entre 30 y 40 cm de 149 altura y un cm de diámetro en el cuello de la raíz, presentar buen estado sanitario y estar bien lignificadas. El riego se aplica cada dos días desde que las plantas nacen hasta un mes después de desaparecer las hojas cotiledonares, pero en regiones en que existen altas temperaturas puede ser necesario un riego diario. Un mes después de la germinación, los riegos pueden espaciarse a dos semanales y a partir del segundo mes se aplica un riego a la semana o cada ocho a diez días (Díaz, 1999 e). La selección y preparación de la planta en vivero, consiste en elegir las plantas más vigorosas, libres de plagas y enfermedades. La raíz deberá ocupar por lo menos el 50% del volumen total del envase, el diámetro basal del tallo deberá ser alrededor de 0.25 cm, la altura total no mayor a 30 cm y por lo menos una ¼ parte de la longitud total del tallo con tejido leñoso. Se recomienda aplicar un riego a saturación un día antes del transporte de las plantas (Cervantes et al., s/f). Si la siembra de las semillas se realiza directamente en campo, en el desarrollo inicial de la planta se debe eliminar la maleza; en terrenos con pasto, se restringe la aereación y las plantas no se pueden desarrollar (Peña, 1984). Con la finalidad de propagar in vitro a T. grandis, se han realizado estudios y algunos de los resultados se muestran en los Cuadros 24, 25 y 26 (Daquinta et al., 2005). Cuadro 24. Resultados de tratamientos para callogenésis in vitro de Tectona grandis. Tratamiento MS MS + 0.1 mg/L TDZ MS + 0.2 mg/L MS + 0.5 mg/L TDZ MS + 1.0 mg/L TDZ Ms + 2.0 MG/l TDZ ES Ápices Entrenudos Cotiledones 0c 68 b 68 b 76 b 76 b 92 a 0.08 0b 100 a 100 a 100 a 100 a 100 a 0.32 0c 30 a 12 b 13 b 22 b 25 a 0.15 Fuente: Daquinta et al., 2005. Cuadro 25. Resultados de tratamientos para enraizamiento in vitro de Tectona grandis. Tratamiento Número de raíces Longitud raíz 1.0 b 2.0 a 1.8 a 0.15 1.0 c 3.8 a 2.8 b 0.11 Sin polvo 1000 mg/L ANA + 1000 mg/L AIB 2000 mg/L ANA + 2000 mg/L AIB ES Fuente: Daquinta et al., 2005. 150 Cuadro 26. Resultados de tratamientos para establecimiento in vitro de Tectona grandis. Tratamiento MS MS + 0.5 BAP MS + 1.0 BAP MS + 0-5 BAP+ 1-0 GA3 MS + 1.2 BAP + 1.0 GA3 ES Brotación (%) No. De hojas Callo (%) 33 b 100 a 100 a 62.5 ab 33 b 0.15 2.0 b 4.6 a 4.8 a 2.0b 1.3 b 0.13 0.0 b 83 (++) a 83 (+) a 75 (+++) a 66 (++) a 0.16 Fuente: Daquinta et al., 2005. El protocolo de propagación in vitro de árboles de T. grandis L. indica que en la fase de establecimiento (Cuadro 27) la mejor concentración para establecer yemas apicales fue en un medio de cultivo suplementado con 0.5 mg/l de BAP, alcanzó una longitud de brotes de 1.87 cm. En la fase de multiplicación (Cuadro 28) la mejor concentración para obtener un mayor número de brotes fue en un medio de cultivo suplementado con 1.0 mg/l de BAP + 0.5 mg/l de KIN, se obtuvo 1.95 número de brotes por vitroplanta. En la fase de enraizamiento y aclimatización ex vitro (Cuadro 29), la mejor respuesta se presentó en el testigo (sin polvo enraizador), para las variables longitud de raíz y supervivencia, con un promedio de 5.21 cm y 90%, respectivamente. Del 100% de las plantas que sobrevivieron se tuvo un 98.75% de plantas enraizadas (Cruz, 2005). Cuadro 27. Influencia de los medios de cultivo en el establecimiento de yemas terminales de Tectona grandis. Laboratorio de Biotecnología, UTEQ. Quevedo, 2001. Variables Longitud de brotes (cm) Supervivencia (%) MS 1.23 b 78.13 a Tratamientos MS + 0.5 BAP MS + 1.0 BAP 1.87 a 1.71 ab 71.88 a 75.00 a MS +1.5 BAP 1.50 ab 78.13 a Nota: Concentraciones de citoquininas expresadas en miligramos/L. Fuente: Cruz, 2005. Cuadro 28. Evaluación de diferentes niveles de BAP y Kinetina en la multiplicación de brotes de Tectona grandis. Laboratorio de Biotecnología, UTEQ. Quevedo, 2001. Variables Número de brotes Longitud de brotes (cm) Supervivencia (%) MS + 0.5 BAP + 0.25 KIN 1.58 a 2.00 a 81.25 a Tratamientos MS + 1.0 BAP + 0.5 KIN 1.95 a 1.90 a 71.43 a Nota: Concentraciones de citoquininas expresadas en miligramos/L. Fuente: Cruz, 2005. 151 MS +1.5 BAP + 0.75 KIN 1.94 a 1.80 a 78.13 a Cuadro 29. Respuesta del enraizamiento de brotes de Tectona grandis bajo diferentes concentraciones de auxinas. Laboratorio de Biotecnología, UTEQ. Quevedo, 2001. Variables Tratamientos Testigo 500 ANA + 500 AIB Plantas enraizadas (%) 100 a 100 a Número de raíces 2.59 a 2.74 a Longitud de raíz (cm) 5.21 a 4.91 a Supervivencia (%) 90.00 a 63.33 ab Nota: Concentraciones de auxinas expresadas en miligramos/L. Fuente: Cruz, 2005. 1000 ANA + 1000 AIB 1500 ANA + 1500 AIB 100 a 3.06 a 3.02 b 56.67 b 94 a 2.94 a 2.90 b 56.67 b Con la finalidad de establecer la metodología básica para la micropropagación de teca, se utilizaron brotes provenientes de plantas adultas y brotes de estacas enraizadas y mantenidas en condiciones de invernadero. Estas últimas se asperjaron con Agrimicin® + Benomil® (1 g/L de cada uno) dos veces por semana antes de ser utilizadas. Se evaluó la eficiencia del Cloruro de mercurio (HgCl), el Hipoclorito de calcio (CaOCl), y la mezcla de Agrimicin® + Benomil® como desinfectantes. Para el establecimiento in vitro de los brotes provenientes de plantas adultas, se hizo indispensable la desinfección con HgC12 al 0.5%. Cuando los brotes provenían de las estacas mantenidas en condiciones de invernadero, la adicción en la mezcla con Agrimicin® + Benomil® durante 90 minutos, seguida de la utilización de CaOCl resultó en los mejores porcentajes de explantes asépticos. La brotación de las yemas se vio estimulada por la adición de los reguladores de crecimiento al medio de cultivo, siendo el BA (0 a 15 mg/L) el que resultó más eficiente. El grado de eficiencia dependió del regulador del crecimiento utilizado y la dosis, obteniéndose los mejores resultados al utilizar combinaciones de BA y AlA. Para el enraizamiento in vitro, la adición de AIB al medio de cultivo y el cultivo de los brotes en la oscuridad por 48 h, incrementó el enraizamiento aI 83%. Con esta practica se acortó considerablemente el periodo comprendido entre la introducción del material al cultivo in vitro y su plantación definitiva en el campo. Las plantas producidas fueron sembradas en el campo, en un ensayo comparativo con material proveniente de semilla sexual y de estacas enraizadas por métodos tradicionales. Las plantas producidas in vitro muestran buen crecimiento y tallos más erectos, por que estos resultados demuestran la factibilidad de utilizar las técnicas del cultivo in vitro para la propagación clonal masiva de la teca (Abdelnour y Muñoz, 2005). 152 6.5. ESTABLECIMIENTO Y MANEJO DE PLANTACIONES 6.5.1. Preparación del sitio de plantación Dependiendo del tipo de vegetación existente y de la topografía del lugar, la limpia podrá hacerse en forma manual o mecánica. La quema después de la limpia facilita las labores de plantación, controla la competencia y libera nutrientes que son aprovechados por las plantas (INIFAP, 1997 c). Se recomienda un rastreo para deshacer los terrones y emparejar el suelo (Fierros et al, 1999). Si el terreno presenta problemas de malezas será necesario realizar deshierbes manuales o mecánicos, dependiendo de las condiciones del terreno. Si éste presenta pendientes mayores a 12% se recomienda para evitar la erosión del suelo, remover la vegetación solamente en los sitios donde se establecerán las plantas, franjas o alrededor de las cepas (Arriaga et al., 1994). En suelos muy compactos, como lo son la mayoría de los suelos forestales, el subsoleo es una práctica recomendable, debe hacerse antes de que comience el periodo de lluvias (INIFAP, 1997; Fierros et al., 1999 citado por SIRE, 2005). Aplica solamente cuando se presentan capas endurecidas a escasa profundidad (≤ 15 cm) y en terrenos con pendientes menores a 10% (Arriaga et al., 1994). 6.5.2. Plantación y espaciamiento La cepa común ha sido un método ampliamente usado y las dimensiones pueden ser de 30 x 30 x 30 cm ó 40 x 40 x 40 cm, aunque el tamaño dependerá de las dimensiones del envase que se haya utilizado para la producción de las plantas, por lo que deberán tener de 3 a 5 unidades de volumen adicional al tamaño del cepellón de la planta; no obstante, dependiendo de las condiciones del terreno las dimensiones y tipo de cepas podrán variar, esto en función de las estrategias de conservación de suelo que se deseen emplear, de las características del suelo y de las condiciones climáticas (INIFAP, 1997 c; Arriaga et al., 1994). La plantación debe realizarse durante la época de lluvias y puede ser realizada manualmente, mecanizada o una combinación de ambas. Se recomienda hacer las cepas sobre curvas a nivel en un arreglo a tresbolillo. El espaciamiento óptimo para una plantación dependerá del potencial productivo del sitio; si el producto final será madera aserrada o chapa, lo más recomendable son espaciamientos de 2 x 3 m (1,667 plantas por ha) o 3 x 3 m (1,111 plantas por ha) (INIFAP, 1997 c; Fierros et al., 1999). Para el transporte de las plantas se deben utilizar vehículos cerrados para protegerlas del viento e insolación y con ello evitar su deshidratación. Para optimizar la capacidad de los vehículos y disminuir los costos de transporte, es conveniente construir estructuras sobre la plataforma de carga con la finalidad de acomodar dos o más pisos (SIRE, 2005 c). Con la finalidad de evitar que la planta sufra el menor 153 estrés posible, idealmente el tiempo de transporte no debe exceder a 3 horas (Arriaga et al., 1994). La replantación se realiza manualmente, tiene un costo elevado y sólo se justifica cuando la sobrevivencia de la plantación es menor de 80%, debiendo realizarse en un plazo máximo de 30 días después de la plantación (INIFAP, 1997 c). 6.5.3. Cultivo de las plantaciones T. grandis en su fase inicial de crecimiento es altamente sensible a la competencia de maleza, por lo que esta operación es indispensable, hasta la etapa en la que la población alcanza el crecimiento suficiente y que dominan a la vegetación espontánea, eliminando su competencia. Es recomendable que se realicen limpias y cultivo al suelo por lo menos durante los dos primeros años, después del segundo año se hace necesario dar una limpieza anual hasta los cuatro años en que se libera la plantación (INIFAP, 1997 c; Fierros et al., 1999). La época de fertilización deberá ser de 15 a 30 días después de la plantación, las dosis más comunes y con resultados satisfactorios varían de 100 a 150 g/planta de NPK; las formulaciones más utilizadas han sido las siguientes: 17-17-17, 10-34-6, 1028-6; 5-30-10; 10-30-10 y 5-30-6 (INIFAP, 1997 c; Fierros et al., 1999). Más de la mitad de los suelos de la Zona Norte de Costa Rica (San Carlos y Los Chiles) pertenecen al orden Ultisoles. Las deficiencias nutricionales de esos suelos se presentan en las bases (Ca, K y Mg) y en Zn y Mn y óxidos de Fe y Al. El manejo de estos suelos incluye un encalado prioritario, preferiblemente que contemple tanto el suplemento de Ca como Mg, posteriormente una fertilización generalizada (NPK y otros), abundante y fraccionada (Vásquez, 1991). Se debe considerar la relación catiónica cada vez que se aplica cal al suelo, la cual debe ser acompañada por una fertilización con K. La fórmula 18-5-15-6-0,2 (N-P-KMg-B), fraccionada, es importante para suplir nitrógeno al suelo en esa región, que se pierde por las fuertes precipitaciones, en una dosis de 250 kg/ha. La teca es una especie exigente de otros factores como profundidad efectiva, drenaje y suelos neutros (Rodríguez y Paniagua, 2005). Las podas aplicadas con el objetivo de producir madera para aserrío o chapa sólo deben aplicarse en los árboles que presenten un ritmo grande de crecimiento en diámetro o que con los aclareos, mantenga condiciones de crecimiento acelerado. Esto significa que las podas deben ser realizadas en árboles jóvenes. En ocasiones se poda un gran número de árboles antes del primer aclareo hasta una altura que pueda alcanzarse desde el suelo. La poda debe iniciarse alrededor de los 12 a 18 meses de edad, cuando las ramas más bajas comienzan a morir y la población comienza a cerrar el dosel de copas (Díaz, 1999 f). 154 En los aclareos se remueven los árboles excedentes para que se pueda concentrar el potencial productivo de la población en un número de árboles seleccionados. Los aclareos sistemáticos son aplicados en poblaciones altamente uniformes, donde los árboles aún no se diferencian en clases de copas, lo que implica poblaciones jóvenes no aclaradas anteriormente y los aclareos selectivos implican la selección de los individuos, según ciertas características previamente establecidas, los árboles removidos son siempre los inferiores, dominados o defectuosos (Díaz, 1999 f). Es posible realizar aclareos a los 10, 15 y 20 años de edad de la plantación para obtener productos de cortas dimensiones para molduras y torneados (Díaz, 1999 f; Fierros et al., 1999 citados por SIRE, 2005). Se sabe también que con aclareos a los 6, 7 y 8 años, se obtiene un volumen de madera sin valor comercial, pero cuando los árboles tienen 12 años en adelante generan los primeros ingresos (http://www.bosquestropicales.com/html/Espanol/ubicacion.html). Los resultados de manejo de plantaciones de teca en Venezuela, usando diagramas de manejo de densidad (DMD), en los cuales se representan gráficamente las relaciones temporales entre la densidad del rodal y las dimensiones de los árboles, la altura mayor del rodal y el volumen medio del rodal, indican cuatro escenarios o regímenes para el manejo de las plantaciones de teca en Venezuela. Escenario 1: Régimen con un solo aclareo intensivo para la producción de madera aserrada (diámetro cuadrático (dq) = 40 cm) para muebles, carpintería y machimbrado (dq = 20 cm). Se desea determinar cual sería la densidad inicial de plantación, turno e intensidad de aclareos. Escenario 2: Régimen con aclareos frecuentes para la obtención de productos antes del turno. Se desea determinar cual sería la densidad inicial de plantación, turno e intensidad de aclareos, si se requiere madera para aserrío de alta calidad (dq = 45 cm) al final del turno y madera para aserrío de pequeñas dimensiones (dq = 35 cm), machimbrado y carpintería (dq = 20 cm) y varas (dq = 15 cm). Escenario 3: Régimen con espaciamiento amplio (4 x 4 m o 6 x 2.5 m) y un solo aclareo. Este régimen permite la combinación con cultivos agrícolas durante los primeros años de la plantación. Se desea estimar el turno para la producción de madera para machimbrado (dq =20 cm) y madera para aserrío (dq =45 cm). Escenario 4: Régimen estándar con plantación de teca a 3 x 3 m. Los dos primeros escenarios permiten ilustrar el uso de los DMD’s para planificar el manejo en función de productos deseados antes de haber establecido la plantación. Los dos últimos escenarios ejemplifican el uso de los diagramas cuando ya se ha predeterminado el espaciamiento inicial, bien sea por tradición (3 x 3 m) ó por la necesidad de realizar cultivos agrícolas para pagar costos de establecimiento. 155 Para el escenario 1 primero se determinó que el dq=40 cm es alcanzado con una densidad de 300 árboles/ha, altura mayor de 27 m y un volumen de 450 m 3/ha. Un dq=20 cm puede obtenerse con una densidad de aproximadamente 1,000 árboles/ha, es decir, un único aclareo puede realizarse extrayendo 700 árboles/ha a los 7 años. El volumen en pie sería de aproximadamente 250 m 3/ha y el volumen extraído de 150 m3/ha. Asumiendo una mortalidad del 10%, la densidad inicial sería de alrededor de 1,110 árboles/ha equivalente a un espaciamiento de 3 x 3 m. El rendimiento sería alrededor de 600 m3/ha. En escenario 2 se tiene un turno de 37 años (dq = 45 cm) con un rendimiento de 450 m3/ha. Los productos de los aclareos se obtendrían a los 24 años (35 cm), 8 años (20 cm) y 5 años (15 cm) con volúmenes de 150, 125 y 100 m3/ha, respectivamente. El espaciamiento inicial debería ser de alrededor de 1,600 árboles/ha y el rendimiento total de 855 m3/ha. De acuerdo al DMD, en el escenario 3 se podría aplicar un único aclareo a los 10 años de edad con un dq = 25 cm y luego la corta final a los 30 años con un dq de 45 cm. El volumen total producido sería de aproximadamente 700 m 3/ha. En el escenario 4 se aplica un aclareo a los 6.5 años de edad y otro alrededor de los 14 años. El rendimiento total es alto (750 m3/ha), pero la proporción del volumen en aclareo es relativamente bajo (250 m3/ha). Se concluye que los regímenes con espaciamientos relativamente estrechos y aclareos frecuentes, parecen ser los más promisorios para el manejo de plantaciones de teca, aunque espaciamientos más amplios parecen ser atractivos si se desea madera de mayores dimensiones en turnos más reducidos (Jerez et al., 2005). En plantaciones experimentales ubicadas en el Valle del Sacta en Bolivia, se realizaron podas de formación a los 2 y 6 años después del establecimiento y se realizaron chaponeos anuales de la vegetación arbustiva (Rivero, 2004). En ensayos de aclareos en Cóbano, Puntarenas, Costa Rica, en plantaciones de cuatro y cinco años de edad, se establecieron 12 parcelas permanentes con la finalidad de producir material para construcción rústica y postes de cerca. En el sitio Cóbano 1, los primeros aclareos se realizaron en forma muy leve e irregular, en aclareos realizados posteriormente se cortaron árboles dominantes e intermedios; el primer raleo se ejecutó de forma escalonada, posteriormente se realizaron algunas cortas y en otros se hizo un aprovechamiento. En el Cóbano 2, aunque los aclareos no se realizaron oportunamente, estos favorecieron el desarrollo de los árboles dominantes. En Cóbano 3, se encontró una densidad poco usual (2,430 árboles/ha), que se bajó a 1,900 árboles/ha a los seis años, pero se mantuvo con una alta densidad por mucho tiempo; a los 17 años presentó una densidad de 1,100 árboles/ha. En estos sitios las cortas se realizaron a los 5, 12 y 19 años y el área basal varió desde 15 m2/ha hasta 32.5 m2/ha a la edad de 12 años, a los 20 años el área basal osciló entre 20 y 30 m2/ha. 156 Se recomienda que si el objetivo de la plantación es la producción de madera para aserrío, aplicar aclareos entre los cuatro y seis años, dependiendo de la densidad inicial. Si el primer aclareo se realiza antes de que los árboles disminuyan su proporción de copa viva, se asegura un buen crecimiento hasta el próximo tratamiento y es posible prolongar por varios años el acelerado crecimiento que presenta las plantaciones de teca en las primeras etapas. Asimismo, los aclareos leves y frecuentes aseguran una buena calidad de la madera, al permitir un crecimiento uniforme de los anillos. En general, se acepta un primer aclareo entre los tres y cuatro años, dependiendo de la densidad inicial y de la calidad de sitio, un segundo aclareo entre los seis y ocho años, el tercero entre los 12 y 15 años, que deje una densidad de 200 y 250 árboles/ha para la cosecha final entre los 20 y 25 años, que permitan extraer árboles entre 40 y 50 cm de diámetro (Cháves y Fonseca, 2005). 6.5.4. Crecimiento y rendimiento volumétrico Se menciona que en plantaciones de México, el crecimiento promedio en altura fue de 11 m y en diámetro de 14 cm a los 4 años (Monroy, 1998) y que la cantidad de madera que se obtendrá en la cosecha final (25 años) sería hasta de 350 m3/ha, según la calidad de sitio (Díaz, 1999 f). Una proyección del diámetro de fuste a dos alturas de poda y en cuatro turnos, se presenta para ejemplificar y analizar esta variable, considerando que el diámetro a la altura de 7 m deberá alcanzar por lo menos 21.9 cm al final de la rotación y según las proyecciones del Cuadro 30, este diámetro es posible alcanzarlo en sitios de calidad alta a los 15 años o más, mientras que en sitios de calidad media en 20 años o más. Cuadro 30. Proyecciones del diámetro de fuste a diferentes alturas para Tectona grandis en sitios de calidad media y alta, para diferentes turnos. Calidad de sitio Variable Turno de rotación (Años) 20 25 15 Alta Media H DAP D-7 m D-4 m H DAP D-7 m D-4 m 24.5 33.8 24.7 29.7 20.7 27.0 18.0 22.9 28.1 40.0 30.9 35.9 23.6 32.0 22.9 27.9 Donde: 157 30.6 44.4 35.3 40.3 25.6 35.6 26.5 31.5 30 36.1 54.0 44.9 49.9 29.9 43.2 34.1 39.1 H = Altura total (m) DAP = Diámetro a la altura del pecho (cm) D-7 m = Diámetro del fuste (cm) a la altura de 7 m D-4 m = Diámetro del fuste (cm) a la altura de 4 m En Costa Rica se evaluaron todos los modelos desarrollados que estiman el volumen de árboles de teca en plantaciones y con los resultados del análisis se seleccionaron las ecuaciones: Vtcc = 0.0124845 – 0.00345137 (dap) + 0.00045169 (dap2) + 0.00000994466 (dap3) Vtsc = 0.0170863 + 0.00043843 (dap2) + 0.0000165744 (dap2H) – 0.00575228 (H) Vcomcc = 0.00854761 + 0.000293333 (dap2) + 0.0000200591 (dap2H) – 0.00340548 (H) Vcomsc = 0.000482297 (dap2) – 0.000421815 (dap2H) + 0.000729311 (dapH2) – 0.00163111 (H2) Donde: Vtcc = Volumen total con corteza Vtsc = Volumen total sin corteza Vcomcc = Volumen comercial con corteza Vcomsc = Volumen comercial sin corteza Se concluye que el ajuste de las ecuaciones generadas por otros autores, fueron conformadas en su mayor parte por árboles provenientes de plantaciones muy jóvenes con diámetros menores de 40 cm (Gómez y Mora, 2005). Los resultados de investigaciones usando diagramas de manejo de densidad (DMD), para proyectar la densidad, el diámetro cuadrático y el volumen a lo largo del turno se muestran en el Cuadro 31. Se proponen escenarios o regímenes para el manejo de las plantaciones de teca en Venezuela (Cuadro 32). Regímenes con espaciamientos relativamente estrechos y aclareos frecuentes parecen ser los más promisorios para el manejo de plantaciones de Teca, aunque espaciamientos más amplios parecen ser atractivos si se desea madera de mayores dimensiones en turnos más reducidos (Jerez et al., 2005). Cuadro 31. Valores mínimos y máximos de densidad, diámetro cuadrático, altura promedio y volumen con corteza para parcelas establecidas en rodales de teca de los Llanos Occidentales de Venezuela. Edad (años) 0-5 5-10 10-15 15-20 20-25 25-30 No. De parcelas 28 110 175 328 422 148 Densidad (árboles/ha) 500-2125 483-2125 236-1758 120-1608 120-1842 120-1483 Dq (cm) 5.8-15 11-24 14-28 11-42 13-52 17-37 Fuente: Jerez et al., 2005 158 Alturas (m) 7.0-14.4 11-20 14-24 5-28 5-29 6-29 Volumen 3 (m /ha) 18.6-158.3 52-302 47-417 50-547 50-571 47-501 Cuadro 32. Escenarios de planificación desde el establecimiento hasta el aprovechamiento final. Escenarios Densidad (árboles/ha) En pie Eliminado Mortalidad (%) Hm (m) Edad (años) Dq (cm) antes Volumen 3 (m /ha) extraído después Régimen espaciamiento amplio Densidad inicial Densidad fase establecimiento Raleo 1 (moderado por lo bajo) Aprovechamiento final Volumen total 3 extraído (m /ha) 625 594 594 5 0 294 300 270 0 20 10 25 350 200 150 10 27 30 45 500 500 0 270 700 Densidad inicial Densidad fase establecimiento Raleo 1 (fuerte por lo bajo) Raleo 2 (por lo bajo) Aprovechamiento final Volumen total 3 extraído (m /ha) Régimen estándar 10 10 1110 1000 900 400 500 475 300 175 300 16 6.5 20 250 100 150 23 27 14 30 30 40 375 500 150 500 225 0 5 750 Fuente: Jerez et al., 2005 En las Figuras 7 a 9, se muestra el comportamiento de árboles de T. grandis en cuanto a número de árboles por hectárea, DAP y altura (http://www.bosquestropicales.com/ html/Espanol/ubicacion.html). Figura 7. Dinámica del número de árboles de T. grandis a través del tiempo. Fuente: http://www.bosquestropicales.com/html/Espanol/ubicacion.html 159 Figura 8. Dinámica del DAP de árboles de T. grandis a través del tiempo. Fuente: http://www.bosquestropicales.com/ html/Espanol/ubicacion.html Figura 9. Dinámica en altura de árboles de T. grandis a través del tiempo. Fuente: http://www.bosquestropicales.com/ html/Espanol/ubicacion.html 160 Con condiciones adecuadas de terrenos, aplicación de tecnologías, empleo de materiales adaptados al lugar y prácticas silvícolas, podría obtenerse incremento de volumen de madera de 15 a 25 m 3/ha/año y en condiciones no adecuadas se han logrado rendimientos de 10 a 15 m3/ha/año. Los niveles más altos de rendimiento deben tomarse con precaución, ya que se han generado proyectos de inversión que contemplan rendimientos de hasta 40 m 3 de madera/ha/año, lo que induce a obtener financieramente tasas internas de retorno excesivamente elevadas. En la Figura 10 se aprecian las curvas de volumen de madera en plantaciones de teca (http://www.bosquestropicales.com/html/Espanol/ubicacion.html). Figura 10. Incremento anual de volumen de madera de teca. Fuente: http://www.bosquestropicales.com/html/Espanol/ubicacion.html 6.5.5. Plantaciones agrosilvopastoriles En el estudio ecológico-forestal de la Colonia Agrícola-Ganadera ―Progreso‖, Municipio de Matías Romero, Oaxaca, se propone agregar la ganadería mediante la siembra de pastos, una vez establecida la plantación forestal con cedro rojo (C. mexicana), roble (T. rosea) y teca (T. grandis). Para sistemas agroforestales en terrenos con pendientes del 5 al 15%, se recomienda establecer cultivos anuales entre curvas de nivel y cada 50 m plantar franjas de árboles forestales con espaciamiento de 3 m y 7 m para frutales, con una distancia entre planta y planta de 2 m (a tresbolillo), aunque la distancia entre frutales deberá ser variable, según la especie. Entre las franjas árboles sembrar especies de cobertera con fines forrajeros y de protección del suelo. En pendientes superiores al 15%, se recomienda establecer bosques masivos considerando una distancia entre hileras de 4 m y una distancia entre planta y planta de 2 m (a tresbolillo), además, la siembra intercalada de pastos y especies de leguminosas. Para la siembra de los pastos deberá dejarse pasar cierto periodo para que se establezcan los árboles y los pastos, a fin de que se pueda introducir el ganado (Chavelas et al., 1982). 161 6.6. MEJORAMIENTO GENÉTICO En Costa Rica los avances de mejoramiento genético, indican que a los 4 años de edad se tienen ganancias relativamente bajas (11 y 22%). Los valores de heredabilidad para volumen comercial/árbol son de 0.09, mientras que de 0.21 para calidad. En el índice de calidad el diferencial de selección supera en un 39% a los testigos. Para el año 2000 se tenían seleccionados 45 árboles plus en plantaciones establecidas en la península de Nicoya (Montero, 2000) y los primeros ensayos de progenie se establecieron con 28 familias (Murillo y Badilla, 2005). En un programa de mejoramiento genético, se registraron diferencias altamente significativas en el incremento en altura e índice de calidad entre las familias evaluadas. En cuanto al incremento en altura, el promedio de las mejores 50% de las familias, superaron en 21% al material testigo en los primeros 9 meses de edad. En cuanto a calidad, las mismas familias superan en 14.5% al material comercial. No debe olvidarse que estos son resultados de una evaluación a los 9 meses de edad, y que la evaluación final y válida deberá realizarse hasta la mitad de la rotación (9-10 años de edad). Las ganancias genéticas esperadas a los 4 años de edad muestran resultados relativamente bajos (11.5% en volumen comercial y 21.1% en el índice de calidad), tal y como lo predicen sus estimados de heredabilidad. Si se utiliza el mejor 50% de las familias, las diferencias esperadas son del orden del 39% en calidad y del 24% en volumen comercial. La propagación masiva del material seleccionado permite establecer parcelas monoclonales perfectamente idénticas, con un rendimiento superior al que se alcanzaría si se utiliza la semilla (progenie) de los mismos árboles seleccionados. La uniformidad de la plantación forestal implica ya una ganancia en cuanto al manejo (aclareos sistemáticos) y aprovechamiento (fustes casi idénticos en dimensiones y rectitud) (Murillo y Badilla, 2005). A continuación se menciona el protocolo de clonación de teca, con la finalidad de su mejoramiento genético: 1. Selección del árbol plus En esta etapa se elegirá fenotípicamente un número alto de árboles plus en plantaciones de más de 5 años de edad. Los árboles a seleccionar deben ser individuos superiores a los mejores 4-5 vecinos en un radio de 15-20 m a la redonda. 162 2. Propagación del árbol plus Una opción empleada ha sido la de cortar la rama más baja posible, cortarla en segmentos de 75 cm de largo y sembrarlas en camas de arena dentro de un invernadero. Esta técnica logra la producción abundante de brotes en las ramas y el inicio acelerado de la clonación. Sin embargo, es importante verificar si estos brotes han logrado adquirir la juvenilidad fisiológica y un crecimiento con un único eje dominante. Las colectas de rebrotes deben realizarse de manera ordenada, sistemática y en grupos de 20-30 clones cada vez. Debe cortarse con una podadora de mano únicamente los rebrotes vigorosos y sanos, de 20 cm de largo, los cuales se envuelven en papel periódico húmedo y se amarran. El material es depositado cuidadosamente en una hielera para mantenerlo fresco por unas horas, mientras se llega al invernadero y se inicie su preparación para la propagación. 3. Invernadero y enraizamiento de las estacas Para lograr un adecuado enraizamiento de las estacas en el invernadero, deben establecerse líneas de producción o camas. Estas camas no deben tener más de 11.20 m de ancho para que el riego sea uniforme. En cada línea de producción deberá instalarse una línea de riego automático de aspersión nebulizada, con aspersores cada 1-1.50 m y un microtúnel con plástico transparente, procurando forrar todas paredes y piso de la cama. Este microtúnel deberá tener una altura no mayor a los 40 cm para lograr una alta humedad relativa y temperatura en el ambiente de enraizamiento. 3.1. Preparación de las estacas En el invernadero las estacas se cortan hasta dejarlas de un largo de unos 6-8 cm, procurando que incluyan al menos 2 nudos y eliminando el ápice o entrenudo terminal (últimos 1-2 cm). Por lo general, no se recomienda propagar las estacas muy lignificadas o cercanas a la base del brote, ya que presentan mayor dificultad para enraizar. A las estacas se les poda hasta ¼ de la lámina foliar y se mantienen en un recipiente con una solución desinfectante hasta su siembra. Las hojas deben ser eliminadas completamente, excepto las últimas dos, que se recortan hasta dejarlas aproximadamente a 1/3 de su lámina foliar. En T. grandis se han obtenido las mejores tasas de enraizamiento al utilizar el primer brote o cogollo que se produce de estacas recién enraizadas dentro del invernadero (a las 4 semanas). Este primer brote es mucho más delgado que el brote proveniente del campo, sano y suculento, por lo que es ideal para su propagación vegetativa. 163 Mientras se están cortando las estacas, se recomienda que permanezcan en una solución basada en ajo (10 cc/L) durante 5 segundos. Las estacas de teca han manifestado una alta susceptibilidad al ataque de hongos, por lo tanto, las medidas de prevención fitosanitarias son definitivamente necesarias e incluyen en muchos casos, la desinfección completa con fungicidas de amplio espectro. 3.2. El sustrato para el enraizamiento Si no se tiene un sistema de riego automático nebulizado, se deberá utilizar un sustrato compuesto por tierra y arena (50:50), tierra pura y los pellets. Las bandejas plásticas de 98 cavidades funcionan bien con arena, pero aproximadamente a las 3 semanas debe transplantarse las estacas, ya que el sistema radical podrá sufrir daños si se transplanta posteriormente. El pellet ha dado buenos resultados en el enraizamiento directo de estacas de T. grandis. El día anterior a la siembra los pellets pueden ser preparados con el fin de lograr una mejor consistencia y tamaño. Se sumergen en agua durante unos 2-5 minutos y luego se les continúa aplicando agua con regadera. 3.3. El riego en el invernadero El riego en el invernadero debe ser preferiblemente nebulizado y automático. Si se trabaja con bandejas plásticas y un sustrato de tierra: arena (1:1), un programa de riego adecuado debe mojar unas 2-3 veces al día, con una duración de 30 segundos a un minuto cada vez. En días muy soleados, calurosos o ventosos, el riego deberá aumentar su frecuencia (máximo 4-5 veces al día). En los días lluviosos y con una alta humedad relativa, el riego debe disminuir su frecuencia a una vez cada uno o dos días. Con esto se busca eliminar un exceso de humedad en el medio de enraizamiento. En caso de no contarse con un sistema de riego se aplica en forma manual. Si se realiza el enraizamiento en pellets, entonces el riego debe disminuir considerablemente, hasta uno por día con una duración de 30 segundos a un minuto. Se ha observado en la Zona Norte de Costa Rica, que durante períodos de mal tiempo con alta pluviosidad y humedad relativa, los pellets pueden inclusive mojarse cada 2-3 días. Mientras que en días muy soleados y calurosos deben mojarse hasta 3 veces. 3.4. Uso del enraizador y siembra de las estacas Las estacas se sacan de la solución de desinfección y se dejan escurrir para eliminar el exceso de agua. Se prepara entonces un recipiente con el enraizador que puede ser del producto comercial ó 10,000 ppm de AIB (ácido indol-butírico) y se introduce la base de la estaca hasta lograr que el enraizador se adhiera. La estaca se sacude 164 ligeramente para eliminar el exceso de enraizador y se siembra directamente en el hoyo hecho en el pellet o la bandeja. Una vez sembradas todas las estacas se deben mojar ligeramente con el sistema de riego que se esté utilizando. 3.5. Programación de la producción El sistema de enraizamiento requiere de aproximadamente 4-5 semanas dentro del microtúnel y de 1-2 semanas fuera del invernadero para su aclimatación. Al cabo de 3 semanas es posible identificar claramente el material que sobrevivirá. Por lo general aparece primero la brotación en la estaquilla (3-4 semanas). En algunos casos, la aparición de la raíz ocurre hasta varias semanas después retrasando el proceso. El uso de un fertilizante foliar alto en fósforo se recomienda para fomentar la aparición de raíces. Para esto es necesario que la estaca haya iniciado ya la brotación. Debe recordarse que el pellet es un producto/medio de cultivo de la estaca. No es capaz de sustentar las necesidades nutricionales de la misma, por lo tanto, es necesario iniciar con fertilizaciones foliares semanales a partir de la tercer semana en el invernadero o una vez que se observe la brotación de las estacas. 3.6. Efecto de la época del año Se ha observado que por lo general durante la época seca no se logra alcanzar una tasa de enraizamiento satisfactoria, especialmente en especies caducifolias como la teca, que al parecer entran en un período de latencia natural que disminuye de manera importante todo su metabolismo. Durante esta época, es preferible darles a las plantas un período de descanso y reposición durante la parte del año en que no estarán sometidas a una intensa producción vegetativa (Murillo y Badilla, 2005). 6.7. PROPIEDADES Y USOS 6.7.1. Propiedades físico-mecánicas de la madera Las propiedades físicas y mecánicas de la madera de T. grandis se determinaron en plantaciones de 8, 17 y 28 años (Cuadros 33, 34 y 35); los resultados se mencionan a continuación: Características generales: En condición verde el duramen es de color pardo claro y en condición seca es pardo rojizo grisáceo; el grano es medianamente entrecruzado en bandas angostas; la textura es de mediana a ligeramente cerosa y el lustre es regular. La figura presenta arcos superpuestos, con alguna frecuencia muestra bandas oscuras. El corte presenta bandas angostas verticales claras y oscuras alternadas debido al grano entrecruzado. Posee un aroma fuerte y no tiene sabor característico. 165 Descripción macroscópica: La madera es de porosidad circular o semicircular y los poros son moderadamente pequeños. En el leño temprano son visibles a simple vista formando hileras regulares e irregulares. En su mayoría los poros son solitarios, de forma ovada y en ocasiones redonda. Se presentan poros múltiples radiales en grupos de 2 a 3. Hay excesiva cantidad de poros, en promedio 220/100 mm 2 y puede observarse tílides en las paredes delgadas de algunos poros; éstas son de color blanco, pardo y amarillo. El parénquima se observa a simple vista, en bandas terminales y del tipo paratraqueal vasicéntrico, de color más claro que las fibras. Los radios son medianos, se observan a simple vista y son relativamente escasos; en promedio se encuentran 25 en 5 mm lineales. Descripción microscópica: Los poros tienen un diámetro tangencial promedio de 210 µm en un rango de 190 m 300 µm. La longitud de los elementos vasculares es de 308 µm en un rango de 209 a 418 µm. Las placas perforadas son simples y muy inclinadas; el punteado intervascular es alterno y las punteaduras son de forma ovalada y con aperturas extendidas. El parénquima es paratraqueal escaso de tipo vasicéntrico y presenta de 1 a 2 células de ancho. Los radios son uniseriados con una altura promedio de 6 células y multiseriados con un promedio de 2, 3 y 4 células de ancho por 40 células de alto. Hay radios homogéneos con células rectangulares dispuestas verticalmente. Las fibras son fusiformes, ligeramente estratificadas con punteaduras simples escasas. La longitud promedio de las fibras es 1,550 µm con un mínimo de 955 y un máximo de 2,240 µm. El diámetro tangencial promedio es de 25 µm con un mínimo de 17.8 y un máximo de 31.1 µm. El diámetro promedio del lumen es de 16 µm en un rango de 11.1 a 22.2 µm. El espesor promedio de la pared es de 4,2 µm con un mínimo de 2,2 y un máximo de 6.7 µm. La relación longitud y diámetro tangencial es 64. Se observa gomas de color pardo amarillento en las fibras, en el parénquima longitudinal y en los radios. Propiedades de la madera: Esta especie se clasifica como muy pesada, con un peso específico básico promedio de 0.61. La velocidad de secado es moderadamente rápida, presenta pocos y leves defectos durante este período. Es fácil de trabajar y el duramen es muy difícil de preservar no así la albura. Esta madera es reconocida por su alta resistencia al ataque de organismos xilófagos. Sobre los resultados presentados se tiene que el peso específico básico aumenta con la edad de los árboles: 0.61 para 28 años, 0.58 para 17 años y 0.50 promedio para 8 años. Asimismo, se nota un aumento en la relación de contracciones (radial/tangencial) al aumentar la edad de los árboles. Entre mayor sea la relación de contracciones, mayores problemas de torceduras y grietas se van a presentar en el proceso de secado, por lo que se deben de esperar mayores problemas en la madera proveniente de árboles de mayor edad. La contracción volumétrica presentada en los diferentes estudios es similar. 166 En las propiedades mecánicas se nota un aumento importante de las capacidades mecánicas con la edad, en lo que respecta a los resultados de flexión y compresión paralela, dos de las características más importantes para el diseño estructural. Mientras que, en el caso de la compresión perpendicular, del esfuerzo cortante y de la dureza, los valores son muy similares para las maderas de 17 y 28 años y un poco mayores que para las de 8 años. Para el caso de la compresión perpendicular, del esfuerzo cortante y de la dureza, los valores son muy similares para la madera de 28 y 17 años y un poco mayores que los de 8 años. Cuadro 33. Propiedades físicas de la madera de Tectona grandis de 8 años producida con semillas de diferentes procedencias. Característica Costa rica Tailandia Tanzania Limón Peso específico básico Contracción radial (verde a seco al aire) (%) Contracción radial (verde a seco al horno) (%) Contracción tangencial (verde a seco al aire) (%) Contracción tangencial (verde a seco al horno) (%) Razón de contracciones (rad/tan) (v.a sa) Razón de contracciones (rad/tan) (v.a sh) Contracción volumétrica (verde a seco al aire) (%) Contracción volumétrica (verde a seco al horno) (%) Humedad verde (%) Humedad seca al aire (%) Fuente: Govaere et al., 2005. 0.50 1.66 0.54 2.09 0.50 2.15 0.46 1.50 3.10 3.27 3.43 2.91 2.14 2.74 3.39 2.29 4.29 4.75 5.49 4.50 1/1,3 1/1,31 1/1,58 1/1,53 1/1.3 1/1.42 1/1.60 1/1.54 2.66 2.84 2.52 3.60 6.45 6.81 7.09 7.95 99.8 11.0 95.8 11.1 100.7 12.7 126.5 11.6 167 Cuadro 34. Propiedades mecánicas de Tectona grandis de 28 y 17 años. Localidad Característica Flexión estática 2 Esfuerzo límite proporcional (kg/cm ) 2 Módulo de rotura (kg/cm ) Módulo de elasticidad Trabajo al límite proporcional Trabajo a carga máxima Dureza Extremos (kg) Lados (kg) Compresión paralela 2 Esfuerzo límite proporcional (kg/cm ) 2 Esfuerzo máximo (kg/cm ) 2 Módulo de elasticidad (kg/cm ) 2 Cortante paralelo máximo (kg/cm ) Compresión perpendicular 2 Límite proporcional (kg/cm ) Fuente: Govaere et al., 2005. Quepos Verde Seco al aire Abangares Verde Seco al aire 531 928 141000 1.1 8.0 758 1190 151000 2.2 10.4 435 767 99600 0.95 7.2 587 991 112000 1.5 7.9 534 630 515 557 587 600 543 661 291 450 192000 111 432 552 177000 121 346 492 102 123 78 85 98 Cuadro 35. Propiedades mecánicas de la madera de Tectona grandis de 8 años. Característica 2 Esfuerzo cortante máximo en la cara tangencial (kg/cm ) 2 Esfuerzo cortante máximo en la cara radial (kg/cm ) Dureza lados (kg) Dureza extremos (kg) 2 Compresión paralela, esfuerzo máximo (kg/cm ) Fuente: Govaere et al., 2005. Costa rica 92 73 463 516 274 Tanzania 93 80 505 512 246 Tailandia 88 60 568 568 276 La madera de T. grandis es conocida por su resistencia natural a los agentes degradantes naturales (Cuadros 36 al 39) como lo son la temperatura y humedad, insectos, moluscos, otros organismos marinos y hongos. De los resultados obtenidos, se pueden resaltar que la albura presenta una resistencia mucho menor que el duramen al ataque de los hongos y que la madera de 10 años tiene mucha más resistencia que la de 6 años, ya sea en la albura como en el duramen. En el caso del duramen de 10 años, se presentó muy poca pérdida de peso y de resistencia a la compresión, por lo que se puede decir que es muy resistente ante el ataque de hongos (Monroy, 1998 y Govaere et al., 2005). La durabilidad natural de la albura ante el ataque de termitas de la especie Cryptotermes brevis es moderada mientras que el duramen es muy resistente. El duramen de Teca de más de diez años es resistente al ataque del hongo Rigidoporus sp., no así la albura y el duramen de menor edad; T. grandis es bastante resistente al ataque de organismos marinos cuando se compara con otras especies (Govaere et al., 2005). 168 Cuadro 36. Comparación de la resistencia natural de la madera de Tectona grandis ante el ataque de organismos marinos. Resistencia Mucho más resistentes Más resistentes Igualmente resistentes Un poco menos resistentes Menos resistentes Mucho menos resistentes Nombre común Pino Pochote Pilón Laurel Ciprés Corteza Níspero chicle Guapinol Surá Cedro amargo Amarillón Cocobolo Nazareno Almendro Cistóbal Cenízaro Caobilla Caoba Fruta dorada Nombre científico Pinus oocarpa Bombacopsis quinatum Hieronyma alchorneoides Cordia alliodora Cupressus lusitanica Tabebuia chrysantha Manilkara spectabilis Hymenaea courbaril Terminalia lucida Cedrela mexicana Terminalia amazonica Vatairea lundellii Peltogyne purpurea Dypteryx panamensis Platymiscium polystachyum Pithecelobium saman Carapa sp Swietenia macrophylla Virola koschnyi Fuente: Govaere et al, 2005. Cuadro 37. Comparación de la resistencia natural de la madera de Tectona grandis ante el ataque de termitas. Más resistentes Almendro (Dipterys panamensis) Cedro macho (Carapa guianensis) Cristóbal (Platymiscium polystachyum) Sura (Terminalia lucida) Cocobolo (Vatairea lundelli) Menos resistentes Roble encino (Quercus costaricensis) Laurel (Cordia alliodora) Balsa (Ochroma pyramidale) Fuente: Govaere et al., 2005. Cuadro 38. Pérdida de peso en madera de Tectona grandis por degradación por hongos. Muestra Albura 6 años Albura 10 años Duramen 6 años Duramen 10 años Pérdida de peso debido a degradación por hongos (%) 6.7 4.1 5.1 1.0 Fuente: Govaere et al., 2005. 169 Cuadro 39. Comparación de la resistencia natural de la madera de Tectona grandis ante diferentes tipos de ataque. Agente degradante Condiciones atmosféricas (humedad y temperatura) Resistencia Muy durable a moderadamente resistente Ataque de escarabajos de la familia playpodidae Ataque de escarabajos de la familia lyctidae y bostrychidae Ataquede termitas de madera seca Ataque de termitas subterráneas Ataque de taladradores marinos Baja a medianamente resistente Susceptible Resistente a medianamente resistente Medianamente resistente Resistente a medianamente resistente Fuente: Govaere et al., 2005. Cuando la madera está recién cortada, el duramen es de color verde-oliva, pero se convierte en un color marrón-dorado cuando seca, mostrando frecuentemente bandas de color oscuro que se desvanecen eventualmente con el paso del tiempo. La albura es de color amarillento a blanco y abruptamente separada del duramen. Se distinguen los anillos de crecimiento y, excepto en el caso de anillos ocasionales, éstos son de ocurrencia anual y se muestran en las superficies laterales como líneas de color marrón estrechan que son más oscuras que el resto del duramen. La madera tiene un olor desagradable, con una fragancia aceitosa característica cuando está recién cortada y que se acentúa cuando se humedece o se calienta. Sabor no distintivo, textura fina uniforme, grano recto, brillo mediano y veteado acentuado, producido por los anillos de crecimiento (Kukachka, 1970 y Longwood, 1989). Se estudió la producción de duramen (Cuadro 40) y algunas características físicas de la madera de teca en plantaciones de 10 años de edad, bajo dos densidades de plantación y dos intensidades de aclareo. Los resultados indican que la menor densidad de plantación puede favorecer la producción de duramen, aunque estadísticamente no existe diferencia significativa, también produce ramas más gruesas y mayor conicidad del tronco. Las características como peso específico básico, contenido de humedad, contracción volumétrica y la contracción radial y tangencial, se ven favorecidas o mejoran con una densidad de plantación mayor; mientras que el grado de inclinación de la fibra es muy superior en árboles de esta densidad. El peso específico aumenta conforme avanza la edad y disminuye de la base hacia la copa; mientras el contenido de humedad desciende de la médula hacia la periferia del tronco y de la base hacia la copa y las contracciones ascienden desde la base hacia el ápice y de la médula hacia fuera. En forma general la madera proveniente de la densidad inicial de 830 árboles/ha (actual 447 árboles/ha), presenta mejores características físicas (Cuadro 41) que la proveniente de la densidad inicial de 1,111 árboles/ha (actual 286 árboles/ha), excepto por la inclinación de la fibra (Incli°). Incluso presentan diferencias estadísticamente significativas (µ=0,05), exceptuando el contenido de humedad 170 (CH%). En esta densidad (830 árboles/ha) el peso específico básico (PEB) es mayor, esto significa que la madera es más densa y por consiguiente presenta una resistencia mecánica mayor (Arce y Fonseca, 2005). Cuadro 40. Resultados por densidad de plantación de teca en el porcentaje de duramen. Altura (m) Porcentaje de duramen Porcentaje de duramen (3 x 3 m) (6 x 2 m) 0.30 65.90 71.00 1.25 59.99 65.63 2.50 59.25 63.32 3.75 57.75 61.12 5.00 54.89 60.22 6.25 53.97 58.11 7.50 50.48 55.41 8.75 50.10 53.72 10.00 47.38 49.74 11.25 34.50 36.57 12.50 32.45 35.06 13.75 37.61 22.99 15.00 22.02 30.83 16.25 (28.36) 0 17.50 (23.68) 0 18.75 11.34 * *No existe dato. Los datos entre paréntesis presentan diferencia estadísticamente significativa (α= 0.05). Fuente: Arce y Fonseca, 2005. Cuadro 41. Resultados de la prueba de hipótesis para el total de los datos de cada una de las densidades. Densidad PEB CH CVtotal CV CTtotal CR CLtotal Inclinación (árb/ha) (%) (%) 12 (%) total (%) (%) (%) 1,111 0.527 93.4 6.96 3.85 5.54 3.35 0.55 0.44 830 0.556 91.3 6.17 2.93 4.68 3.05 0.50 1.12 Fuente: Arce y Fonseca, 2005. Donde: PEB = Peso específico CV total = Contracción volumétrica total CV 12 % = Contracción volumétrica de la madera seca al aire CR total = Contracción radial total CH % = Contenido de humedad CT total = Contracción tangencial total Incli = Inclinación de la fibra CL total = Contracción longitudinal total 171 Con madera proveniente de plantaciones experimentales ubicadas en el Valle del Sacta en Bolivia, se determinó las principales propiedades físicas y mecánicas de T. grandis, empleando la metodología en base a las normas ASTM (American Society for Testing and Materials). Los resultados obtenidos se pueden observar en el Cuadro 42 (Rivero, 2004). La madera fue particularmente difícil de secar. A pesar que se utilizó un horno eléctrico y que se aumentó la temperatura gradualmente desde 30 hasta 110 ºC para evitar colapsos, deformaciones y otros tipos de daños en las probetas, el tiempo de secado de éstas duró más de 30 días hasta alcanzar el 0% de contenido de humedad. Tiempo excesivamente largo si tenemos en cuenta las pequeñas dimensiones de cada pieza de madera. Cuadro 42. Propiedades físicas y mecánicas de Tectona grandis. Propiedad Contenido de humedad Densidad Contracción total Volumétrica T/r % % 8,01 2,12 Punto de saturación de las fibras Flexión estática Volumétrica % 26,4 Clasificación * Mediana Mediana Moderada pesada Muy baja Moderada estable Normal Mor Moe Mor Elp Axial Perpendicular Tangencial Radial Axial Perpendicular kg/cm2 kg/cm2 kg/cm2 kg/cm2 kg kg kg/cm2 kg/cm2 kg kg 963,6 105313,2 460,59 70,92 415,161 357.60 125,15 122.65 58 57.5 Medio Bajo Alta Mediana Blanda Muy blanda Alta Alta Alta Alta Peso específico Compresión paralela al grano Compresión perpend. Al grano Dureza Resistencia al cizallaje Extracción de clavos Al 12% c.h. Anhidra Básico Unidad % G/cm3 G/cm3 Promedio 106,68 0,58 0,54 0,50 Fuente: Rivero, 2004. También fue difícil la estabilización al 12% de contenido de humedad, debido a que esta madera tiene características anatómicas que dificultan el proceso de secado, como el aceite presente en la madera. El porcentaje de madera de albura es muy elevado, puesto que supera el 70% del volumen total de las trozas. Este aspecto tiene que ser tomado en cuenta según el tipo de uso final que se le de a la madera aserrada, pues sus propiedades de durabilidad pueden ser influenciadas negativamente en caso que se use la madera a la intemperie o en contacto directo 172 con agentes como agua, suelo, insectos, etc. Además que el color de la albura es claramente diferente al del duramen. Respecto a las propiedades relacionadas con cambios dimensionales de la madera, los valores obtenidos para las contracciones volumétrica, tangencial y radial, así como para el punto de saturación de las fibras clasifican a la madera de teca, como una madera moderadamente estable dimensionalmente tanto al 0% como al 12% de contenido de humedad, con una contracción volumétrica total muy baja, y con un punto de saturación de las fibras normal a bajo. Según las propiedades mecánicas estudiadas (Cuadro 43), se puede clasificar a esta madera de la siguiente manera: su módulo de ruptura (MOR) en flexión estática es mediano y el módulo de elasticidad en flexión estática es bajo, tiene una alta resistencia a la compresión paralela al grano; tiene una mediana resistencia a la compresión perpendicular al grano; su dureza es muy blanda en los sentidos tangencial y radial, y como blanda en el sentido axial. El esfuerzo al cizallamiento es alto en los sentido radial y tangencial; y tienen una resistencia a la extracción de clavos alta en los tres sentidos (Rivero, 2004). Cuadro 43. Clasificación de la madera de Tectona grandis. Propiedad Clasificación Densidad seca al aire (12%) Densidad anhidra (0%) Peso específico básico Contracción volumétrica (%) Relación de contracción t/r Punto de saturación de las fibras Mor en flexión estática Moe en flexión estática Resistencia a la compresión paralela al grano Resistencia a la compresión perpendicular al grano Dureza Axial Tangencial Radial Resistencia al cizallamiento Tangencial Radial Resistencia a la extracción de clavos Axial Tangencial Radial Fuente: Rivero, 2004. 173 Mediana Mediana Moderadamente pesada Muy baja Mediana Normal Mediano Bajo Alta Mediana Blanda Muy blanda Muy blanda Alta Alta Alta Alta Alta En términos generales, se puede concluir que la madera de teca, de ocho años de edad, proveniente de plantaciones experimentales del Valle de Sacta, presenta propiedades físico-mecánica ligeramente inferiores a las reportadas por otros autores en diferentes países, lo cual permite inferir que a esta madera no se le podrían dar los mismos usos que los señalados en la revisión bibliográfica. Cabe resaltar que los resultados obtenidos, aplican principalmente para la zona Valle del Sacta del Subtrópico de Cochabamba en Bolivia y las condiciones de plantación y manejo anteriormente estudiadas, ya que la cantidad de duramen y las propiedades físicas se puede ver afectada por otras condiciones, como clima, suelo y manejo (Rivero, 2004). Otros estudios sobre las propiedades físicas y mecánicas de la madera se presentan en los Cuadros 44, 45 y 46 (Ríos, 1982). Cuadro 44. Propiedades físicas de Tectona grandis. Densidad 3 (g/cm ) Contracción Normal (%) Contracción total (%) Verde 0.80 Tangencial 2.69 4.52 Seca al aire 0.61 Radial 1.61 2.52 Anhidra 0.57 Volumétrica 4.30 7.04 Básica 0.53 T/r 1.67 1.79 Cuadro 45. Propiedades mecánicas de Tectona grandis. Condición Verde + 30% SECO AL AIRE 12% Flexión estática Elp 2 (kg/cm ) 455 633 3 MOR 2 (kg/cm ) MOEx10 2 (kg/cm ) ELP 2 (kg/cm ) 780 1005 97.05 108.17 254 336 Compresión Paralela 3 MOR MOEx10 361 458 37.2 Perpendicular ELP MOR 2 2 (kg/cm ) (kg/cm ) 63 75 Cuadro 46. Propiedades mecánicas de la madera de Tectona grandis. Condicion Contenido Humedad (%) Verde + 30% Seco al Aire 12% Dureza Extremo s Red. Tang. Cizalladura (lg/c,2) Lateral 447 481 487 489 476 494 103 111 Donde: ELP: Esfuerzo en el límite proporcional MOR. Módulo de ruptura MOE: Módulo de elasticidad 174 Tenacidad (kg-m) Radial 6.1 3.8 Extrac. Clavos (kg) Radial Extremos Tangenc. 115 93 86 83 Preservación: La madera es considerada muy difícil de tratar con inmunizantes. La albura tratada por el sistema vacío-presión o inmersión, tiene una penetración incompleta y una retención de 50 a 100 kg/m 3 y el duramen es imposible de tratar, cualquiera que sea el método que se utilice (Junta del Acuerdo de Cartagena, 1988; Kukachka, 1970 y Longwood, 1989). Durabilidad natural: Es resistente, con una duración en uso exterior de 10 a 15 años. El duramen es resistente al ataque de termitas de madera seca, siendo comparable a la Caoba de las Indias Occidentales (Swietenia mahogani) en este aspecto. Es también moderadamente resistente a termes subterráneo y muy durable en el suelo, pero es fácilmente atacada por la polilla de mar. La albura no tiene ninguna de las propiedades de durabilidad del duramen, además de ser atacada por la Carcoma (Junta del Acuerdo de Cartagena, 1988; Kukachka, 1970 y Longwood, 1989). Trabajabilidad: Es una madera fácil de trabajar con herramientas comunes y no ofrece ninguna dificultad a los procesos de maquinado. La madera posee contenidos variables de Sílice que llegan hasta el 1.4% lo cual hace que esta sea abrasiva siendo por lo tanto necesario utilizar herramientas con filos reforzados. Es una madera moderadamente buena para doblar al vapor. Da un buen acabado y se deja encolar fácilmente (Kukachka, 1970 y Longwood, 1989). Secado: La madera se estabiliza bien con el secado, pero esto ocurre lentamente. Seca fácilmente al aire presentando ligeras deformaciones, pero no endurecimientos ni tensiones superficiales. El secado al horno es bueno, sin tendencias a rajaduras o alabeos, pero ocurren variaciones considerables en las tasas individuales de secado de tableros. Se recomiendan como horarios de secado: el T10-D4S y el T8DES de los Estados Unidos y el H. del Reino Unido (Junta de Acuerdo de Cartagena, 1989; Kukachka, 1970; Longwood, 1989). En el Instituto Tecnológico de Costa Rica se efectuaron ensayos para evaluar las propiedades físico-mecánicas de Tectona grandis, procedente de plantaciones forestales con tres rangos de edad y de dos regiones geográficas. Los resultados indican que la madera procedente de Costa Rica, manifiesta un valor de peso específico básico que la clasifica como una madera pesada; mientras que la madera proveniente de Panamá se ubica como madera muy pesada. Respecto a las propiedades con cambios dimensionales (contracciones y punto de saturación de las fibras), se clasifica como de contracción media y estable dimensionalmente. Referente a las propiedades mecánicas, la madera procedente de Panamá manifiesta valores de resistencia mecánica un poco más altos que la de Costa Rica, principalmente en los esfuerzos de cortante paralelo a la fibra, dureza lateral y compresión paralela a la fibra (Cuadros 47 al 50). En resumen, la madera de teca independiente de la edad o procedencia, presenta propiedades físico-mecánicas que la hacen apta para uso estructural, el valor de dureza lateral se ubica en el rango medio de las especies de madera utilizadas para la elaboración de piso y parquet (Córdoba y Sáenz, 2005). 175 Cuadro 47. Valores promedio de contenido de humedad, densidad y peso específico para madera de Tectona grandis. Procedencia Contenido de humedad (%) Verde 44.86 Costa Rica 15 años La Marina, Guápiles, Limón Costa Rica 20 años 56.25 Tapezco, Guápiles, Limón Costa Rica 25 años 52.16 Diamantes, Guápiles, Limón Panamá 18-20 48.85 años Puerto Arguelles, Chiriquí Panamá 23-25 46.28 años Puerto Arguelles, Chiriquí Panamá 27-32 38.78 años Puerto Arguelles, Chiriquí Fuente: Córdoba y Sáenz, 2005. Densidad (g/cm3) Peso específico Seco aire 11.33 Verde 0.82 Seco aire 0.65 Básico 0.57 Seco aire 0.59 Anhidro 0.61 11.43 0.82 0.61 0.53 0.54 0.56 11.02 0.86 0.65 0.57 .059 0.60 10.55 0.94 0.72 0.63 0.65 0.67 11.31 0.89 0.70 0.61 0.63 0.65 10.94 0.87 0.71 0.63 0.64 0.66 Cuadro 48. Valores promedio de contracciones y punto de saturación de las fibras para madera de Tectona grandis. Procedencia Valores de contracción total (%) Vol. Costa Rica 15 años 6.41 La Marina, Guápiles, Limón Costa Rica 20 años 6.55 Tapezco, Guápiles, Limón Costa Rica 25 años 6.09 Diamantes, Guápiles, Limón Panamá 18-20 años 5.49 Puerto Arguelles, Chiriquí Panamá 23-25 años 6.67 Puerto Arguelles, Chiriquí Panamá 27-32 años 5.34 Puerto Arguelles, Chiriquí Fuente: Córdoba y Sáenz, 2005. Tangencial Radial Relación contracción Tang/Rad 7.51 3.21 2.35 21.87 26.05 21.74 4.92 2.43 2.04 22.09 23.21 20.81 4.14 2.17 1.93 22.11 21.90 21.28 4.64 2.38 1.97 18.35 20.46 20.73 5.90 2.62 2.25 19.67 19.93 19.59 3.91 2.10 1.87 20.39 20.64 21.20 176 Punto de saturación de las fibras (%) Vol. Tangencial Radial Cuadro 49. Valores promedio de propiedades mecánicas en estado seco al aire, para madera de Tectona grandis. Procedencia Costa rica 15 años La marina, guápiles, limón Costa rica 20 años Tapezco, guápiles, limón Costa rica 25 años Diamantes, guápiles, limón Panamá 1820 años Puerto arguelles, chiriquí Panamá 2325 años Puerto arguelles, chiriquí Panamá 2732 años Puerto arguelles, chiriquí Flexión estática Mor Moe 2 2 (kg/cm ) (kg/cm ) 1015.52 122181.35 Compresiónparalela 2 a la fibra (kg/cm ) Cortante paralelo 2 (kg/cm ) Tangencial Radial Dureza (kg) Axial Lateral 491.32 170.72 159.91 569.24 535.40 935.87 115494.25 491.78 173.98 169.44 606.25 576.65 984.76 121042.75 546.39 172.30 149.11 563.64 562.67 775.72 110402.39 512.83 203.68 200.88 620.78 644.12 1064.91 129421.95 586.73 185.26 171.78 581.03 605.97 917.80 111899.95 527.45 190.68 185.50 542.41 582.53 Fuente: Córdoba y Sáenz, 2005. 177 Cuadro 50. Valores promedio de propiedades mecánicas ajustadas al 12% de contenido de humedad, para madera de Tectona grandis. Procedencia Costa rica 15 años La marina, guápiles, limón Costa rica 20 años Tapezco, guápiles, limón Costa rica 25 años Diamantes, guápiles, limón Panamá 1820 años Puerto arguelles, chiriquí Panamá 2325 años Puerto arguelles, chiriquí Panamá 2732 años Puerto arguelles, chiriquí Flexión estática Mor 2 (kg/cm ) Moe 2 (kg/cm ) 960.14 118757.96 872.35 Compresión paralela a la fibra 2 (kg/cm ) Cortante paralelo 2 (kg/cm ) Dureza (kg) Tangencial Radial Axial Lateral 458.65 157.67 147.55 524.94 504.48 111369.83 446.06 158.38 153.58 527.84 518.82 948.71 118737.96 540.24 162.71 141.11 511.31 522.57 754.79 108956.21 487.87 195.88 191.94 562.75 597.66 1027.49 127074.27 546.51 184.29 170.58 525.88 561.83 872.72 109070.22 496.97 180.53 175.95 508.88 554.26 Fuente: Córdoba y Sáenz, 2005. En el Centro de Investigación en Integración Bosque Industria (CIIBI) de la Escuela de Ingeniería Forestal del Instituto Tecnológico de Costa Rica, se efectuaron los ensayos de trabajabilidad para T. grandis, procedente de plantaciones forestales con tres rangos de edad y de dos regiones geográficas. En cepillado, el defecto de grano rugoso fue el más frecuente y representó en promedio un 56,29% del área por pieza, el grano arrancado contabilizó el 8.70%, el grano velloso el 5.44% y el grano levantado tan solo el 0.43% (Cuadro 51). En el ensayo con lija Nº 60, la madera de mayor edad procedente de Panamá mostró magnitudes significativamente mayores de temperatura de lijado, así como las mayores dificultades de remoción (Cuadro 52). En taladrado se logran espesores de viruta muy eficientes con la broca de metal (adaptada para madera), mientras que con la broca de madera se consideran muy deficientes. La broca para madera da una calidad visual de la superficie considerada entre buena y regular, mientras que la broca adaptada para madera presentó 178 superficies con calidad inferior, la cual se clasifica como de regular a mala. En la operación de torneado los ángulos de 40 y 60º en corte oblicuo presentaron la mejor calidad superficial (Serrano y Sáenz, 2005). Cuadro 51. Resumen del área libre de defectos por procedencia de madera de Tectona grandis. Procedencia 15-cr 25-cr 20-21-cr 18-20-pa 23-25-pa 27-32-pa Promedio Área libre defecto (%) Rugoso Arrancado (%) Velloso (%) Levantado (%) 32.23 36.36 30.17 22.67 31.44 21.93 29.13 52.82 48.96 52.91 61.69 59.41 61.97 56.29 8.59 6.86 5.49 12.45 6.49 12.30 8.70 5.18 7.63 10.86 2.90 2.43 3.60 5.44 1.16 0.18 0.55 0.27 0.22 0.19 0.43 Fuente: Serrano y Sáenz, 2005. Donde: Los números indican la edad; CR = Costa Rica y PA = Panamá. Cuadro 52. Resumen de remoción y temperatura en lijado en madera de Tectona grandis. Procedencia Valor promedio de remoción Clasificación Valor promedio temperatura Clasificación 23-25 pa 27-32 pa 18-20 pa 15-cr 25-cr 20-21-cr 0.2512 0.2114 0.3729 0.3830 0.3999 0.2234 Muy fácil Muy fácil Muy fácil Muy fácil Muy fácil Muy fácil 36.70 35.69 30.25 33.17 31.19 37.82 Media Media Baja Baja Baja Alta Fuente: Serrano y Sáenz, 2005. En México, el INIFAP desarrollo una secuela (H) para el secado de T. grandis L. para madera de 4/4‖ (Zavala, 1999). El coeficiente de aserrío es del 50%, es decir que la obtención de madera aserrada equivalente al 50% de biomasa (http://www. bosquestropicales.com/html/Espanol/ubicacion.html). Se realizó un trabajo con el objetivo de evaluar la relación que existe entre las características anatómicas y propiedades físico-mecánicas de la especie T. grandis de 20 años de edad proveniente de Venezuela. Los resultados mostraron que existe relación entre las características anatómicas (proporción de poros, radios, parénquima y fibras) con las propiedades físicas (densidad, peso específico, contracciones y T/R) y mecánicas (flexión, compresión paralela, compresión perpendicular, dureza, cizallamiento y tenacidad). En relación a las propiedades 179 físicas, la prueba de contracciones desde la condición verde a seca al aire y de verde a seca al horno y en las propiedades mecánicas, tanto en la condición verde y seca al aire, en los ensayos de tenacidad presentaron un comportamiento irregular, pero se mantienen los patrones en relación a las características anatómicas (Ulises et al., 2005). Para la determinación de la relación entre la densidad básica y la contracción de la madera de teca, se utilizaron árboles de 10 años con dos diferentes espaciamientos (6 x 2 m y 3 x 3 m). Los análisis estadísticos demostraron que la densidad básica resultó mayor en el espaciamiento de 3 x 3 m, mientras que las contracciones de la madera fueron mayores en el espaciamiento de 6 x 2 m. Los resultados demostraron que cuando se emplean árboles de 10 años de edad la densidad básica no es un buen indicativo para predecir las contracciones de la madera de teca (Moya y Arce, 2005). Se caracterizó químicamente la especie T. grandis (Cuadros 53 al 56) de seis años de edad y los resultados indican que presentó contenidos en base seca de 64.8% de holocelulosa, 30% de lignina, 1% de cenizas y 4.3 % de extractos totales. Las solubilidades en agua caliente y fría fueron muy similares entre sí, de 1.6% y 1.5% respectivamente, mostrando un bajo contenido de almidones. El contenido de solubles en NaOH 1% fue de 11%, siendo éstos en su mayoría hemicelulosa. Dentro de las sustancias extraíbles, la mayor cantidad de ellas fueron solubles en etanol a 95º, representando en promedio 3.4% de la madera (Abarca et al., 2005). Cuadro 53. Composición química de Tectona grandis en distintas zonas del fuste. Muestra Basal Medio Distal Compuestos esenciales Holocelulosa Lignina (% base seca) (% base seca) 57.2 31.0 52.6 31.6 54.3 32.1 Compuestos secundarios Extractos totales Inorgánicos (% base seca) (% base seca) 11.6 0.2 14.3 1.5 13.5 0.1 Fuente: Castro, 1998 citado por Abarca et al., 2005. Cuadro 54. Solubilidad de distintas zonas del fuste de Tectona grandis en diferentes solventes. Muestra Basal Medio Distal En NAOH 1 % (% base seca) 15.2 15.6 16.6 Solubilidad En agua caliente (% base seca) 4.2 3.9 4.8 Fuente: Abarca et al., 2005 180 En agua fría (% base seca) 3.8 3.9 2.2 Cuadro 55. Composición química global de la madera de Tectona grandis (base seca). Características Holocelulosa Lignina Extractos totales Cenizas a 525 ºC En NaQH al 1 % En agua caliente En agua fría En etanol al 95 % Albura Duramen Compuestos esenciales 64.31 63.42 29.98 29.73 Compuestos secundarios 4.20 6.00 1.51 0.85 Solubilidad 13.30 12.71 1.70 1.61 1.41 1.51 2.52 3.72 Albura + duramen 64.76 29.95 4.31 0.98 10.94 1.60 1.51 3.35 Fuente: Abarca et al., 2005 Cuadro 56. Composición inorgánica elemental de la madera de Tectona grandis. Elemento Albura Duramen N P Ca Mg K Fe Cu Zn Mn B S 0.35 0.14 0.30 0.10 0.27 0.0054 0.0006 0.0008 0.0006 0.00087 0.06 0.33 0.07 0.17 0.10 0.17 0.0198 0.0010 0.0020 0.0002 0.00117 0.04 Fuente: Abarca et al., 2005. 6.7.2. Usos La madera de T. grandis se utiliza en construcción marina en general, madera contrachapada, paneles decorativos, juguetería, madera torneada y tallada, muebles y gabinetes, marcos de puertas y ventanas, carpintería en general y pulpa (Monroy, 1998; Govaere et al., 2005). La madera es utilizada para cubiertas de aviones, barcos y otras embarcaciones grandes. Se usa para pisos, ebanistería, pilotes, coches de ferrocarril, construcciones interiores, construcciones pesadas sometidas a la intemperie, marcos de puertas y ventanas, tornería, talla, muebles y papelería. Es excepcionalmente apropiada para tanques, tinas, bañeras, cocinas, para bancos de laboratorios y plantas químicas (debido a su alta resistencia a los ácidos), estacones, armazones de casas y chapas 181 decorativas. La madera no corroe los metales cuando se usa en contacto con ellos (Kukachka, 1970 y Longwood, 1989). Los principales mercados para la madera teca lo constituyen Norteamérica, Europa y Japón en los que se usa para la construcción de casas sometidas a condiciones ambientales extremas, muebles lujosos, muebles de exteriores y en el recubrimiento de superficies exteriores e interior de yates, etc. (http://www.bosquestropicales.com/ html/Espanol/ubicacion.html). La madera de esta especie es muy apreciada en el mercado mundial, es empleada para la fabricación de muebles, palmetas y chapas, floreros, ebanistería, puertas, paneles, muebles fijos en laboratorio, construcción de casas, vagones de ferrocarril, durmientes y cabinas de trabajo: también se recomienda para uso ornamental, barreras o cercos (Peña, 1984; Niembro, 1986 y Somarriba et al., 1999). 182 7. LITERATURA CITADA Abarca E. R., Blanco R. L. y Solano S. P. 2005. Composición química de Tectona grandis. Laboratorio de Productos Forestales. Universidad de Costa Rica. Abdelnour A. y Muñoz A. 2005. Micropropagación de teca (Tectona grandis). Centro de Investigación en Biotecnología, Cartago, Costa Rica. Andrade T. A. y Alonso L. A. 2001. Germinación in vitro de cedrela odorata. In: Memorias del Congreso Mexicano de Recursos Forestales. ―Manejo de Recursos Forestales para el 3er. Milenio‖. CUCBA-Universidad de Guadalajara. Sociedad Mexicana de Recursos Forestales, A. C. Guadalajara, Jal. México. 5 p. Anduaga M. F. J. 1988. Respuesta de maculis (Tabebuia rosea) y siricote (Cordia dodecandra) a siembra mecanizada y manual, bajo dos condiciones ecológicas: dosel protector y campo abierto, en la Chontalpa-Tabasco. Tesis Maestría en Ciencias. Colegio de Postgraduados. Programa Forestal. Montecillo, México. 162 p. Anónimo. 1972. Brosimum alicastrum Sw. subsp. alicastrum C.C. Berg (1972). — Moraceae. In: Flora Neotropica. Monograph 7: 170-171. Anónimo. 1979. Tropical Legumes: Resources in the Future. National Academy of Sciences. Washington, D.C. Arce V. y Fonseca. W. 2005. Relación albura-duramen y características físicas de la madera Tectona grandis L. F. en plantaciones de diez años con diferente densidad de siembra, Guanacaste, Costa Rica. Precious Woods. Instituto de Investigación y Servicios Forestales, UNA. Costa Rica. Arreola P. J. A. 1995. Germinación y crecimiento inicial de cinco especies forestales tropicales en vivero. Tesis de Licenciatura. Universidad Autónoma Chapingo. División de Ciencias Forestales. Chapingo, México. 105 p. Arriaga V. V. y Vargas M. A. 1994. Manual de reforestación con especies nativas: colecta y preservación de semillas, propagación y manejo de plantas. SEDESOL/INE–Facultad de Ciencias-UNAM. México, D. F. Azcárraga R. R., y Rabiza A. S. I. 2001. El mundo de las plantas IV. Vegetación de México. In: http://www.correodelmaestro.com/anteriores/2001/Julio/2anteaula 62.htm (Disponible 29 de Noviembre del 2005). Batis A. I., Alcocer M. G. M. I., Sánchez C. y Vázquez Y. C. 1999. Árboles y Arbustos Nativos Potencialmente Valiosos para la Restauración ecológica y la Reforestación. CONABIO-Instituto de Ecología-UNAM. México, D. F. 183 Bertoni V. R. y Juárez G. V. M. 1980. Comportamiento de nueve especies forestales tropicales plantadas en 1971 en el C. E. F. Tropical ―El Tormento‖. Cien. For. 5 (25):3-40. Betancourt B. A. 1988. Silvicultura especial de árboles maderables tropicales. Editorial Científico-Técnica. La Habana, Cuba. p. 92-109. Burley J. y Lamb A. F. A. 1971. Status of the C.F.I. International provenance trial of Cedrela odorata (including Cedrela mexicana and Cedrela tubiflora). Commonwealth Forestry Review, 50 (3): 234-237. Burns R., Mosquera M. y Whitmore J. 1998. Árboles Útiles de la región tropical de América del Norte. USDA, SEMARNAP, SAGAR, USA Forest Service, Canadá Natural Resources, Canadian Forest Service, Washington, D.C. Cabrera C. E., Souza S. M. y Téllez V. D. 1982. Imágenes de la flora Quintanarroense, Ed. CIQRO. México. 100 p. Camarena T. J. C. y T. Sánchez V. 2002. Determinación de las características físicas y mecánicas en la madera de Acrocarpus fraxinifolius. Investigación Descriptiva. Vol. 8 Época 2. Ciencia y Tecnología de la Madera. Facultad de Ingeniería en Tecnología de la Madera. UMSNH. Morelia, Michoacán. p. 2026. Carranza M. M. A., Sánchez V. L. R., Pineda L. M. R. y Cuevas G. R. 2003. Calidad y potencial forrajero de especies del bosque tropical caducifolio de la Sierra de Manantlán, México. Agrociencia. Vol. 37. No. 2. México, D. F. Castillo V. C. 1999 (a). La recolección, almacenamiento y manejo de semillas forestales tropicales. In: 500 Tecnologías Llave en Mano. División Forestal. INIFAP: SAGAR. p. 103 Castillo V. C. 1999 (b). Semilla de calidad de Cedrela odorata L (cedro rojo). In: 500 Tecnologías Llave en Mano. División Forestal. INIFAP. SAGAR. México. p. 107. Castro C. J. de los S. 1997. Guía silvicultural de Enterolobium cyclocarpum (Griseb.) (Parota, orejón, guanacaste) especie de árbol de uso múltiple en México. In: Musalem, M. A. Ed. Guía silvicultural de especies de árboles de uso múltiple de México. Programa de Agroforestería para el Desarrollo Sostenible. Universidad Autónoma Chapingo. Chapingo, Mex. 250 p. Cedeño S. O. 1984. Acrocarpus fraxinifolius Wgh. Arn. Especies promisorias para plantaciones forestales en el trópico húmedo. In: Memoria Tercera Reunión Nacional sobre Plantaciones Forestales. INIF-SARH. Publicación Especial. No. 48. p. 561-566. 184 Centeno E. L. R. 2000. Enriquecimiento de acahuales con especies forestales tropicales. In: 1er. Congreso Nacional de Reforestación. Colegio de Postgraduados. PRONARE-SEMARNAP. Texcoco, Estado de México. México. Cervantes V. M., López S. N. y Hernández. G. s/f. Técnicas para propagar especies nativas de la Selva Baja Caducifolia y criterios para establecer áreas de reforestación. Facultad de Ciencias, UNAM–PRONARE-SEMARNAP. Inédito. Chaplin G. E. 1980. Progress with provenance exploration and seed collection of Cedrela spp. Proceeding of the 11TN Commonwealth Forestry Conference Oxford, England. Commonwealth Forestry Institute: 1-17. Chavelas P. J. 1985. Estudios preliminares en Acrocarpus fraxinifolius Wight. Arn. In: Memoria Tercera Reunión Nacional sobre Plantaciones Forestales. Publicación Especial. No. 48. INIF-SARH. México, D.F. p. 204-218. Chavelas P. J. y Dewall M. S. 1988. Árboles Útiles de la parte Tropical de América del Norte. Grupo de estudio de silvicultura. Comisión Forestal de América de Norte. No. 3. Washington, EE-UU. Chavelas P. J., Soria R. G. y Zamora S. C. 1982. Estudio ecológico-forestal de la colonia agrícola-ganadera ―Progreso‖, Municipio de Matías Romero, Oaxaca. Boletín Técnico. No. 77. SARH-INIF. México, D. F. 35 p. Chaves S. E. y Fonseca, G. W. 2005. Ensayos de aclareo y crecimiento en plantaciones de teca (Tectona grandis L.f.) en la Península de Nicoya, Costa Rica. Instituto de Investigación y Servicios Forestales (INISEFOR). Universidad Nacional. Heredia, Costa Rica. Cibrián T. D., J. T. Méndez M., R. Campos B., H. Yates O. y J. Flores, L. 1995. Insectos Forestales de México/Forest Insects of México. Publicación No. 6. Universidad Autónoma de Chapingo. Texcoco, Edo. de México. 453 p. CNIC. 2005. Arboles encontrados en zonas cafetaleras. Colombia. 149 p. Committe on the flora of China. 1985. Chinese Silvicultura. China Agricultural Publications. 1342 p. Córdoba F. R. y Sáenz M. M. Propiedades físico-mecánicas de Teca de Costa Rica y Panamá. FUNDATEC ITCR. Cartago, Costa Rica. Corral L. M. G. 1985. Características anatómicas de la madera de once especies tropicales. Boletín Técnico. No. 127. SARH. INIFAP. México, D. F. 185 COTECOCA. 1972. Memoria regional de Coeficientes de agostadero del Estado de Chiapas. Secretaría de Agricultura y Ganadería. México, D. F. 118 p. COTECOCA. 1980. Memoria regional de Coeficientes de agostadero del Estado de Oaxaca. Secretaría de Agricultura y Recursos Hidráulicos. México, D. F. 306 p. Cruz R. N. 2005. Micropropagación Clonal in vitro de árboles seleccionados de Tectona grandis L. (Teca). Curiel A. G. M. 1992. Estudio de manejo integral forestal del predio particular ―fracción de Puentecillas‖ municipio de Tomatlán, Jalisco. Unidad de conservación y desarrollo forestal No. 5 ―Costa de Jalisco‖. El Tuito Cabo Corrientes, Jalisco. Daquinta G. M., Rodríguez R. y Castro D. 2005. Manejo in vitro de especies forestales de interés económico. Díaz M. E. 1999 (a). Control de Hypsiphylla grandella en plantaciones de Meliáceas (cedro rojo y caoba). In: 500 Tecnologías Llave en Mano. División Forestal. INIFAP. SAGAR. p. 77-78. Díaz M. E. 1999 (b). Producción de planta de cedro (Cedrela odorata) a raíz desnuda. In: 500 Tecnologías Llave en mano. División Forestal. INIFAP. SAGAR. Mèxico. p. 89-90. Díaz M. E. 1999 (c). Manejo de plantaciones de cedro rojo (Cedrela odorata). In: 500 Tecnologías Llave en Mano. División Forestal. INIFAP: SAGAR. p. 79-80 Díaz F. V. H. 1999 (d). Sistemas agroforestales para conservar el suelo y su productividad en áreas tropicales de ladera. In: 500 Tecnologías Llave en Mano. División Forestal. INIFAP: SAGAR. p. 25. Díaz M. E. 1999 (e). Producción de planta de Teca (Tectona grandis) a raíz desnuda. In: 500 Tecnologías Llave en Mano. División Forestal. INIFAP. SAGAR. México. p. 97-98. Díaz M. E. 1999 (f). Manejo de plantaciones de Teca (Tectona grandis). In: 500 Tecnologías Llave en Mano. División Forestal. INIFAP. SAGAR. p. 83-84. Dirección General del Inventario Forestal. 1979. Análisis automatizado de imágenes de satélite en la elaboración de mapas de erosión. Información Técnica del Inventario Forestal. SARH. Núm. 3. Vol. I. México, D. F. 30 p. Egger K. 1986. L´intensification ecologique, conservation (LAE) et amelioration des soils tropicaux par les systemes agro-silvo-pastoraux. Colletion Documents Systemes Agraries 6: 129-135. 186 Enríquez V. J. R. 1985. Propagación in vitro de cedro rojo (Cedrela odorata L). Tesis de Licenciatura. Universidad Autónoma Chapingo. Depto. de Bosques. Chapingo, México. 93 p. Espejel I. y Martínez E. 1979. El Guanacaste. Comunicado No 33. Instituto Nacional Sobre Recursos Bióticos. INIREB Informa. México, D. F. 3 p. Espinoza P. 1986. El componente arbóreo en el sistema agroforestal cafetal arbolado en Costa Rica. El Chasqui (Costa Rica) 12: 17-22. Evans J. 1982. Plantation Forestry in the tropics, Clarendon Press, Oxford: 136, 148, 191, 350, 386, 398. FAO. 1994. Requerimientos ambientales de algunas especies forestales tropicales. (Base de datos). Febles T. E. G., Ruiz B. CH., Alonso O., Gutiérrez J. C., Díaz H. y Hernández L. 1999. Evaluación de diferentes especies de árboles y arbustos para el desarrollo de sistemas silvopastoriles en el trópico. In: http://www.cipav.org.co/ redagrofor/memorias99/FeblesG.htm (Disponible 26 de Octubre del 2005). Fierros A., Noguez A. y Velasco E. 1999. Paquetes tecnológicos para el establecimiento de plantaciones forestales comerciales en ecosistemas de climas templados-fríos y tropicales de México. Vol. I. SEMANARP. México, D. F. Franco B. 2005. Comparación de los patrones alimenticios de Alouatta palliata mexicana en hábitat contrastantes en Tabasco, México. Postgrado Colegio de la Frontera Sur (ECOSUR - San Cristóbal de las Casas). In: http://www.primatesmx.com/staff1.htm (Disponible 26 de Octubre del 2005). Fuentes F. R. 1979. Coffee production farming systems in México. Agro-Forestry systems in Latin America (Workshop). Turrialba. Costa Rica. Centro Agronómico Tropical de Investigación y Enseñanza. p. 60-72. Gallegos R. A., Abundio R. E., Morales R. M. E. y Hernández A. E. 2001. Valor de importancia de especies arbóreas en un bosque tropical de la costa de Jalisco. In: Memorias del Congreso Mexicano de Recursos Forestales. ―Manejo de Recursos Forestales para el 3er. Milenio‖. CUCBA-Universidad de Guadalajara. Sociedad Mexicana de Recursos Forestales, A. C. Guadalajara, Jal. México. 11 p. García M. T., Bocanegra O. S. y Tapia M. C. 2002. Características anatómicas de la madera de arbolado joven de Acrocarpus fraxinifolius Wight & Arn. Investigación Descriptiva. Vol. 8 Época 2. Ciencia y Tecnología de la Madera. 187 Revista de la Facultad de Ingeniería en Tecnología de la Madera. UMSNH. Morelia, Michoacán, México. p. 8-13. Geilfus F. 1989. El árbol al servicio del agricultor; manual de Agroforestería para el desarrollo rural. Vol. 2: Guía de especies. Santo Domingo. Enda-Caribe y CATIE. p. 377. Gómez Q. M. y F. Mora CH. 2005. Comparación de modelos y unificación de ecuaciones de volumen para árboles individuales en plantaciones de Teca (Tectona grandis L.) en Costa Rica. Instituto de Investigación y Servicios Forestales (INISEFOR), Universidad Nacional, Heredia, Costa Rica. Gómez T. J. 1989. Comparación del crecimiento de ocho especies forestales tropicales, en Escárcega, Campeche, México. Tesis Profesional. Subsecretaría de Educación e Investigación Tecnológica. Dirección General de Educación Tecnológica Agropecuaria y Ciencia del Mar. Instituto Tecnológico Agropecuario No. 5. China, Campeche, México. 64 p. Gómez T. J. 1998. El uso de composta orgánica en la producción de plantas de cedro. In: 500 Tecnologías Llave en mano. División Forestal. INIFAP. SAGAR. p. 131-132. González M. S. A., Ariceaga S. N. y Altamirano G. N. A. 1985. Evaluación del valor nutritivo de la parota (Enterolobium cyclocarpum) en alimentación de ovinos. Tesis de Licenciatura. Universidad Autónoma de Chapingo. Departamento de Zootecnia. Chapingo, México. 42 p. Govaere G., I. Carpio y L. Cruz. 2005. Descripción anatómica, durabilidad y propiedades físicas y mecánicas de Tectona grandis. Laboratorio de Productos Forestales, Universidad de Costa Rica. Guevara M. G. 1988. Experiencias colombianas con Cedro (Cedrela odorata L.) Serie Documentación No. 12. Corporación Nacional de Investigación y Fomento Forestal (CONIF). Convenio CONIF-Holanda. Ed. Gente Nueva. Bogotá Colombia. 78 p. Guido A. L. M. 1993. Porcentaje de sobrevivencia al transplante de Cedrela odorata L. (Cedro rojo), en diferentes condiciones en los Tuxtlas, Ver. Tesis de Licenciatura. Universidad Autónoma Chapingo. División de Ciencias Forestales. Chapingo, México. 58 p. Herrera A. Z. y Lanuza R. 1995. Especies para reforestación en Nicaragua. Managua, Servicio Forestal Nacional. 185 p. http://148.202.81.1/new/informacionacademica/coaxican/plts_mex/capomo.htm (Disponible 1 de Diciembre del 2005). 188 http://ctfs.si.edu/webatlas/spanish/brosal.html (Disponible 29 de Noviembre del 2005). http://darnis.inbio.ac.cr/ubis/FMPro?-DB=UBIpub.fp3&-lay=WebAll&-error=norec. html&-Format=detail.html&-Op=eq&id=175&-Find (Disponible 5 de Junio del 2006). http://www. biologie.uni-hamburg.de/b-online/wood/spanish/bigtaros.htm (Disponible 5 de Diciembre del 2005). http://www.acguanacaste.ac.cr/1999/educacion/sectorbs.html Noviembre del 2005). (Disponible 29 de http://www.acguanacaste.ac.cr/bosque_seco_virtual/bs_web_page/paginas_de_espe cies/enterolobium_cyclocarpum.html (Disponible 29 de Noviembre del 2005) http://www.arbolesornamentales.com/Cedrelaodorata.htm Noviembre del 2005). (Disponible 7 de http://www.arbolesornamentales.com/Tabebuiarosea.htm (Disponible 5 de Diciembre del 2005). http://www.birdlife.org/datazone/sites/?action=SitHTMDetails.asp&sid=14927&m=0 (Disponible 29 de Noviembre del 2005). http://www.bosqueprotector.espol.edu.ec/Informate/Flora/flora.html (Disponible 29 de Noviembre del 2005). http://www.bosquestropicales.com/html/Espanol/ubicacion.html (Disponible 28 de Noviembre del 2005). http://www.catie.ac.cr/bancoconocimiento/C/Coleccionesjardinbotanicoarboldeguanac aste/Coleccionesjardinbotanicoarboldeguanacaste.asp?CodSeccion=381 (Disponible 7 de Noviembre del 2005). http://www.cideiber.com/infopaises/Peru/Peru-04-02.html Noviembre del 2005). (Disponible 29 de http://www.conabio.gob.mx/conocimiento/info_especies/arboles/doctos/36-melia2m. pdf (Disponible 7 de Noviembre del 2005). http://www.conabio.gob.mx/conocimiento/info_especies/arboles/doctos/41legum16m.pdf (Disponible 7 de Noviembre del 2005). http://www.conabio.gob.mx/conocimiento/infoespecies/arboles/doctos/11-bigno7m. pdf (Disponible 5 de Diciembre del 2005). 189 http://www.conafor.gob.mx/programas_nacionales_forestales/pronare/fichas20tecnic as/Acrocarpus20fraxinifolius.pdf. (Disponible 21 de Octubre del 2005). http://www.conafor.gob.mx/revista_forestal/pdf20articulos/Vol206/Num6/2720y20282 0CONAFOR.pdf (Disponible 12 de Enero del 2006). http://www.fs.fed.us/global/iitf/Enterolobiumcyclocarpum.pdf Noviembre del 2005). (Disponible 7 de http://www.ibw.com.ni/~eco/PrVerdur.htm (Disponible 30 de Noviembre del 2005). http://www.inbio.ac.cr/bims/k03/p13/c045/o0138/f01348/g009166/s029354.htm (Disponible 28 de Noviembre del 2005). http://www.ine.gob.mx/ueajei/publicaciones/libros/2/manan.html (Disponible 30 de Noviembre del 2005). http://www.mexicoco.net/Fotografìagrafias/quintanaroo/chetumal/datos/historia_de_c hetumal.html (Disponible 30 de Noviembre del 2005). http://www.peruwoodproducts.com/Congona.html (Disponible 1 de Diciembre del 2005). http://www.prensalibre.com/pl/domingo/archivo/revistad/2005/Junio05/050605/dambie nte.shtml (Disponible 1 de Diciembre del 2005). http://www.primatesmx.com/staff1.htm (Disponible 1 de Diciembre del 2005). http://www.regionloreto.gob.pe/amazonia/libros/51/5100003.htm Diciembre del 2005). (Disponible 1 de http://www.sagarpa.gob.mx/dlg/michoacan/ganaderia/cotecoca/html/ Vegetacion.html (Disponible 5 de Junio del 2006). http://www.semarnat.gob.mx/pfnm2/fichas/enterolobium_cyclocarpum.htm (Disponible 1 de Diciembre del 2005). http://www.semarnat.gob.mx/pfnm2/fichas/tabebuia_rosea.htm Diciembre del 2005). (Disponible 5 de http://www.sian.info.ve/porcinos/publicaciones/lrrd/lrrd12/lrrd124/mend124.htm (Disponible 1 de Diciembre del 2005). Huerta C. M. 1983. La parota Enterolobium cyclocarpum (Jacq) Griseb., como un recurso forestal de las zonas cálido-húmedas en Jalisco. Tesis Profesional. Escuela de Agricultura de la Universidad de Guadalajara. 86 p. 190 Huerta C. J. y Becerra M. J. 1974. Anatomía macroscópica y algunas características físicas de diecisiete maderas tropicales mexicanas. Boletín Divulgativo. No. 33. SAG-SFF-INIF. México, D. F. p. 21. Huerta C. J. y Becerra M. J. 1982. Anatomía macroscópica y algunas características físicas de diecisiete maderas tropicales mexicanas. Boletín Divulgativo. No. 46. SARH. INIF. 61 p. INIFAP. 1997 (a). Combate biológico del barrenador de brotes en plantaciones de cedro rojo y caoba. In: 500 Tecnologías Llave en Mano. División Forestal. INIFAP. SAGAR. p. 149-150. INIFAP. 1997 (b). 1997. Establecimiento de plantaciones de cedro rojo en el trópico de México. In: 500 Tecnologías Llave en Mano. División Forestal. INIFAP: SAGAR. p. 151-152. INIFAP. 1997. Establecimiento de plantaciones de Teca en el Sureste de México. In: 500 Tecnologías Llave en Mano. División Forestal. INIFAP. SAGAR. México. p. 153-154. Janzen D. H. and Higgins M. L. 1979. How hard are Enterolobium cyclocarpum (Leguminosae) seeds?. Brenesia 16:61-67. Jerez M., L. Vincent y Moret Y. 2005. Regímenes de espaciamiento inicial y aclareo en plantaciones de teca (Tectona grandis L.f.) en Venezuela. Juárez B. C. 1988. Análisis del incremento periódico de caoba (Swietenia macrophylla King) y cedro (Cedrela odorata L.) en un relicto de selva en el Estado de Campeche. Tesis de Licenciatura. Universidad Autónoma Chapingo. División de Ciencias Forestales. Chapingo, México. 87 p. Juárez G. V., Espinoza B. A. y Cedeño S. O. 1989. Observaciones fenológicas en 70 especies forestales tropicales y su importancia en la producción. In: Memorias del Congreso Forestal Mexicano. Tomo II. México. p. 874-882 Junta del Acuerdo de Cartagena. 1988. Manual del Grupo Andino para la Preservación de Maderas. Lima, Perú. 386 p. Junta de Acuerdo de Cartagena. 1989. Manual del Grupo Andino para el Secado de Maderas. Lima Perú. 440 p. Kukachka B. F. 1970. Properties of Imported Tropical Woods. Forest. Products. Laboratory. Madison, Wisconsin, U.S.A. FPL-125. 66 p. Lamprech H. 1989. (b). Silviculture in the Tropics. Technical Cooperation. Alemania. 191 Lamprecht H. 1989 (a). Silviculture in the Tropics. Tropical Forest Ecosystems and their Tree Species–Possibilities and Methods for Their Long-term Utilization. Institute for silviculture of the University of Gôttingen. Eschborn, Alemania. Limón L. A. 1989. Comportamiento de tres especies forestales tropicales durante los primeros tres años de desarrollo en la sabana de Huimanguillo, Tabasco. In: Memorias del Simposio Agroforestal en México. Sistemas y métodos de uso múltiple del suelo. Linares, Nuevo, León. México. p. 209-225. Llera Z. M. y Meléndez N. F. 1989. Evaluación de especies tropicales como alternativa para la sustitución del árbol de sombra mote (Erythrina spp.) en el cultivo del cacao. In: Memorias del Simposio Agroforestal en México. Sistemas y métodos de uso múltiple del suelo. Linares, Nuevo León. México. p. 263277. Manzanilla B. H., Martínez D. M. y Martínez, M. A. 2001. Monografías de especies nativas promisorias para el establecimiento de plantaciones forestales comerciales en Jalisco cedro y rosa morada. Documento Técnico. No. 30. FIPRODEFO. Guadalajara, Jal. México. p. 51-73. Marín Q. M. 1999. Barrenador del tronco del cedro rojo. In: 500 Tecnologías Llave en mano. División Forestal. INIFAP: SAGAR. p. 73. Marquetti J. R. 1990. Híbridos de Cedrela resistentes a Hypsipyla grandella. Revista Forestal Baracoa. 20 (1): 97-101. Martínez D. M. 1997. Guía silvicultural de Tabebuia rosea (Bertol) (Rosa Morada): especie de árbol de uso múltiple en México. In: Musalem, M. A. Ed. Guía silvicultural de especies de árboles de uso múltiple de México. Programa de Agroforestería para el Desarrollo Sostenible. Universidad Autónoma Chapingo. Notas para el curso de Maestría. Primavera de 1997. Chapingo, Mexico. 250 p. Martínez M. 1979. Catalogo de nombres vulgares y científicos de plantas Mexicanas. Fondo de la cultura económica. México, D. F.1220 p. Más P. J. y Borja G. 1974. ¿Es posible mediante el Sistema Taungya aumentar la productividad de los Bosques Tropicales en México?. Boletín Técnico. No. 39. Instituto Nacional de Investigaciones Forestales. México, D. F. Medrano F. H. s/f. Programa de manejo forestal para el Ejido 20 de Noviembre, Municipio de Hopelchen, Campeche. México. Inédito. Melchor, M. J. I. y Barrosa C. J. T. 1994. Producción de planta y establecimiento de plantaciones de cedro rojo en el Estado de Veracruz. SARH. INIFAP. México, D. F. 27 p. 192 Menagro. 2001. Seeds and plant discussion. In: http:/ / seedcoseeds. Com/seedtalk2/ _seedtalk/0000028c.htm (Disponible Marzo 28 del 2003). Mendoza C. H., Tzec-Sima G. S. y Solorio S. F. 2000. Efecto de las frecuencias de rebrote sobre la producción y calidad del follaje del árbol "Ramón" (Brosimum alicastrum Swartz). In: http://www.sian.info.ve/porcinos/publicaciones/ lrrd/lrrd12/lrrd124/mend124.htm (Disponible 1 de Diciembre del 2005). Menéndez H. H. 1997. Cedro rosado. Guía del cultivo. http://www.monografias. com/trabajos20/cedro-rosado/cedro-rosado.shtml (Disponible 8 de Agosto del 2005). Miss C. D. 1987. Embriogénesis somática en guanacaste (Enterolobium cyclocarpum) Tesis de Licenciatura. Universidad Autónoma Chapingo. División de Ciencias Forestales. Chapingo, México. 61 p. Monroy R. C. 1998. Establezca plantaciones forestales en el trópico utilice especies de alto valor comercial o de rápido crecimiento. In: 500 Tecnologías Llave en Mano. División Forestal. INIFAP. SAGAR. México. p. 175-177. Mora CH. F. A. y Gómez Q. M. 2005. Ecuaciones y tablas de volumen para árboles individuales en plantaciones de Teca (Tectona grandis). Vertiente del Pacífico, Costa Rica. Instituto de Investigación y Servicios Forestales (INISEFOR), Escuela de Ciencias Ambientales (EDECA). Universidad Nacional (UNA). Costa Rica. Mora F. y Meza V. 2005. Curvas de índice de sitio para Teca (Tectona grandis Linn.) en la Vertiente del Pacífico de Costa Rica. Instituto de Investigación y Servicios Forestales Universidad Nacional, Heredia, Costa Rica. Mora S. A., J. I. Valdez H. y H. Vaquera, H. 2001. Regeneración natural de tres especies arbóreas en una selva mediana subcaducifolia de la costa de Jalisco. In: Memorias del Congreso Mexicano de Recursos Forestales. ―Manejo de Recursos Forestales para el 3er. Milenio‖. CUCBA-Universidad de Guadalajara. Sociedad Mexicana de Recursos Forestales, A. C. Guadalajara, Jal. México. 5 p. Moya R. R. y Arce L. V. 2003. Efecto del espaciamiento en plantación sobre dos propiedades físicas de madera de teca a lo largo del fuste. Artículo de Investigación. Madera y Bosques 9 (2) 2003:15-27. Murillo G. O. 2001. Estado del desarrollo de la evaluación y control de calidad de plantaciones forestales en costa rica. In: Memorias del Congreso Mexicano de Recursos Forestales. ―Manejo de Recursos Forestales para el 3er. Milenio‖. CUCBA-Universidad de Guadalajara. Sociedad Mexicana de Recursos Forestales, A. C. Guadalajara, Jal. México. 7 p. 193 Murillo O. Y. y Badilla O. 2005. Propagación vegetativa de la Teca en Costa Rica. ITCR, FUNDATEC. Cartago, Costa Rica. Navarro C. y Vásquez W. 1987. Variabilidad genética en semillas y plántulas de Cedrela odorata. Centro Agronómico Tropical de Investigación y Enseñanza, CATIE. Departamento de Recursos Naturales Renovables. Turrialba, Costa Rica. 12 p. Niembro R. A. 1992. Árboles y arbustos útiles de México. Ed. LIMUSA. México. 206 p. Ojeda E. L. A. 1986. Microinjerto in vitro en Cedrela odorata L. empleando ápices juveniles y adultos. Tesis Maestría en Ciencias. Colegio de Postgraduados. Centro de Genética. Montecillo, México. Olvera C. L. P. 1981. Estudio anatómico de la madera de siete especies del género Pinus. Boletín Técnico. No. 71. INIF. SARH. México, D. F. 52 p. Olvera C. L. P., Vázquez S. L., Reséndiz M. J. F. y Sandoval C. L. 2005. Micomicetos presentes en rizósfera de cedro rosado en la Sierra Norte de Puebla. In: Memoria de Resúmenes del VII Congreso Mexicano de Recursos Forestales. CONAFOR. Fundación Produce Chihuahua. Fideicomiso Chihuahua Forestal. FIRA. CONAZA. INIFAP. SEMARNAT. Secretaría de Desarrollo Rural del Estado de Chihuahua. Chihuahua. Chih. México. p. 301-302. Ontiveros A. S. y García M. T. 2002. Descripción botánica de la especie Acrocarpus fraxinifolius Wight et Arn. Investigación Descriptiva. Vol. 8 Época 2. Ciencia y Tecnología de la Madera. Facultad de Ingeniería en Tecnología de la Madera. UMSNH. Morelia, Mich. p. 2-7. Padilla M. R. 2005. Bioecología de la cochinilla rosada y su riesgo de ingreso en Honduras. Programa Entomología. IHCAFE. Tegucigalpa, Honduras. In: http://web.catie. ac.cr/información/RMIP/rmip57/art2-a.htm Padilla P. J. I. 1996. Comparación del crecimiento de cinco especies forestales tropicales, en Tecomán, Colima. Tesis de Licenciatura. Universidad Autónoma Chapingo. División de Ciencias Forestales. Chapingo, México. 45 p. Patiño V. F., De la Garza P., Villagómez A. Y., Talavera A. I. y Camacho M. F. 1983. Guía para la recolección y manejo de semillas de especies forestales. Boletín Técnico. No. 63. SARH-INIF. México, D. F. 181 p. Pellicer L. 2005. La nuez de los mayas. Las semillas del ramón, antiguo alimento maya, tiene posibilidades de ser comercializada en Estados Unidos. In: http://www.prensalibre.com/pl/domingo/archivo/revistad/2005/Junio05/050605/ dambiente.shtml (Disponible 1 de Diciembre del 2005). 194 Peña M. 1984. Guía Agropecuaria de Costa Rica. La teca (Tectona grandis) en Costa Rica. Ediciones Agropecuarias Ver. No. 9. San Juan Tibas, Costa Rica. Pennington T. D. y Sarukhán K. J. 1998. (a). Árboles Tropicales de México. Fondo de Cultura Económica. Segunda edición. UNAM - Fondo de Cultura Económica. México, D. F. p. 138-139. Pennington T. D. y Sarukhán K. J. 1998. (b). Manual para la identificación de campo de los principales árboles tropicales de México. FAO-Instituto Nacional de Investigaciones Forestales. México, D. F. p. 122-123. Peralta N., Palma J. M. y Macedo R. 2006. Efecto de diferentes niveles de inclusión de parota (Enterolobium cyclocarpum) en el desarrollo de ovinos en estabulación. In: http://www.engormix.com/s_articles_view.asp?art=552 (Disponible 15 de Junio del 2006). Pérez C. L. D. y Kanninen M. 2005. Hacia el manejo intensivo de la Teca (Tectona grandis) en Centroamérica. CIFOR, Jakarta, Indonesia. Pérez C. G. U. y Chacón E. J. C. 1994. Potencial forestal en el trópico húmedo mexicano, una alternativa para el desarrollo económico; características botánicas y agroecológicas de las principales especies forestales para plantaciones forestales, en el trópico húmedo de México. Proyecto para el establecimiento de una plantación en Teapa, Tabasco. México. Inédito. PRODEFO. 2000. Manual de producción de plantas forestales en contenedores. Ciclo económico Forestal. Documento Técnico. No. 25. Programa de Desarrollo Forestal de Jalisco. Guadalajara, Jal. México. 219 p. Quintanar O. J. 2002. Estimación de la productividad y potencial tecnológico del cedro rosado Acrocarpus fraxinifolius, en el Estado de Puebla. In: http://www.conafor.gob.mx/programas_nacionales_forestales/imasd/proyectos _2002/48.htm (Disponible 21 de Octubre del 2005). Rebollar D. S., Santos J. V. y Sánchez A. R. L. 2002. Estrategias de recuperación de selvas en dos ejidos de Quintana Roo, México. Madera y Bosques 8(1):19-38. REMGEFOR (Red Mexicana de Germoplasma Forestal). 2005. Acrocarpus fraxinifolius Wight & Arn. Fichas técnicas de especies forestales estratégicas. Ficha. No. 13. PRONARE. SEMARNAP. p. 67-69. Reséndiz M. J. F., Vázquez S. L., Olvera C. P. L. y Sandoval C. L. 2005. Sintomatología de daños detectados en cedro rosado (Acrocarpus fraxinifolius), en la Sierra Norte de Puebla. In: Memoria de Resúmenes del VII Congreso Mexicano de Recursos Forestales. CONAFOR. Fundación Produce Chihuahua. Fideicomiso Chihuahua Forestal. FIRA. CONAZA. INIFAP. 195 SEMARNAT. Secretaría de Desarrollo Rural del Estado de Chihuahua. Chihuahua. Chih. México. p. 293-294. Reyes R. J. 2005. El sistema Agroforestal café (Coffea sp.) cedro rosado (Acrocarpus fraxinifolius Wight. & Arn.) a diferentes altitudes en el Soconusco, Chiapas. In: VII Congreso Mexicano de Recursos Forestales. Chihuahua, Chihuahua, México. 10 p. Richter H. G. and Dallwitz. M. J. 2000. Commercial timbers: descriptions, illustrations, identification, and information retrieval. Version 4th. (http://biodiversity.uno.edu/delta/). Ríos R. C. A. 1982. Propiedades físico-mecánicas y anatómicas de la Teca. (Tectona grandis L. F.) del Departamento de Córdoba. Tesis de Grado Ingeniería Forestal. Universidad Nacional de Colombia. Seccional Medellín. Medellín, Colombia 76 p. Rivera L. R. 1999. (a). Establecimiento de plantaciones comerciales de cedro rojo en la Península de Yucatán. In: 500 Tecnologías Llave en Mano. División Forestal. INIFAP. SAGAR. p. 94. Rivera L. R. R. 1999. (b). Establecimiento de plantaciones agroforestales con cedro rojo en el Estado de Yucatán. In: 500 Tecnologías Llave en Mano. División Forestal. INIFAP: SAGAR. p. 112-113. Rivero M. J. G. 2004. In: http://www.monografias.com/trabajos16/gmelina-arborea/ gmelina-arborea.shtml. (25 de Noviembre de 2005). Rodríguez D. A. y Paniagua V. A. 2005. Encalado y fertilización en Tectona grandis (Teca) en la región Huetar Norte de Costa Rica. Instituto de Investigación y Servicios Forestales. Universidad Nacional. Heredia, Costa Rica. Rojas M. G. 1995. Experiencias de plantación comercial de Cedrela odorata L. en sistemas agroforestales en la región de los Tuxtlas, Veracruz. Memoria de Experiencia Profesional. Universidad Autónoma Chapingo. División de ciencias forestales y del ambiente. Chapingo, México. 114 p. Rueda S. A., Ruiz J. A., Benavides S. J. de D. y Flores G. J. G. 2007. Definición de áreas favorables para seis especies forestales tropicales en el estado de Jalisco. SAGARPA-CIRPAC-INIFAP. Libro Técnico. Núm. 5. Tepatitlán de Morelos, Jalisco. México. 165 p. Rzedowski J. 1981. Vegetación de México. Ed. LIMUSA. México, D. F. 432 p. Rzedowski J. 1983. Vegetación de México. México, LIMUSA México. D. F. 431 p. 196 Sánchez M. A. 1998. Plantaciones de cedro rojo para la obtención de madera aserrada. In: 500 Tecnologías Llave en Mano. División Forestal. INIFAP: SAGAR. p. 133-134. Sánchez P. L., Macario M. P. y Flores R. H. 2000. Experiencia en el establecimiento de un sistema agroforestal en el norte de Quintana Roo. In: 1er. Congreso Nacional de Reforestación. Colegio de Postgraduados. PRONARESEMARNAP. Texcoco, Estado de México. México. Sánchez V. L. R. 1984. Ecología y uso de Cedrela odorata L. en Misantla, Veracruz. Ciencia Forestal 9 (48):23-36. Sandoval F. J. A. 1995. Influencia de la densidad de siembra en vivero a raíz desnuda y tipo de empaque sobre una plantación de Cedrela odorata L. Tesis de Licenciatura. Universidad Autónoma Chapingo. División de Ciencias Forestales. Chapingo, México. 111 p. SEDER. 1995. Principales características de algunas especies forestales susceptibles de aprovechamiento comercial en el Estado de Jalisco. Programa de Desarrollo Forestal Integral del Estado de Jalisco. Guadalajara, Jal. México. 32 p. SEDER. 1996. Principales características de algunas especies forestales susceptibles de aprovechamiento comercial en el Estado de Jalisco. Programa de Desarrollo Forestal Integral del Estado de Jalisco. Guadalajara, Jal. México. 32 p. SEMARNAP. 1999. Establecimiento de plantaciones de Cedrela odorata L. en México. Nota Técnica. No. 13. Subsecretaría de Recursos Naturales. Dirección General Forestal. México, D. F. 8 p. Sepatro. 2001. Semillas y Productos Agroforestales del Trópico, S. P. R. de R. L. de C. V. Serrano M. J. R. y Sáenz M. 2005. Trabajabilidad de Teca (Tectona grandis) de Costa Rica y Panamá. Escuela de Ingeniería Forestal, Instituto Tecnológico de Costa Rica-Fundación Tecnológica de Costa Rica. Costa Rica. SIRE. 2005. (a). Acrocarpus fraxinifollius Wiight et Arn. Paquetes Tecnológicos. CONABIO-PRONARE. In: http://www.arboraccess.com/wca/qryBotName.ASP ?Botanical+Name=264 SIRE. 2005. (b). Paquetes tecnológicos. Brosimum alicastrum Swarts. CONABIOPRONARE. In: (http://www.icraf.cgiar.org/treessd/AFT/Images/IMG00334.jpg). SIRE. 2005. (c). Paquetes Tecnológicos. Tectona grandis. CONABIO-SEMARNAP. In: http://www.icraf.cgiar.org/treessd/AFT/Images/IMG00334.jpg 197 Somarriba E., Berr J., Morataya R. y Calvo G.. 1999. Linderos de Tectona grandis L. F. en el trópico húmedo de Costa Rica y Panamá. Revista Centroamericana. CATIE No. 28. Costa Rica. Sosa J. L. 1997. Evaluación de plantaciones de cedro (Cedrela odorata L.) y caoba (Swietenia macrophylla King) en sistemas agroforestales en el área del bosque modelo, Calakmul, Campeche. Tesis de Licenciatura. Universidad Autónoma Chapingo. División de Ciencias Forestales. Chapingo, México. 106 p. Sotomayor C. J. R. 2005. Características mecánicas y clasificación de la madera de 150 especies mexicanas. Vol. 1, Número 1. Investigación e Ingeniería de la Madera. Sociedad Mexicana de Ciencia y Tecnología de la Madera. UMSNH. Morelia, Mich. 21 p. Susano H. R. 1981. Especies arbóreas forestales susceptibles de aprovecharse como forraje. Cien. For. 29 (6):31-39. Treviño T. D. y Jara N. L. F. 1988. Memorias ―Seminario–Taller sobre investigaciones en semillas Forestales Tropicales. Bogotá; Octubre 26 al 28. Serie de documentación No. 18. Colombia. p. 64-79. Treviño T. D., Acosta R. S. y Castillo A. 1990. Técnicas de manejo de semillas para algunas especies forestales neotropicales en Colombia. Proyecto cooperativo: CONIF- INDERENA-CHD (Canadá). Serie de Documentación No. 10. Colombia. p. 68-75. Valero U. W., Reyes C. E. C., León H. W. J. y Garay J. D. A. 2005. Relación entre anatomía y propiedades físico-mecánicas de la especie Tectona grandis proveniente de los llanos occidentales de Venezuela. Laboratorio Nacional de Productos Forestales. Universidad de Los Andes. Mérida, Venezuela. Vega G. L. E., Leguizamo B. A. y Patiño A. H. 1985. Asociación de Cedrela odorata L., Borojoa patinoi Cuatr. y Pauteria caimito en rotación con barbecho y cultivos agrícolas en bajo Calima, Colombia. Serie Técnica No. 14. Corporación Nacional de Investigación y Fomento Forestal. Bogotá, Colombia. Vega L. A. 1989. Metodología para la delimitación de los trópicos húmedo y seco de México por medio de los tipos de vegetación. SARH-COTECOCA. México, D. F. 86 p. Vega L. A., Valdez H. J. I. y Cetina A. V. M. 2003. Zonas ecológicas de Brosimun alicastrum Sw. en la Costa del Pacífico Mexicano. Madera y Bosques 9(1):2553. 198 Von Carlowitz P. G., Wolf G. V. y Kemperman R. E. 1991. The Multipurpose and Shrub Database. An Information and Decision-Support System. User’s manual, Versión 1.0. ICRAF. Nairobi, Kenia. Weeb D. G. 1980. Guía y clave para seleccionar especies en ensayos forestales de regiones tropicales y subtropicales, Overascas development administration Londres, Inglaterra. 275 p. Weeb D. G. 1984. Guía y clave para seleccionar especies en ensayos forestales de regiones tropicales y subtropicales. Development Administration. Londres, Inglaterra. 275 p. Whitmore J. L. y Otarola A. T. 1976. Acrocarpus faxinifolius Wight., especie de rápido crecimiento inicial, buena forma y madera de uso múltiple. In: Turrialba 26:2. CATIE. Turrialba. Costa Rica. p. 201-203. Zavala Z. D. 1999. Secado de maderas tropicales en estufas convencionales. Cien. For. en Méx. 24 (86):65-82. 199 AGRADECIMIENTOS Para la realización de este trabajo se recopiló información de un gran número de autores que han generado conocimientos científicos y tecnológicos, tanto de Universidades como de Instituciones nacionales y del extranjero que realizan investigación sobre las especies forestales que se exponen en este documento, por lo que expresamos nuestro agradecimiento y reconocimiento, ya que son los generadores de la información. Nuestro agradecimiento a la Comisión Forestal del Estado de Michoacán (COFOM) y a la Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT), por las aportaciones de recursos económicos para la realización del presente documento. Al Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), con gratitud y esperanza. Un agradecimiento muy especial al Dr. Ignacio Vidales Fernández, Director de Coordinación y Vinculación Estatal del INIFAP, por las facilidades de apoyo logístico y al Ing. Vicente Rangel Piñón, Ex Subdirector de Restauración Forestal de la COFOM, por el apoyo y sugerencias aportadas. Nuestro agradecimiento a las secretarias: Ma. Estela Coria Arreola, Silvia Medina Argueta y Marcela Oseguera Figueroa, por su invaluable labor en la captura de la información. 200 ESTA PUBLICACIÓN ES PRODUCTO DEL PROYECTO: DETERMINACIÓN DE ÁREAS POTENCIALES PARA ESTABLECIMIENTO DE PLANTACIONES FORESTALES COMERCIALES EN EL ESTADO DE MICHOACÁN, FINANCIADO POR LA COMISIÓN FORESTAL DEL ESTADO DE MICHOACÁN 201 Impreso en los talleres de la Comisión Forestal del Estado de Michoacán Calle Justo Mendoza. Bosque Cuauhtémoc Lote 11 Col. Centro C. P. 58000 Morelia, Mich. Teléfono: (443) 3-12-30-26 y 3-12-3742 Fax: (443) 3-12-39-06 La edición consta de 500 ejemplares Impreso en México Printed in México Septiembre de 2012 202 COORDINADORES DE LA INFORMACIÓN Dr. Gerardo Salazar Gutiérrez Dr. Ignacio Vidales Fernández REVISIÓN TÉCNICA M. C. Antonio Cano Pineda Dr. J. Jesús García Magaña Biol. Jaqueline Xelhuantzi Carmona M. C. Álvaro Agustín Chávez Durán EDICIÓN Ing. J. Trinidad Sáenz Reyes COMITÉ EDITORIAL DEL C. E. URUAPAN Presidente: Secretario: Vocales: Ing. H. Jesús Muñoz Flores Ing. J. Trinidad Sáenz Reyes Dr. Víctor Manuel Coria Ávalos Dr. Luis Eduardo Cossío Vargas Código de publicación UNESCO-INIFAP-SAGARPA MX-0-310605-52-05-27-06-15 Para mayor información acuda, llame ó escriba a: Centro de Investigación Regional Pacífico Centro. INIFAP Parque Los Colomos s/n. Colonia Providencia Apartado Postal 6-103 C.P. 44660 Guadalajara, Jalisco, México. Tel.: (33) 36 41 69 71 y (33) 36 41 60 21 Fax: (33) 36 41 35 98 Campo Experimental Uruapan Av. Latinoamericana 1101 Col. Revolución C. P. 60150, Uruapan, Michoacán Tel. (452) 523-73-92 Fax (452) 524-40-95 CAMPO EXPERIMENTAL URUAPAN Dr. Ignacio Vidales Fernández Jefe de Campo Ing. Alma Adriana Zamudio Cervantes Jefe de Operación CP. Alejandro Alcántar Palomera Jefe Administrativo PERSONAL INVESTIGADOR Ing. Mauro Raúl Mendoza López Frutales Caducifolios Dr. Víctor Manuel Coria Avalos Frutales Tropicales MC. Juan Antonio Herrera González Frutales Tropicales MC. Antonio Larios Guzmán Frutales Tropicales Dr. Luis Mario Tapia Vargas Frutales Tropicales Ing. Lucas Madrigal Huendo Plantaciones y Sistemas Agroforestales Ing. H. Jesús Muñoz Flores Plantaciones y Sistemas Agroforestales MC. Gabriela Orozco Gutiérrez Plantaciones y Sistemas Agroforestales Ing. J. Trinidad Sáenz Reyes Plantaciones y Sistemas Agroforestales Dr. Fernando Bahena Juárez Sanidad Vegetal Biol. Miguel B. Nájera Rincón Sanidad Vegetal MC. Gerardo Barrera Camacho Socioeconomía MVZ. Clicerio Ibáñez Reducindo Transferencia de Tecnología Ing. Jorge Jiménez Ochoa Transferencia de Tecnología Centros Nacionales de investigación Disciplinaria, Centros de Investigación Regional y Campos Experimentales Sede de Centro de Investigación Regional Centro Nacional de Investigación Disciplinaria Campo Experimental www. gobiernofederal.gob.mx www. sagarpa.gob.mx www. inifap.gob.mx