Continuación y bibliografía
Anuncio
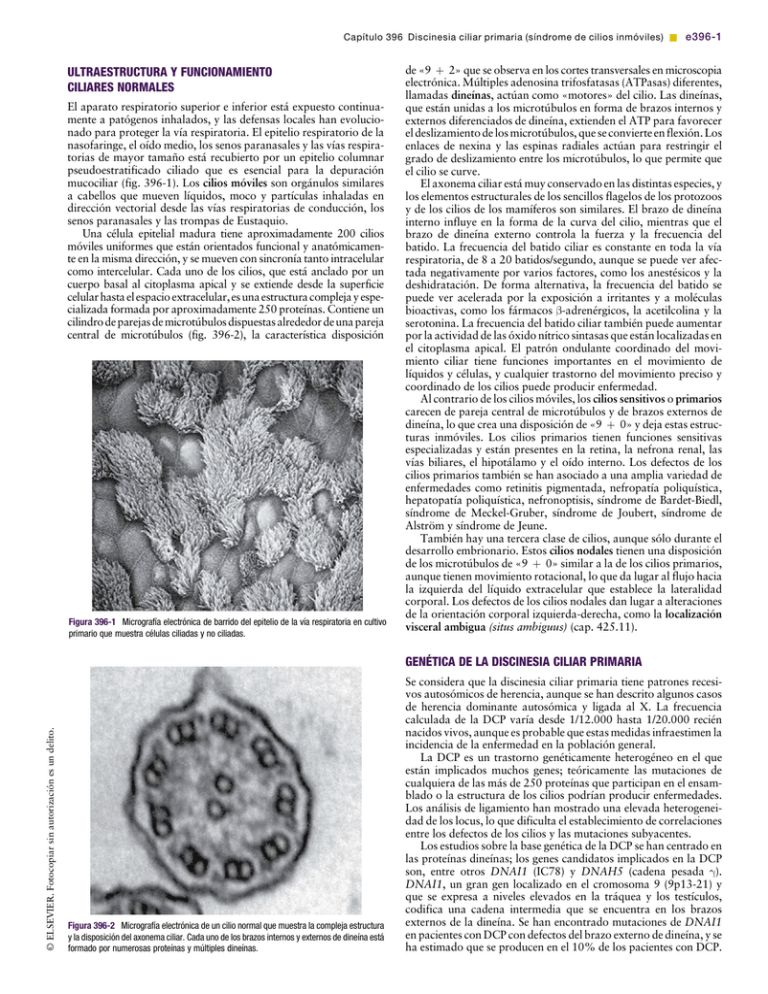
Capítulo 396 Discinesia ciliar primaria (síndrome de cilios inmóviles) & e396-1 ULTRAESTRUCTURA Y FUNCIONAMIENTO CILIARES NORMALES El aparato respiratorio superior e inferior está expuesto continuamente a patógenos inhalados, y las defensas locales han evolucionado para proteger la vía respiratoria. El epitelio respiratorio de la nasofaringe, el oído medio, los senos paranasales y las vías respiratorias de mayor tamaño está recubierto por un epitelio columnar pseudoestratificado ciliado que es esencial para la depuración mucociliar (fig. 396-1). Los cilios móviles son orgánulos similares a cabellos que mueven líquidos, moco y partículas inhaladas en dirección vectorial desde las vías respiratorias de conducción, los senos paranasales y las trompas de Eustaquio. Una célula epitelial madura tiene aproximadamente 200 cilios móviles uniformes que están orientados funcional y anatómicamente en la misma dirección, y se mueven con sincronía tanto intracelular como intercelular. Cada uno de los cilios, que está anclado por un cuerpo basal al citoplasma apical y se extiende desde la superficie celular hasta el espacio extracelular, es una estructura compleja y especializada formada por aproximadamente 250 proteínas. Contiene un cilindro de parejas de microtúbulos dispuestas alrededor de una pareja central de microtúbulos (fig. 396-2), la característica disposición [(Figura_1)TD$IG] © ELSEVIER. Fotocopiar sin autorización es un delito. Figura 396-1 Micrografía electrónica de barrido del epitelio de la vía respiratoria en cultivo primario que muestra células ciliadas y no ciliadas. de «9 þ 2» que se observa en los cortes transversales en microscopia electrónica. Múltiples adenosina trifosfatasas (ATPasas) diferentes, llamadas dineínas, actúan como «motores» del cilio. Las dineínas, que están unidas a los microtúbulos en forma de brazos internos y externos diferenciados de dineína, extienden el ATP para favorecer el deslizamiento de los microtúbulos, que se convierte en flexión. Los enlaces de nexina y las espinas radiales actúan para restringir el grado de deslizamiento entre los microtúbulos, lo que permite que el cilio se curve. El axonema ciliar está muy conservado en las distintas especies, y los elementos estructurales de los sencillos flagelos de los protozoos y de los cilios de los mamíferos son similares. El brazo de dineína interno influye en la forma de la curva del cilio, mientras que el brazo de dineína externo controla la fuerza y la frecuencia del batido. La frecuencia del batido ciliar es constante en toda la vía respiratoria, de 8 a 20 batidos/segundo, aunque se puede ver afectada negativamente por varios factores, como los anestésicos y la deshidratación. De forma alternativa, la frecuencia del batido se puede ver acelerada por la exposición a irritantes y a moléculas bioactivas, como los fármacos b-adrenérgicos, la acetilcolina y la serotonina. La frecuencia del batido ciliar también puede aumentar por la actividad de las óxido nítrico sintasas que están localizadas en el citoplasma apical. El patrón ondulante coordinado del movimiento ciliar tiene funciones importantes en el movimiento de líquidos y células, y cualquier trastorno del movimiento preciso y coordinado de los cilios puede producir enfermedad. Al contrario de los cilios móviles, los cilios sensitivos o primarios carecen de pareja central de microtúbulos y de brazos externos de dineína, lo que crea una disposición de «9 þ 0» y deja estas estructuras inmóviles. Los cilios primarios tienen funciones sensitivas especializadas y están presentes en la retina, la nefrona renal, las vías biliares, el hipotálamo y el oído interno. Los defectos de los cilios primarios también se han asociado a una amplia variedad de enfermedades como retinitis pigmentada, nefropatía poliquística, hepatopatía poliquística, nefronoptisis, síndrome de Bardet-Biedl, síndrome de Meckel-Gruber, síndrome de Joubert, síndrome de Alström y síndrome de Jeune. También hay una tercera clase de cilios, aunque sólo durante el desarrollo embrionario. Estos cilios nodales tienen una disposición de los microtúbulos de «9 þ 0» similar a la de los cilios primarios, aunque tienen movimiento rotacional, lo que da lugar al flujo hacia la izquierda del líquido extracelular que establece la lateralidad corporal. Los defectos de los cilios nodales dan lugar a alteraciones de la orientación corporal izquierda-derecha, como la localización visceral ambigua (situs ambiguus) (cap. 425.11). [(Figura_2)TD$IG] GENÉTICA DE LA DISCINESIA CILIAR PRIMARIA Figura 396-2 Micrografía electrónica de un cilio normal que muestra la compleja estructura y la disposición del axonema ciliar. Cada uno de los brazos internos y externos de dineína está formado por numerosas proteínas y múltiples dineínas. Se considera que la discinesia ciliar primaria tiene patrones recesivos autosómicos de herencia, aunque se han descrito algunos casos de herencia dominante autosómica y ligada al X. La frecuencia calculada de la DCP varía desde 1/12.000 hasta 1/20.000 recién nacidos vivos, aunque es probable que estas medidas infraestimen la incidencia de la enfermedad en la población general. La DCP es un trastorno genéticamente heterogéneo en el que están implicados muchos genes; teóricamente las mutaciones de cualquiera de las más de 250 proteínas que participan en el ensamblado o la estructura de los cilios podrían producir enfermedades. Los análisis de ligamiento han mostrado una elevada heterogeneidad de los locus, lo que dificulta el establecimiento de correlaciones entre los defectos de los cilios y las mutaciones subyacentes. Los estudios sobre la base genética de la DCP se han centrado en las proteínas dineínas; los genes candidatos implicados en la DCP son, entre otros DNAI1 (IC78) y DNAH5 (cadena pesada g). DNAI1, un gran gen localizado en el cromosoma 9 (9p13-21) y que se expresa a niveles elevados en la tráquea y los testículos, codifica una cadena intermedia que se encuentra en los brazos externos de la dineína. Se han encontrado mutaciones de DNAI1 en pacientes con DCP con defectos del brazo externo de dineína, y se ha estimado que se producen en el 10% de los pacientes con DCP. e396-2 & Parte XIX El aparato respiratorio En familias con DCP también se han encontrado varias mutaciones diferentes de otro gen, DNAH5, un gen de la cadena pesada de la dineína axonémica localizado en el cromosoma 5p (5p14-5p15) y que se expresa en el pulmón, el riñón, el encéfalo y los testículos. Más de la mitad de los pacientes con DCP con defectos conocidos del brazo externo de dineína tienen mutaciones de DNAH5. Otros genes (DNAH11, TXNDC y DNAI2) están implicados también en la DCP. DNAH11 es particularmente interesante porque se ha demostrado que las mutaciones de este gen producen serotipos clínicos típicos sin defectos ultraestructurales aparentes del axonema. MANIFESTACIONES CLÍNICAS DE LA DISCINESIA CILIAR PRIMARIA (TABLA 396-1) La mayoría de los pacientes con DCP consultan en el período neonatal, poco después del nacimiento, por dificultad respiratoria, que se manifiesta como taquipnea, hipoxemia o incluso insuficiencia respiratoria que precisa ventilación mecánica. No se ha reconocido lo suficiente la asociación entre la dificultad respiratoria en recién nacidos a término y la DCP. La tos crónica y la rinosinusitis persistente han estado presentes con frecuencia desde el comienzo de la lactancia. En relación con la afectación de la vía respiratoria superior, el lactante puede tener problemas para alimentarse y retraso del crecimiento, similar al efecto de la fibrosis quística (cap. 395), lo cual puede confundir el diagnóstico. De hecho, el aparato respiratorio superior está afectado casi siempre en la DCP. La inadecuación innata de la depuración de moco se manifiesta como sinusitis crónica (cap. 372) y poliposis nasal. La enfermedad del oído medio es frecuente, con grados variables de otitis media crónica que producen pérdida auditiva de conducción y necesidad de colocación de tubos de miringotomía, lo que con frecuencia se complica por otorrea recurrente. La alteración de la depuración mucociliar del aparato respiratorio inferior produce tos crónica secundaria a neumonía o bronquitis recurrente. Los cultivos bacterianos del esputo o de los aspirados bronquiales con frecuencia permiten detectar Haemophilus influenzae no tipificable (cap. 186), Staphylococcus aureus (cap. 174.1), Streptococcus pneumoniae (cap. 175) y Pseudomonas aeruginosa (cap. 197.1). La infección y la inflamación persistente de las vías respiratorias producen bronquiectasias, incluso en niños en edad preescolar. Las acropaquias son un signo de afectación pulmonar crónica. En la DCP se encuentran defectos de la lateralidad izquierdaderecha; el 50% de los pacientes tienen localización visceral Tabla 396-1 MANIFESTACIONES CLÍNICAS DE LA DISCINESIA CILIAR PRIMARIA APARATO RESPIRATORIO Pulmón Dificultad respiratoria neonatal Tos crónica Neumonía recurrente Bronquiectasias Oído medio Otitis media crónica Pérdida auditiva de conducción Senos paranasales Rinitis neonatal Rinitis mucopurulenta crónica Pansinusitis crónica Poliposis nasal APARATO GENITOURINARIO Infertilidad masculina y femenina DEFECTOS DE LA ORIENTACIÓN IZQUIERDA-DERECHA Localización visceral invertida (situs inversus) Heterotaxia SISTEMA NERVIOSO CENTRAL Hidrocefalia Retinitis pigmentada invertida total (situs inversus totalis) con transposición de los órganos torácicos y abdominales. Cuando no hay ganglios nodales funcionales en el período embrionario la orientación toracoabdominal es aleatoria. Estos pacientes tienen la tríada de Kartagener, que se define como localización visceral invertida total, sinusitis crónica y bronquiectasias. Aproximadamente el 25% de los pacientes con localización visceral invertida total tienen DCP, aunque la localización invertida total por sí sola no establece el diagnóstico de DCP. En la DCP se han descrito otras formas de defectos de la lateralidad, como heterotaxia, y pueden coexistir con malformaciones congénitas cardíacas, asplenia o poliesplenia. La mayoría de los hombres con DCP tienen espermatozoides inmóviles porque las ultraestructuras de la maquinaria central del flagelo y del cilio móvil son similares. La infertilidad masculina es típica, pero no se encuentra siempre en esa enfermedad. También se han descrito problemas de fertilidad en mujeres; probablemente se deban a disfunción ciliar de las trompas de Falopio. Algunas descripciones de casos han relacionado la hidrocefalia neonatal con la DCP. Los epéndimos de los ventrículos cerebrales están tapizados por epitelio ciliado y son importantes para el flujo del líquido cefalorraquídeo a través de los ventrículos y el acueducto de Silvio. Se ha propuesto que el hallazgo de ventrículos cerebrales dilatados en la ecografía, asociado a localización invertida total, es un marcador diagnóstico prenatal de DCP. Se ha vinculado la retinitis pigmentada con la DCP. Las proteínas de transporte intraflagelares son esenciales para el ensamblado de los fotorreceptores, y cuando están mutadas dan lugar a apoptosis dentro del epitelio pigmentado de la retina (cap. 622). La retinitis pigmentada ligada al cromosoma X se ha asociado a infecciones respiratorias recurrentes en familias con mutaciones del gen RPGR. DIAGNÓSTICO DE DISCINESIA CILIAR PRIMARIA Actualmente el diagnóstico de DCP precisa la presencia del fenotipo clínico característico y de defectos ultraestructurales de los cilios. Debe sospecharse en niños con infecciones crónicas o recurrentes del aparato respiratorio superior e inferior. La manifestación clínica de la DCP puede ser variable y sutil en las formas más leves de esta enfermedad, en las que se conserva de forma parcial el funcionamiento ciliar. Incluso en niños que tienen los datos clínicos clásicos, como rinitis crónica en la lactancia, otitis media persistente o incluso localización visceral invertida total, el diagnóstico con frecuencia es tardío. La media de edad en el momento del diagnóstico de DCP es >4 años; es necesario un elevado índice de sospecha. Los estudios de imagen muestran afectación extensa de los senos paranasales. En la radiografía de tórax con frecuencia se ve hiperinsuflación pulmonar bilateral, infiltrados peribronquiales y atelectasia lobular. La TC del tórax muchas veces muestra bronquiectasias, incluso en niños pequeños. La presencia de localización visceral invertida total en un niño que tiene síntomas crónicos del aparato respiratorio es prácticamente diagnóstica de DCP, aunque esta configuración se produce sólo en el 50% de los pacientes con DCP. El estudio funcional respiratorio de niños mayores habitualmente muestra obstrucción progresiva de la vía respiratoria intratorácica. La microscopia electrónica de transmisión es en la actualidad el método de referencia para evaluar los efectos ultraestructurales del cilio. El legrado del epitelio nasal o del cepillado bronquial puede ofrecer una muestra adecuada para su estudio. La identificación de un defecto discreto y constante en cualquier aspecto de la estructura ciliar, con los consiguientes rasgos fenotípicos, es suficiente para hacer el diagnóstico. El acortamiento o la ausencia de brazos de dineína es la alteración más frecuente que se ve en la DCP, y es responsable del 90% de los casos que tienen defectos ultraestructurales definidos (fig. 396-3). Otros cambios axonémicos compatibles con la DCP son transposición microtubular, defectos de las prolongaciones radiales y de los enlaces de nexina, y agenesia ciliar. Lamentablemente, el estudio ultraestructural de los cilios como prueba diagnóstica para detectar DCP tiene inconvenientes significativos. Es necesaria una interpretación cuidadosa de los hallazgos Capítulo 396 Discinesia ciliar primaria (síndrome de cilios inmóviles) & e396-3 [(Figura_3)TD$IG] TRATAMIENTO © ELSEVIER. Fotocopiar sin autorización es un delito. Figura 396-3 Micrografía electrónica de cilios obtenidos de un paciente con discinesia ciliar primaria (síndrome de Kartagener). Aunque el axonema ciliar tiene la conformación normal de «9 þ 2», los brazos interno y externo de dineína están ausentes en todos los cilios. ultraestructurales porque se pueden ver cambios secundarios inespecíficos por la exposición a contaminantes ambientales e infecciones. Los defectos ciliares pueden ser adquiridos. La infección y la inflamación agudas de la vía respiratoria pueden producir cambios ultraestructurales (fusión de cilios y cilios con aspecto vesicular). También se ha propuesto la alteración de la orientación de los cilios como una forma de discinesia ciliar primaria, aunque este fenómeno puede ser la consecuencia de una lesión de la vía respiratoria. Con frecuencia el diagnóstico de DCP se puede diferir o pasar por alto porque se obtiene una muestra de tejido inadecuada o se procesa de manera errónea, además de la ausencia de un anatomopatólogo con experiencia que pueda distinguir entre los defectos ciliares primarios y los adquiridos. En varias revisiones se ha propuesto el cultivo de las células epiteliales de la vía respiratoria para permitir que se resuelvan los cambios secundarios. Sin embargo, la presencia de una ultraestructura normal del axonema no excluye la DCP. Se han utilizado pruebas cualitativas para evaluar el funcionamiento ciliar como técnicas de cribado de la DCP. La prueba de la sacarina se ha aplicado para valorar cualitativamente el funcionamiento mucociliar. Este abordaje tiene varias limitaciones. No está estandarizado, no distingue entre las formas primarias y secundarias de discinesia ciliar y no se puede utilizar en niños pequeños. También se han utilizado como pruebas de cribado mediciones de la frecuencia del batido ciliar que utilizan técnicas microscópicas convencionales. Este método por sí solo pasará por alto algunos casos de DCP, como la transposición ciliar, porque estos defectos pueden tener una frecuencia de batido normal. La visualización digital de elevada resolución y a alta velocidad del movimiento ciliar en múltiples planos ha permitido un análisis más completo de los patrones de batido ciliar anormal. También se ha utilizado la visualización con inmunofluorescencia para mostrar la localización errónea de las proteínas de los datos de dineína. Estas técnicas son herramientas de investigación y no están disponibles de forma generalizada. Otro abordaje aprovecha la observación de que la concentración nasal de óxido nítrico (NO) está reducida en pacientes con DCP. Como la medición del NO nasal es relativamente fácil de realizar y no es invasora, este método es una prueba prometedora para el cribado de DCP en pacientes >5 años, siempre que se haya excluido la fibrosis quística (cap. 395). Se han descrito pocos estudios en niños pequeños, y no se ha establecido la exactitud de la medición del NO nasal en lactantes. Se dispone de estudio genético para la DCP, y los laboratorios comerciales ofrecen el estudio de mutaciones específicas de DNAI1 y DNAH5. No se ha estudiado adecuadamente ningún tratamiento de modo que se pueda demostrar su eficacia en la DCP. Muchos de los tratamientos aplicados a pacientes con DCP son similares a los que se utilizan en otras neumopatías supurativas caracterizadas por alteración de la depuración de las vías respiratorias y bronquiectasias, como la fibrosis quística. No se ha demostrado que ningún tratamiento corrija la disfunción ciliar en la DCP. Las estrategias para mejorar la depuración mucociliar son fundamentales para el tratamiento de la DCP, y la limpieza frecuente de la vía respiratoria con drenaje postural, chalecos de percusión, dispositivos de presión positiva espiratoria y otras técnicas se debe aplicar a diario. Como hay un deterioro del funcionamiento ciliar, la tos se convierte en un mecanismo fundamental para la eliminación del moco, y no se debe suprimir. El ejercicio puede mejorar la limpieza de la vía respiratoria en pacientes con DCP, y se debe fomentar. Con frecuencia se utilizan mucolíticos inhalados para el tratamiento de la fibrosis quística, y algunas descripciones de casos han mostrado mejoría del funcionamiento pulmonar en pacientes con DCP después de este tratamiento. Deben realizarse estudios más extensos que respalden estos hallazgos antes de que se puedan utilizar habitualmente estos fármacos como tratamiento de mantenimiento en la DCP. Cuando los niños que tienen DCP presentan síntomas respiratorios cada vez más intensos compatibles con infección, se debe iniciar el tratamiento antimicrobiano de acuerdo con los resultados del cultivo respiratorio y la sensibilidad bacteriana. No se han estudiado estrategias de erradicación temprana para eliminar las bacterias del pulmón con DCP. Se puede utilizar con precaución el tratamiento de mantenimiento con antibióticos inhalados u orales en pacientes con DCP que tienen bronquiectasias o agudizaciones frecuentes, aunque en la literatura médica actual no hay datos que respalden el tratamiento antimicrobiano a largo plazo. La vacunación contra la tos ferina, la gripe y el neumococo es un pilar del tratamiento. Otras medidas preventivas adicionales son evitar el humo de tabaco y otros irritantes de las vías respiratorias. Aunque se ha demostrado que los agonistas b-adrenérgicos mejoran la frecuencia del batido ciliar en modelos de células epiteliales, no hay datos que muestren que mejoran el funcionamiento de los cilios discinéticos. Además, estos fármacos no producen necesariamente broncodilatación en pacientes con DCP y enfermedad obstructiva de las vías respiratorias. En pacientes con DCP se ha realizado la resección quirúrgica del pulmón bronquiectásico, habitualmente en casos de enfermedad localizada con hemoptisis grave o infecciones febriles recurrentes. No está claro que las intervenciones quirúrgicas produzcan ninguna mejoría a largo plazo ni ninguna prolongación de la supervivencia. En pacientes con DCP se ha descrito progresión hasta neumopatía terminal. En pacientes adultos se ha realizado con éxito el trasplante cardiopulmonar, bipulmonar o lobular de donante vivo. La localización visceral invertida total complica la intervención debido a las consideraciones anatómicas. Por lo demás, la supervivencia es similar a la de otros receptores de trasplante. Hay controversia sobre el tratamiento de la otitis media y los derrames del oído medio en pacientes con DCP. En niños con DCP se utilizan con frecuencia tubos de miringotomía, aunque no carecen de complicaciones porque pueden producir otorrea mucoide crónica, perforación permanente de la membrana y timpanoesclerosis. Los tubos de miringotomía no han producido mejorías mensurables de la agudeza auditiva. Aunque la audición tiende a mejorar con el tiempo, se debe realizar un cribado sistemático, y se deben utilizar audífonos cuando sea necesario. La rinitis y la sinusitis crónicas son manifestaciones clínicas frecuentes de la DCP. No se ha demostrado que ningún tratamiento sea eficaz, aunque con frecuencia se trata a los pacientes con lavado sinusal y antibióticos sistémicos cuando tienen síntomas. Como con cualquier otra sobreutilización de antimicrobianos, es preocupante la aparición de microorganismos resistentes. Cuando los síntomas iniciales son intensos o refractarios al tratamiento médico se puede e396-4 & Parte XIX El aparato respiratorio realizar cirugía sinusal endoscópica para favorecer el drenaje o la aplicación local de medicamentos. PRONÓSTICO Aunque en las primeras fases de la DCP predominan los síntomas y signos relacionados con la enfermedad del aparato respiratorio superior, las manifestaciones clínicas de la enfermedad de las vías respiratorias inferiores tienden a aumentar con la edad y se convierte en la principal causa de morbilidad y mortalidad en pacientes con DCP. Se piensa que se puede retrasar la progresión y la extensión de la neumopatía con un diagnóstico y un tratamiento tempranos. Por tanto, los estudios de seguimiento sistemático recomendaron que la asistencia de los niños con DCP incluya espirometría para monitorizar el funcionamiento pulmonar, radiografías de tórax y cultivos de esputo o de secreciones orofaríngeas para evaluar la flora de las vías respiratorias. Los pacientes con DCP habitualmente tienen un deterioro más lento del funcionamiento pulmonar que los que tienen fibrosis quística; el pronóstico y la supervivencia a largo plazo son mejores. De hecho, la mayoría de los pacientes con DCP tienen una esperanza de vida normal o casi normal, aunque algunos tienen bronquiectasias progresivas e insuficiencia respiratoria. BIBLIOGRAFÍA Bush A, Chodhari R, Collins N, et al: Primary ciliary dyskinesia: current state of the art, Arch Dis Child 92:1136-1140, 2007. Bush A, Cole P, Hariri M, et al: Primary ciliary dyskinesia: diagnosis and standards of care, Eur Respir J 12:982-988, 1998. Ibanez-Tallon I, Heintz N, Omran H: To beat or not to beat: roles of cilia in development and disease, Hum Mol Genet 12:R27-R35, 2003. Kennedy MP, Omran H, Leigh MW, et al: Congenital heart disease and other heterotaxic defects in a large cohort of patients with primary ciliary dyskinesia, Circulation 115:2814-2821, 2007. Knowles MR, Boucher RC: Mucus clearance as a primary innate defense mechanism for mammalian airways, J Clin Invest 109: 571-577, 2002. Leigh MW, Pittman JE, Carson JL, et al: Clinical and genetic aspects of primary ciliary dyskinesia and Kartagener syndrome, Genet Med 11:473-487, 2009. Lie H, Ferkol T: Primary ciliary dyskinesia: recent advances in pathogenesis, diagnosis and treatment, Drugs 67:1883-1892, 2007. Noone PG, Leigh MW, Sannuti A, et al: Primary ciliary dyskinesia: diagnostic and phenotypic features, Am J Respir Crit Care Med 169: 459-467, 2004.