Guía de estudio
Anuncio

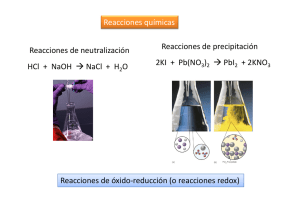
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM ESCUELA DE FORMACIÓN DE PROFESORES DE NIVEL MEDIO –EFPEM– REACCIONES DE OXIDO-REDUCCION (REDOX) Elaborado por: Lic. Raúl Hernández Mazariegos 1. Defina los siguientes términos: a) Oxidación b) Reducción c) Número o estado de oxidación d) Electrones transferidos e) Agente oxidante f) Agente reductor 2. 3. Indique el número de oxidación del: a) B en el B2O3 b) I en el NaIO4 c) Cr en el K2Cr2O7 d) S en el Fe2(SO3)3 e) N en el (NH4)3PO4 Escriba las letras AO debajo del agente oxidante y AR debajo del agente reductor en las siguientes ecuaciones: 2Fe 3Cl2 2FeCl3 a) b) Mg Cu( NO3 )2 Cu Mg ( NO3 )2 c) 2PbO C 2Pb CO2 d) Cl2 2 NaBr Br2 2 NaCl 1|Página UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM ESCUELA DE FORMACIÓN DE PROFESORES DE NIVEL MEDIO –EFPEM– Ejemplo 1 para ajustar una reacción redox por el método de la variación en el estado de oxidación: H 2O H 2 O2 Lo primero es escribir los estados de oxidación. 1 2 0 1 2 0 0 H 2 O H 2 O2 Ahora, determine quién se oxida, observando quién aumenta su número o estado de oxidación. 0 H 2 O H 2 O2 oxidación 2 0 O O2 Ahora, determine quién es el agente reductor 1 2 0 Agente reductor reducción 0 H 2 O H 2 O2 1 0 H2 H2 Ahora, determine quién se reduce, observando quién disminuye su estado de oxidación. 1 2 0 Agente reductor reducción 0 H 2 O H 2 O2 1 0 H2 H2 Ahora, determine quién es el agente oxidante 1 2 0 Agente reductor y oxidante reducción 0 H 2 O H 2 O2 1 0 H2 H2 Ahora, determine el número de electrones perdidos en la oxidación y el número de electrones ganados en la reducción. 1 2 H2 O Agente reductor y oxidante 0 H2 0 reducción 1e x 2 H 2 e O2 oxidación 2 e x 2 O 4 e Cruce estos dos valores. Estos los primeros dos coeficientes. 1 2 0 0 H 2 O 4H 2 Agente reductor y oxidante reducción 1e x 2 H 2 e 2O2 oxidación 2 e x 2 O 4 e Ajuste por tanteo el resto de sustancias. 1 2 0 4H 2 O 4H 2 Agente reductor y oxidante reducción 1e x 2 H 2 e 0 2O2 oxidación 2 e x 2 O 4 e Finalmente, simplifique los coeficientes ya que todos son divisibles entre 2. 1 2 0 2H 2 O 2H 2 Agente reductor y oxidante 2|Página reducción 1e x 2 H 2 e 0 O2 oxidación 2 e x 2 O 4 e UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM ESCUELA DE FORMACIÓN DE PROFESORES DE NIVEL MEDIO –EFPEM– Ejemplo 2 para ajustar una reacción redox por el método de la variación en el estado de oxidación: Cu HNO3 Cu( NO3 )2 NO2 H 2O Lo primero es escribir los estados de oxidación. 0 1 5 2 2 5 2 4 2 1 2 0 1 5 2 2 5 2 4 2 1 2 Cu H N O3 Cu ( N O3 )2 N O2 H 2 O Ahora, determine quién se oxida, observando quién aumenta su número o estado de oxidación. Cu H N O3 Cu ( N O3 )2 N O2 H 2 O oxidación 0 Cu Cu 2 Ahora, determine quién es el agente reductor. 1 5 2 0 2 5 2 4 2 1 2 Cu H N O3 Cu ( N O3 )2 N O2 H 2 O Agente reductor oxidación Ahora, determine quien se reduce, observando quién disminuye su estado de oxidación. 1 5 2 0 2 5 2 4 2 1 2 Cu H N O3 Cu ( N O3 )2 N O2 H 2 O Agente reductor reducción oxidación 5 4 N N Ahora, determine quién es el agente oxidante. 0 1 5 2 Agente reductor Agente oxidante 2 5 2 1 2 Cu H N O3 Cu ( N O3 )2 NO2 H 2 O reducción 1e oxidación 2 e Cruce estos dos valores. Estos los primeros dos coeficientes. 0 1 5 2 Agente reductor Agente oxidante 2 5 2 1 2 Cu H N O3 Cu ( N O3 ) 2 2 NO2 H 2 O oxidación 2 e reducción 1e Ajuste por tanteo el resto de sustancias. 0 1 5 2 2 5 2 1 2 2 Cu 4 H N O3 Cu ( N O3 ) 2 2 NO2 2 H 2 O Agente reductor Agente oxidante oxidación 2 e reducción 1e Ajuste las siguientes reacciones e indique que elemento se oxida, se reduce, agente oxidante, agente reductor y el número de electrones transferidos: 4. KMnO4 HCl MnCl2 Cl2 KCl H 2O a) Estados de oxidación: b) Elemento que se oxida: c) Elemento que se reduce: 3|Página UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM ESCUELA DE FORMACIÓN DE PROFESORES DE NIVEL MEDIO –EFPEM– d) Agente oxidante: e) Agente reductor: f) Electrones transferidos: 5. FeSO4 KMnO4 H 2 SO4 Fe2 (SO4 )3 MnSO4 K2 SO4 H 2O a) Estados de oxidación: b) Elemento que se oxida: c) Elemento que se reduce: d) Agente oxidante: e) Agente reductor: f) Electrones transferidos: 6. Cu H 2 SO4 CuSO4 SO2 H 2O a) Estados de oxidación: b) Elemento que se oxida: c) Elemento que se reduce: d) Agente oxidante: e) Agente reductor: f) Electrones transferidos: 7. KI H 2 SO4 H 2 S I 2 K2 SO4 H 2O a) Estados de oxidación: b) Elemento que se oxida: c) Elemento que se reduce: d) Agente oxidante: e) Agente reductor: 4|Página UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM ESCUELA DE FORMACIÓN DE PROFESORES DE NIVEL MEDIO –EFPEM– f) Electrones transferidos: 8. K2Cr2O7 FeSO4 H 2 SO4 Cr2 (SO4 )3 Fe2 (SO4 )3 KHSO4 H 2O a) Estados de oxidación: b) Elemento que se oxida: c) Elemento que se reduce: d) Agente oxidante: e) Agente reductor: f) Electrones transferidos: 9. NiS HCl HNO3 NiCl2 NO S H 2O a) Estados de oxidación: b) Elemento que se oxida: c) Elemento que se reduce: d) Agente oxidante: e) Agente reductor: f) Electrones transferidos: 10. KIO3 H 2 SO3 KHSO3 H 2 SO4 I 2 H 2O a) Estados de oxidación: b) Elemento que se oxida: c) Elemento que se reduce: d) Agente oxidante: e) Agente reductor: f) Electrones transferidos: 5|Página UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM ESCUELA DE FORMACIÓN DE PROFESORES DE NIVEL MEDIO –EFPEM– 11. As2 S5 HNO3 H3 AsO4 H 2 SO4 NO2 H 2O a) Estados de oxidación: b) Elemento que se oxida: c) Elemento que se reduce: d) Agente oxidante: e) Agente reductor: f) Electrones transferidos: 12. FeCl3 KI KCl FeCl2 I 2 a) Estados de oxidación: b) Elemento que se oxida: c) Elemento que se reduce: d) Agente oxidante: e) Agente reductor: f) Electrones transferidos: 13. K2CrO4 KI HCl CrCl3 KCl I 2 H 2O a) Estados de oxidación: b) Elemento que se oxida: c) Elemento que se reduce: d) Agente oxidante: e) Agente reductor: f) Electrones transferidos: 6|Página UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM ESCUELA DE FORMACIÓN DE PROFESORES DE NIVEL MEDIO –EFPEM– Respuestas. 2. a) +3 3. a) b) +7 0 3 0 e) -3 1 AO 2 0 5 2 2 0 5 2 Mg Cu ( N O3 )2 Cu Mg ( N O3 )2 b) AR AO 2 2 0 AO AR 4 2 0 2 PbO C 2 Pb C O2 c) 1 0 1 1 0 1 Cl2 2 Na Br Br2 2 Na Cl d) 1 7 AO AR 2 1 1 2 1 1 1 0 1 2 2 K MnO4 16 H Cl 2 MnCl2 5 Cl2 2 K Cl 8 H 2 O Agente reductor Agente oxidante 2 5. d) +4 2 Fe 3 Cl2 2 FeCl3 AR 4. c) +6 1 7 reducción 5 e 2 1 oxidación 2 e 6 2 3 6 2 2 10 electrones transferidos 6 2 1 6 2 10 Fe SO4 2 K MnO4 8H 2 S O4 5Fe2 ( S O4 )3 2Mn S O4 K 2 S O4 8H 2O Agente reductor Agente oxidante 1 0 6 2 reducción 5 e oxidación 2 e 2 6 2 4 2 1 2 2Cu 4 H 2 S O4 2Cu S O4 2 S O2 4 H 2 O 4 e transferidos Agente reductor 6. Agente oxidante 1 0 oxidación 2 e 6 2 reducción 2 e 2 6 2 4 2 oxidación 2 e reducción 2 e 1 2 Cu 2 H 2 S O4 Cu S O4 S O2 2 H 2 O Agente reductor 1 Agente oxidante 1 1 6 2 1 2 0 1 se divide entre dos: 2e transferidos 6 2 1 2 16 K I 10 H 2 S O4 2 H 2 S 8I 2 8K 2 S O4 8H 2 O Agente reductor 7. 1 Agente Oxidante 1 1 6 2 reducción 8 e oxidación 2 e 1 2 0 reducción 8 e oxidación 2 e 1 6 2 1 2 8K I 5H 2 S O4 H 2 S 4 I 2 4 K 2 S O4 4 H 2 O Agente reductor 7|Página Agente Oxidante 16 electrones transferidos 8 electrones transferidos 10 electrones transferidos UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM ESCUELA DE FORMACIÓN DE PROFESORES DE NIVEL MEDIO –EFPEM– 1 6 2 2 6 2 1 6 2 3 6 2 3 6 2 1 1 6 2 2 K 2 Cr2 O7 12 Fe S O4 16 H 2 S O4 2Cr2 ( S O4 )3 6 Fe2 ( S O4 )3 4 K H S O4 28H 2O 8. Agente reductor Agente oxidante 1 6 2 2 6 2 reducción 6 e 1 6 2 3 oxidación 2 e 6 2 3 6 2 1 1 6 2 K 2 Cr2 O7 6 Fe S O4 8H 2 S O4 Cr2 ( S O4 )3 3Fe2 ( S O4 )3 2 K H S O4 7 H 2O Agente reductor Agente oxidante 2 2 9. 1 1 reducción 6 e 1 5 2 2 1 oxidación 2 e 2 2 1 2 0 3 Ni S 6 H Cl 2 H N O3 3 Ni Cl2 2 N O 3 S 4 H 2 O Agente reductor reducción 3e Agente oxidante 1 5 2 1 4 2 1 1 4 2 oxidación 2 e 1 6 2 0 6 electrones transferidos 1 2 4 K I O3 14 H 2 S O3 4 K H S O3 10 H 2 S O4 2 I 2 2 H 2 O 10. Agente oxidante Agente reductor 1 5 2 1 4 2 Agente oxidante Agente reductor oxidación 2 e 1 1 4 2 reducción 10 e 1 6 2 1 2 0 2 K I O3 7 H 2 S O3 2 K H S O3 5 H 2 S O4 I 2 H 2 O 5 11. 2 1 5 2 1 5 2 oxidación 2 e reducción 10 e 1 6 2 4 2 10 electrones transferidos As 2 S5 40 H N O3 2 H 3 As O4 5 H 2 S O4 40 N O2 12H 2O Agente reductor Agente oxidante 3 1 1 1 oxidación 40 e 1 1 2 1 0 reducción 1e 13. 2 K 2 Cr O4 6 K I 16 H Cl 2 Cr Cl3 10 K Cl 3I 2 8H 2O Agente oxidante 1 6 Agente oxidante 8|Página 2 1 1 Agente reductor reducción 1e 1 1 3 oxidación 2 e 1 reducción 3e 40 electrones transferidos 2 electrones transferidos 12. 2 FeCl3 2 K I 2 K Cl 2 FeCl2 I 2 Agente reductor 20 electrones transferidos 1 1 0 oxidación 2 e 6 electrones transferidos 12 electrones transferidos 6 electrones transferidos