Equilibrio y Cinética.
Anuncio

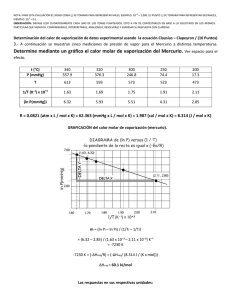
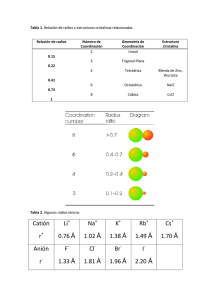
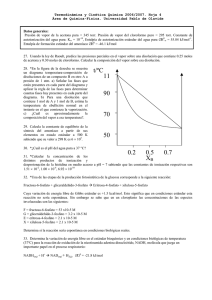
Equilibrio y Cinética. Reto 1. Esta es una tarea para entregar resuelta a mano el día del primer examen parcial. Si lo resuelves bien, contará como un punto extra. OJO, tienes que resolverla a mano de manera clara y completa. 1. Usar los siguientes datos para calcular la entropía molar estándar del nitrógeno gaseoso a 298.15 K. Utilizar gráficas para indicar claramente qué hiciste en cada etapa del procedimiento seguido. ó 0.03165 0.05460 2.064 10 Válida de 10 K a 35.61 K ó 3.52 10 0.1696 0.2379 3.0.6 10 4.214 10 Válida de 35.61 K a 63.15K í 18.44 1.053 7.064 10 0.0148 Válida de 63.15K a 77.36 K 3.500 Válida desde 77.36 K hasta 1000K, Entre 0 y 10 K Cp puede tomarse como 6.15 J K‐1 mol‐1; la temperatura de transición de sólido 1 a sólido 2 es de 35.61 K y el cambio de entalpía para esta transición es de 0.2289 kJ mol‐1; la temperatura de fusión es de 63.15 K y el cambio de entalpía para la fusión es de 0.71 kJ mol‐1; la temperatura de vaporización es de 77.36 K y el cambio de entalpía para la vaporización es de 5.57 kJ mol‐1 El resultado es aproximadamente 191 J mol‐1 K‐1