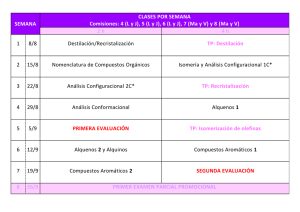
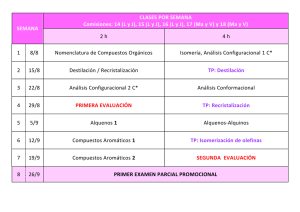
LECCIÓN 16 ALDEHÍDOS Y CETONAS
Anuncio

Química Orgánica 2º. LECCIÓN 16 Antonio Galindo Brito 1 ALDEHÍDOS Y CETONAS Objetivos Formular y nombrar los aldehídos y cetonas. Predecir la reactividad de los aldehídos y cetonas en base a la estructura electrónica del grupo carbonilo. Conocer sucintamente el mecanismo de las adiciones nucleófilas y el papel catalítico jugado por los ácidos próticos y de Lewis en este tipo de reacciones. Comparar la reactividad relativa de los aldehídos y cetonas en base a los efectos electrónicos y estéricos. Conocer las más importantes reacciones de adición nucleófila de aldehídos y cetonas. Contrastar las reacciones de condensación con las de adición nucleófila, examinando sus puntos comunes y viendo sus diferencias. Conocer los diferentes métodos de oxidación y reducción de aldehídos y cetonas, poniendo énfasis en los aspectos estereoquímicos de la reducción de las cetonas. Conocer los más importantes métodos de preparación de aldehídos y de cetonas, escogiendo el más adecuado en función de la estructura del compuesto carbonílico deseado. Finalmente, repasar la presencia de algunos aldehídos y cetonas en la naturaleza destacando el papel que juegan. LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 2 Aldehídos y Cetonas: clasificación y nomenclatura :O: C ; Grupo Carbonilo ; C R :O : :O : :O : R ; C R R´ Cetona simétrica Cetona no simétrica C R H Aldehído TABLA I. Prefijos para la nomenclatura común de aldehídos y cetona Prefijo R Prefijo R Form- H Isobutir- (CH3)2CH- Acet- CH3- Valer- n-C4H9- Propion- C2H5- Isovaler- (CH3)2CCH2- Butir- n-C3H7- Benz- C6H5- LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 3 : O: Ejemplos de nomenclatura común de aldehídos y cetonas :O : :O: H H ; :O : :O H ; H ; H formaldehído acetaldehído propionaldehído : O: ; Valeraldehído : O: :O : Butilmetilcetona Benzaldehído :O: ; ; Dimetilcetona Etilmetilcetona Dietilcetona : O: ; H ; : O: ; :O : : O: Isovaleraldehído :O : ; H Metilpropilcetona Etilpropilcetona :O : :O : ; ; Metilisopropilcetona ; Butiraldehído Isobutiraldehído :O: H H Diisopropilcetona Terc-butilisopropilcetona LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 4 Nomenclatura sistemática de aldehídos :O: :O : H H ; .. Metanal .. Br :.. : OMe :O : :O : H Etanal ; H; Propanal H Butanal ; .. :Cl .. Pentanal :O : : O: H ; H ; H2N H H .. (2S)-2-amino-3-trans, (4R, 5R)- 6-bromo-4,5-dimetil5-metoxi-2-trans-hexenal 5-cis-heptadienal :OHC .. CHO : .. .. CHO ; .. :O : .. CHO ; .. ciclopropan2-Ciclobutencarboxaldehído carboxaldehído ; H H .. H CHO .. (2S, 5S)-2-butil-5-cloro3-trans, 6-heptadienal .. Br : .. (2S)-metil-3-ciclopenten- (3S)-bromo-1-ciclohexencarboxaldehído carboxaldehído .. CHO: ; 2,4,6-ciclopentatriencarboxaldehído LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 5 Nomenclatura sistemática de cetonas .. :Br: :O : :O: ; : NH2 4-amino-7-metil-4Z, 6-octadien-2-ona .. : Br .. 2-bromo-(5R)-etil-6-metilen2Z,7-octadien-4-ona .. .. O: H CHO ; :O : .. O .. ; (6S)-cloro-2,4ciclohexadienona 4-oxo-5-trans, 7-trans-nonadienal :O : 3-etil-(6S, 7)-dimetil-4-octanona :O: :Cl : ; (5R)-Bromo2-ciclopentenona 3-Oxo-pentanodial ; H H .. OHC .. :O: H H meso-3,6-dimetil4-cicloheptenona Ácido (6S)-formil-(4R)-metil3-oxo-octanoico .. .. OHC CHO ; .. .. .. OH .. : O : :O : H H CH3 LECCIÓN 16 Química Orgánica 2º. : O: C : O: CH3 ; C Acetofenona fenilmetilcetona Propiofenona fenilpropilcetona :O : :O: ; C C Butirofenona butilfenilcetona Benzofenona Difenilcetona .. OH .. :O: C H3C O2N .. : Cl .. :O : C :O : C CH3 2-hidroxi-4-metilacetofenona (2-hidroxi-4-metilfenil), metil, cetona O2N Antonio Galindo Brito 6 ; .. :Br ; .. 3-nitrofenilpropiofenona (3-nitrofenil), propil cetona .. Br : O2N .. :O: C O2N 4-cloro-3-nitrobutirofenona (4-cloro-3-nitrofenil), butil, cetona 2,4-dibromo-2´,4´-dinitrobenzofenona (2,4-dibromofenil), (2´,4´-dinitrofenil), cetona LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 7 Radicales acilo HO - CO - R - OH O CH3CO - Radical acetilo (Ar) (R´) - CO - R - R´ R-C- Cetona; eliminación de un resto alquilo (arilo) PhCO - Estructura del grupo carbonilo Enlace C=O 175-180 kcal/mol Enlace pi (p-p) Radical benzoilo Enlace C=C 146 kcal/mol Electrones sin compartir del átomo de oxígeno : O : C Radical formilo Ácido carboxílico; eliminación de un grupo hidroxilo R - CO Radical acilo HCO - 120º 120º O C 120º Enlace sigma (sp2-sp2) Enlace pi (p-p) º 1,204 A H º 1,124 A H3 C C .. O .. º 1,500 A 121 H 114º H3 C C 125º .. O .. .. .. LECCIÓN 16 Química Orgánica 2º. H C O: ¨ H3C H + .. - C O: H3C ; Antonio Galindo Brito 8 δ+ .. C O ¨ Propiedades físicas de los aldehídos y cetonas δ - ¨ µ aproximadamente 2,7 D TABLA II. Momentos dipolares de aldehídos y cetonas comparados con otras sustancias Sustancia Tipo Fórmula µ (D) G. Funcional Metanal Aldehído HCHO 2,33 -CHO Etanal Aldehído CH3CHO 2,72 -CHO Propanal Aldehído CH3CH2CHO 2,52 -CHO Propanona Cetona CH3COCH3 2,88 -CO- Acetofenona Cetona CH3COPh 3,02 -CO- Ciclobutanona Cetona C4H6O 2,99 -CO- Ácido acético A. Carboxílico CH3COOH 1,74 -COOH Cloruro de acetilo Cloruro de ácido CH3COCl 2,72 -COCl Acetato de metilo Éster CH3COOCH3 1,72 -COOR Acetamida Amida CH3CONH2 3,76 -CONH2 1-Buteno Alqueno CH3CH2CH=CH2 0,30 -C=C- LECCIÓN 16 Química Orgánica 2º. Aldehídos Cetonas Antonio Galindo Brito 9 Fórmula PF (ºC) PE (ºC) Solubilidad g/100ml agua Metanal HCHO - 92 -21 Muy soluble Etanal CH3CHO - 123,5 20,2 ∞ Propanal CH3CH2CHO - 81 49,5 20 Butanal CH3(CH2)2CHO - 99 75,7 4 Pentanal CH3(CH2)3CHO - 92 103,4 Ligera Hexanal CH3(CH2)4CHO 131 Ligera Heptanal CH3(CH2)5CHO - 42 155 0,1 Benzaldehído PhCHO - 28 178 0,3 o-Tolualdehído (o-CH3)-PhCHO 196 m-Tolualdehído (m-CH3)-PhCHO 199 p-Tolualdehído (p-CH3)-PhCHO 205 Propanona CH3COCH3 - 94, 8 56,2 ∞ Butanona CH3CH2COCH3 - 86,9 79,6 37 2-Pentanona CH3(CH2)2COCH3 - 77,8 102,4 Ligera 3-Pentanona CH3CH2COCH2CH3 - 39,9 102,0 4,7 2-Hexanona CH3(CH2)3COCH3 - 35 150 2,0 3-Hexanona CH3CH2CH2COCH2CH3 124 Ligera Acetofenona PhCOCH3 21 202 Insoluble Benzofenona PhCOPh 48 306 Insoluble LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 10 Los primeros aldehídos (metanal y etanal) polimerizan fácilmente en solución, pero se puede obtener la forma monomérica destilándolos: H .. .. .. .. CH2OCH2OCH2O .. .. .. Paraformaldehído O: ;:O : O: .. Trioxano Me ; .. Ácidos .. :O 3 CH3CHO .. etanal H Me .. O: Me H O : trímero del .. etanal Reactividad química de los aldehídos y cetonas Centro electrófilo Atacado por nucleófilos Centro nucleófilo y básico : O : Atacado por electrófilos y ácidos (próticos y de Lewis) C (R) (H) H H Hidrógenos ácidos (pKA = 19-29) Abstraidos por bases fuertes Dado que el átomo de carbono del grupo carbonilo de los aldehídos y cetonas es un centro deficiente en electrones (un centro electrófilo), será atacado por nucleófilos y como el punto débil del grupo carbonilo es el enlace pi (π), la reacción típica de los aldehídos y cetonas será la ruptura del doble enlace por ataque de un nucleófilo, es decir, la formación de un enlace carbono-nucleófilo con ruptura del enlace pi, de modo, que el proceso globalmente, es una adición nucleófila (AdN): LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 11 Adiciones nucleófilas: mecanismo y estereoquímica .. .. - :O Nu : nucleófilo - + :O : AdN C *C R´ R R´= H; aldehído R´ = alquilo o arilo; cetona (carbono proquiral) Nu : R .. .. H .. *C R´ Nu R Nu A carbono proquiral C B Nu : (b) .. O .. A B A B H - + OH R´ Nu (±) Mezcla racémica (carbono quiral) (a) :O O H .. - O: * .. .. O: .. * Nu H+ * Nu A B enantiómeros H+ A B * .. O H .. .. O .. carbono quiral Nu H LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 12 Reacciones de condensación R´= H; aldehído R´ = alquilo o arilo; cetona carbono quiral .. :O H2Nu : + R (±) Mezcla racémica .. - C *C R´ carbono proquiral R´ NuH2 R + R .. + H+ - H+ :O : AdN compuesto aquiral carbono quiral :O *C H E2 R´ NuH R .. HOH + .. R´ C = Nu .. Reactividad relativa de aldehídos y cetonas en las reacciones AdN Los aldehídos reaccionan más rápidamente que las cetonas en las reacciones AdN tanto por razones estéricas como electrónicas .. :O Efectos estéricos Nu: - .. δ :O C + R C R´ R´= H; Alquilo; Arilo El estado de transición está más apiñado cuando R´es un grupo alquilo o arilo R´ R Nu δ- * LECCIÓN 16 Química Orgánica 2º. :O : Efectos electrónicos C δ R + + + δ < δ 1 2 1 :O: C + δ2 H R R´ Antonio Galindo Brito 13 R y R´donan electrones al Carbono El H no es donante electrónico, por DD lo que las cetonas son menos reactivas Efectos electrónicos de los sustituyentes (efecto – I) Reactividad creciente .. .. .. .. R -CH2 - CHO R - CHCl - CH2 - CHO > .. R -CCl2 - CHO > R -CHCl - CHO > .. .. .. .. .. .. .. -R - R > R - CH2 - CO - R > R - CHCl - CH2 - CO R - CCl2 - CO - R > R - CHCl - CO .. .. .. .. El Cloro retira electrones por efecto -I Reactividad creciente Efectos estéricos :O : :O : Dimetilcetona Me >> > Dietilcetona :O : :O : Me Me Me H Me H >> Disopropilcetona Me Me MeMe Me Diterc-butilcetona LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 14 Adiciones nucleófilas de aldehídos y cetonas Catálisis ácida.- Los ácidos próticos y de Lewis aumentan la reactividad de los aldehídos y cetonas, porque aumentan la deficiencia electrónica del carbono carbonílico. Sin embargo, la catálisis ácida debe hacerse con cuidado para que el nucleófilo no se protone, porque ello disminuye la nucleofilia ralentizando la reacción: La catálisis ácida hace al carbono más deficiente en electrones .. C O: + + H3 O : .. H 2O : + Cetona o Aldehído Catión Hidronio .. C O: .. C O + .. C + H Catión oxonio O H ¨ Carbocatión Los ácidos de Lewis hacen más deficiente al carbono + .. + - BF3 C O + C BF3 La protonación del nucleófilo disminuye la nucleofilia RH2Nu : Nucleófilo + H3O Catión hidronio RH3Nu O .. carbocatión catión oxonio .. + .. + + Nucleófilo protonado .. H2O .. BF3 LECCIÓN 16 Química Orgánica 2º. Adición de agua y alcoholes a aldehídos y cetonas :O: R´ R H3O : Catión Hidronio Cetona o Aldehído .. O: + .. R-O-H + .. alcohol + R H O .. C * .. O .. .. H2O: + C Catión oxonio .. + H3O : C C O + H R Catión oxonio C R + .. OR Catión oxonio O + .. H Catión oxonio R´ diol geminal R (muy inestable) R´= H; aldehído Formación de hemiacetales C .. .. HO::OH + .. + H2O: Antonio Galindo Brito 15 O: .. + .. O O + : .. H + H2O : .. C O H * .. H .. H2O : + H + Catión oxonio Catión oxonio .. .. OR H2O: .. C OH2 .. * + Catión oxonio R O C H .. + H3O : + C .. OR .. .. * .. OH Catión Hidronio Hemiacetal .. OR .. ..+ Química Orgánica 2º. Formación de acetales C LECCIÓN 16 Antonio Galindo Brito 16 .. C .. + H2O: OH2 OR + Catión oxonio (quiral) Catión oxonio (aquiral) .. .. R-O-H+ .. alcohol .. .. C OR + + C Catión oxonio (quiral) .. + H3O : .. OHR .. .. Catión oxonio (aquiral) OR C OR + H2O: Catión hidronio Catión oxonio(quiral) (1 mol) .. .. RCHO : + R´OH .. .. .. RCHO + 2 R´OH .. .. + C .. OR .... OR .. Acetal (aquiral) .. .OH . .. RCH * . . + H2O: OR´ .. acetal .. (aquiral) OR´ .. .. RCH . . + 2 H2O: .OR´ . hemiacetal (quiral) (2 moles) + OHR .. LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 17 Acetales como grupo protectores de aldehídos, cetonas y 1,2-dioles :O : R´ R .. OH .. .. + HO.. 1,2-etanodiol Aldehído (R´= H) o Cetona (R´= alquilo, arilo) R R´ H H HO: :OH :O .. O ..: R R´ + .. H2O: Acetal (Aldehído o Cetona protegidos) :O : R R´ H + H :O .. O: .. + .. H2O: .. .. Propanona 1,2-Diol Acetal (1,2-diol protegido) Eliminación del grupo carbonilo vía tioacetales :O: .. SH .. .. R´ + HS R .. Aldehído o Cetona :S .. R 1,2-etanotiol :S .. ..S : R R´ Tioacetal + R´ Tioacetal Ni Raney H2 .. .. + H2O: S: R alcano R´ .. + NiS.. LECCIÓN 16 Química Orgánica 2º. :N Adición de cianuro de hidrógeno : O: R´ R :CN + R R´´ + R´ Cetona H R + Aldehído R´ - MgX .. O: .. .. .. + H2O: R´´ O .. R´ .. CHO + .. Aldehído R H R´ - .. + :OH .. ( +- ) - Alcohol terciario .. .. .. H R´ O : + H O :R´ O .. .. R Grignard :OH .. + (±)-Cianhidrina Grignard .. :O R R´´ - MgX - .. R´ R R´ Adición de organometálicos .. :O .. OH .. .. C .. NC O : + H2O: .. R Aldehído o Cetona Antonio Galindo Brito 18 H R H - .. + :OH .. ( +- ) - Alcohol secundario .. H O: H Li - Ar C R Arilitio ( + ) - Alcohol secundario - - .. + :OH .. LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 19 Reacción de Wittig. Síntesis de olefinas Las cetonas y los aldehídos se convierten en alquenos por acción de los iluros de fósforo (fosforanos), en un proceso conocido como reacción de Wittig. Los iluros se preparan in situ por acción de trifenilfosfina sobre un haluro de alquilo seguido de tratamiento básico: .. .. - :O R - + P (Ph)3 C H .. + :O : Betaína C C C Aldehído Haluro de trifenilalquilfosfonio Cetona H R H C .. R H C Alqueno H C O: Ph3P C R R C + .. O = PPh3 .. Óxido de fosfina + P (Ph)3 Ph3P + C :O : - .. Betaína LECCIÓN 16 Química Orgánica 2º. Preparación de iluros de fósforo Ph3P : + R - CH2 - X Trifenilfosfina - .. + R - CH - PPh3 : X : .. R´Li - .. + : R - CH2 - PPh3 : X .. SN2 Haluro de alquilo . Haluro de trifenilalquilfosfonio - R + R´H H .. C H - + P (Ph)3 Iluro de fósforo + P (Ph)3 C .. H + LiX Iluro de fósforo Haluro de trifenilalquilfosfonio Alcano R Antonio Galindo Brito 20 R C H P (Ph)3 Fosforano Ventajas de la reacción de Wittig :O: Wittig + CH2 = PPh3 + Butanona .. :Br:CH 3 2-metil-1-buteno .. + NaOMe .. (±)-2-bromo-butano .. O=PPh 3 .. CH2 Óxido de trifenilfosfina CH2 + 2-metil-1-buteno 2-buteno Mayoritario .. + HOMe .. LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 21 Reacciones de condensación Formación de iminas .. O: C + - .. + H3O+ : O : NH2R´´ : NH2R´´ R´ R Aldehido R´= H Cetonas .. .. HO : NHR´´ R R´ R R´ R H 3 O+ .. H2O : + R´ + .. H .. H2 O NR´´ H2O: .. R´ R .. + H3O + H3O+ R´´ R´´ :N ; + H2O : + R´ R R N: C C :N .. Imina Heminal Carbinolamina R .. Heminal Carbinolamina Amina primaria .. .. .. H O : NHR´´ Iminas diastereómeras (syn y anti) R´ R´´ (anti + syn) C R´ LECCIÓN 16 Química Orgánica 2º. H3C N: CH3 :N C H3C Antonio Galindo Brito 22 C CH2CH3 H C 3 Imina anti Imina syn CH2CH3 Formación de sales de imonio y enaminas .. CHO : + : NH(CH ) 3 2 .. Benzaldehído C Dimetilamina H O: C .. + Propanona : NH(CH3)2 HO NMe2 CH3 + N CH3 Sal de imonio NMe2 + Dimetilamina Hemiaminal Enamina .. H2O: LECCIÓN 16 Química Orgánica 2º. .. pirrolidinenamina de la ciclohexanona O: Antonio Galindo Brito 23 .. N H C + ciclohexanona ácidos C .. N H pirrolidina Condensaciones con hidroxilamina e hidracinas .. C O: + : NH2 - Z Ácidos .. C .. N - Z + H2O .. El esquema anterior representa una reacción genérica entre un compuesto carbonílico (aldehído o cetona) y una serie de derivados que contienen un grupo amino (-NH2) unido a un grupo Z variable. Así, cuando Z = H el reactivo es el amoniaco, cuando Z = alquilo o arilo será una alquil- o arilamina primaria, cuando Z = OH será la hidroxilamina, cuando Z = NH2 será la hidracina ( si Z= - NHPh será la fenilhidracina) y finalmente, cuando Z = -NHCONH2 tendremos la semicarbacida. Química Orgánica 2º. LECCIÓN 16 Antonio Galindo Brito 24 TABLA IV Z Reactivo (NH2 – Z) (nucleófilo) Producto (syn + anti) -H H2N – H (amoniaco) C = N H2 (Iminas) -R H2N – (R, Ar) (amina primaria) C = NH (R , Ar) (Base de Schiff) - OH H2N – OH (hidroxilamina) C = N OH (Oximas) - NH2 H2N – NH2 (hidracina) C = N – NH2 (Hidrazonas) - NHPh H2N – NHPh (fenilhidracina) C = N – NHPh (Fenilhidrazonas) - NHCONH2 H2N – NHCONH2 (semicarbazida) C = N – NHCONH2 (Semicarbazonas) Las bases de Schiff, las oximas, las hidrazonas y las semicarbazonas pueden existir como dos diastereómeros llamados anti y syn, de las que el más estable siempre es el diastereómero anti, pues coloca a los grupos más voluminosos lo más alejados posible. LECCIÓN 16 Química Orgánica 2º. .. .. CHO + : NH2OH .. .. Benzaldehído Ciclohexanona :O : Butanona .. Ph OH H Oxima anti del .. .. Ph Ácidos H N C H Oxidaciones y Reducciones de aldehídos y cetonas .. NHPh + H2O .. .. .. .. .. .. + H O 2 .. NHNHCONH2 .. Semicarbazona anti de la butanona .. Ácido carboxílico O Oxidante .. R .. (Hidrazona anti de la ciclohexanona) .. .. .. ÁcidosPh + : NH2NHCONH .. 2 .. R - CHO .. N C .. Aldehído .. + H2O .. benzaldehído) Fenilhidrazina Semicarbazida .. N C Ácido Hidroxilamina .. .. O + : NH2NHPh .. Antonio Galindo Brito 25 C Oxidante = K2Cr2O7; CrO3; KMnO4;Ag2O .. OH .. LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 26 El Ag2O es un oxidante muy suave que oxida selectivamente los aldehídos a ácidos carboxílicos en presencia de alcoholes. La reacción se conoce como prueba de Tollens y es usada como certeza de la existencia de un grupo aldehído en la molécula. El reactivo en realidad es una solución amoniacal de sales de plata y si el ensayo es positivo se deposita plata metálica en las paredes del tubo de ensayo (espejo de plata). .. R - CHO .. + Aldehído 2 [Ag(NH3)2] + - .. .. .. RCOOH + 2 Ag(s) + .. .. + 3 : ..OH Reactivo de Tollens .. 4 .. NH3 + 2 H2O .. Ácido carboxílico Las cetonas en condiciones normales no se oxidan y si se fuerzan las condiciones experimentales se rompen en dos fragmentos. Reducciones de aldehídos y cetonas R C .. O .. R´ R´= H; aldehído R´= Alquilo o Arilo; Cetona NaBH4 .. OH .. R C R´ H R´= H; Alcohol primario R´= Alquilo o Arilo; Alcohol secundario quiral ( + -) Las reducciones también pueden hacerse con boranos (BHR2; BH2R; BH3) y con hidrógeno molecular (H2) en presencia de níquel como catalizador, pero estos reactivos no son compatibles con la presencia de dobles y triples enlaces en la molécula que se hidrogenarían. A efectos prácticos, el NaBH4 puede considerarse como una fuente de aniones hidruro (H: - ) y es preciso tener en cuenta los aspectos estereoquímicos de la reducción de cetonas ya comentados anteriormente. Este reactivo no hidrogena los dobles enlaces no conjugados. LECCIÓN 16 Química Orgánica 2º. Butanal :O : 1.- NaBH4 2.- H2O H Acetofenona Fenilmetilcetona .. O .. 1-Butanol Antonio Galindo Brito 27 .. H O .. - (+-) -1-Feniletanol :H C CH CH3 H: CH3 R prioritario sobre R´ alcoholes enantiómeros .. (a) cara si H H - (a) R caras proquirales C O: .. R´ H: .. OH .. (b) (b) cara re .. O: .. .. O: .. R R´ R R´ H H O H .. R R´ .. R H O H .. R´ H .. O .. .. O .. H H LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 28 Reacciones de desoxigenación: conversión de aldehídos y cetonas en alcanos Zn(Hg)-HCl Reducción de Clemensen C R´ R C .. O .. NH2 - NH2 , KOH H NaBH4 C R´ H R´= H; Alcohol primario R´= alquilo o Arilo; Alcohol secundario LiAlH4 C TsCl - Piridina R´ H .. OTs .. R .. R C R´ Alcano .. OH H R Alcano Reducción de Wolff-Kishner R´ R´= H aldehído R´= Alquilo, Arilo; Cetona H R H Tosilato de alquilo Sustituciones en posición alfa: halogenaciones, enolatos Los α-H (en relación al grupo carbonilo) de los aldehídos y cetonas son ácidos (pKA = 20) y son abstraídos por bases tales como hidróxidos y alcóxidos, para formar una nueva entidad conocida como enolato (un potente nucleófilo), aunque es preciso tener en cuenta que cuando se usan las bases citadas, en el equilibrio la cantidad de enolato presente es muy pequeña: LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 29 : O: C (R´) (H) H H Hidrógenos ácidos pKA = 20 Abstraidos por bases .. .. :O R C :O H C - .. R´ +: ..OR H Cetona o Aldehído; Alcóxido pKA = 20; Base más débil Ácido más débil - .. .. R C R´ :O .. C carbanión H R oxanión R´ C C H .. + R -O-H .. Alcohol Anión Enolato. Dos formas resonantes. Una es un Ácido más carbanión y otra un oxanión. Mayoritaria la oxanión, fuerte pues todos los átomos tienen su octete completo y la carga se sitúa sobre el átomo (el oxígeno) más apto pKA = 16 para soportarla. Base más fuerte LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 30 Es posible transformar completamente una cetona o un aldehído en el correspondiente enolato usando una base fuerte como un amiduro, siendo la más utilizada el LDA (LitioDiisopropilAmiduro) que puede prepararse tratando el butilitio con diisopropilamina: .. C4H9 - Li .. :O R C Butillitio + C4H10 H - N (Pr-i)2 .. :O C H R´ + LDA .. R C Base más fuerte Cetona o Aldehído pKA = 30, Ácido más fuerte R´ ..:O .. C - + Li - N (Pr-i)2 Butano Diisopropilamina H .. R H Li LDA + C .. R´ C H Enolato. Base más débil. Excelente nucleófilo + H - N - (isoPr)2 Diisopropilamina pKA = 40 Ácido más débil Halogenación promovida por bases .. R - CO - CH2 - R´ + X2 .. cetona .. + KOH .. .. .. .. KX: H O R - CO .. - CHX - R´ + .. + 2 .. ( +)−α-halocetona )−α - LECCIÓN 16 Química Orgánica 2º. .. :O C C H Cetona - .. + :OH .. .. :O .. C .. + H2O .. C Anión enolato Anión hidróxido - .. :O .. Antonio Galindo Brito 31 O C C .. .. + : ..X - X.. : C C X α-Halocetona .. + : ..X : Si la reacción se efectúa en medio alcalino puede ocurrir polihalogenación, es decir, la entrada de varios átomos de halógeno. Es posible evitarlo efectuando la reacción en medio ácido (ácido acético) y en estas condiciones el proceso transcurre a través del enol intermedio y no por el enolato: 3-Pentanona .. +2 :O: .. : Br .. .. Br : .. + Br2 + 2 KOH .. 2,2-Dibromo3-pentanona : O: .. .. 2 KBr : + 2 H2O: .. LECCIÓN 16 Química Orgánica 2º. Tautomería ceto-enol .. .. O: H H H + H 2-pentanona H + OH3 .. Hidronio .. H2O : + H H H 2-pentanona protonada H H 2-pentanona protonada H C + .. :O + O H H .. H : OH2 + H :O .. Antonio Galindo Brito 32 H H H H H + H 1-penten-2-ol .. :O R´= H; Aldehído R´= Alquilo; Arilo; Cetona .. :O H Ácidos R Forma Ceto + :OH3 Hidronio Un enol H H R´ H H C + .. :O R R´ Forma Enol H H H LECCIÓN 16 Química Orgánica 2º. Formas enol Formas ceto .. : O: Antonio Galindo Brito 33 K % Ceto 2. 10-5 100 0 1,5 . 10-7 100 0 98,8 1,2 76 24 % Enol : OH H .. H :O : : OH : O: .. H : OH 5 . 10-5 .. :O: : O: : OH :O: 3,16 [Enol] K = [Ceto] LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 34 .. :O 3-Pentanona .. O .. +H :O: Cetona protonada Ácido acético Un catión oxonio C - CH3 :O H H :O H + H Agua O: .. H +O .. X H Anión acetato H + Cetona protonada Un catión oxonio H CH3 - C .. O: .. Enol de la 3-pentanona .. + OH .. 2 + + + O O: + .. OH3 Catión hidronio .. H .. .. X X-X .. + : X.. : .. .. O+ H .. H X + :O: .. + : X.. : .. H X .. : LECCIÓN 16 Química Orgánica 2º. :O: Ácido carboxílico Aldehído R-C-H + X2 .. + H2O .. Antonio Galindo Brito 35 :O : .. R - C - O -H + .. .. 2H-X : .. Condensaciones aldólicas catalizadas por bases (±)-3-hidroxi-butanal Etanal .. :O: : OH : O : KOH 2 H H Propanona 4-hidroxibutanona .. :O : KOH 2 : O : HO : CH3 Los aldehídos y las cetonas dan una reacción de condensación en medio alcalino, proporcionando unos aductos conocidos como aldoles, que en realidad son β-hidroxi-aldehídos o β-hidroxicetonas. Los aldehídos reaccionan más rápidamente que las cetonas por razones fundamentalmente estéricas. En muchas ocasiones los aldoles se deshidratan formando compuestos carbonílicos α , β – insaturados, o sea, aldehídos o cetonas α , β – insaturados. Química Orgánica 2º. LECCIÓN 16 .. : O: : OH :O : KOH 3-hidroxi-butanal; un aldol .. .. HO: CH3 KOH .. + H2O.. H H :O Antonio Galindo Brito 36 2-trans-butenal : O: .. + H2O.. 4-Hidroxi-4-metil-2-pentanona; 4-metil-3-penten-2-ona un aldol .. HO H - :O : HO : + H .. HO .. HO .. carbanión H H O H .. H - 2-trans-butenal H H :O : .. - H + .. - H :O: + H HO : .. .. H2O : LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 37 Mecanismo de la condensación aldólica : O : Acetaldehído Anión hidróxido Catalizador .. HO: + .. - .. Enolato : O: + H H H .. H2O : H .. :O .. - Acetaldehído H H H :O: H + -H : .. H :O : .. H O .. .. H (+ - )-3-Hidroxibutanóxido H H H :O: H O : H2O: C .. - O: H H Enolato del acetaldehído H H .. H ( + )-3-Hidroxi- butanal .. HO: + .. H Anión hidróxido Catalizador La condensación aldólica es reversible y la reacción inversa es conocida como retro-aldólica. :O : H .. OH .. H (+ - )-3-Hidroxi-butanal .. HO: .. 2 :O : H Acetaldehído H H H LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 38 Preparación de aldehídos y cetonas Oxidación de alcoholes R .. OH .. .. CCP R Aldehído Alcohol primario H :O: : OH ; R CrO3- piridina R´ (±)-Alcohol secundario R R 1-butanol .. OH .. .. .. OH .. Na2Cr2O7 - H2SO4 R butanal .. OH Ácido carboxílico + + : O: :O : .. OH .. H Ácido butanoico : O : H2SO4 .. K2Cr2O7 OH CCP .. R´ Cetona + NH [CrO3Cl] = CCP = clorocromato de piridinio Alcohol primario :O: LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 39 Ozonólisis de alquenos R R C C H R C C H R R´ C H R´´ R R´´ C R´ .. 2 RCHO: H (1) O3 R´ (2) Me 2S ó (Zn-HOAc) H C (1) O3 (2) Me2S ó (Zn-HOAc) C R´´´ .. .. RCHO: (1) O3 (2) Me2S ó (Zn-HOAc) + R´CHO: R´ .. .. RCHO : + :O C R´´ (1) O3 (2) Me2S ó (Zn-HOAc) R .. :O .. C R´ + :O R´´ C R´´´ LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 40 Hidratación de alquinos :O: Hg+2-H2SO4 CH3 R R C CH .. OH .. R Alquino terminal Metilalquilcetona : O: Aldehído R H (1) R2BH-THF (2) H2O2 - NaOH Enol (cis+trans) Síntesis de arilcetonas por acilación de Friedel-Cratfs R R R´COCl-AlCl3 : O: + R = alquilo R´ R´ R Aril, alquil, cetonas O .. : LECCIÓN 16 Química Orgánica 2º. Antonio Galindo Brito 41 Reducciones de ácidos carboxílicos y sus derivados ( Se estudiarán en la lección 18). Aldehídos y cetonas en la naturaleza. Aldehídos de la corteza de la naranja neral dodecanal geranial .. ; CHO .. decanal octanal 2-decenal CHO β -sinensal ; .. perillaldehído ..OHC ; ; ..OHC .. .. CHO .. undecanal .. CHO .. nonanal .. CHO .. .. 2-dodecenal CHO .. 2-hexenal .. CHO .. citronelal .. CHO .. ; .. CHO .. ; .. CHO ; .. .. ; CHO .. α-sinensal ..OHC .. .. LECCIÓN 16 Química Orgánica 2º Antonio Galindo Brito 42 Componentes cetónicos del aceite de naranja propanona :O : :O : :O: 3-metil-3E-hepten-2-ona 2-decanona ; ; Componentes cetónicos del aceite de vegetales (+)-carvona (semilla de alcaravea) (-)-carvona (menta) nootkatona .. .. O O .. .. .. O .. H H Componentes del aroma de la margarina :O: :O : H etanal :O : ; ; :O : 2,3-butanodiona (diacetilo) H 4-cis-heptenal LECCIÓN 16 Química Orgánica 2º Antonio Galindo Brito 43 Componentes del aroma de especias :O : :O : :O: H ; ; benzaldehído (olor almendras amargas) 3-fenil-2-trans-propenal (cinamaldehído; canela) 2-heptanona (clavo) Cetonas en perfumería α-irona .. O .. .. O .. .. O β -irona .. ; .. O .. ; ; .. O .. γ-irona 2-metil-3-(p-t-butilfenil)-propanal ; H β -ionona α-ionona muscona civetona ; O: .. :O : .. O .. LECCIÓN 16 Química Orgánica 2º Antonio Galindo Brito 44 Aldehídos y cetonas del vino :O: etanal propanal butanal H H ; ; :O: : O: propanona H ; H : O: :O : decanal ; H H : O: 2-pentanona : O: : O: ; ; butanona :O : heptanal ; : O: ; ; nonanal H :O : 2-metil-butanal H :O : :O: octanal :O : ; ; 2-heptanona 2-hexanona diacetilo Aldehídos y cetonas del zumo de melocotón :O: etanal : : isopentanal O :O: 3-trans-hexenal :O : :O: ; H ; 3-cis-hexenal H :O: 2-trans-hexenal H ; H nonanal :O : H ; H ; 2-cis-hexenal hexanal H : O: ; 2-trans-4-trans-decadiennal H : O: furfaral ; H .. O .. .. CHO .. :O : LECCIÓN 16 Química Orgánica 2º Cetonas con esqueleto esteroidal .. HO: H testosterona trans-androsterona H .. HO : H H H H : O: estrona H .. O .. H aldosterona progesterona H .. O .. : O: H H corticosterona .. .. HO: H H ; .. O .. H H .. .. O : OH .. H :O H .. O .. ..H OH .. .. :O ; H H .. :O H .. HO : H H H H .. HO .. cis-androsterona ; ; .. O .. Antonio Galindo Brito 45 H .. O ..