Tema 5: Propiedades de las sustancias en función del tipo
Anuncio

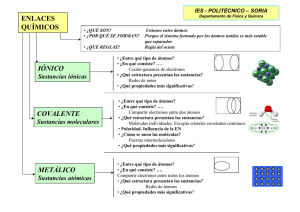
Tema 5: Propiedades de las sustancias en función del tipo de enlace que poseen. Relacionar las propiedades de las sustancias, con el tipo de enlace que tiene lugar entre los átomos que la constituyen, tiene una doble finalidad: • • Conociendo la constitución de una sustancia, se pueden predecir las propiedades que tendrá. Si necesitamos un material de determinadas propiedades, se puede deducir la constitución que ha de tener. QU.U2.T5. Propiedades de las sustancias en función del tipo de enlace que poseen. • Sustancias iónicas Las sustancias iónicas están formadas por la unión de átomos metálicos, que pierden electrones y átomos no metálicos, que ganan electrones, se forman pues iones, que forman una red cristalina.. La mayoría de las propiedades de las sustancias iónicas dependen de la energía de red que es la energía necesaria para destruir completamente un mol de red iónica, para formar los iones correspondientes. La energía de red es tanto mayor cuanto mayores son las cargas de los iones y cuanto menores sean sus tamaños. Estados de agregación. Dureza y fragilidad. Todas las sustancias iónicas son sólidas a temperatura ambiente y presentan elevados puntos de fusión y ebullición, que puede explicarse por el elevado valor de la energía de red. Las sustancias iónicas presentan una gran resistencia a ser rayadas, por eso son duras , pero la dureza depende de la energía de red. Son frágiles, pues al golpearlas, las partículas de igual carga quedan enfrentadas, produciéndose la ruptura del cristal Las sustancias iónicas son más o menos solubles en disolventes Solubilidad. polares como el agua, pero su solubilidad es muy variable, dependiendo del valor de la energía de red. Conductividad Las sustancias iónicas no conducen la corriente eléctrica en estado eléctrica. en estado sólido, pero sí en estado líquido o disuelto. QU.U2.T5. Propiedades de las sustancias en función del tipo de enlace que poseen. • Sustancias metálicas Las sustancias metálicas están formadas por átomos metálicos que pierden los electrones de la capa de valencia y forman una red cristalina, inmersa en la nube electrónica. Estados de agregación. Todas las sustancias metálicas son sólidas a temperatura ambiente, excepto el mercurio. Los puntos de fusión y ebullición son muy variables Las sustancias metálicas tienen una dureza variable, que puede ser media o baja, dependiendo de la fuerza de unión. Dureza y fragilidad. No son frágiles, resisten muy bien el golpe, sin que se produzcan enfrentamientos de cargas eléctricas. Se pueden deformar permanentemente por presión (maleabilidad). Las sustancias metálicas no se disuelven en ningún tipo de disolvente. Con el agua, algunos Solubilidad. metales reaccionan formando óxidos o hidróxidos que si pueden disolverse, lo que puede dar lugar a confusión. Conductividad eléctrica. En general, las sustancias metálicas son muy buenas conductoras de la electricidad, pues los electrones no están unidos a ningún átomo en concreto, y poseen una gran movilidad. QU.U2.T5. Propiedades de las sustancias en función del tipo de enlace que poseen. • Sustancias covalentes Las sustancias covalentes (redes covalentes) están formadas por átomos no metálicos unidos entre sí por enlaces covalentes, formando una red espacial. Estados de agregación. Dureza y fragilidad. Solubilidad. Conductividad eléctrica. Las sustancias covalentes son sólidas, con altos puntos de fusión y de ebullición, debido a la fortaleza de los enlaces covalentes que mantienen unidos a los átomos. Las sustancias covalentes son muy duras y no son frágiles ni maleables. Esto puede justificarse por los fuertes enlaces covalentes que unen rígidamente a los átomos. Las sustancias covalentes no son solubles en ningún tipo de disolvente. Las sustancias covalentes, salvo excepciones no conducen la corriente eléctrica, pues los electrones son compartidos entre átomos contiguos y no tienen movilidad alguna. QU.U2.T5. Propiedades de las sustancias en función del tipo de enlace que poseen. • Sustancias moleculares. Las sustancias moleculares están constituidas por moléculas, en las que varios átomos se unen mediante enlaces covalentes y éstas, se unen entre sí, mediante débiles fuerzas intermoleculares. Estados de agregación. En general las sustancias moleculares son gaseosas a temperatura ambiente, pero si las fuerzas intermoleculares son importantes, pueden encontrarse en estado líquido, incluso en estado sólido. Pero en todo caso, sus puntos de fusión y ebullición son relativamente bajos. Dureza y fragilidad. Cuando son sólidos son blandos y fácilmente deformables, pero no son frágiles Solubilidad. Conductividad eléctrica. Las sustancias polares son solubles en disolventes polares, como el agua, y las sustancias apolares se disuelven en disolventes apolares. La sustancias moleculares, en general no conducen la corriente eléctrica, QU.U2.T5. Propiedades de las sustancias en función del tipo de enlace que poseen. • Comparación de las propiedades de las sustancias. Tipo de sustancia Molecular Covalente Metálica Iónica Tipo de Tipo de unión partícula entre partículas y de enlace Moléculas (enlace covalente) Átomos no metálicos (enlace covalente) Átomos metálicos (enlace metálico) Iones (enlace iónico) Propiedades •Puntos de fusión y ebullición bajos, debido a las débiles fuerzas intermoleculares. •Si son sólidos son muy blandos, pues las fuerzas que mantienen unidas a Fuerzas las moléculas son débiles. intermoleculares •No conducen la corriente eléctrica, al no disponer de cargas eléctricas con movilidad •Generalmente son insolubles en agua, salvo que sean polares, en cuyo caso si se disuelven en agua. •Puntos de fusión y ebullición elevados, pues sus partículas están unidas por fuertes enlaces covalentes. Enlace •Son duros y no son frágiles, pues hay que romper fuertes enlaces covalente covalentes para rayarlos. •No conducen la corriente eléctrica, salvo en algunos casos como el grafito y derivados. •Son insolubles en cualquier tipo de disolvente. •Puntos de fusión y ebullición medianos o altos. •Son duros, pero también maleables, resistiendo muy bien el golpe. Enlace metálico •Son buenos conductores de la corriente eléctrica. •Son insolubles en cualquier disolvente. Pero pueden reaccionar con el agua produciendo óxidos o hidróxidos. •Puntos de fusión y ebullición bajos. •Son duros, pero frágiles (se rompen al golpearlos fuertemente). •No conducen la corriente eléctrica en estado sólido, pero sí en estado Enlace iónico líquido o al disolverse. •En general son solubles en agua, pero su solubilidad es variable, pues depende de la energía de red. Ejemplos Oxígeno (O2) Cloro (Cl2) Agua (H2O Amoniaco (NH3) Propano (C3H8) Diamante (C) Sílice(SiO2) Hierro (Fe) Cobre (Cu) Aluminio (Al) Cloruro de sodio (NaCl) Óxido de magnesio (MgO) Carbonato de calcio (CaCO3) QU.U2.T5. Propiedades de las sustancias en función del tipo de enlace que poseen.