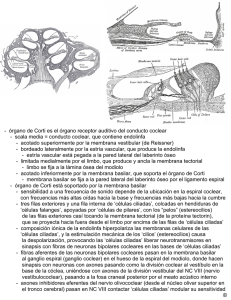
Corrientes iónicas en células ciliadas de órganos otolíticos y
Anuncio

Corrientes iónicas en células ciliadas de órganos otolíticos y canales semicirculares del axolotl (Seminario de Investigación y Tesis - IV) Angélica Almanza Gutiérrez Maestría en Ciencias Fisiológicas Instituto de Fisiología BUAP Tutores: Enrique Soto y Rosario Vega Julio del 2001 Corrientes iónicas en células ciliadas Resumen Las células sensoriales de los sistemas auditivo y vestibular, así como de la línea lateral son transductores mecanoeléctricos que transforman una deflexión mecánica del haz de cilios de la célula en un flujo de corriente a través de su superficie apical, generando un potencial receptor. La respuesta de las células ciliadas a los estímulos mecánicos es resultado de sus propiedades eléctricas pasivas y de la interacción de la corriente de transducción con los canales iónicos localizados en la superficie basolateral. El mecanismo de transducción parece ser similar en las células ciliadas de diferentes órganos vestibulares; sin embargo, el procesamiento postransduccional del estímulo mecánico parece ser diferente en las células ciliadas de los receptores (canales semicirculares, sáculo, lagena, utrículo, papila amphibiorum, papila basilar) que conforman el vestíbulo y también entre células ciliadas de un mismo receptor. Mediante la técnica de fijación de voltaje, registramos la corriente total en células ciliadas aisladas de los canales semicirculares, el sáculo y el utrículo del axolotl. En los tres órganos, la corriente total fue predominantemente una corriente de salida con una inactivación parcial. La cinética de la corriente total en las células de los canales semicirculares fue 4.5 veces más rápida que la corriente en el sáculo y en el utrículo. Utlizando procedimientos electrofisiológicos y farmacológicos en las células de los canales semicirculares y en las del utrículo, encontramos tres corrientes iónicas salientes de potasio: una corriente sostenida (IK,s), una corriente transitoria (IK,t) y una corriente dependiente de Ca2+ (IK,Ca). En los canales semicirculares la IK,s aportó un 45% de la corriente total, mientras que en el utrículo, esta corriente aportó el 4.5% de la corriente total. La contribución de la IK,Ca fue mayor en el utrículo, en donde aportó un 65.1% comparado con un 40% en los canales semicirculares. La IK,t contribuyó con un 65.1% de la corriente total en el utrículo, mientras que en los canales semicirculares representó un 15%. En congruencia con los datos obtenidos del registro de la corriente total, las corrientes iónicas registradas en las células aisladas del utrículo fueron más lentas que las registradas en las células de los canales semicirculares. En el 100% de las células registradas del sáculo y del utrículo, y en el 60% de las de los canales semicirculares, encontramos una corriente de K+ rectificante de entrada (IIR). En las células del sáculo, IIR tuvo una magnitud significativamente mayor que en las células de los otros dos órganos. Nuestros resultados sugieren que, en el aparato vestibular del axolotl, la expresión de las corrientes iónicas así como sus cinéticas están relacionadas con el órgano del cual provienen las células. Esto indica que las propiedades intrínsecas de las células ciliadas contribuyen al procesamiento de la entrada sensorial en el aparato vestibular del axolotl. 1 Angélica Almanza G Introducción Los órganos vestibulares se comportan de manera análoga a un sistema de control inercial, ya que responden a aceleraciones angulares y lineales de la cabeza; las aceleraciones lineales pueden ser el resultado del movimiento translacional de la cabeza o de un cambio en la orientación de la misma con respecto a la normal; mientras que, las aceleraciones angulares resultan de movimientos rotatorios de la cabeza (Young, 1984). El control del movimiento corporal comprende la integración de la información vestibular con la aportada por otros órganos de los sentidos (entradas visuales y somatosensoriales) para producir respuestas motoras coordinadas. Dicha integración sucede al nivel de núcleos vestibulares, cerebelo, núcleos motores y corteza, generándose un esquema sobre la postura y el movimiento (Correia y Guedry, 1978; Goldberg y Fernández, 1984; Soto, Budelli y Holmgren, 1998; Guth y cols., 1998). Las estructuras sensoriales del sistema vestibular son colectivamente conocidas como aparato vestibular. En el hombre, este aparato tiene tres funciones: 1) es el órgano primario del equilibrio, jugando un papel dominante en la sensación subjetiva del movimiento y la orientación espacial, 2) las entradas vestibulares al sistema de control postural generan el ajuste de la actividad muscular y la posición corporal para mantener el equilibrio, y 3) las influencias vestibulares sobre los movimientos de los ojos tienden a estabilizar a estos últimos en el espacio durante los movimientos de la cabeza (Correia y Guedry, 1978; Young, 1984). El laberinto membranoso El sistema vestibular es filogenéticamente muy antiguo; se ha encontrado en todos los vertebrados existentes y en restos fósiles de vertebrados. Es sorprendentemente constante en anatomía y función a través del reino animal, lo cual indica su importancia y su papel central en el control sensorial del comportamiento (Goldberg y Fernández, 1984; Guth y cols., 1998); existe consenso acerca de que el oído interno de los vertebrados representa el resultado evolutivo de una migración hacia el interior y de una especialización de los elementos del sistema de la línea lateral (Baird, 1974). Embriológicamente, el laberinto vestibular se origina por una invaginación del ectodermo dando origen a una vesícula, el otocisto, el cual sufre una complicada reorganización para 2 Corrientes iónicas en células ciliadas formar las diversas partes del laberinto (Aidley, 1998; Wersäll y Bagger-Sjöbäck, 1974; Morsli y cols., 1998). El sistema vestibular (que constituye la porción no auditiva del oído interno), es un sistema bilateral de sacos membranosos, llamados órganos otolíticos y canales semicirculares. Estos órganos están llenos de fluido y están contenidos en una cápsula de cartílago o hueso ubicada en el espesor del hueso temporal y denominada laberinto óseo, (Lowenstein, 1974; Anniko, 1988; Wersäll y Bagger-Sjöbäck, 1974). El espacio entre el laberinto membranoso y el óseo está lleno de perilinfa, mientras que en el interior de los sacos y canales encontramos un fluido llamado endolinfa. Estos fluidos CA U PB S CP L Figura 1. Aparato vestibular de una salamandra (estado adulto del axolotl). La ubicación del vestíbulo está indicada con un círculo. El vestíbulo se muestra desde su parte medial y se observa la inervación del canal anterior (CA), utrículo (U), sáculo (S), papila basilar (PB), lagena (L), papila amphibiorum (PA) y canal posterior (PC). Desde esta vista, el canal horizontal se localiza detrás del utrículo. El ducto endolinfático (E) se extiende del sáculo hacia adentro de la cavidad craneal (Tomado de Fritzsch, 1996). 3 Angélica Almanza G protegen a las delicadas estructuras de choques mecánicos y contribuyen al proceso de acoplamiento mecánico y de transducción (Young, 1984). En el axolotl, el laberinto membranoso se divide en dos partes: una superior, que comprende a los tres canales semicirculares y al utrículo, y una inferior, formada por el sáculo, la lagena, la papila basilar y la papila amphibiorum (Izquierdo, 1929; Cruz, 1994; García, 1994) (Figura 1). Según la anatomía comparada, las papilas basilar y amphibiorum están destinadas a la función auditiva y las demás a la del equilibrio (Izquierdo, 1929). Tanto las máculas como las crestas ampulares son regiones especiales del laberinto vestibular formadas por células ciliadas; éstas son células especializadas en la mecanorrecepción y constituyen el elemento funcional básico del sentido del equilibrio (Anniko, 1988). Las células ciliadas Las células ciliadas varían en su tamaño (10-50 µm) y en su forma; han sido clasificadas de acuerdo con la morfología de los cilios y el patrón de inervación (Wersäll y Bagger-Sjöbäck, 1974; Goldberg y Fernandez, 1984; Guth y cols., 1998). La primera clasificación de células ciliadas en el epitelio sensorial de amniotes las agrupa en dos tipos: células ciliadas tipo I y tipo II (Wersäll y Bagger-Sjöbäck, 1974). Las células tipo I tienen forma de ánfora y se encuentran rodeadas por un cáliz formado por la terminal de una fibra nerviosa aferente; las terminales nerviosas eferentes generalmente hacen sinapsis con el cáliz aferente (Figura 2). Las células ciliadas tipo II son de forma cilíndrica y reciben terminales nerviosas aferentes y Figura 2. Células ciliadas tipo I y II. Puede observarse que las células ciliadas tipo I tienen forma de ánfora y están rodeadas be completamente por el cáliz de una terminal aferente. Las células ciliadas tipo II son más cilíndricas y reciben terminales aferentes (ba) y eferentes (be) en botón. Ambos tipos de terminales aferentes presentan un cuerpo sináptico cuya función se desconoce (Tomado de ba 4 Eatock y Rush, 1997). Corrientes iónicas en células ciliadas Figura 3. Fotografía con microscopía electrónica del haz de cilios de una célula del oído interno de la rana toro. El haz está formado por aproximadamente 50 estereocilios y un cilio verdadero: el kinocilio. En estado de reposo, el haz de cilios tiene la forma de un cono vertical. Las células de soporte que rodean a la célula ciliada presentan múltiples microvellosidades que se extienden desde su superficie apical (Tomado de Hudspeth, 1983). eferentes en forma de botón; estas células son consideradas filogenéticamente más antiguas que las células ciliadas tipo I (Anniko, 1988; Goldberg y Fernández, 1984). El haz de cilios está formado por varios estereocilios y un kinocilio. El kinocilio, es un cilio verdadero; mientras que los demás, llamados estereocilios, son microvellosidades. Los cilios emergen de la superficie apical de las células ciliadas (Figura 3); su número es variable, pero grupos de más de 50 estereocilios son comunes (Lowenstein, 1974; Wersäll y Bagger-Sjöbäck, 1974). Los estereocilios tienen diferentes longitudes, están dispuestos muy regularmente de forma hexagonal. Cada estereocilio está rodeado por otros seis equidistantes; la longitud de los estereocilios disminuye al alejarse del kinocilio. Este arreglo da origen a la polarización funcional de las células ciliadas en el neuroepitelio de las máculas y crestas, en donde la localización del kinocilio coincide con la dirección de excitación de la célula ciliada (Anniko, 1988; Correia y Guedry, 1978; Hudspeth, 1983; Wersäll y Bagger-Sjöbäck, 1974). Transducción mecanoeléctrica Una de las posibles claves para entender la transducción en las células ciliadas radica en entender la relación entre las asimetrías anatómicas y funcionales del haz de cilios (Pickles y cols., 1984). Los estereocilios contienen un centro de filamentos de actina, lo que les confiere una estructura rígida; así, cuando sufren una deflexión, la inclinación de los estereocilios sucede a nivel de su base ( Flock y cols., 1977; Hackney y Furness, 1995). Los estereocilios 5 Angélica Almanza G A B TL LL Figura 4. Fotografía electrónica de las uniones de punta y laterales en las células ciliadas de la papila basilar de pollo. (A) Se muestra el arreglo característico de las uniones de punta (tip links) entre los estereocilios (flechas). La unión de punta une los canales iónicos mecanotransductores de la región apical con los que se localizan en la pared lateral del siguiente cilio. (B) Estereocilio en el que se aprecia la unión de punta (TL), y las uniones laterales entre los estereocilios (LL) (Tomado de Pickles y cols., 1984; Pickles y cols., 1989). están unidos en su ápice a través de lo que se denomina uniones de punta (tip links; Figura 4). Estas uniones de punta se han encontrado en las células ciliadas de todas las clases representativas de vertebrados, por lo tanto es muy probable que estén presentes en la mayoría de las células ciliadas mecanorreceptoras en el sistema acústicolateral. Estas uniones especializadas emergen de las puntas de los estereocilios y unen la punta del estereocilio corto hacia el vecino más largo en la próxima fila (Pickles y cols., 1984; Pickles y cols., 1989; Dunnebier y cols., 1995). Un análisis detallado empleando microscopía electrónica con enfriamiento rápido reveló que la unión de punta se divide en dos ramas en su inserción con la membrana del estereocilio más largo y en tres ramas en su inserción con el estereocilio más corto. Si se considera que existe un canal transductor por cada rama, entonces puede haber más de seis canales por cada unión de punta (Kachar y cols., 2000); sin embargo, existen reportes previos que, con base en el análisis de la conductancia unitaria, han concluido que la relación canales-cilios es 1:1 (Ohmori, 1985). Mecanismo electrofisiológico de la transducción y potencial receptor La superficie apical de la célula ciliada está en contacto con la endolinfa cuya composición es alta en iones potasio y baja en iones sodio (similar a la del interior de la célula). La superficie 6 Corrientes iónicas en células ciliadas basal de la célula está en contacto con la perilinfa, similar al líquido extracelular: alta en iones sodio y baja en iones potasio (Tabla I) (Lowenstein, 1974; Ferrary y cols., 1992; Sauer y cols., 1999). Tabla I. Composición iónica de la endo y la perilinfa en diferentes especies animales (valores expresados en milimoles). Humano1 Paloma2 Cobayo1 Rana3 Perilinfa Endolinfa Perilinfa Endolinfa Perilinfa Endolinfa Perilinfa Endolinfa Potasio 7-8 1.7 121 Sodio 135-150 13-16 Cloruro 135 1 140-160 120-130 4.2 140.6 4.8-5 142-144 150 ---- 148-150 15-26 120 5.4 116.6 142.2 120-121 107-110 102 94 Lowenstein, 1974. 2 Sauer y cols., 1999. 3 Ferrary y cols., 1992. El potencial de membrana de la célula recibe influencias tanto de la permeabilidad del área basal como del área apical; en reposo, existe una permeabilidad debida a que algunos canales iónicos están abiertos (los canales de transducción tienen baja probabilidad de apertura); en este estado, la permeabilidad basal es mayor que la apical generándose el potencial de membrana en reposo (Hudspeth, 1983). Debido a que la membrana basal es permeable principalmente a iones K+, el potencial de membrana entre el medio intracelular y la perilinfa, tiende a ser cercano al potencial de equilibrio de éste ión (Fig. 5). Hudspeth y Corey (1977) estimulando directamente por medio de deflecciones mecánicas al haz de cilios, registraron intracelularmente los cambios que acompañan al movimiento del haz de cilios y encontraron que el componente despolarizante del potencial receptor corresponde al estímulo dirigido hacia el kinocilio y es debido a la apertura de canales adicionales en el área apical, a través de los cuales fluyen iones positivos hacia el interior celular generando la corriente de transducción y despolarizando a la célula; a esta despolarización se le conoce como potencial receptor (Hudspeth y Corey, 1977; Hudspeth, 1983). El componente hiperpolarizante del potencial receptor corresponde al estímulo en la dirección opuesta al kinocilio, lo que genera que los pocos canales que estaban abiertos en el área apical en el estado de reposo se cierren (Hudspeth, 1983; Pickles y Corey, 1992). Registros de corrientes de transducción (Fig. 6) muestran que la relación corriente-desplazamiento de los cilios es saturable, no lineal y 7 Angélica Almanza G Figura 5. Esquema del neuroepitelio vestibular que muestra la composición de la endo y la perilinfa. El epitelio mantiene el gradiente iónico gracias a las uniones estrechas entre las células que lo forman. In situ, la corriente de transducción es acarreada principalmente por iones K+ que producen una corriente entrante despolarizando a la célula (potencial receptor). En cambio, en una célula aislada, la corriente de transducción es acarreada por iones Na+ y Ca2+. ampliamente asimétrica (Hudspeth y Corey, 1977; Hudspeth, 1983; Holt y cols., 1997; Thurm, 1983). De acuerdo con lo anterior, la deflexión del haz de cilios causa la apertura o cierre de canales iónicos transductores en los estereocilios, modulando el flujo de corriente hacia el interior de la célula (Hudspeth y Corey, 1977). Experimentos de fijación de voltaje han demostrado que la corriente de transducción es acarreada principalmente por iones K+ pero, además, los canales de transducción son altamente permeables al Ca2+, y este último contribuye también a la corriente de transducción (Ohmori, 1985, 1989). Hallazgos realizados utilizando colorantes sensibles al Ca2+ (calcium-green, Fluo 3) en la pipeta de registro indican que estos canales están localizados en ambos extremos de las uniones de punta de los estereocilios adyacentes y que la concentración de Ca2+ aumenta rápidamente en las puntas de los estereocilios cuando los canales se abren (Denk y cols., 1995; Lumpkin y Hudspeth, 1995; para revisión ver Jaramillo, 1995). 8 Corrientes iónicas en células ciliadas El proceso de transducción es un evento rápido, la latencia entre el desplazamiento del haz y la apertura de canales es de alrededor de 10 µs; esta latencia corta descarta que la apertura de canales sea a través de la activación de una cascada de segundos mensajeros y favorece el modelo que propone que los canales de transducción son abiertos directamente por componentes elásticos denominados "resortes de disparo" (Corey y Hudspeth, 1983b). El descubrimiento de las uniones de punta (Pickles y cols., 1984) sugirió que éstas podían ser los elementos elásticos; sin embargo, estudios de microscopía electrónica de alta resolución indican que la estructura de dichas uniones es altamente rígida y, por tanto, carece de elasticidad, por lo que se propone la existencia de otro elemento elástico ubicado dentro del cilio y conectado en serie con la unión de punta. Esta conexión es la que transmitiría la fuerza hacía el canal generando su apertura (Kachar y cols., 2000). B Corriente (pA) A I µm) Desplazamiento del haz (µ Figura 6. Corriente de transducción en las células ciliadas. (A) Gráfica de la corriente de transducción contra el desplazamiento de la punta del haz de cilios. Se observa que la relación corriente-desplazamiento es marcadamente asimétrica: la respuesta positiva que se genera con el desplazamiento hacia el kinocilio muestra una aproximación gradual hacia un nivel y alcanza una magnitud absoluta mayor que la respuesta negativa que se genera con el desplazamiento hacia el lado contrario del kinocilio. (B) Esquema que muestra el arreglo experimental para desplazar el haz de cilios. La corriente de transducción mecanoeléctrica se registra con un electrodo de fijación de voltaje (Tomado de Ohmori, 1985). Adaptación en las células ciliadas Ante una deflexión sostenida del haz de cilios, los canales de mecanotransducción se cierran y la respuesta sensorial disminuye. A este decaimiento de la corriente de transducción se le denomina adaptación sensorial; este fenómeno fue observado por primera vez en las células ciliadas del sáculo de la rana (Eatock y cols., 1987) y, posteriormente, en las células del utrículo del ratón (Holt y cols., 1997) y de la cóclea de la tortuga (Crawford y cols., 1989; 9 Angélica Almanza G Fettiplace y cols., 1992). Los hallazgos experimentales en estas especies indican que la adaptación está asociada a un corrimiento de la relación corriente-desplazamiento a lo largo del eje del desplazamiento en dirección del estímulo aplicado (despolarizante o hiperpolarizante), con lo que la probabilidad de apertura de los canales mecanotransductores regresa a su valor en reposo (Corey y Hudspeth, 1983a; Eatock y cols., 1987; Holt y cols., 1997). Funcionalmente, se propone que ante un estímulo lento o prolongado, el proceso de adaptación estaría restaurando la sensibilidad de la célula ante un nuevo estímulo mediante un cambio en el rango de operación del haz, para así registrar su nueva posición (para una revisión ver Lenzi y Roberts, 1994; Eatock, 2000). Se han propuesto dos modelos para explicar la adaptación: el modelo del motor activo (para revisión ver Holt y Corey, 2000) y el modelo de cierre dependiente de Ca2+ (Crawford y cols., 1989; Crawford y cols., 1991). El primer modelo considera que la tensión de las uniones de punta es controlada por un motor de miosina conectado en serie con el canal de transducción y con el elemento elástico. Con base en este modelo, el mecanismo es como sigue: ante una deflexión positiva del haz, la tensión en las uniones de punta se incrementa y los canales se abren; en consecuencia, las moléculas de miosina se deslizan hacia abajo sobre los filamentos de actina del citoesqueleto, la tensión de las uniones de punta disminuye, los canales comienzan a cerrarse y el haz se relaja en su nueva posición. En respuesta a una deflexión negativa, la tensión en las uniones de punta disminuye y los canales se cierran; en este caso, el motor de miosina sube por el estereocilio, restaura la tensión de las uniones de punta y jala al haz en la dirección negativa (para revisión ver Hudspeth y Gillispie, 1994; Jaramillo, 1995; Gillispie y Corey, 1997; Eatock, 2000; Holt y Corey, 2000). El modelo de cierre dependiente de Ca2+ considera que la adaptación depende de la concentración de Ca2+ dentro de las puntas del estereocilio; la unión directa del Ca2+ en sitios ubicados en el canal de manera intracelular induce un rearreglo molecular que favorece el cierre de los canales (para una revisión ver Holt y Corey, 2000; Eatock, 2000; Choe y cols., 1998; Lenzi y Roberts, 1994). Electrofisiología de las células ciliadas El potencial receptor en las células ciliadas depende de la interacción entre la corriente de transducción y las propiedades activas de las células ciliadas que se originan en los canales 10 Corrientes iónicas en células ciliadas iónicos presentes en su membrana basolateral y, pasivamente, por la capacitancia y la resistencia de la membrana (Hudspeth y Lewis, 1988a; Hudspeth, 1986; Rennie y cols., 1996). Las canales de K+ de salida son los más abundantes en la región basolateral. Se activan en respuesta a potenciales receptores despolarizantes. El eflujo de iones potasio a través de estos canales se opone a la corriente de transducción repolarizando a la célula. Los canales de K+ de salida pueden pertenecer a una de las siguientes familias: dependientes de Ca2+, rectificadores retardados y de tipo transitorio (Eatock y Rüsh, 1997). También se encuentran los canales de calcio activados por voltaje en las células ciliadas; al igual que en otras células (por ejemplo, en neuronas del sistema nervioso central), la entrada de Ca2+ a través de estos canales tiene varias funciones, entre ellas, activar la exocitosis y la endocitosis de las vesículas que contienen al transmisor, y promover la apertura de canales de K+ dependientes de Ca2+. (Parsons y cols., 1994; Issa y Hudspeth, 1996; Cousin y Robinson, 1998; Beutner y cols., 2001). Otro tipo de canales comúnmente presentes en las células ciliadas son los rectificantes de entrada; estos canales se abren en respuesta a hiperpolarizaciones (por ejemplo, una deflexión negativa del haz de cilios), su rango de activación depende de la concentración de K+ extracelular y la relación corriente-voltaje para la corriente que fluye a través de estos canales muestra una rectificación alrededor de su potencial de inversión. El flujo iónico a través de estos canales puede contribuir a la conductancia en reposo y consecuentemente influir en el valor del potencial de membrana (Holt y Eatock, 1995; Eatock y Rüsh, 1997). La electrofisiología de las células ciliadas aisladas ha sido estudiada en la rana (Hudspeth y Lewis, 1988a,b; Holt y Eatock, 1995), la paloma (Correia y Lang, 1990), el cobayo (Rennie y Ashmore, 1991), la rata (Eatock y Hutzler, 1992), el ratón (Rüsh e Eatock, 1996a,b), el axolotl (Vega, 2001) y el pollo (Masetto y cols., 1998) (Tabla II). Además, Oghalai y cols. (1998), encontraron que las conductancias dependientes del voltaje expresadas en las células ciliadas aisladas del vestíbulo de humano son similares a las descritas en otros mamíferos, resultados que sugieren que la electrofisiología de las células ciliadas aisladas está esencialmente conservada en los vertebrados. 11 Angélica Almanza G Tabla II. Electrofisiología de las células ciliadas del aparato vestibular Corriente Tipo de Órgano Animal CSC Paloma1,5, jerbillo2 Utrículo. Ratón3, rata4 Utrículo Ratón3,6 CSC Pollo7, rana8, paloma1,9, cobayo10, axolotl11 Sáculo Pez dorado12 Sáculo Rana13, pez dorado12 P. Amph. Rana14 CSC Pollo7, rana8,15,16 Sáculo Rana13, pez dorado12 P. Amph. Rana14 CSC Pollo7 CSC Rana8,17,18, paloma1,9, cobayo10, pollo7, axolotl11 P. Amph. Rana14 Sáculo Rana18,19, pez dorado12 CSC Paloma1,9, cobayo10 Sáculo Rana18,19, pez dorado12 P. Amph. Pollo7, rana14 célula IK,L IK,DR IK,1 IK,h IK,A IK,Ca ICa 1 I I, II I, II I, II I, II I, II I, II Correia y Lang, 1990; 2Rennie y cols., 1996; 3Rüsh y cols., 1998; 4Eatock y Hutzler, 1992; 5Rennie y Correia, 1994; 6Holt y cols., 1999; 7Masetto y cols., 1998; 8Masetto y cols., 1994; 9Masetto y Correia, 1997; 10 Rennie y Ashmore, 1991; 11 Vega, 2001; 12Sugihara y Furukawa, 1989; 13Holt y Eatock, 1995; 14Smotherman y Narins, 1999; 15Marcotti y cols., 1999; 16Masetto y cols., 1999; 17Ricci y cols., 1994; 18Hudspeth y Lewis, 1988 a,b; 19Lewis y Hudspeth, 1983. En términos generales, se ha encontrado que las células ciliadas tipo I de los canales semicirculares de la paloma y del jerbillo exhiben potenciales de membrana en reposo más negativos y conductancias de entrada mayores que las células ciliadas tipo II (Correia y Lang, 1990; Rennie y cols., 1996). Corriente rectificadora lenta de bajo umbral IK,L. Las células ciliadas tipo I, a diferencia de las tipo II, poseen una corriente de potasio que es activada a voltajes inusualmente 12 Corrientes iónicas en células ciliadas negativos. A esta corriente Rennie y Correia (1994) la denominaron IK,I, mientras que Rüsh y Eatock (1996a,b) la nombran IK,L (low-voltaje-activating K+ current). La IK,L se ha encontrado en células ciliadas tipo I de órganos vestibulares en mamíferos y aves, marcando una diferencia importante entre las células ciliadas tipo I y tipo II (Eatock y Hutzler, 1992; Correia y Lang, 1990; Rennie y Correia, 1994; Rüsh y cols., 1998). IK,L es una corriente saliente de K+, su potencial de inversión es cercano al potencial de equilibrio del K+; tiene una baja permeabilidad para iones sodio, una alta sensibilidad para el bloqueador del canal de K+ 4-aminopiridina (4-AP, 5 mM) y es sensible al Ba2+. Lo anterior indica que el K+ es el principal ión acarreador de esta corriente. IK,L se activa a potenciales inusualmente negativos, es sensible a fosforilación, su rango de activación es dependiente de la temperatura, sigue una cinética lenta y sigmoidal y es modulada posiblemente vía óxido nítrico (Eatock y Hutzler, 1992; Rüsh y Eatock, 1996; Ricci y cols., 1996; Chen y Eatock, 2000). A diferencia de muchos canales de K+, IK,L no es bloqueada por Cs+ ( Rüsh y Eatock, 1996a,b). IK,L se asemeja a la conductancia IK,n encontrada en las células ciliadas externas de la cóclea, y se ha sugerido que el canal por el que fluye esta corriente está formado por la subunidad KCNQ4, cuya ausencia genera sordera (para revisión ver Rogawski, 2000; Steel y Kros, 2001). IK,L tiene importantes consecuencias funcionales en las células ciliadas tipo I. Su gran conductancia (21 nS/pF) lleva el potencial de membrana de la célula tipo I cerca del potencial de equilibrio del K+, de tal manera que cambios en el voltaje de transducción tendrán mínimos efectos sobre las conductancias dependientes del voltaje, disminuyendo la ganancia de la célula y dando como resultado que el potencial receptor sea una función lineal de la corriente de entrada. Si IK,L es la corriente dominante in situ, entonces las células ciliadas tipo I son capaces de responder rápidamente a cambios repentinos en la posición de la cabeza (Rennie y cols., 1996; Rüsh y Eatock, 1996a,b; Rennie y Correia, 1994). Corriente rectificadora retardada IK,DR. La corriente dominante en las células ciliadas tipo II en rata y ratón es una rectificante retardada activada por voltaje (IK,DR) (Rüsh y Eatock, 1996a,b). Esta corriente tiene una cinética sigmoidal y su rango de activación corresponde a una corriente de K+ rectificante de salida. Una característica distintiva entre IK,L e IK,DR es su activación en el estado de reposo: mientras que un 30% de IK,L está activada en el reposo, solo alrededor de un 0.5% de IK,DR está activada en este estado, lo que indica que IK,DR tiene un 13 Angélica Almanza G voltaje medio de activación desplazado a valores positivos con respecto de IK,L (Rüsh y Eatock, 1996a,b). Con base en el potencial de inversión de la IK,DR, se observó que esta corriente es principalmente acarreada por K+ (Eatock y Hutzler, 1992). IK,DR es la corriente dominante en todas las células ciliadas del utrículo en el ratón hasta el día 4 postnatal, cuando las células ciliadas tipo I empiezan a adquirir IK,L (Holt y cols., 1999; Rüsh y cols., 1998). IK,DR es también la corriente dominante en las células ciliadas de canales semicirculares en pollo de 10-12 días de vida embrionaria, incrementándose la variedad de corrientes iónicas en días posteriores (Masetto y cols., 1998). IK,DR se ha descrito también en células ciliadas de canales semicirculares de rana (Masetto y cols., 1994), canales semicirculares de paloma (Masetto y Correia, 1997; Correia y Lang, 1990), sáculo del pez dorado (Sugihara y Furukawa, 1989), en células ciliadas de canales semicirculares del cobayo (Rennie y Ashmore, 1991) y del axolotl (Vega, 2001). Corrientes rectificantes de entrada IK,1 y Ih. Se han descrito dos tipos de corrientes rectificantes de entrada en las células ciliadas del sáculo, la papila anfibiana de rana y el sáculo del pez dorado (Holt y Eatock, 1995; Smotherman y Narins, 1999a; Sugihara y Furukawa, 1989): una de ellas se activa rápidamente y es selectiva al K+ (IK,1), mientras que la otra se activa lentamente y es menos selectiva a K+ (Ih). Ambas corrientes se han descrito también en células ciliadas de los canales semicirculares del pollo (Masetto y cols., 1998) y en células ciliadas de utrículo de ratón (Rüsh y Eatock, 1996; Rüsh y cols., 1998). En canales semicirculares y papila basilar de rana sólo se ha reportado la presencia de IK,1 (Marcotti y cols., 1999; Masetto y cols., 1994; Masetto y cols., 1999; Smotherman y Narins, 1999b), la cual presenta características similares a la descrita en sáculo y papila amphibiorum: su rango de activación depende de la concentración de K+ externa, muestra selectividad al K+, su activación es una rápida monoexponencial con un decaimiento temporal a potenciales muy negativos y es bloqueada por Ba2+ y Cs+ (Marcotti y cols., 1999; Holt y Eatock., 1995; Masetto y cols., 1994; Masetto y Correia., 1997 ). La Ih en las células ciliadas es una mezcla de corriente de Na+ y K+; es relativamente lenta, y alcanza su estado estable en cientos de milisegundos, en contraste con la IK,1 que llega a su estado estable en pocos milisegundos. Su activación e inactivación siguen una cinética sigmoidal lenta. La Ih es bloqueada por Cs+ externo, pero no por Ba2+ (Holt y Eatock, 1995). 14 Corrientes iónicas en células ciliadas Corriente transitoria de salida, IK,A. La IK,A es una corriente de K+ inactivante cuya cinética de activación e inactivación es dependiente del voltaje, es sensible a bajas concentraciones de 4-AP y se encuentra parcialmente inactivada en el potencial de reposo. IK,A ha sido descrita en células ciliadas de canales semicirculares de rana (Masetto y cols., 1994; Ricci y cols., 1994; Hudspeth y Lewis, 1988a,b), de paloma (Masetto y Correia, 1997; Correia y Lang, 1990), de cobayo (Rennie y Ashmore, 1991), de pollo (Masetto y cols., 1998), de axolotl (Vega, 2001) y en células ciliadas de la papila anfibiana de la rana (Smotherman y Narins, 1999a). Corriente de Ca2+, ICa. Originalmente, la corriente de Ca2+ fue descrita en las células ciliadas del sáculo de la rana por Hudspeth y Lewis (1988a,b). En estas células, la amplitud de la corriente es muy variable con una media de 240 pA, alcanzando la corriente máxima a –10 mV; se activa a potenciales más positivos de -60 mV, no presenta inactivación durante despolarizaciones prolongadas y se encuentra parcialmente activada en potenciales cercanos al potencial de reposo (Lewis y Hudspeth, 1983b). En células ciliadas cocleares del pollo y de los canales semicirculares de la rana, la ICa es de tipo L y presenta alta sensibilidad al Cd2+ extracelular (100µM) y al Ni2+ en altas concentraciones. Es parcialmente bloqueada con nifedipina y activada con BayK8644; presenta una rápida activación y no se inactiva, (Fuchs y cols., 1990; Prigioni y cols., 1992; Zidanic y Fuchs, 1995). Sin embargo, en células ciliadas saculares de rana, mediante registros de canal único, además de distinguir canales de Ca2+ de tipo L, se detectaron canales de Ca2+ de tipo no L, los cuales son insensibles a dihidropiridinas y presentan una activación a potenciales más negativos que los de tipo L (abajo de -50 mV), por lo que los autores sugieren que se trata de canales de tipo N (Su y cols., 1995). Se piensa que los canales de Ca2+ de tipo L son los que están directamente acoplados a la liberación de neurotransmisor (Perin y cols., 2000; Zidanic y Fuchs, 1995) mientras que el papel de los canales de Ca2+ de tipo no L no se conoce con precisión (Perin y cols., 2000). Corriente de K+ activada por Ca2+, IK,Ca. En células ciliadas aisladas del sáculo de la rana la corriente más prominente es la corriente de K+ de salida activada por Ca2+ (IK,Ca); esta corriente se activa a potenciales más positivos de -60 mV, es sensible a TEA y se elimina con condiciones que bloqueen a la ICa; la activación de esta corriente es de 10 a 100 veces más rápida que la IK,Ca reportada en neuronas de caracol (Hudspeth y Lewis, 1988a,b; Lewis y Hudspeth, 1983; Meech y Standen, 1975). 15 Angélica Almanza G En anfibios y en mamíferos la IK,Ca, además de su rápida activación, presenta una inactivación parcial a un nivel estacionario (Masetto y cols., 1994; Rennie y cols., 1996; Armstrong y Roberts, 1998). En células ciliadas del sáculo de la rana, IK,Ca es sensible a la iberiotoxina en un rango nM, lo cual indica que se produce a través de canales de K+ de tipo BK (Big K) (Armstrong y Roberts, 1998). Por el contrario, en las células ciliadas de canales semicirculares del jerbillo y de la paloma, así como en las de la papila basilar de tortuga, IK,Ca no muestra sensibilidad para la iberiotoxina, pero es bloqueada por apamina en rango nM, lo que sugiere que se produce a través de canales de K+ de tipo SK (Small K) (Rennie y Correia, 1994; Tucker y Fettiplace, 1996 ). Variabilidad en la expresión de corrientes iónicas. Las células ciliadas tienen marcadas diferencias fisiológicas, morfológicas, bioquímicas y farmacológicas; aun dentro de un mismo órgano presentan diferentes propiedades. Las conductancias mecanosensibles de las células parecen ser similares en muchas de sus propiedades; sin embargo, las conductancias basolaterales expresadas por una célula pueden ser distintas a las de las células de la vecindad. Debido a esto, es altamente probable que estas diferencias de permeabilidad controlen la manera en la cual las células ciliadas responden individualmente a las señales de entrada, las procesan y producen una modificación en la salida para su ulterior procesamiento neural (Guth y cols., 1998; Eatock y Rüsh, 1997). Las conductancias iónicas en las células ciliadas varían dependiendo de la especie animal, el órgano y la región del órgano del oído interno del cual provienen, así como del estado de desarrollo del animal (Masetto y cols., 1998; Marcotti y cols., 1999; Sugihara y Furukawa, 1989; Masetto y cols., 1994; Rüsh y cols., 1998). En rebanadas de las crestas ampulares de la rana se distinguen morfológicamente tres clases de células ciliadas: células con forma cilíndrica, ubicadas en la parte central de la cresta; células con forma de bastón (células "club"), que prevalecen en las regiones periféricas, y células con forma de pera, las cuales se localizan en las regiones intermedias (Masetto y cols., 1994; Marcotti y cols., 1999). Registros electrofisiológicos en rebanadas de canales semicirculares de rana y paloma muestran que la IK,A es el principal componente de la corriente de salida en las células ciliadas de las regiones periféricas de la cresta, encontrándose ausente en las células de la región central en donde IK,DR es la conductancia predominante, 16 Corrientes iónicas en células ciliadas mientras que la expresión de IK,Ca es similar en las células de ambas regiones (Masetto y cols., 1994; Marcotti y cols., 1999; Masetto y Correia, 1997). La expresión de las corrientes rectificantes de entrada IK,1 e Ih en las células ciliadas saculares de la rana, se ha relacionado con la forma de la célula, siendo las de forma cilíndrica las que expresan ambas corrientes, mientras que las de forma esférica solo presentaron Ih (Holt y Eatock, 1995). De manera similar, Sugihara y Furukawa, en 1989, encontraron en el sáculo del pez dorado que las células cilíndricas expresan IK,1, a diferencia de las células ovoides. Sin embargo, en los canales semicirculares de la rana, las células con forma “club”, ubicadas en la parte media de la región periférica cercana al centro de la cresta, expresan IK,1, a diferencia de las células de la misma forma pero localizadas en la periferia (Marcotti y cols., 1999). Las propiedades eléctricas de las células ciliadas de la papila anfibiana de la rana también varían dependiendo de la ubicación de las células en el epitelio sensorial. Todas las células, expresan IK,Ca e ICa, mientras que IK,A se limita a las células ubicadas rostralmente, e IK,1 se localizó solamente en las células de la región caudal (Smotherman y Narins, 1999a). Las diferencias regionales arriba mencionadas indicarían que las células ciliadas localizadas en áreas discretas de los epitelios sensoriales vestibulares pueden extraer diferente información de la señal sensorial para su codificación (Steinacker y Romero, 1991). Resonancia eléctrica El procesamiento auditivo y vestibular comprende la transformación de estímulos complejos en señales eléctricas y en sus componentes de frecuencia; las células ciliadas, además de ser responsables de la mecanotransducción, también pueden jugar un papel importante en la Figura 7. Resonancia eléctrica en una célula ciliada de la papila anfibiana de la rana. Se muestra la respuesta de la célula ante pulsos despolarizantes de amplitud creciente (25, 50...125 pA). El factor de calidad (Qc) disminuye conforma aumenta la intensidad del estímulo. La frecuencia de resonancia se incrementa conforme se incrementa la intensidad del estímulo. La oscilación al final del pulso permanece sin cambio (tomado de Smotherman y Narins, 1999). 17 Angélica Almanza G selectividad de frecuencias (Fettiplace, 1987). En 1981, Crawford y Fettiplace describieron la resonancia eléctrica en las células cocleares (papila basilar) de la tortuga; en estas células la resonancia se manifiesta como oscilaciones de voltaje generadas por la inyección de pulsos de corriente (Fig. 7) y se piensa que la frecuencia de esta resonancia eléctrica determina la frecuencia auditiva característica; es decir, la frecuencia de sonido que produce la máxima respuesta de voltaje (Crawford y Fettiplace, 1981). La resonancia eléctrica de las células ciliadas ha sido descrita en anfibios, reptiles y peces, principalmente en órganos relacionados con respuestas a estímulos sonoros como son el sáculo y la papila basilar (Crawford y Fettiplace, 1981; Husdpeth y Lewis, 1988a, b; Lewis y Husdpeth, 1983b; Sugihara y Furukawa, 1989, 1995). En la rana, Lewis y Hudspeth (1983b, Husdpeth y Lewis, 1988a, b) encontraron que el comportamiento oscilatorio que presentan las células ciliadas aisladas enzimáticamente del sáculo es generado por la interacción entre la IK,Ca y la ICa. Inicialmente, cuando se inyecta un pulso de corriente despolarizante, el capacitor de la membrana se carga y la célula se despolariza; entonces, la ICa dependiente de voltaje se activa y el calcio intracelular aumenta; tanto el incremento de calcio intracelular como la despolarización activan a la IK,Ca y se produce una corriente de potasio de salida la cual hiperpolariza a la célula deactivando a la ICa (Fettiplace, 1987; Husdpeth, 1986). Para caracterizar la resonancia eléctrica de las células ciliadas se asume que la célula se comporta como un circuito resonante ante un pulso de corriente; la respuesta de tal circuito es una oscilación sinusoidal que se amortigua exponencialmente, que tiene una frecuencia f y una constante temporal de amortiguamiento τd , con lo cual se puede calcular el factor de calidad Q de acuerdo con la siguiente ecuación (Crawford y Fettiplace, 1981): [ ] Q = (πτ d f ) + 0.25 2 1 2 Valores grandes para Q corresponden a oscilaciones más prolongadas e indican que la célula se encuentra sintonizada con la frecuencia f. Recientemente, se reportó que el tratamiento enzimático utilizado para aislar a las células ciliadas modifica las corrientes iónicas que determinan la resonancia, por lo cual las diferencias entre preparaciones y especies deben ser reconsideradas (Armstrong y Roberts, 1998). 18 Corrientes iónicas en células ciliadas Planteamiento del problema En los órganos vestibulares de los amniotes han sido descritos dos tipos de células ciliadas: tipos I y II; además de la diferencia existente entre su terminal aferente, ellas difieren en su forma, en la geometría de su haz de cilios y en sus conductancias de K+. En los anfibios se encuentran únicamente células ciliadas tipo II; sin embargo, aun perteneciendo a un mismo tipo celular, éstas presentan diferencias morfológicas tanto in situ como aisladas, y pudieran también tener diferencias entre sus conductancias iónicas dependiendo del órgano vestibular al que pertenecen. Es por esto que es importante determinar las propiedades electrofisiológicas de las células ciliadas en diferentes órganos vestibulares, y con ello establecer si estas especializaciones están relacionadas con la función que cada órgano desempeña en el oído interno. El axolotl, representa un modelo adecuado para llevar a cabo este trabajo, ya que nos permite estudiar un tipo de células ciliadas y definir si existen diferencias electrofisiológicas dentro de un mismo tipo celular. Hipótesis Las células ciliadas tipo II en el axolotl, presentan diferencias tanto morfológicas como electrofisiológicas dependiendo del órgano vestibular al que pertenecen, lo cual está relacionado con la función que cada órgano desempeña dentro del aparato vestibular. Objetivos 1. Caracterizar mediante protocolos de estudio electrofisiológico y farmacológico las corrientes salientes presentes en las células ciliadas del sáculo, utrículo (órganos otolíticos) y canales semicirculares (órgano no otolítico). 2. Caracterizar mediante el estudio electrofisiológico y farmacológico las corrientes entrantes presentes en las células ciliadas aisladas del sáculo, utrículo y canales semicirculares. 3. Caracterizar los diferentes tipos de corrientes iónicas salientes presentes en las células ciliadas de los canales semicirculares y en el utrículo. 19 Angélica Almanza G 4. Definir las propiedades cinéticas, la sensibilidad al voltaje y la farmacología de las corrientes iónicas presentes en las células ciliadas. 5. Caracterizar la morfología de las células ciliadas aisladas del sáculo, utrículo y canales semicirculares. 6. Establecer de manera general la presencia de diferencias electrofisiológicas entre las células ciliadas de los órganos estudiados en este trabajo. 7. Integrar la información de las corrientes iónicas con los datos morfológicos para producir mapas de distribución de subtipos celulares, relacionando el tipo de corrientes iónicas con la morfología de las células aisladas. Material y métodos Animal de experimentación En este trabajo utilizamos ajolotes de las especies Ambystoma tigrinum o Ambystoma mexicanum, sin importar el tamaño de los anfibios. Disección Para aislar el oído interno del axolotl, el animal se decapitó y el maxilar inferior se separó del superior; éste último se conservó desprendiéndole el epitelio que lo cubre. El cráneo se fijó en una cámara con base de SylgardMR y se perfundió inmediatamente con solución extracelular normal (Tabla III) a 4°C para anfibio (Bracho y Budelli, 1978). Bajo un microscopio estereoscópico se identificó la región del oído interno, se retiró el cartílago que recubre al vestíbulo (cápsula ótica) hasta observar las estructuras que lo componen; se localizaron el utrículo, el sáculo y las ámpulas de los canales semicirculares y se disecaron cada uno de ellos por separado. Mediante un corte en el epitelio se descubrieron las máculas y las crestas sensoriales y, en el caso de las máculas, la membrana otolítica fue removida mediante un flujo lento de solución extracelular normal. Disociación celular Una vez que se disecaron las máculas otolíticas y las crestas, se efectuó la disociación enzimática para aislar a las células ciliadas localizadas en cada una de las preparaciones (cada 20 Corrientes iónicas en células ciliadas Tabla III. Soluciones (en mM). KCl NaCl MgCl2 CsCl TEACl BaCl2 CaCl2 HEPES EGTA GTPMg ATPNa2 NMDG+ Glucosa Extracelular 5 111 1 ---- ---- ---- 1.8 5 ---- ---- ---- ---- 10 Normal Intracelular 100 10 2 ---- ---- ---- 0.134 10 2 Normal Extracelular 5 111 ---- ---- ---- ---- ---- 5 ---- ---- ---- ---- 10 ---- ---- ---- 49.5 27 ---- 0.1 9 9 0.09 1.8 63 ---- ---- 63 ---- 22.5 18 4.5 0.9 9 ---- ---- ---- ---- 10 ---- sin Ca2+ ni Mg2+ Intracelular modificada con Cs+ para ICa Extracelular modificada con Ba2+ para ICa Osmolaridad ajustada a 240 mOsm. Soluciones extracelulares ajustadas a pH 7.4 con NaOH. Solución intracelular normal ajustada a pH 7.2 con KOH. Solución intracelular modificada con Cs+ ajustada a pH 7.2 con CsOH . preparación se trató individualmente). Diversos autores han reportado resultados satisfactorios usando como enzima a la papaína (Hudspeth y Lewis, 1988a,b; Tucker y Fettiplace, 1996; Smotherman y Narins, 1999); en nuestro laboratorio, usando la misma enzima, se obtuvo una gran cantidad de células en buenas condiciones (Vega, 2001); sin embargo, antecedentes en nuestro laboratorio indican que la papaína hace desaparecer la actividad aferente de las neuronas vestibulares del axolotl, y en un estudio reciente se reportó que la actividad proteolítica de esta enzima modifica las propiedades electrofisiológicas de las células ciliadas de los canales semicirculares de la rana (Armstrong y Roberts, 1998), por lo cual decidimos utilizar una enzima diferente. Ensayos realizados en el laboratorio nos llevaron a establecer un método de disociación con el cual obtuvimos células ciliadas aisladas en buenas condiciones a juzgar por su apariencia al microscopio. El procedimiento fue el siguiente: 21 Angélica Almanza G 1. El epitelio sensorial se colocó en solución extracelular normal a la cual se le agregó colagenasa tipo IA (Sigma) 0.1 mg/ml durante 7 minutos a una temperatura de 30°C. 2. La preparación se cambió a la solución extracelular sin Ca2+ ni Mg2+ (Tabla III) conteniendo tripsina (Sigma) 1 mg/ml durante 10 minutos a 30°C. 3. Posteriormente la preparación se colocó en solución extracelular sin Ca2+ ni Mg2+ con albúmina bovina (Sigma) 1 mg/ml durante 10 minutos a 4°C. 4. Por último, el tejido se trasladó a la cámara de registro ubicada en el microscopio invertido (Nikon Diaphot) en donde las células ciliadas se separaron mecánicamente con dos disectores de vidrio con puntas finas redondeadas y se dejaron reposar durante 10 minutos en solución extracelular normal sin flujo para que las células se adhirieran al fondo de la cámara. Inmediatamente después se inició la perfusión con solución extracelular normal. Morfometría de las células aisladas Las células ciliadas se observaron por medio de un microscopio invertido (Nikon Diaphot) con óptica de contraste de fase. La imagen de las células al microscopio se digitalizó por medio de una cámara de video compuesto blanco y negro (NEC TI-24A CCD), acoplada al tubo lateral del microscopio y conectada con una tarjeta digitalizadora de video (Data Translation 6800). Las imágenes se procesaron mediante el uso del programa Global Lab Image Ver. 2.0 (Data Translation). En estas imágenes se estudió la forma de la célula ciliada, se midieron sus diámetros para calcular su área y, con base en ésta, calcular teóricamente su capacitancia. La capacitancia así obtenida se comparó con la medida electrónicamente por el amplificador de fijación de voltaje. Registros eléctricos Los registros de las corrientes iónicas se llevaron a cabo mediante la técnica de fijación de voltaje en su versión de célula completa (Sakman y Neher, 1984) y se realizaron a temperatura ambiente (20-22°C) usando un amplificador de fijación de voltaje (Axopatch 1D y 200B, Axon Instruments). La señal de salida del amplificador se filtró con un corte de frecuencias de 2 a 5 KHz y se muestreó a 5 o 10 KHz dependiendo del protocolo en cuestión. Los registros se digitalizaron con un conversor analógico-digital (Digidata 1200) de 12 bits utilizando un sistema pClamp (versión 5 y 8, Axon Instruments) y se almacenaron en el disco duro de una 22 Corrientes iónicas en células ciliadas computadora PC compatible. Las pipetas para los registros de fijación de voltaje se fabricaron con un estirador horizontal (Sutter P-80/PC) y se emplearon pipetas de vidrio de borosilicato (WPI) de 1.2 mm de diámetro externo. Las pipetas se llenaron con solución intracelular (Tabla III) y, en el baño, tuvieron una resistencia eléctrica de 2.5 a 4 MΩ y un diámetro de punta de 1µm aproximadamente. El potencial de punta medido experimentalmente en varios ensayos (Neher, 1992) fue de 1.5 mV. La versión de célula completa de la técnica de fijación de voltaje se obtuvo después de cancelar la capacitancia de la pipeta y de formar un sello >2 GΩ. En estas condiciones, la resistencia de acceso (Ra), la resistencia de membrana (Rm), la constante de tiempo (τm) y la capacitancia de membrana (Cm), fueron calculadas en línea por el programa pClamp 8. Además, en las células estudiadas, dimos un pulso de -10 mV partiendo de un potencial de sostenimiento de -70 mV (con los filtros abiertos y digitalizado a 20 KHz); este pulso fue utilizado para calcular posteriormente la Cm, y la τm, valores con los que obtuvimos la resistencia en serie (Rs) a través de τ = R × C. No encontramos diferencias significativas entre los valores obtenidos en línea y los obtenidos con el pulso de voltaje. Para medir el potencial de membrana (Vm) de las células ciliadas de los tres órganos utilizamos el método de fijación de corriente sin inyección de corriente. Una vez que registramos las propiedades pasivas, en todos los registros (a menos que se especifique otra cosa), la capacitancia y el 80% de la resistencia en serie se compensaron electrónicamente. No se aplicaron correcciones adicionales para el potencial de punta ni para la resistencia en serie sin compensar. La perfusión de las soluciones extracelulares fue de manera constante con un flujo de 0.5 ml por minuto usando una bomba peristáltica (LKB, Microperpex). Para la microperfusión de los fármacos utilizamos un sistema de inyección para microdiálisis (Baby Bee, BAS). Los fármacos usados fueron 4-aminopiridina (4-AP), tetraetilamonio (TEA) y BaCl2, todos bloqueadores de canales de K+, así como NiCl2, bloqueador de canales de Ca2+. Para el estudio de la IK,Ca, el CdCl2, bloqueador del canal de Ca2+, simplemente se añadió a la solución extracelular normal. En el estudio de la ICa, se utilizaron soluciones modificadas para bloquear a las corrientes de K+ (Tabla III). 23 Angélica Almanza G Análisis de datos Los datos de fijación de voltaje fueron analizados mediante el programa Clampfit (versión 8, Axon Instruments). Para determinar las constantes de tiempo de activación e inactivación en las corrientes, se ajustó una función exponencial a cada trazo de corriente usando un algoritmo de mínimos cuadrados en el pClamp. A los datos obtenidos para las constantes de tiempo en función del voltaje, les ajustamos funciones exponenciales. Consideramos como aceptables ajustes con un coeficiente de correlación (r2) ≥ 0.98. Para la activación e inactivación de estado estable, los datos fueron aproximados con funciones de Bolztmann utilizando el programa computacional Origin 4 (Microcal). Las funciones de Boltzmann presentadas en este trabajo son de la forma: f(x) = 1/[1 + exp((V1/2 - Vm)/S)] donde f(x) = I/Imax para la inactivación, y f(x) = g/gmax para la activación, V1/2 es el voltaje medio de activación o inactivación (mV), Vm es el potencial de membrana en mV, y S es la pendiente (constante de Boltzmann). La amplitud de la corriente en el estado estable se midió 50 ms antes del final del pulso. La amplitud de la corriente al pico se determinó calculando la corriente máxima para cada paso de voltaje con el Clampfit. Análisis estadístico. Los resultados se presentan como la media ± ES. La prueba estadística empleada fue la t de Student; se consideraron como diferencias estadísticamente significativas aquellas con P < 0.05, y altamente significativas aquellas en que P < 0.001. Resultados Para aislar las células del epitelio sensorial vestibular utilizamos enzimas que producen una digestión parcial del tejido. Las células de los canales semicirculares se obtuvieron utilizando papaína en concentración de 0.25 mg/ml, lo cual, nos permitió aislar células ciliadas en buenas condiciones (superficie brillante, lisa y sin organelos visibles). Debido a que el uso de esta enzima para aislar células ciliadas ha sido cuestionado por otros grupos de investigación, decidimos cambiar la enzima por colagenasa en concentración de 0.1 mg/ml. Con esta enzima, se aislaron las células ciliadas de la mácula del utrículo y el sáculo obteniendo tambien células en buenas condiciones. 24 Corrientes iónicas en células ciliadas Resistencia en serie Los valores de la Rs no fueron significativamente diferentes entre las células aisladas de los diferentes órganos vestibulares. El valor medio de Rs fue de 7.6 ± 0.6 MΩ y la Rs no compensada fue de 1.8 ± 0.4 MΩ. En las células de los tres órganos vestibulares realizamos un análisis de correlación entre la cinética de activación e inactivación de las corrientes iónicas y la Rs no compensada; en el sáculo, el coeficiente de correlación tuvo un valor de 0.09, en el utrículo de 0.2 y en los canales semicirculares de 0.3. Estos resultados indican que no existe una correlación entre la Rs no compensada y la cinética de la corriente iónica en las células aisladas de los diferentes órganos vestibulares. Propiedades eléctricas pasivas de las células ciliadas Las propiedades pasivas de las células aisladas con papaína no fueron estadísticamente diferentes de las células aisladas con colagenasa. En la tabla IV y en la figura 8 se presentan las propiedades pasivas para las células ciliadas de los órganos vestibulares estudiados. Tabla IV. Propiedades pasivas de las células ciliadas tipo II en el axolotl Rm Cm-E Cm-T Vm n CSC 392 ± 47 MΩ 17.2 ± 0.5 pF 12.8 ± 2.5 -51 ± 1.8 mV 57 Utrículo 325 ± 29 MΩ 11.9 ± 0.5 pF 10.8 ± 0.54 -55 ± 1.2 mV* 57 Sáculo 250 ± 41 MΩ Ψ 20 ± 2 pF** 18 ± 2 -60 ± 1.4 mV Ψ Ψ 7 Cm-E se refiere a la capacitancia de membrana medida electrónicamente. Cm-T se refiere a la capacitancia de membrana obtenida teóricamente con base a la superficie de membrana. Comparaciones estadísticas (t-student) fueron hechas entre las medias de los parámetros de las células aisladas del sáculo vs. utrículo (*), sáculo vs. canales (Ψ) y utrículo vs. canales (†). *, Ψ , † P<0.05. **, Ψ Ψ , †† P<0.001. 25 Angélica Almanza G 30 (n = 50) 25 Capacitancia pF Eléctrica 20 15 Morfológica 10 5 0 10 20 30 40 50 Células (orden progresivo) Figura 8. Gráfica de los valores de capacitancia medidos eléctricamente y los calculados con base en el análisis de la morfología celular para las células de los canales semicirculares. Los datos se presentan ordenados de menor a mayor. Puede observarse que el análisis morfológico subestima los valores de capacitancia, debido a que los cilios no son distinguibles claramente y por tanto no se toman en cuenta en este análisis, en tanto que la medición eléctrica necesariamente incluye el aporte capacitivo de la membrana que forma el aparato ciliar. En algunos casos ambas capacitancias coinciden. Suponemos esto es debido a que las células perdieron completamente su aparato ciliar durante la discociación. Corrientes iónicas totales Para determinar si hay diferencias en las corrientes iónicas expresadas en células ciliadas realizamos registros electrofisiológicos de corrientes totales en células aisladas de los canales semicirculares (CCSC, n = 7), utrículo (CU, n = 7) y sáculo (CS, n = 7). Denominamos corriente iónica total a la que se produjo con un protocolo de fijación de voltaje de doble pulso. Este protocolo partió de un potencial de sostenimiento de -85 mV y se aplicaron pulsos de prueba con duración de 800 ms entre -130 y 50 mV con incrementos de 10 mV (Vtest1), los cuales fueron seguidos por un pulso con duración de 200 ms y un valor de voltaje constante a 20 mV (Vtest2). En Vtest1 se midió la corriente al pico y la constante temporal de activación e inactivación de la corriente. En Vtest2 se estudió la inactivación de estado estable. 26 Corrientes iónicas en células ciliadas Canal Utrículo 1 nA 5 nA Sáculo 2 nA Figura 9. Corrientes totales generadas con un protocolo de doble pulso. Ejemplos típicos de registros obtenidos de células aisladas de los canales semicirculares, del utrículo y del sáculo. Se observa que, las cinéticas de activación e inactivación de las corrientes iónicas en las células de los canales semicirculares son más rápidas que en las células del utrículo y del sáculo. 200 ms En todas las células estudiadas encontramos que las corrientes dominantes fueron las de salida de potasio; sin embargo, se observaron diferencias cinéticas en las células aisladas de los diferentes órganos. Por ejemplo, en las CCSC, las corrientes iónicas tuvieron una activación media hasta 4.5 veces más rápida que en las CU y CS (Fig. 9). Sáculo. En las CS, la corriente total registrada con el protocolo de doble pulso mostró claramente dos componentes: uno entrante y uno saliente (Fig. 10). El componente entrante se produce en el rango de Vm de -130 a -90 mV y tiene una rectificación entre -80 y -50 mV. Su potencial de inversión fue de -86.2 ± 0.5 mV, valor cercano al potencial de equilibrio I/Imax 1.0 0.4 0.2 -140 -100 -60 Figura 10. Relación corriente-voltaje para valores al pico (●) y a los 800 ms (○) para la corriente total en el sáculo. Los puntos representan la media ± E.S (n = 7). -20 20 60 -0.2 Voltaje (mV) 27 Angélica Almanza G calculado para el K+, por lo cual pensamos que este componente corresponde a una corriente de K+ que fluye a través de canales del tipo rectificador anómalo. Para el componente entrante, la corriente media al pico fue de 0.18 ± 0.02 nA a -130 mV, y la corriente media a los 800 ms fue de 0.16 ± 0.02 nA en el mismo voltaje. En cuanto al componente de salida, éste se activa alrededor de -50 mV alcanzando un valor medio de la corriente al pico de 9.3 ± 1.2 nA a +50 mV y un valor medio de la corriente a los 800 ms de 5 ± 0.7 nA. A -bx -bx τinac-T (ms) τact-T (ms) B 30 f(x) = ae a = 9.8 ± 0.2 b = 0.016 f(x) = yo +ae + cx a = 17± 7.2 b = 0.07 ± 0.01 c = 0.89 ± 0.3 yo = 262.2 ± 10.1 600 20 400 10 0 -60 -40 -20 0 200 -60 -40 -20 20 40 60 Voltaje (mV) C 0 20 40 60 Voltaje (mV) 1.0 0.8 * V1/2 = -80 ± 1 mV S = 3.4 ± 1.4 Istst / Istst-max G/Gmax D 1.0 0.8 0.6 0.6 0.4 0.4 † V1/2 = -18 ± 4 mV S = 27 ± 4 0.2 V1/2 = -55.5 ± 1.4 mV S = 6.7 ± 1.2 0.2 0.0 0.0 -120 -80 -40 0 40 Voltaje (mV) -120 -80 -40 0 40 Voltaje (mV) Figura 11. Características de la corriente total en las células ciliadas del sáculo (n = 7). En A y B, gráfica de la constante temporal de activación e inactivación como función del potencial de membrana; en los insertos se muestra la función exponencial utilizada para ajustar a los datos, así como los valores de los parámetros. En C y D, curvas de activación e inactivación de estado estable para la corriente en función del voltaje. La curva para la activación se obtuvo ajustando dos funciones de Boltzmann a los datos. La primera entre -130 y -50 mV (para el componente de entrada) y la segunda entre -60 y +50 mV (para el componente de salida). En los insertos, se muestra el valor del voltaje medio de activación (V1/2) y la constante de Boltzmann (S) para el componente entrante (*) y para el componente saliente (†). Para la inactivación de estado estable, los datos se ajustaron con una función de Boltzmann entre -130 y +50 mV; en el inserto, valores para el V1/2 y S de la inactivación de estado estable. En todos los casos, los símbolos representan la media ± E.S. 28 Corrientes iónicas en células ciliadas La constante temporal de activación (τact-T) para la corriente de salida fue calculada ajustando una exponencial simple a la fase de subida de cada trazo de corriente. El curso temporal de la activación en las células aisladas del sáculo mostró una dependencia exponencial del voltaje (Fig. 11A), con valores para la τact-T entre 1.4 y 36.8 ms (entre -40 y +50 mV), con un valor medio de 9.8 ± 2.8 ms a 0 mV. La constante temporal para la inactivación (τinac-T) de la corriente saliente en el sáculo se calculó ajustando a la fase de caída de la corriente una exponencial simple. En estas células, la τinac-T también mostró una dependencia exponencial del voltaje (Fig. 11B), con valores para la τinac-T entre 184 y 600 ms (entre -40 y +50), con un valor medio de 279 ± 35 ms a 0 mV. La activación de la corriente en función del voltaje se ajustó mediante dos ecuaciones de Boltzmann considerando la presencia de dos componentes en la corriente total (Fig. 11C), uno entrante en el rango de -130 a -50 mV con un V1/2 = -80 ± 1 mV y S = 3.4 ± 1.4; y uno saliente entre -60 y +50 mV con un V1/2 = -18.4 ± 3.7 mV y S = 26.6 ± 4. La inactivación de estado estable para la corriente total se ajustó igualmente con una ecuación de Boltzmann (Fig. 11D) teniendo un V1/2 = -55.5 ± 1.4 mV y S = 6.7 ± 1.2. La corriente total en el sáculo tuvo una gmax = 68.1 ± 8.6 nS. Utrículo. Al igual que en el sáculo, el registro de la corriente total en las CU mostró tanto el componente entrante como el saliente (Fig. 12A). El componente entrante, al igual que en el sáculo, se activó en el rango de Vm de -130 a -90 mV mostrando una rectificación entre -80 y -50 mV con un potencial de inversión en -84.5 ± 0.4 mV. El valor medio de la corriente al pico fue de -0.09 ± 0.01 nA a -130 mV y el valor medio de la corriente a los 800 ms fue -0.07 ± 0.01 nA en el mismo voltaje. El componente de salida se activó alrededor de -50 mV alcanzando un valor medio de la corriente al pico de 3.4 ± 0.8 nA a +50 mV y un valor medio de la corriente a los 800 ms de 1.14 ± 0.17 nA en el mismo voltaje. El curso temporal de la activación para la corriente total se relacionó de forma compleja con el voltaje de membrana, ya que la τact-T disminuyó con la despolarización hasta potenciales por debajo de 20 mV y a potenciales mayores se incrementó (Fig. 12B). Los valores para la τact-T estuvieron en el rango de 0.8 a 14.5 ms (entre -40 y +50 mV) con un valor medio de 2.4 ± 0.6 ms a 0 mV. 29 Angélica Almanza G La τinac-T para la corriente total en el utrículo se calculó ajustando a la fase de caída de la corriente una doble exponencial. En todas las células, tanto la τinac-T1 como la τinac-T2 fueron independientes del voltaje (datos no mostrados), presentando una gran variabilidad. Los valores para la τinac-T1 estuvieron en el rango de 135 a 586 ms (medidos entre -40 y +50 mV) con un valor medio de 483 ± 70 ms a 0 mV; y los valores para la τinac-T2 estuvieron en el rango de 34.3 a 204.2 ms (medidos entre -40 y +50 mV) con un valor medio de 84.4 ± 7.8 ms a 0 mV. A B τact-T (ms) I/Imax 1.0 0.6 -bx f(x) = yo +ae + cx a = 11 ± 11 b = 0.02 ± 0.01 c = 0.22 ± 0.1 yo = -9.2 ± 11 8 6 4 2 Voltaje (mV) -140 -60 60 -60 -0.2 -20 0 20 40 Voltaje (mV) 1.0 *V1/2 = -78 ± 5 mV S=8±4 0.8 0.6 0.4 Istst / Istst-max D C G/Gmax -40 V1/2 = -55.5 ± 1.4 mV S = 13.5 ± 2 1.0 0.8 0.6 0.4 † V1/2 = -23 ± 2 mV S = 12.4 ± 1.5 0.2 0.0 -120 -80 -40 0 40 Voltaje (mV) 0.2 0.0 -120 -80 -40 0 40 Voltaje (mV) Figura 12. Características de la corriente total en las células ciliadas del utrículo (n = 7). En A, relación corriente-voltaje para valores de la corriente al pico (●) y a los 800 ms (○); nótese que por arriba de +50 mV se observa una rectificación de la corriente. En B, gráfica de la constante temporal de activación en función del voltaje; en el inserto, se muestra la función exponencial utilizada para ajustar los datos, así como los valores de los parámetros para tal función. En C y D, curvas de activación e inactivación de estado estable para la corriente en función del voltaje. La curva para la activación de la corriente se obtuvo ajustando dos funciones de Boltzmann a los datos. La primera entre -130 y -50 mV (para el componente entrante) y la segunda entre -60 y +50 mV (para el componente saliente). En los insertos, se muestra el valor del V1/2 y S para el componente entrante (*) y para el componente saliente (†). Para la inactivación de estado estable los datos se ajustaron con una función de Boltzmann entre -130 y +50 mV. En el inserto, valores para el V1/2 y S de la inactivación de estado estable. En todos los casos, los símbolos representan la media ± E.S. 30 Corrientes iónicas en células ciliadas La activación de la corriente en función del voltaje se ajustó mediante dos ecuaciones de Boltzmann considerando la presencia de dos componentes en la corriente total (Fig. 12C), uno entrante en el rango de -130 a -50 mV con un V1/2 = -78.1 ± 5 mV y S = 8 ± 4; y uno saliente entre -60 y +50 mV con un V1/2 = -22.7 ± 1.7 mV y S = 12.4 ± 1.5. La inactivación de estado estable para la corriente total se ajustó igualmente con una ecuación de Boltzmann (Fig. 12D) teniendo un V1/2 = -55.5 ± 1.4 mV y S = 13.5 ± 1.7. La corriente saliente total en el utrículo tuvo una gmax = 27.3 ± 5 nS; cabe hacer notar que tanto el componente de corriente entrante como el saliente tuvieron una magnitud menor que en el sáculo. Canales semicirculares. A diferencia de las células registradas del utrículo y del sáculo, la corriente total en las CCSC mostró un componente entrante despreciable, cuyo valor medio de la corriente al pico y a los 800 ms fue de -20 ± 7 pA. Con respecto al componente de salida, éste se activó alrededor de -55 mV alcanzando un valor medio de la corriente al pico de 8.8 ± 1.8 nA a +50 mV y un valor medio de la corriente a los 800 ms de 4.5 ± 1.5 nA en el mismo voltaje (Fig. 13A). El curso temporal de la activación de la corriente mostró una dependencia exponencial del voltaje haciéndose más rápida con potenciales despolarizantes (Fig. 13B). Los valores para la τact-T estuvieron en el rango de 0.4 a 10 ms (entre -40 y +50 mV) con un valor medio de 1.9 ± 0.9 ms a 0 mV. Al igual que en el utrículo, la τinac-T para la corriente total en los canales semicirculares se calculó ajustando a la fase de caída de la corriente una doble exponencial. Tanto la τinac-T1 como la τinac-T2 fueron independientes del voltaje (datos no mostrados) y presentaron gran variabilidad. Los valores para la τinac-T1 estuvieron en el rango de 71.6 a 992.5 ms (medidos entre -40 y +50 mV) con un valor medio de 279 ± 56.3 ms a 0 mV; y los valores para la τinac-T2 estuvieron en el rango de 9.3 a 43.2 ms (medidos entre -40 y +50 mV) con un valor medio de 22.3 ± 5.8 ms a 0 mV. Tanto la activación como la inactivación de estado estable se ajustaron con una ecuación de Boltzmann entre -130 y +50 mV (Fig. 13C y D). La activación tuvo un V1/2 = -23.8 ± 2.3 mV y S = 15 ± 2 y la inactivación un V1/2 = -60.4 ± 0.8 mV y S = 10.6 ± 0.7. 31 Angélica Almanza G B A 3 I/Imax τact-T (ms) 1.0 -bx f(x) = ae a = 2 ± 0.03 b = 0.016 2 0.6 1 0 -140 -60 60 -0.2 Voltaje (mV) -60 -40 -20 0 20 40 60 Voltaje (mV) D G/Gmax 1.0 0.8 V1/2 = -24 ± 2.3 mV S = 15 ± 2 0.6 1.0 Istst / Istst-max C V1/2 = -60 ± 0.8 mV S = 10.6 ± 0.7 0.8 0.6 0.4 0.4 0.2 0.2 0.0 0.0 -120 -80 -40 0 40 Voltaje (mV) -120 -80 -40 0 40 Voltaje (mV) Fig. 13. Características de la corriente total en las células ciliadas de los canales semicirculares (n = 7). En A, relación corriente-voltaje para valores de la corriente al pico (●) y a los 800 ms (○). En B, gráfica de la constante temporal de activación en función del voltaje; en el inserto se muestra la función exponencial utilizada para ajustar los datos así como los valores de los parámetros de ésta función. Se observa que la τact-T muestra una dependencia exponencial del voltaje. En C y D, curvas de activación e inactivación de estado estable para la corriente total en función del voltaje. En ambos casos, los datos se ajustaron con una función de Boltzmann entre -130 y +50 mV. En los insertos, se muestran los valores para el V1/2 y S de la activación e inactivación de estado estable, respectivamente. En todos los casos, los símbolos representan la media ± E.S. La corriente saliente total en los canales semicirculares fue cercana a la de las células del sáculo, con una gmax = 64.5 ± 13 nS. En la tabla V se resumen los datos de los registros de corriente en las células aisladas de cada órgano vestibular. 32 Corrientes iónicas en células ciliadas Tabla V. Resumen de los parámetros obtenidos del registro de la corriente total en células ciliadas aisladas de cada órgano (sáculo, utrículo y canales semicirculares). Parámetro n Sáculo Utrículo Canales Semicirculares 7 7 7 Propiedades Activas Componente entrante (paso de voltaje de -80 a -130 mV) Ip, nA -0.18 ± 0.02*** -0.09 ± 0.01 -0.02 ± 0.007 Ψ Ψ Ψ Ip/Cm, nA/pF -0.075 ± 0.01** -0.03 ± 0.004†† -0.014 ± 0.003 Ψ Ψ Ψ Iss, nA -0.16 ± 0.02** -0.07 ± 0.01 -0.02 ± 0.007 Ψ Ψ Iss/Cm, nA/pF -0.07 ± 0.01** -0.03 ± 0.004† -0.013 ± 0.003 Ψ Ψ V1/2, mV -80.1 ± 1 -78.1 ± 5 -------- S 3.4 ± 1.4 8±4 -------- Gmax, nS 40 ± 5 14 ± 3 -------- Gmin, nS 12 ± 1.5 7±1 -------- Componente saliente (paso de voltaje de -80 a 0 mV) Ip, nA 4.2 ± 0.7** 1.9 ± 0.3† 4.4 ± 1 Ip/Cm, nA/pF 0.19 ± 0.04 0.19 ± 0.03 0.325 ± 0.09 Iss, nA 2.1 ± 0.4** 0.9 ± 0.06 2.3 ± 0.7 Iss/Cm, nA/pF 0.096 ± 0.023 0.095 ± 0.017 0.166 ± 0.05 τa-T, ms 9.8 ± 2.8*** 2.4 ± 0.6† 1.9 ± 0.9 Ψ Ψ Ψ τi-T1, ms 279 ± 35* 483 ± 70† 279 ± 56.3 τi-T2, ms -------- 84.4 ± 7.8††† 22.3 ± 5.8 -18.4 ± 3.7 -22.7 ± 2.3 -23.8 ± 2.3 26.6 ± 4 12.4 ± 1.5 15 ± 2 -55.5 ± 1.4 -55.5 ± 1.4 -60.4 ± 0.8 6.7 ± 1.2 13.5 ± 1.7 10.6 ± 0.7 68.1 ± 8.6** 27.3 ± 5† 64.5 ± 13 V1/2a-T, mV Sa-T V1/2ss-T, mV Sss-T gmax, nS Comparaciones estadísticas (t-test) fueron hechas entre las medias del sáculo vs. utrículo (*), sáculo vs. canales (Ψ) y utrículo vs. canales (†). *, Ψ , † P<0.05; **, Ψ Ψ , †† P<0.01; ***, Ψ Ψ Ψ , ††† P<0.001 33 Angélica Almanza G Densidad de corriente La amplitud de la corriente total medida al pico (Ip) y al final (Iss) del pulso de voltaje fue significativamente diferente en las células provenientes de los diferentes órganos vestibulares; por esta razón decidimos calcular la densidad de corriente (amplitud de la corriente entre la Cm celular) y determinar si estas diferencias se mantenían. De la relación densidad de corriente-voltaje (Fig. 14) podemos observar que en el rango de -80 a 40 mV la densidad de corriente fue semejante en las células provenientes de los tres órganos vestibulares (tabla V); sin embargo, por debajo de -80 mV, la densidad de corriente en las células saculares fue 5 veces mayor que en las células de los canales semicirculares y 2.5 mayor que en las células del utrículo. Además, a potenciales por arriba de 40 mV, la densidad de corriente en las células del utrículo mostró una rectificación, disminuyendo con valores de voltaje despolarizantes. A B pA/pF pA/pF 800 400 400 200 * * -80 -40 40 Voltaje (mV) -80 * -40 40 Voltaje (mV) Figura 14. Densidad media de la corriente total al pico (A) y a los 800 ms (B) en las células de los canales semicirculares (■), sáculo (●) y utrículo (▽). La densidad de la corriente en el sáculo es significativamente mayor (*) a voltajes de membrana hiperpolarizantes, mientras que a voltajes por arriba de 40 mV, la densidad de la corriente es significativamente menor en el utrículo. 34 Corrientes iónicas en células ciliadas 20 µm 970321 -canal ánfora 970730 - canal club 980219 canal cilíndrica A90811-1, utrículo club A90811-1, utrículo cilíndrica 20 µm 92211-3, utrículo ánfora Figura 15. Microfotografías de células ciliadas aisladas de los canales y del utrículo representativas de las formas que hemos denominado como anforas, club y cilíndricas. 35 Angélica Almanza G Morfología celular Las células ciliadas aisladas de los diferentes órganos vestibulares fueron clasificadas con base en su forma. En los canales semicirculares y el utrículo, distinguimos tres tipos celulares morfológicamente diferentes: células cilíndricas, en forma de bastón (club) y ánforas. Mientras que en el sáculo encontramos un solo grupo celular en forma de pera. En las Figuras 15 y 16 se muestran algúnos ejemplos representativos. 20 µm A01312-3 sáculo pera A01312-1 sáculo pera Figura 16. Microfotografías de células ciliadas aisladas del sáculo representativas de la forma que hemos denominado como peras. Para establecer alguna correlación entre la morfología celular y las propiedades electrofisiológicas, consideramos la media de los siguientes parámetros obtenidos de la corriente total: coeficiente de inactivación (Ip/Iss)1, constante temporal de activación y constante temporal de inactivación. Debido a que en el sáculo encontramos un solo grupo celular, este análisis se llevó a cabo solamente en el utrículo (Fig. 17) y en los canales semicirculares (Fig. 18). Los resultados indican que en ninguno de los órganos vestibulares 1 Definimos como coeficiente de inactivación a la relación entre la corriente al pico con la corriente al final del pulso de voltaje. Es un valor numérico que nos indica que tanto se inactiva la corriente. 36 Corrientes iónicas en células ciliadas existe una correlación significativa entre la forma celular y los parámetros electrofisiológicos más significativos que definen a las corrientes iónicas en estas células. A 0.8 τact-T (ms) Iss / Ip B 0.6 6 4 0.4 2 0.2 0.0 0 Cilíndricas Club Ánforas τinac-T (ms) C 300 250 200 150 100 50 0 Cilíndricas Club Ánforas Cilíndricas Club Ánforas Figura 17. Relación entre la morfología celular y las propiedades electrofisiológicas en las células del utrículo. Se identificaron tres grupos celulares morfológicamente diferentes: células cilíndricas, club y ánforas; en cada gráfica se muestra la relación entre los diferentes parámetros electrofisiológicos considerados y los grupos celulares. En A, relación coeficiente de inactivación-morfología. En B, relación constante temporal de activaciónmorfología. En C, relación constante temporal de inactivación-morfología. Identificación de las corrientes iónicas en las células ciliadas Para disecar las diferentes corrientes iónicas que componen a la corriente total de las células ciliadas del axolotl, realizamos procedimientos electrofisiológicos y farmacológicos en 50 células aisladas de los canales semicirculares y en 56 células aisladas del utrículo. En la literatura existe una amplia información sobre las diferentes corrientes iónicas expresadas en las células del sáculo, por esta razón, decidimos considerar para este análisis solamente a las células del utrículo y de los canales semicirculares. Las corrientes salientes de K+ que identificamos en estas células son: una corriente no inactivante, una corriente transitoria de salida y una corriente sensible al Ca2+. En adición, identificamos dos corrientes entrantes: una de K+ y una de Ca2+ con al menos dos componentes (uno con inactivación y otro sostenido). 37 Angélica Almanza G B τact-T (ms) Iss / Ip A 0.6 0.4 1.0 0.8 0.6 0.4 0.2 0.2 0.0 0.0 Cilíndricas Club Ánforas C Cilíndricas Club Ánforas Cilíndricas Club Ánforas D τinac2-T (ms) τinac1-T (ms) 40 200 150 100 30 20 10 50 0 0 Cilíndricas Club Ánforas Figura 18. Relación entre la morfología celular y las propiedades electrofisiológicas en las células de los canales semicirculares. Se identificaron tres grupos celulares morfológicamente diferentes: células cilíndricas, club y ánforas; en cada gráfica se muestra la relación entre los diferentes parámetros electrofisiológicos considerados y los grupos celulares. En A, relación coeficiente de inactivaciónmorfología. En B, relación constante temporal de activación-morfología. En C y D, relación constante temporal de inactivación-morfología; para la inactivación, ajustamos una exponencial doble a la fase de caida de la corriente (τinac1 y τinac2). Corriente transitoria de salida. Inicialmente, para aislar las corrientes iónicas utilizamos el procedimiento electrofisiológico descrito por Connor y Stevens (Connor y Stevens, 1971a,b; Hille, 1984), el cual permite separar las corrientes inactivantes de las no inactivantes. En este método, las corrientes obtenidas con un protocolo de fijación de voltaje con potencial de sostenimiento de -30 mV, pulsos crecientes de 10 mV desde -100 hasta +40 mV y duración de 400 ms, se restaron a las corrientes obtenidas con un protocolo de fijación de voltaje igual pero con un potencial de sostenimiento de -85 mV. Adicionalmente, se añadió Cd2+ 0.1 mM en el baño como un bloqueador de la corriente de Ca2+ y, consecuentemente, de las corrientes activadas por Ca2+. 38 Corrientes iónicas en células ciliadas En presencia de Cd2+, la corriente resultante de la sustracción fue una corriente de K+ transitoria de salida (IK,transitoria) (Fig. 19A y B). Tanto en las CU (n = 10) como en las CCSC (n = 50), IK,transitoria se activó a potenciales cercanos a -60 mV, alcanzando un valor medio de la corriente al pico de 7.6 ± nA a 50 mV. La activación de la corriente se ajustó con una función de Boltzmann (entre -100 y +50 mV), con un V1/2 = -30 ± 3.5 mV y S = 19 ± 3.5 para los canales semicirculares (Fig. 19C), y V1/2 = -6.9 ± 1.5 mV y S = 19.5 ± 1.5 para el utrículo (Fig. 14D). Para estudiar la inactivación de estado-estable de la IK,transitoria, utilizamos un protocolo de doble pulso el cual partió de un potencial de sostenimiento de -85 mV y se aplicaron pulsos de prueba con duración de 600 ms entre -100 y +50 mV con incrementos de 10 mV (Vtest1), los cuales fueron seguidos por un pulso con duración de 200 ms y un valor de voltaje constante a +20 mV (Vtest2). La corriente al pico medida durante Vtest2 nos permitió definir la inactivación de estado estable, esta corriente fue normalizada como función de la máxima corriente y el componente no inactivante fue sustraído como sigue: i I transitori a , stst = i I (Vtest 2 ) − minI (Vtest 2 ) maxI (Vtest 2 ) − minI (Vtest 2 ) Los datos obtenidos para la inactivación de estado-estable (stst) fueron ajustados con una función de Boltzmann (entre -100 y +50 mV) con un V1/2 = -71 ± 2.3 mV y S = 23 ± 1.3 para los canales semicirculares (Fig. 19C) y V1/2 = -66.8 ± 1.5 mV y S = 12.1 ± 1.2 para el utrículo (Fig. 19D). Para determinar las propiedades cinéticas de la IK,transitoria, ajustamos funciones exponenciales a la fase de subida y de caida de cada trazo de la corriente. La constante temporal para la activación (τn) de la IK,transitoria en ambos órganos fue dependiente del voltaje, haciéndose más rápida con los pulsos de voltaje despolarizantes. La activación de la IK,transitoria en las células aisladas de los canales semicirculares (Fig. 19E) fue alrededor de 9 veces más rápida que en el utrículo (Fig. 19F); por ejemplo, en los canales semicirculares a 0 mV, τn = 1.7 ± 0.11 ms y en el utrículo a 0 mV τn = 14.2 ± 2.2 ms. Con base en la constante temporal de inactivación (τh), al igual que se ha descrito para la rana (Norris y cols., 1992), en las células ciliadas aisladas de los canales semicirculares distinguimos claramente dos grupos de células. Un 80% de las células tuvo una inactivación rápida con una τh promedio = 33.5 ± 2.8 ms, mientras que el 20% restante 39 Angélica Almanza G Figura 19. Corriente de K+ transitoria de salida (IK,transitoria) en las células de los canales semicirculares (A,C,E,G) y del utrículo (B,D,F). En A y B, registros típicos de IK,transitoria. En C y D, gráficas de la conductancia en función del voltaje para la activación (●) e inactivación (○) de la IK,transitoria (para CCSC, n = 50 y para CU, n = 5). En E y F, gráficas para la constante temporal de activación τn,transitoria contra el voltaje en los canales semicirculares (n = 39, E) y utrículo (n = 5, F). En G, constante temporal de inactivación τh-rápida (n = 24) y τh-lenta (n = 18) en función del voltaje para los canales semicirculares. En E, F y G, los datos se ajustaron con una función exponencial de la forma f(x) = ae-bx. En todos los casos, los símbolos representan la media ± E.S. 40 Corrientes iónicas en células ciliadas mostró una cinética de inactivación lenta con una τh promedio = 130.9 ± 8.1 ms. En ambos grupos, la τh tuvo una dependencia exponencial del voltaje (Fig. 19G). La ecuación que puede modelar de manera general a la IK,transitoria es: I K ,transitoria = g K ,transitoria ⋅ n Kr ,transitoria (V ) ⋅ hK ,transitoria (V ) ⋅ (V − E K ) donde g K ,transitoria es la máxima conductancia, n es el parámetro de inactivación elevado a una potencia r, h es el parámetro de inactivación, V es el pulso de voltaje y Ek es el potencial de equilibrio del K+. En el utrículo del ajolote g K ,transitoria = 60 ± 1 nS y en los canales semicirculares g K ,transitoria = 58 ± 10 nS. A Cd 2+ 1 mM 50 ms 1 nA IK,sostenida IK,transitoria C 4 Corriente (nA) Corriente (nA) B 3 -80 I350 ms 1 -40 Control con Cd2+ IK,transitoria IK,sostenida 3 2 2 Ipico 4 40 Voltaje (mV) -80 1 -40 40 Voltaje (mV) Figura 20. Corriente de K+ sostenida (IK,sostenida). En A, registro típico de una célula aislada de los canales semicirculares; después de la perfusión con Cd2+, la corriente transitoria y la sostenida se identificaron mediante la sustracción con diferentes potenciales de sostenimiento. En B, se muestra la relación I/V para los valores al pico de la corriente control (con Cd2+), la corriente transitoria y la corriente sostenida para la célula en A. En C, se muestra la relación I/V para los valores a los 350 ms de las mismas corrientes que en B. 41 Angélica Almanza G Para aislar farmacológicamente a la IK,transitoria se perfundió 4-AP 10 mM. Las corrientes se obtuvieron con un protocolo de fijación de voltaje con un potencial de sostenimiento de -85 mV, pulsos crecientes de 10 mV desde -100 hasta 40 mV y duración de 800 ms. Después de perfundir 4-AP (en CU, n = 4 y en CCSC, n = 50), con la sustracción de la corriente restante a la corriente control se aisló la corriente sensible a 4-AP, la cual mostró características similares a la aislada de manera electrofisiológica. La IK,transitoria representó un 15% de la corriente total en los canales semicirculares, y un 30.4% en el utrículo. Corriente rectificadora retardada. Con el mismo método ya descrito, y con un potencial de sostenimiento de -30 mV, se separó una corriente de activación lenta que no presentó inactivación durante los pulsos de 400 ms (Fig. 20A). Esta corriente sostenida mostró ser altamente sensible a TEA, fue bloqueada totalmente a una concentración de 1 mM de TEA. En ambos órganos, esta corriente sostenida del tipo rectificador retardado, se activó alrededor de -60 mV (Fig. 20B y C) y, en los canales semicirculares (n = 50), el curso temporal de la activación τn estuvo en el rango de 1.03 a 0.81 ms (para pulsos de voltaje entre -40 y +50 mV); mientras que en el utrículo (n = 10), el curso temporal de esta corriente fue más lento, siendo el rango para la τn = 5-10 ms (para pulsos de voltaje entre -10 y +50 mV). De acuerdo con lo anterior, en nuestras células, IK,sostenida puede ser descrita por la siguiente ecuación: I K , sostenida = g K , sostenida ⋅ n Kr , sostenida ⋅ (V − E K ) La corriente IK,sostenida fue predominante en los canales semicirculares, constituyendo un 45% de la corriente total, mientras que en el utrículo, IK,sostenida fue casi despreciable, representando sólo un 4.5% de la corriente total. Corriente de K+ activada por Ca2+ (IK,Ca). Para definir la presencia de la IK,Ca y estudiar algunas de sus características se usó el Cd2+ para bloquear a la corriente de Ca2+(hay que considerar que en nuestros experimentos bloqueamos la corriente de Ca2+, por lo que la corriente que llamamos IK,Ca es realmente una suma de IK,Ca y ICa). La aplicación de Cd2+ 0.1 mM en el baño, modificó de manera consistente el curso temporal de las corrientes de salida de K+ registradas en las 12 células del utrículo y en las 12 células de los canales semicirculares. El protocolo de pulsos empleado para el estudio de esta corriente partió de un potencial de sostenimiento de -80 mV y se aplicaron pulsos de -100 a +100 mV con incrementos de 10 mV y una duración de 400 ms. Cuando la corriente residual (luego de la 42 Corrientes iónicas en células ciliadas aplicación de Cd2+ 0.1 mM) se sustrajo de la corriente control, encontramos una corriente de salida que se activa rápidamente y con una inactivación parcial (Fig. 21A y 22A). La curva corriente -voltaje calculada en la corriente aislada tiene forma de N, tal como fue descrito originalmente por Meech y Standen (1975) para la IK,Ca en las neuronas de molusco. Tanto en las células aisladas del utrículo como en las de los canales semicirculares, la corriente se activa a potenciales cercanos a –40 mV y tanto el componente transitorio como el sostenido muestran una pendiente negativa a potenciales mayores a +50 mV (Fig. 21B y 22B). Esta forma de la curva corriente-voltaje se debe al decremento en el influjo de Ca2+ cuando el voltaje se aproxima al potencial de equilibrio del Ca2+ (Meech y Standen, 1975). A 1 nA Control Con Cd 50 ms 2+ IK,Ca B C -bx τn (ms) I/Imax 1 f(x) = ae a = 0.7 ± 0.02 b = 0.02 1.0 0.5 0.0 -100 -50 50 Voltaje (mV) -20 0 20 40 Voltaje (mV) Figura 21. La corriente de K+ activada por Ca2+ (IK,Ca) en las células de los canales semicirculares. En A, ejemplo del procedimiento de substracción para obtener la corriente sensible a Cd2+ (IK,Ca + ICa). En B, se muestra la curva normalizada de la corriente contra el voltaje (n = 12) para valores al pico (●) y a los 350 ms (○) En C, gráfica de la constante temporal de activación (τn) en función del voltaje (n = 10); en el inserto se muestra la función exponencial empleada para ajustar los datos. En todos los casos, los símbolos representan la media ± E.S. 43 Angélica Almanza G 50 ms 0.5 nA A C I/Imax τh (ms) B 20 -bx f(x) = ae a = 0.7 ± 0.02 b = 0.013 15 10 5 -100 -50 50 100 Voltaje (mV) 0 -60 -20 20 60 Voltaje (mV) Figura 22. La corriente de K+ activada por Ca2+ (IK,Ca) en las células del utrículo. En A, registro característico de la corriente sensible a Cd2+. En B, relación corriente-voltaje para valores al pico (●) y a los 350 ms (○) de la IK,Ca (n = 12). En C, constante temporal de activación τn en función del voltaje (n = 8); en el inserto, función exponencial empleada para ajustar los datos. En todos los casos, los símbolos representan la media ± E.S. Para calcular la constante temporal de activación τn de la IKCa, en ambos órganos, se ajustó una función exponencial a la fase de activación de la corriente. En las células ciliadas de ambos órganos, la τn mostró una dependencia exponencial del voltaje, disminuyendo con la despolarización (Fig. 21C y 22C). La IK,Ca presentó una activación más rápida en las células aisladas de los canales semicirculares. Por ejemplo, en el utrículo, a 0 mV, la τn fue de 2.62 ± 0.7 ms, mientras que en los canales semicirculares la τn fue de 0.67 ± 0.06 ms. En el utrículo, la constante temporal de inactivación se calculó ajustando a la fase de caída una doble exponencial y, en los canales semicirculares, una exponencial simple. En todas las células, la τh para la inactivación fue independiente del voltaje, mostrando una gran variabilidad. A 0 mV, en el utrículo, la τh1 varió entre 5 y 45 ms y τh2 entre 70 y 130 ms; mientras que en los canales semicirculares, la τh varió entre 23 y 80 ms. 44 Corrientes iónicas en células ciliadas Debe mencionarse que esta corriente tiene dos flujos de corriente (Masetto y cols., 1994): una corriente entrante de Ca2+ y una corriente saliente de K+ por lo que, pensando en términos de las ecuaciones de Hodgkin y Huxley (1952) podríamos describirla de forma general como: I K ,Ca = g K ,Ca ⋅ n Kr ,Ca (V , [Ca ]) ⋅ hk ,Ca ([Ca ]) ⋅ (Vm − E K ) donde, la activación de la corriente (parámetro n) depende de la concentración de Ca2+ en el citoplasma y del voltaje de membrana; mientras que, de acuerdo con nuestros resultados, la inactivación (parámetro h) es independiente del voltaje, pero aparentemente es dependiente de la concentración de Ca2+ intracelular. El porcentaje de IK,Ca con respecto a la corriente total fue muy prominente en ambos órganos; en los canales semicirculares esta corriente aportó un 40% de la corriente total, y en el utrículo constituyó un 65%. B 200 pA Corriente (pA) A 100 ms 0 -200 -400 -600 -140 -120 -100 -80 -60 Voltaje (mV) Figura 23. Corriente rectificante de entrada (IK,IR). En A, registro de IK,IR en una célula aislada de los canales semicirculares. La corriente se generó con un VH = -70 mV y pasos de voltaje de -130 a -70 mV. En B, relación corriente-voltaje para IK,IR en células del utrículo (○, n = 16) y de los canales semicirculares (●, n = 50). En la gráfica se observa que el potencial de inversión para esta corriente en ambos órganos es alrededor de -75 mV, cercano al valor teórico para el potencial de equilibrio del K+ (EK = -78 mV). Corriente rectificante de entrada. Utilizando un potencial de sostenimiento de -70 mV y pasos de voltaje hiperpolarizantes (entre -130 y -50) con una duración de 380 ms, apareció una corriente rectificante de entrada (IIR) en el 60% de las células de los canales semicirculares (n=50) y en el 100% de las células del utrículo (n=16) (Fig. 23A). La IIR se activó a potenciales negativos con respecto al potencial de membrana (Fig. 23B), su potencial de inversión fue alrededor de -74 mV y se bloqueó completamente con 500 µM de BaCl2. En las células de ambos órganos, la IIR mostró una activación rápida; en los canales semicirculares la media para la constante temporal de activación fue τm = 0.19 ± 0.02 ms, y en 45 Angélica Almanza G Tabla VI. Parámetros obtenidos de las diferentes corrientes iónicas aisladas de las células del utrículo y de los canales semicirculares. Parámetro Canales Semicirculares Utrículo -60 -60 τn, ms (a 0 mV) 1.7 ± 0.11†† 14.2 ± 2.2 τ h, ms (a 0 mV) 33.5 ± 2.8 (80% de las células)†† 302 ± 78 IK,transitoria Vact, mV 131 ± 8.1 (20% de las células)† V1/2n, mV -30 ± 3.5 -6.9 ± 1.5 Sn 19 ± 3.5 19.5 ± 1.5 V1/2h, mV -71 ± 2.3 -66.8 ± 1.5 Sh 23 ± 1.3 12.1± 1.2 60 ± 1 58± 10 15†† 30.4 -60 -60 1.03-0.81†† 5-10 -------- -------- 45†† 4.5 -40 -40 0.67 ± 0.06†† 2.62 ± 0.7 5-45†† 70-100 40†† 65 -74 ± 2 -74 ± 2 τ m, ms (a -130 mV) 0.19 ± 0.02†† 0.72 ± 0.05 τ h, ms (a -130 mV) 59.3 56.7 ± 5.5 gmax, nS (IK,transitoria/Itotal) x 100 IK,sostenida Vact, mV τ n, ms (entre -40 y +50 mV) τ h, ms (IK,sostenida/Itotal) x 100 IK,Ca Vact, mV τ n, ms (a 0 mV) τ h, ms (entre -40 y +50 mV) (IK,Ca/Itotal) x 100 IK,IR EK, mV Comparaciones estadísticas (t-test) fueron hechas entre las medias de los parámetros de las células aisladas de los canales semicirculares vs. utrículo. † P<0.05. †† P<0.001. 46 Corrientes iónicas en células ciliadas el utrículo, τm = 0.72 ± 0.05 ms. En el 80% de las células de los canales semicirculares con corriente de entrada, IIR no se inactivó. En el 20% restante, IIR se inactivó con una τh = 59.3 ± ms. En todas las células del utrículo, IIR presentó inactivación con una τh = 56.7 ± 5.5 ms. De manera general, podemos describir a esta corriente con la siguiente ecuación: r I IR = g IR ⋅ m IR ⋅ hIR ⋅ (Vm − Eión ) donde, los parámetros tienen el significado ya mencionado antes y Eión es el potencial de inversión para la corriente, el cual fue muy cercano a EK; sin embargo, necesitamos hacer una caracterización más completa para poder establecer su selectividad iónica. En la tabla VI se resumen los valores de los parámetros medidos en las diferentes corrientes iónicas aisladas en las células del utrículo y de los canales semicirculares. Corriente de calcio. El registro de esta corriente (ICa) se realizó en 16 células ciliadas aisladas de los canales semicirculares del axolotl; para su estudio, utilizamos soluciones modificadas para bloquear las corrientes de K+ en las cuales sustituimos al K+ por Cs+ y colocamos TEA en la solución extracelular (Tabla III). En las corrientes de Ca2+ registradas con un potencial de sostenimiento de -70 mV, el potencial de inversión fue cercano a +20 mV, un valor bajo comparado con el potencial de equilibrio estimado (muy positivo), lo cual probablemente se debe a un bloqueo incompleto de las corrientes de salida, tal como ha sido descrito por otros autores (Ohmori, 1984; Prigioni, 1992). La contribución de las corrientes de salida a las corrientes entrantes totales se estudió bloqueando la corriente entrante de Ca2+ con Cd2+ 0.1 mM en la solución extracelular, con lo cual el bloqueo de ICa fue completo quedando solamente las probables corrientes de salida, incrementando de una manera casi lineal a potenciales positivos. La figura 24A muestra la relación IV para la corriente de Ca2+, obtenida como la diferencia entre las corrientes registradas antes y después de la aplicación de Cd2+. En todos los experimentos dirigidos a estudiar la ICa, el Ca2+ se sustituyó por Ba2+ en la solución extracelular. En la figura 24B se muestra un trazo representativo de la relación corriente voltaje para la corriente de Ca2+ y la corriente de Ba2+; se puede apreciar que la amplitud de la corriente entrante incrementa aproximadamente al doble cuando el Ca2+ se sustituye por 4.5 mM de Ba2+. La existencia de “run-down” en las corrientes de calcio se ha reportado tanto en células ciliadas del oído interno (Ohmori, 1984; Martini y cols., 2000; Hudspeth y Lewis, 1988a) 47 Angélica Almanza G B A -0.2 0.02 Voltaje (mV) -40 -20 20 Voltaje (mV) -80 -40 -0.10 I (nA) 0.2 I (nA) -0.06 Corriente (pA) C 180 160 140 120 100 80 60 0 2 4 6 8 10 12 Tiempo (min) Figura 24. En A, relación corriente-voltaje para una célula de los canales semicirculares. Se muestra la ICa registrada en condiciones control (▼), la corriente residual (saliente) luego de la perfusión de Cd2+ 0.1 mM (■) y la ICa (●) obtenida como la diferencia entre la corriente entrante y la corriente de salida. En B, relación corriente-voltaje en una célula para la ICa (●) y la IBa (○). En C, variación de la amplitud de la ICa en función del tiempo. como en otros tipos de células, (por ejemplo, en neuronas vestibulares del ratón) (Chambard y cols., 1999). Para estudiar la presencia de este fenómeno en las células ciliadas del ajolote utilizamos un pulso a un valor fijo de -20 mV con un potencial de sostenimiento de -80 mV con una duración de 80 ms (n = 6). En todas las células observamos que hay una fase inicial en que la corriente de Ca2+ crece. A este fenómeno se le ha llamado “run-up” y se presenta también en otras preparaciones (para una revisión ver Meir y cols., 1999). Una vez que el “run-up” ocurre, la amplitud de la ICa permanece estable durante unos minutos (aproximadamente entre tres y cinco minutos). Posteriormente, ocurre un decremento en la amplitud de la corriente de Ca2+, fenómeno que se ha denominado en la literatura como "rundown" (Fig. 24C). Los estudios realizados sobre la ICa se llevaron a cabo una vez que el “runup” sucedió y antes de que el “run-down” ocurriera. Utilizando un protocolo de pulsos de voltaje de 10 mV que va de -70 a +50 mV, con un potencial de sostenimiento de -70 mV y una duración de 200 ms, se registró una corriente entrante de pequeña amplitud (en un rango de 50 a 80 pA), con inactivación parcial y que es 48 Corrientes iónicas en células ciliadas bloqueada por Cd2+ y Ni2+ 0.1 mM (datos no mostrados), lo que indica que se trata de una corriente de Ca2+. Debido a que observamos que la ICa presentaba una inactivación parcial con el potencial de sostenimiento de -70 mV, decidimos probar diferentes potenciales de sostenimiento para ver si la inactivación era dependiente del voltaje. La ICa se registró en una misma célula (n = 6) con dos diferentes potenciales de sostenimiento: uno de -100 mV, con el que se obtuvo la ICa total y otro de -60 mV, con el que se obtuvo un componente de la ICa que no se inactivó. Restando B A 50 pA 50 ms -100 mV 50 ms D C 0.15 16 τh (ms) -bx f(x) = yo +ae + cx a = 9.2 ± 1.9 b = 0.03 ± 0.02 c = 0.5 ± 0.4 yo = -4.3 ± 1.9 12 Voltaje (mV) -80 50 pA -60 mV -40 80 -0.06 Corriente (nA) 8 4 0 -60 -40 -20 0 20 Voltaje (mV) Figura 25. Corriente de Ca2+ (ICa) en las células ciliadas de los canales semicirculares. En A, corriente entrante generada con pulsos de voltaje partiendo de un potencial de sostenimiento (VH) de -60 mV; este componente es sostenido. En B, la corriente generada con un VH = -60 mV fue substraída de la corriente generada con un VH = -100 mV; la corriente residual nos muestra al componente que se inactiva. En C, relación corriente-voltaje para el componente sostenido (●) y para el componente que se inactiva (○, valores al pico). En D, la constante temporal de inactivación τh en función del voltaje para el componente inactivante. En el inserto, se muestra la función exponencial utilizada para ajustar los datos. 49 Angélica Almanza G las corrientes generadas con el potencial de sostenimiento de -60 mV de las generadas con el de -100 mV, obtuvimos el componente de la ICa que presentó inactivación (Fig. 25A y B). El componente sostenido se activó a potenciales más positivos de -60 mV, alcanzando su máxima amplitud alrededor de -30 mV y su magnitud, a este potencial, varió entre 60 y 180 pA (Fig. 25C). Su activación fue rápida, siendo el valor para la τ de activación de 3.1 ± 0.6 ms (medida entre -30 y -10 mV). En cuanto al componente que se inactiva, a -60 mV éste se encuentra ya parcialmente activado, alcanzando su máxima amplitud alrededor de -40, mV y su magnitud a este potencial varió de 30 a 50 pA (Fig. 25C). La τ para la inactivación mostró una relación compleja con el voltaje pues, inicialmente, con los pulsos despolarizantes la inactivación fue más rápida, y a voltajes más positivos de -10 la τ se incrementó (Fig. 25D). Con base en los datos anteriores pensamos que la corriente de calcio puede describirse de forma general por la siguiente ecuación: I Ca = g Ca ⋅ m(V ) ⋅ (V − ECa ) + g Ca , x ⋅ m(V ) ⋅ h(Vhold ) ⋅ (V − ECa ) donde g Ca , x se refiere a la conductancia inactivante de Ca2+ cuyas características aún no hemos identificado suficientemente como para definirla, y g Ca a la corriente de Ca2+ que no presenta inactivación. El Ca2+ participa en la regulación de una gran variedad de funciones celulares; específicamente, en las células ciliadas, el Ca2+ está involucrado en varios eventos como son la mecanotransducción, la adaptación de la corriente de transducción, la resonancia eléctrica y la liberación del transmisor (entre otras). Se ha demostrado la existencia de una gran variedad de canales de Ca2+ activados por voltaje, los cuales difieren entre sí en cuanto a su biofísica, bioquímica y a su farmacología; considerando las múltiples funciones celulares dependientes de este ión, es posible que cada tipo de canal de Ca2+ se encuentre asociado a una función específica. Dada la gran importancia del Ca2+ en la regulación de diversas funciones celulares, existe un gran interés en determinar qué tipos de canales de Ca2+ se localizan en las células ciliadas; sin embargo, el estudio de los diferentes subtipos de corrientes de Ca2+ implica una problemática experimental debida en gran parte a la ausencia de herramientas farmacológicas 50 Corrientes iónicas en células ciliadas suficientes que puedan bloquear selectivamente a uno u otro canal. En nuestro caso, hemos iniciado el estudio de la corriente de Ca2+ en los canales semicirculares del aparato vestibular del axolotl; sin embargo, debido a las limitaciones temporales de este estudio y a las dificultades experimentales ya mencionadas, decidimos posponer el estudio detallado de esta corriente en los diferentes órganos vestibulares. A 0 mV0 -70 mVmV- 100 mV 5 5 ms Voltaje (mV) D 0 -40 B 0 mV0 -80 -120 --70 mV70 100 mV 55 msms -160 Utrículo Sáculo Canales -200 C 0 mV0 -70 mV -240 -0.8 10020 mV -0.4 0.0 0.4 0.8 Corriente (nA) 5 msms Figura 26. Fijación de corriente. En A, B y C, respuesta de voltaje de las células aisladas de los canales semicirculares, sáculo y utrículo (respectivamente) ante pulsos de corriente hiper- y despolarizante. Las células se fijaron alrededor de -70 mV y se registró la respuesta ante la inyección de corriente desde -0.5 hasta 0.5 nA en incrementos de 0.1 nA. En D, relación voltaje-corriente para células del sáculo (n = 4), utrículo (n = 4) y canales semicirculares (n = 10). Se observa que, las células de los canales semicirculares tienen una mayor ganancia ante pulsos de corriente hiperpolarizante, mientras que las células saculares muestran una menor ganancia. Ante pulsos de corriente despolarizante, las células de los tres órganos muestran ganacias similares. 51 Angélica Almanza G Fijación de corriente Para evaluar el cambio en el voltaje de membrana ante pulsos de corriente, el potencial de membrana fue fijado a -70 mV mediante inyección de corriente, y dimos una serie de pulsos de corriente entre -0.5 y 0.5 nA en incrementos de 0.1 nA con una duración de 800 ms. La presencia de una corriente de Ca2+ y una corriente de K+ activada por Ca2+, nos sugirió la posible presencia de resonancia eléctrica en nuestras células, tal y como se ha descrito en otras preparaciones (Crawford y Fettiplace, 1981; Hudspeth y Lewis, 1988a,b). Ante pulsos de corriente hiperpolarizante, en las células de los canales semicirculares la membrana se hiperpolarizó lentamente y continuó haciéndolo, como si fuera una respuesta pasiva, durante el tiempo que duró el pulso de corriente (Fig. 26A). Este mismo comportamiento se ha observado en las células ciliadas ubicadas periféricamente en la cresta de los canales de la rana, en donde IK1 está ausente (Marcotti y cols., 1999). En cambio, en el sáculo y en el utrículo, ante el mismo estímulo, la respuesta fue completamente diferente, ya que la membrana se hiperpolarizó rápidamente pero con una amplitud pequeña (Fig. 26B y C). Este tipo de respuesta es característica de las células ciliadas que expresan IK1 (Sugihara y Furukawa, 1989; Masetto y cols., 1994). Ante pulsos de corriente despolarizante, las células provenientes de los tres órganos mostraron una resonancia altamente amortiguada que consistió en un único transitorio (Fig. 26A, B y C). No encontramos evidencia de más de una oscilación en el voltaje de membrana. Esto nos sugiere que Q es menor de 1 y, como se ha sugerido, posiblemente esta oscilación con bajo factor de calidad no sea una resonancia eléctrica como tal que nos indique que la célula está sintonizada a cierta frecuencia, sino más bien que la membrana celular se está comportando como un filtro pasabajas (ver Weng y Correia, 1999). En el rango de 0 a -0.4 nA, la resistencia de entrada (Ri) en el estado estable (obtenida de la regresión lineal ajustada a la media de los datos) para las células del sáculo (n = 4) fue de 54 MΩ, para las del utrículo (n = 4) de 69.5 MΩ, y para los canales semicirculares (n = 10) de 311.5 MΩ; mientras que en el rango de 0 a 0.6 nA la Ri fue de 65 MΩ en sáculo, 102 MΩ en utrículo y 36 MΩ en los canales semicirculares (Fig. 26D). Aun cuando en los tres órganos se observa un transitorio, podemos notar que los valores de Ri con pulsos despolarizantes son diferentes, siendo las células de los canales semicirculares 52 Corrientes iónicas en células ciliadas las que presentan una muy baja Ri en el estado estable, determinada seguramente por la magnitud de la corriente iónica sostenida que se activa lentamente. Discusión Uno de los hallazgos principales de nuestro trabajo es que las corrientes iónicas de salida en las células ciliadas de los canales semicirculares tienen cinéticas de activación e inactivación rápidas, mientras que las corrientes con cinéticas lentas se encuentran en las células provenientes de los órganos otolíticos. Estas claras diferencias cinéticas no están relacionadas con las diferentes formas celulares encontradas, lo que indica que las propiedades electrofisiológicas de las células ciliadas tipo II no dependen de la morfología celular, sino más bien del órgano vestibular del cual provienen. En la literatura existen pocos estudios que comparen las propiedades cinéticas del conjunto de corrientes iónicas en células ciliadas de diferentes órganos vestibulares en una misma especie. Eatock y Hutzler (1992) registraron la corriente iónica total en células del utrículo y canales semicirculares de la rata; el curso temporal de la activación de la corriente, la relación I/V y la magnitud de la corriente rectificante de entrada fueron semejantes entre las células de un mismo tipo sin importar el órgano de origen. Encontraron diferencias significativas entre las células tipo I y II, ya que en la mayoría de las tipo I se encontró una corriente de salida activa en el reposo. Posteriormente, Ricci y cols. (1996), encontraron que las conductancias basolaterales de las células tipo I aisladas de la paloma son semejantes entre órganos vestibulares funcionalmente diferentes (canales semicirculares, utrículo, sáculo y lagena). Weng y Correia (1999) compararon, en la paloma, las corrientes iónicas de salida presentes en las células ciliadas tipo II de los canales semicirculares con las del utrículo. Estos autores encontraron que en ambos órganos existen células con cinéticas rápidas y lentas dependiendo de su ubicación regional en cada órgano. Propiedades Pasivas Las células ciliadas del vestíbulo del axolotl difieren en sus propiedades pasivas dependiendo de su localización vestibular. Las células saculares tuvieron un Vm más negativo que las células de los canales semicirculares (P < 0.01) y del utrículo (P < 0.05). Una explicación para 53 Angélica Almanza G estas diferencias es la expresión de una corriente rectificante de entrada en las células del sáculo que sería la responsable de mover el Vm hacia valores más negativos (y cercanos al EK). Otra diferencia fue en cuanto a la Cm y la Rm: las células del sáculo mostraron una baja Rm con respecto a las de los canales semicirculares y una Cm mayor que las del utrículo; estas diferencias podrían explicarse considerando que el área de las células en este órgano fue mayor que la de las células de los otros órganos y, por tanto, la relación R ∝ 1/C se cumple. Sin embargo, la Cm en el sáculo no fue significativamente diferente a la Cm encontrada en las células de los canales semicirculares. Por lo tanto, pensamos que en el potencial de reposo de las células saculares se encuentra activa una conductancia, lo que hace que la Rm disminuya (R = 1/G); la presencia en mayor magnitud de una corriente rectificante de entrada en las células del sáculo nos hace suponer nuevamente que es esta conductancia la que determina las diferencias mencionadas. La Cm medida electrónicamente (Cm-E) en las células saculares y del utrículo no fue significativamente diferente a la calculada con base a la superficie de membrana (Cm-T), aun cuando Cm-E mostró una tendencia a ser siempre ligeramente mayor; sin embargo, en las células de los canales semicirculares, Cm-E fue significativamente mayor (P < 0.05) que Cm-T. Esta diferencia puede explicarse por el método empleado para realizar la medición: la medición de capacitancia eléctrica considera la capacitancia dada por el haz de cilios, mientras que la medición morfológica no toma en cuenta este valor, ya que en nuestras condiciones experimentales el haz de cilios no es distinguible como para hacer un análisis de su estructura y considerar la capacitancia que aporta la superficie de membrana de los cilios. El que en las células saculares y del utrículo la diferencia entre Cm-E y Cm-T no haya sido significativa concuerda con lo observado al microscopio: los cilios de las células de estos dos órganos son mucho más cortos que los cilios en las células de los canales semicirculares. En general, las propiedades eléctricas pasivas de las células ciliadas estudiadas en este trabajo fueron comparables con las reportadas previamente por otros autores para las células tipo II (Rennie y Ashmore, 1991; Norris y cols., 1992; Ricci y cols., 1994; Masetto y cols., 1994; Rennie y cols., 1996). Corrientes iónicas totales Densidad de corriente. La magnitud de la corriente total (Ip, Iss) fue significativamente 54 Corrientes iónicas en células ciliadas diferente en los tres órganos vestibulares, pero la densidad de corriente fue homogénea entre -80 y 40 mV; en este rango, la diferencia en la magnitud de la corriente se debió a la mayor área de membrana presente en las células del sáculo. Sin embargo, a potenciales más negativos que -80 mV, la densidad de corriente en las células saculares fue significativamente mayor que en las células de los canales semicirculares (P < 0.001) y que en las del utrículo (P < 0.05); esto nos indica que, a potenciales hiperpolarizantes, la diferencia en la magnitud de la corriente se debe a un incremento de la conductancia por unidad de membrana más que a una diferencia en el área de la célula. Otro dato interesante es que a potenciales de membrana más positivos de +40 mV, la densidad de corriente en las células del utrículo rectifica y se hace significativamente menor que la densidad en las otras células; esto nos dice que en las células del utrículo, a valores muy despolarizantes, la conductancia por unidad de membrana disminuye; además, la rectificación observada en la densidad de corriente como función del voltaje nos da un indicio de que en estas células se expresa de manera dominante la corriente de K+ activada por Ca2+ descrita en las neuronas de molusco por Meech y Standen (1975). Componente entrante. La presencia de un componente entrante se correlacionó con el origen vestibular de las células ciliadas. En el sáculo, la conductancia entrante por unidad de membrana fue hasta 5 veces mayor que en los canales semicirculares (donde este componente fue casi despreciable) y 2.5 veces más que en el utrículo. Las características generales del componente entrante registrado en las células saculares y del utrículo se asemeja a la corriente rectificante de entrada (IK1) descrita en otros tipos celulares; por ejemplo, la relación IV mostró una rectificación alrededor del potencial de membrana y produjo una pequeña corriente de salida a potenciales de membrana positivos con respecto al EK (Sakmann y Trube, 1984). En el sáculo de la rana leopardo se reportó la presencia de dos corrientes rectificantes de entrada: IK1 e Ih; la activación de IK1 tuvo un V1/2 = -86 ± 0.7 mV, S = 5.3 ± 0.14, Gmax = 31 ± 2.2 nS y Gmin = 9 ± 1.3 nS; mientras que para Ih, V1/2 = -92 ± 2.2 mV, S = 9.6 ± 0.43, Gmax = 5.3 ± 0.7 nS y Gmin = 1.5 ± 0.5 nS (Holt y Eatock, 1995); estos valores para la IK1 en el sáculo de la rana leopardo son semejantes a los obtenidos (con el ajuste de Boltzmann para la curva de activación entre -130 y -50 mV) en las células saculares del axolotl para el componente entrante (ver tabla V), lo cual nos hace pensar que esta conductancia entrante es IK1. Los valores obtenidos con el mismo ajuste en el utrículo, caen entre lo reportado para IK1 e Ih, por lo que probablemente ambas conductancias se estén 55 Angélica Almanza G coexpresando en las células utriculares (cabe mencionar que el V1/2 reportado para Ih varía entre -67 y -97 mV). Hay una correspondencia entre la magnitud de la corriente entrante y el Vm: las células saculares son las que tuvieron una mayor conductancia entrante y un Vm más negativo con respecto al utrículo y los canales semicirculares; nuestros resultados sugieren que la presencia de IK1 afecta de manera importante al potencial de membrana y a la conductancia en reposo y, como consecuencia, a las respuestas de voltaje ante pulsos de corriente, punto que se discutirá más adelante. En otras células ciliadas también se ha reportado que el Vm es afectado de la misma forma por la expresión de IK1 (Holt y Eatock, 1995; Sugihara y Furukawa, 1989; Masetto y cols., 1994; Masetto y Correia, 1997; Marcotti y cols., 1999). Componente saliente. En las células del sáculo y del utrículo, la conductancia saliente total se detectó realmente activa alrededor de -40 mV, mientras que en los canales semicirculares la corriente se activó a un voltaje más negativo (alrededor de -50 mV). Esta diferencia de alrededor de 10 mV en la activación posiblemente se debe a que las diferentes corrientes de K+ que constituyen a la corriente total tienen una dependencia intrínseca del voltaje diferente en cada órgano vestibular (Eatock y Hutzler, 1992). Estos valores de voltaje en que encontramos ya activado al conjunto de corrientes salientes es similar a lo reportado en otras células ciliadas (rango de activación entre -60 y -50 mV) (Hudspeth y Lewis, 1988a; Rennie y Ashmore, 1991; Eatock y Hutzler, 1992; Smotherman y Narins, 1999; Masetto y cols., 1994; Masetto y Correia, 1997). El ajuste de Boltzmann para las curvas de activación (G/Gmax) de la corriente saliente revela que el valor del voltaje en el cual se encuentra activo el 50% de la conductancia máxima fue semejante en las células de los tres órganos (alrededor de -20 mV); sin embargo, hubo una clara diferencia en los valores de la constante de Boltzmann (S), la cual nos indica el cambio necesario en el voltaje para que la conductancia cambie e-veces. Por lo tanto, considerando los valores de S, podemos concluir que de los tres órganos, las células saculares son las menos sensibles a los cambios en el voltaje; esto quiere decir que para producir un cambio significativo en la activación de la corriente es necesario que exista un cambio grande en el voltaje de membrana. En la misma curva de activación podemos notar que para las células del sáculo y del utrículo, la conductancia no se hace cero en ningún voltaje; alrededor del potencial de 56 Corrientes iónicas en células ciliadas membrana, en el sáculo, el 20% de la conductancia se encuentra activa, en el utrículo un 10% y en los canales tan solo un 5%. El porcentaje de la conductancia activa en el sáculo es similar a lo reportado en las células saculares de la rana leopardo donde, en el reposo, alrededor de un 28% de IK1 se encuentra activa (Holt y Eatock, 1995). Una vez más, parecería que la conductancia entrante, expresada en diferente magnitud en los tres órganos vestibulares del axolotl, determina el porcentaje de conductancia activa en el reposo. Con respecto a la inactivación de estado estable, alrededor del potencial de membrana en las células de los tres órganos un 50% de los canales iónicos se encuentran inactivados; visto de otra manera, en el reposo, el 50% de los canales iónicos se encuentra disponible para repolarizar a la célula ante un estímulo despolarizante. Como se observa en la curva, la inactivación de la corriente total en los tres órganos fue incompleta, quedando alrededor de un 40% de los canales disponibles a potenciales más positivos de -40 mV; esta inactivación incompleta posiblemente se debe a que la corriente total consiste de más de un componente, al menos uno inactivante y uno sostenido, o bien, componentes con una inactivación incompleta a lo largo del tiempo (Marcotti y cols., 1999). Las propiedades cinéticas de la corriente saliente fueron similares en todas las células dentro de cada órgano y ampliamente diferentes entre los mismos. La activación de la corriente en las células de los canales semicirculares fue casi 20 veces más rápida (τ = 0.5 ± 0.1 ms) que en las células saculares (τ = 9.8 ± 2.8 ms) y 5 veces más rápida que en las células del utrículo (τ = 2.4 ± 0.6 ms). Estos resultados discrepan, al menos parcialmente, con lo reportado en la literatura, lo cual discutimos a continuación. No conocemos evidencias de que células ciliadas saculares en otras especies tengan cinéticas de activación tan lentas como las encontradas en el sáculo del axolotl (ver tabla V); las células tipo I y II, en la rata, tienen una constante de activación entre 8-15 ms, pero éstas provenían del utrículo y de los canales semicirculares (Eatock y Hutzler, 1992); un valor similar es el encontrado en las células ciliadas tipo I de la paloma, en donde sin importar el órgano estudiado (sáculo, utrículo, canales semicicrculares y lagena) la τ para la activación fue alrededor de 10 ms (Ricci y cols., 1996). Por el contrario, en el pez dorado, la τ para la corriente en las células saculares fue menor a 5 ms (Sugihara y Furukawa, 1989), la mitad de lo encontrado en el sáculo del axolotl. 57 Angélica Almanza G En los canales semicirculares de la rana (Masetto y cols., 1994) y la paloma (Masetto y Correia, 1997; Weng y Correia, 1999), se encontró que las células ciliadas en diferentes regiones de la cresta ampular tienen un conjunto de conductancias con propiedades cinéticas diferentes. En la periferia, se encontraron células con cinéticas de activación e inactivación rápidas (células rápidas), mientras que en la región central, las células tuvieron cinéticas lentas (células lentas). La disección de corrientes en las células de los canales semicirculares de la rana (Masetto y cols., 1994), mostró que en las células rápidas, la corriente dominante es una corriente de K+ transitoria de salida (IK,A), mientras que en la región central, la corriente de salida total se encuentra dominada por una corriente rectificadora retardada (IK,DR). Por analogía, se sugiere que esta expresión diferencial de corrientes encontrada en la rana se mantiene en la paloma (Masetto y Correia, 1997; Weng y Correia, 1999). Siguiendo el mismo patrón, en el utrículo de la paloma se encontraron también células lentas y células rápidas; las células rápidas se localizaron en la zona extraestriolar, mientras que las células lentas, estuvieron ubicadas en la región estriolar (Weng y Correia, 1999). Al igual que los autores anteriores, nosotros también encontramos células lentas y células rápidas pero, a diferencia de ellos, las propiedades cinéticas de la corriente en las células pertenecientes a un mismo órgano vestibular fueron homogéneas y la diferencia se dio entre las células de diferentes órganos. Las células lentas las encontramos en el utrículo, mientras que las células rápidas se ubicaron en los canales semicirculares, y un tercer tipo celular que podemos clasificar como "muy lentas" corresponde a las células que conforman a la mácula sacular. Aun cuando dentro de un mismo órgano no encontramos dos grupos celulares distinguibles por sus propiedades cinéticas, dos datos interesantes resaltan cuando comparamos la cinética de las células del utrículo y de los canales semicirculares del axolotl con lo reportado por Weng y Correia (1999) en estos mismos órganos pero de la paloma: 1) las características cinéticas de la corriente en las células de los canales semicirculares del axolotl corresponden a la cinética de las células rápidas ubicadas en la periferia de la cresta ampular de los canales semicirculares de la paloma, y 2) las características cinéticas de la corriente en las células del utrículo del axolotl corresponde a la cinética de las células lentas ubicadas en la zona estriolar del utrículo de la paloma. Éste es un hallazgo muy interesante que nos sugiere dos cosas: 1) que nuestro procedimiento experimental de alguna manera sesgó nuestros resultados y, por tanto, sólo registramos células provenientes de la periferia (en el 58 Corrientes iónicas en células ciliadas caso de los canales) y de la zona estriolar (en el caso del utrículo); o bien, 2) que a diferencia de la paloma, las propiedades cinéticas de las células tipo II en el axolotl son homogéneas dentro de cada órgano vestibular, pero heterogéneas entre ellos. La diferencia en las propiedades cinéticas de las células tipo II puede indicar que en cada órgano vestibular la codificación del estímulo sensorial es diferente. Corrientes iónicas aisladas Tanto en las células ciliadas aisladas de los canales semicirculares como en las células ciliadas del utrículo encontramos principalmente tres corrientes de K+ de salida: una transitoria, una sostenida y una dependiente de Ca2+; sin embargo, la contribución de cada una de éstas a la corriente total fue diferente. Además, y en congruencia con los resultados obtenidos del registro de la corriente total, las cinéticas de las corrientes aisladas en las células de los canales semicirculares fueron más rápidas que en el utrículo. Corriente de K+ transitoria (IK,t). En los canales semicirculares, la corriente transitoria de K+ sensible a 4-AP se identificó como una corriente de tipo A (Connor y Stevens, 1971a,b), cuyas cinéticas de rápida activación e inactivación coinciden con las reportadas por otros autores en células ciliadas (Hudspeth y Lewis, 1988; Rennie y Ashmore, 1991; Norris y cols., 1992). La IK,A es el componente principal de la corriente de salida en células aisladas de los canales semicirculares en la rana (Norris y cols., 1992), en la paloma (Lang y Correia, 1989) y en el cobayo (Rennie y Ashmore, 1991). Sin embargo, en los canales semicirculares del axolotl, IK,A no es la corriente dominante, ya que constituyó un 15% de la corriente total, comparado con el 40% que representó la IK,Ca. En el utrículo, la corriente transitoria de salida constituyó un 30% de la corriente total y también fue sensible a 4-AP; sin embargo, la cinética fue alrededor de 9 veces más lenta que en los canales semicirculares; por esta razón, aun cuando esta corriente se asemeja a la tipo A, decidimos denominarla únicamente como "transitoria" (IK,t). Una corriente con cinéticas similares se reportó en las células ciliadas aisladas del sáculo del pez dorado donde la corriente transitoria tiene una constante temporal de activación entre 0.4-10 ms y una constante temporal de inactivación entre 0.6 - 2 seg (Sugihara y Furukawa, 1995). En diversas preparaciones (por ejemplo: neuronas vestibulares, 59 Angélica Almanza G miocitos ventriculares, entre otras), también se ha reportado la presencia de corrientes transitorias que se activan e inactivan lentamente (Xu y cols., 1999; Chabbert y cols., 2001). Se ha sugerido que la principal función de IK,t es la de un amortiguador que se activa luego de las hiperpolarizaciones y que actuaría de una manera transitoria y rápida en contra de la despolarización producida por un estímulo (Housley, 1989). Esta función estaría principalmente restringida a las células de los canales semicirculares del axolotl, por lo que cuando las células son despolarizadas después de un estímulo hiperpolarizante (condición que remueve la inactivación), IK,t se activaría y rápidamente repolarizaría a la membrana celular frenando la liberación de neurotransmisor. El reclutamiento de esta corriente originaría un aumento significativo en la conductancia de membrana con una consecuente disminución en la constante temporal de membrana, lo que le permitirá a la célula seguir al estímulo de manera más fiel. Sin embargo, ante estímulos largos, debido a la inactivación de IK,t, su contribución sería pobre. Por lo tanto, la presencia dominante de IK,t en las células ciliadas de los canales semicirculares del axolotl, disminuiría la respuesta de la célula ante despolarizaciones rápidas y determinaría que estas células no tengan resonancia eléctrica ante pulsos de corriente. Corriente de K+ sostenida (IK,s). Al igual que en las células ciliadas de los canales semicirculares de la rana, paloma, jerbillo, y el utrículo de ratón (Masetto y cols., 1994; Ricci y cols., 1996; Marcotti y cols., 1999; Rennie y cols., 1994; Rush y Eatock, 1996a,b), encontramos que, en los canales semicirculares del axolotl, una corriente sostenida de salida tipo IK,DR (decidimos llamar a esta corriente "sostenida", IK,s) representó un alto porcentaje de la corriente total (45%). Contrario a lo esperado, en las células aisladas del utrículo del axolotl, la corriente dominante fue IK,Ca, mientras que IK,s representó solamente un 4.5% de la corriente total estando ausente, de hecho, en la gran mayoría de las células. La predominancia de IK,t o IK,s determina que las células ciliadas sean "rápidas" o "lentas", respectivamente (Lang y Correia, 1989; Masetto y cols., 1994; Masetto y Correia, 1997). Sin embargo, según nuestros resultados, en el utrículo del axolotl esto no es así, pues aun cuando IK,s es despreciable, las células provenientes de este órgano son lentas, así que podemos decir que no es la presencia de una u otra corriente lo que está determinando que la célula sea lenta o rápida, sino más bien la cinética individual de cada corriente y, por supuesto, el peso que ésta tenga sobre el complejo de corrientes iónicas. Así, la ausencia de IK,s en el utrículo se compensa con la presencia de una corriente IK,t sumamente lenta, mientras que en los canales 60 Corrientes iónicas en células ciliadas semicirculares, tanto la IK,t como la IK,Ca presentan cinéticas de activación e inactivación muy rápidas. Debido a que IK,s carece de un proceso de inactivación o éste es sumamente lento, probablemente ésta sea la principal corriente presente ante despolarizaciones sostenidas cuando ya otros canales se han inactivado. Corriente de K+ dependiente de Ca2+. En las células utriculares, la corriente de K+ dependiente de Ca2+ (IK,Ca) fue la dominante, constituyendo el 65% de la corriente total, y en los canales semicirculares esta corriente representó el 40% de la misma. La presencia de la IK,Ca como corriente dominante en células ciliadas se ha descrito solamente en los canales semicirculares y en el sáculo del pez sapo (Steinacker y cols., 1997; Steinacker y Romero, 1991) y en el sáculo de la rana (Lewis y Hudspeth, 1983b; Hudspeth y Lewis, 1988a); sin embargo, Armstrong y Roberts (1998) reportan también la presencia dominante de IK,DR en el sáculo de la rana. En nuestra preparación pudimos observar dos características interesantes en relación con la IK,Ca; una de ellas es la compleja dependencia que se da entre la activación y el voltaje a potenciales por arriba de 20 mV, y la otra, es la rápida inactivación dependiente del tiempo. En cuanto a la activación, la τ se incrementó a potenciales más positivos de 20 mV; esto puede explicarse (tentativamente) asumiendo que la disminución del influjo de Ca2+ determina no solamente una reducción en la corriente de salida de K+, sino también una disminución en su velocidad de activación (Hudspeth y Lewis, 1988a). En cuanto a la inactivación, Masetto y cols., en 1994, plantean la posibilidad de que ésta sea debida a una compuerta dependiente del tiempo y del voltaje (como en el caso del canal para la corriente de tipo A) y no dependiente de la cinética de la corriente de Ca2+; este planteamiento se basa en el hecho de que Prigioni y cols., en 1992, en las células aisladas de los canales semicirculares de la rana, no encontraron evidencia alguna de que la corriente de Ca2+ presentara inactivación. Sin embargo, en nuestras células no es así, pues hemos encontrado que la corriente de Ca2+ presente en las células aisladas de los canales semicirculares tiene un componente que se inactiva, el cual, entonces, podría ser el que está acoplado a la IK,Ca y ser por tanto el que determinaría la inactivación de esta corriente. Se han descrito tres tipos de canales de K+ dependientes de Ca2+ con base a la conductancia de canal único: pequeños (SK, 2-25 pS), intermedios (IS, 25-100 pS) y grandes (BK, 100-300 61 Angélica Almanza G pS); los cuales, además, difieren en cuanto a la secuencia primaria de aminoácidos, sensibilidad al Ca2+, cinéticas de activación, perfil farmacológico y función fisiológica (para revisión ver Vergara y cols., 1998; Wallner y cols., 1999; Kaczorowski y García, 1999; Ha y cols., 2000). La expresión simultánea de estas diferentes poblaciones de canales, tanto en las células de los canales semicirculares como en las del utrículo, podría explicar la presencia invariable de un componente transitorio rápido seguido por un componente sostenido en el registro de la IK,Ca, así como también las diferencias en los valores de la τ para la activación y la gran variabilidad en la τ de inactivación. Posiblemente la IK,Ca, estaría actuando como un amortiguador transitorio ante el influjo de iones Ca2+; se ha planteado que esta corriente, junto con la ICa, es la responsable de la resonancia eléctrica en células ciliadas de anfibios, reptiles y peces, principalmente en los órganos relacionados con respuestas a estímulos sonoros como son el sáculo y la papila basilar (Crawford y Fettiplace, 1981; Husdpeth y Lewis, 1988a, b; Lewis y Husdpeth, 1983b; Sugihara y Furukawa, 1989, 1995). Sin embargo, aun cuando la presencia de IK,Ca es dominante en las células ciliadas aisladas del utrículo del axolotl, no encontramos evidencia de resonancia eléctrica. Corriente de Ca2+. La existencia de diferentes tipos de canales de Ca2+ se ha demostrado mediante estudios cinéticos, farmacológicos y moleculares en diversas preparaciones (Randall y Tsien, 1997; Pérez-Reyes y cols., 1998; Cribbs y cols., 1998; Bean y McDonough, 1998; Pérez-Reyes, 1999; Lee y cols., 1999a,b; Jiménez y cols., 2000; Protas y Robinson, 2000; revisión por Meir y cols., 1999; revisión por Triggle, 1999). Sin embargo, las propiedades de los canales de Ca2+ en el sistema vestibular son menos conocidas. En el sistema acústico vestibular, estudios farmacológicos han indicado la presencia de una población de canales de Ca2+ tipo L; sin embargo, el umbral de activación para estos canales es más negativo que el observado en canales de Ca2+ tipo L neuronales (Fuchs y cols., 1990; Zidanic y Fuchs, 1995). En los canales semicirculares de la rana se identificó una población homogénea de canales de Ca2+ tipo L (Prigioni y cols., 1991) mientras que, en el cobayo, los canales de Ca2+ parecen ser del tipo T (Rennie y Ashmore, 1992). En el sáculo de la rana, estudios de canal único sugieren la existencia de otros canales de Ca2+, probablemente de tipo N (Su y cols., 1995). Martini y cols., (2000) reportaron una población heterogénea de canales de Ca2+ en los canales 62 Corrientes iónicas en células ciliadas semicirculares de la rana; esta población está constituida por canales de Ca2+ tipo L y dos canales de Ca2+ tipo R: uno con inactivación y otro sin inactivación. En nuestro trabajo en las células ciliadas aisladas de los canales semicirculares, cuando bloqueamos a las corrientes salientes de potasio, encontramos una corriente entrante de pequeña amplitud (alrededor de 50 pA), la cual es bloqueada con Cd2+ y Ni2+ y cuya amplitud incrementa al doble cuando el Ca2+ extracelular es sustituido por Ba2+. Lo anterior indica que se trata de una corriente de Ca2+. A diferencia de los resultados de Prigioni y cols. (1992), que sólo encontraron una corriente de Ca2+ que no presenta inactivación, nosotros hemos encontrado que en las células de los canales semicirculares del axolotl hay por lo menos dos tipos de corrientes de Ca2+: una que no se inactiva, con una activación rápida (τ = 3.1 ± 0.6 ms, medida entre -20 y -10 mV), y se activa a potenciales cercanos a -50 mV, tratándose posiblemente de una corriente de Ca2+ tipo L; el segundo tipo de corriente corresponde a un canal de Ca2+ con inactivación y que se activa a potenciales de membrana negativos (alrededor de -60 mV), tratándose probablemente de un canal de Ca2+ tipo T o R. Sin embargo, para determinar con claridad los tipos de canales de Ca2+ presentes en nuestras células, debemos utilizar en el futuro agentes farmacológicos como las dihidropiridinas y las conotoxinas. Armstrong y Roberts (1998) demostraron que la inactivación en la corriente de Ca2+ (que no está presente en las células disociadas enzimáticamente, Hudspeth y Lewis, 1988a) desaparece cuando el Cs+ en la pipeta de registro es sustituido por N-metilglucamina (NMG+), y sugieren que el componente inactivante es una corriente de Cs+ fluyendo a través de canales dependientes de Ca2+ e independientes del voltaje del tipo SK. En nuestro trabajo, el componente inactivante permanece, aun cuando en nuestra pipeta colocamos NMG+, lo cual sugiere la presencia de un canal distinto al que genera la corriente no inactivante. A diferencia de lo observado por Martini y cols. (2000), en nuestras células, la inactivación de la corriente de Ca2+ no es dependiente de Ca2+, pues cuando sustituimos el Ca2+ por Ba2+, sigue estando presente este componente; debido a estas diferencias, es probable que un canal distinto a los reportados por Martini se encuentre en las células ciliadas aisladas de los canales semicirculares del axolotl. Al igual que en otros sistemas, por ejemplo en neuronas de los ganglios dorsales de rata y en neuronas vestibulares de ratón (Fedulova y cols., 1985; Chambart y cols., 1999), las corrientes de Ca2+ mostraron un decaimiento (run-down) que ocurrió después de algunos 63 Angélica Almanza G minutos de registro; además de este fenómeno, se presentó antes un incremento progresivo en la amplitud de la corriente cuando se dieron de manera repetitiva pasos despolarizantes (runup). Ambos fenómenos se encuentran relacionados con fosforilaciones y desfosforilaciones de proteínas intracelulares, las cuales estarían modulando y determinando la probabilidad de apertura o cierre del canal (Cox y Dunlap, 1992; Diversé-Pierluissi y Dunlap, 1993; para revisión ver Lederer y Lewis, 1999; Meir y cols., 2000; Martini y cols., 2000). Fijación de corriente Se ha reportado que las células ciliadas tipo I y II difieren en cuanto a sus valores de resistencia de entrada (Ri), constante temporal de membrana (τm) y, por tanto, en su respuesta ante inyecciones de corriente; (Correia y Lang, 1990; Rennie y Ashmore, 1991). Así, por ejemplo, en los canales semicirculares del jerbillo, las células tipo I tienen una Ri alrededor de 21.4 ± 14.3 MΩ y una τm entre 0.03-0.4 ms, mientras que las tipo II tienen una Ri = 860.9 ± 273.6 MΩ y una τm = 4 ms (Rennie y cols., 1996). La baja resistencia de entrada en las células tipo I es debida a la presencia de IK,L, la cual se encuentra activa en el reposo (Eatock y Hutzler, 1992; Rüsh y Eatock, 1996; Ricci y cols., 1996). La presencia de IK,L en las células ciliadas tipo I determina que estas células tengan una relativa homogeneidad en cuanto a sus propiedades pasivas y activas; sin embargo, esto no ocurre en las células tipo II, donde se observa más bien una heterogeneidad en cuanto a las mismas propiedades. Así, por ejemplo, la Ri reportada en las células tipo II varía dependiendo de la especie, el órgano vestibular y la región del epitelio sensorial estudiado, encontrándose valores para Ri entre 300 MΩ y 1.5 GΩ (Rennie y cols., 1996; Rennie y Ashmore, 1991; Ricci y cols., 1994; Masetto y cols., 1994). De acuerdo con nuestros resultados, en el aparato vestibular del axolotl la Ri varía dependiendo del órgano vestibular del cual provienen las células; esta diferencia posiblemente está determinada por la presencia de la conductancia entrante activa en el reposo. Como ya se mencionó, IK1 se encuentra activa en mayor proporción en las células del sáculo, y son éstas células las que tienen una menor Ri en el reposo, le siguen las células del utrículo y finalmente, las de los canales semicirculares, las cuales tienen la mayor Ri. Las diferencias no significativas entre los valores de Cm descartan que sea el tamaño de la célula el responsable de las diferencias en la Ri. 64 Corrientes iónicas en células ciliadas Considerando los valores de Ri y con base en la gráfica VI, podemos decir que ante una inyección de corriente hiperpolarizante, el cambio en el potencial de membrana en las células saculares es menor que en las células del utrículo y mucho menor que en las de los canales semicirculares. Las células de los canales semicirculares son las que muestran una mayor ganancia en las curvas corriente-voltaje, aunque las diferencias en la dirección excitatoria son no significativas (ver Fig. 23). Por lo tanto, con base a las propiedades pasivas (Ri, τm, Cm) y activas de la células, podemos establecer, tentativamente, las siguientes implicaciones fisiológicas: 1. En analogía con las células ciliadas tipo I, en el axolotl, ante cambios inmediatos en la posición de la cabeza, el sáculo es capaz de responder más rápidamente que el utrículo y los canales semicirculares, aunque lo hace con una ganancia menor. 2. Nuestros resultados indican que las células provenientes del sáculo tienen baja ganancia, no rectifican significativamente y sus propiedades cinéticas sugieren que no son capaces de seguir estímulos de alta frecuencia como sería de esperar si realmente cumplieran con una función auditiva. 3. Las células del utrículo tienen una mayor ganancia, mejor capacidad de seguir estímulos de mayor frecuencia (< 25 Hz) y no rectifican significativamente. 4. Las células de los canales semicirculares, muestran una rectificación significativa, con alta ganancia en la dirección hiperpolarizante y, a pesar de que sus corrientes tienen una cinética mucho más rápida, la alta resistencia de entrada de estas células determina que tengan igualmente una baja capacidad para seguir estímulos de alta frecuencia (< 30 Hz). 5. Dada la notable rectificación que se ha reportado en la corriente de transducción, pensamos que los canales codifican de forma bidireccional, en tanto el utrículo y el sáculo no tienen una buena sensibilidad bidireccional. Conclusiones 1. La diferencia principal en los diferentes órganos vestibulares es la cinética del conjunto de corrientes iónicas expresadas por las células ciliadas: las células de los canales semicirculares son más rápidas que las células del utrículo y del sáculo. 3. La corriente de K+ sostenida (IK,s) es la corriente dominante en las células de los canales semicirculares, mientras que en el utrículo, es despreciable. 4. La corriente de K+ activada por Ca2+ (IK,Ca) es la corriente dominante en el utrículo. 65 Angélica Almanza G 5. La corriente de K+ transitoria sensible a 4-AP (IK,t) contribuye de manera similar en el utrículo y en los canales semicirculares, sin embargo, su cinética de activación e inactivación es cinco veces más rápida en las células de los canales semicirculares. 6. En las células de los canales semicirculares, hay al menos dos tipos de ICa: una sostenida, posiblemente tipo L, y una inactivante, posiblemente tipo T. 7. La corriente rectificante de entrada tipo IK1, se encuentra expresada en el 100% de las células del sáculo y del utrículo, y en el 60% de las células de los canales semicirculares. La magnitud de IK1, así como el porcentaje de activación de esta conductancia en valores cercanos al potencial de membrana, fue significativamente mayor en las células saculares. 8. Nuestro estudio sugiere que, en el axolotl, la expresión de corrientes iónicas, así como sus cinéticas se encuentran regionalizadas en los diferentes órganos vestibulares, lo cual determinaría la especialización funcional que cada órgano tiene dentro del aparato vestibular. 9. Estos resultados nos permiten concluir que las células ciliadas del utrículo y sáculo del axolotl no tienen propiedades electrofisiológicas que sugieran que están relacionadas con la codificación de estímulos sonoros, hecho que coincide con observaciones conductuales que indican que estos animales no emiten sonidos (vocalizaciones) ni responden a estímulos auditivos. Bibliografía Aidley, D.J. (1998) The physiology of excitable cells. Cambridge University press. 226-263. Anniko, M. (1988) Functional morphology of the vestibular system. In: Physiology of the ear, (Ed) Jhan, A.F., Sacchi, S. Raven Press, New York, 457-472. Armstrong, C.E. y Roberts, W.M. (1998) Electrical properties of frog saccular hair cells: distortion by enzymatic dissociation. The Journal of Neuroscience 18, 2962-2973. Baird, I.L. (1974) Anatomical features of the inner ear in submammalian vertebrates. In: Handbook of Sensory Physiology Vol V., (Ed) Keidel, W.D., Neff, W.D. 159-206. Bean, B.P. y McDonough, I.S. (1998) Two for T. Neuron 20, 825-828. Beutner, D., Voets, T., Neher, E. y Moser, T. (2001) Calcium dependence of exocytosis and endocytosis at the cochlear inner hair cell afferent synapse. Neuron 29, 681-690. Bracho, H. y Budelli, R. (1978) The generation of resting membrane potentials in an inner ear hair cell system. Journal of Physiology 281, 445-4665. 66 Corrientes iónicas en células ciliadas Chabbert, C., Chambard, J.M., Sans, A. y Desmadryl, G. (2001) Three types of despolarization-activated potassium currents in acutely isolated mouse vestibular neurons. Journal of Neurophysiology 85, 1017-1026. Chambart, J.M., Chabbert, C., Sans, A. y Desmadryl, G. (1999) Developmental changes in low and high voltage-activated calcium currents in acutely isolated mouse vestibular neurons. Journal of Physiology 518, 141-149. Chen, J.W. y Eatock, R.A. (2000) Major potassium conductance in type I hair cells from rat semicircular canals: characterization and modulation by nitric oxide. Journal of Neurophysiology 84, 139-151. Choe, Y., Magnasco, M.O. y Hudspeth, A.J. (1998) A model for amplification of hair-bundle motion by cyclical binding of Ca2+ to mechanoelectrical-transduction channels. Proceedings of the National Academy of Sciences 95, 15321-15326. Connor, J.A. y Stevens, C.F. (1971a) Inward and delayed outward membrane currents in isolated neural somata under voltage clamp. Journal of Physiology 213, 1-19. Connor, J.A. y Stevens, C.F. (1971b) Voltage clamp studies of a transient membrane outward current in gastropod neural somata. Journal of Physiology 213, 21-30. Corey, D.P. y Hudspeth, A.J. (1983a) Analysis of the microphonic potential of the bullfrog′s sacculus. The journal of Neuroscience 3, 942-961. Corey, D.P. y Hudspeth, A.J. (1983b) Kinetics of the receptor current in bullfrog saccular hair cells. The journal of Neuroscience 3, 962-976. Correia, M.J. y Guedry, F.E. (1978) The vestibular system: basic biophysical and physiological mechanisms. In: Handbook of Behavioral Neurobiology Vol 1. Sensory Integration, (Ed) Board, 311-346. Correia, M.J. y Lang, D.G. (1990) An electrophysiological comparison of solitary type I and type II vestibular hair cells. Neuroscience Letters 116, 106-111. Cousin, M.A. y Robinson, P.J. (1998) Ba2+ does not support synaptic vesicle retrieval in rat cerebrocortical synaptosomes. Neuroscience Letters 253, 1-4. Cox, D.H. y Dunlap, K. (1992) Pharmacological discrimination of N-type from L-type calcium current and its selective modulation by transmitters. The Journal of Neuroscience 12, 906-914. Crawford, A.C. y Fettiplace, R. (1981) An electrical tuning mechanism in turtle cochlear hair cells. Journal of Physiology 312, 377-412. Crawford, A.C., Evans, M.G. y Fettiplace, R. (1989) Activation and adaptation of transducer currents in turtle hair cells. Journal of Physiology 419, 405-434. 67 Angélica Almanza G Crawford, A.C., Evans, M.G. y Fettiplace, R. (1991) The actions of calcium on the mechanoelectrical transducer current of turtle hair cells. Journal of Physiology 434, 369-398. Cribbs, L.L., Lee, J., Satin, J., Zhang, Y., Daud, A., Barclay, J., Williamson, M.P., Fox, M., Rees, M. y Perez-Reyes, E. (1998) Cloning and characterization of α1H from human heart, a member of the T-type Ca2+ channel gene family. Circulation Research 83, 103-109. Cruz, L.R. (1994) Patrón de inervación, ultraestructura y biofísica de los canales semicirculares en el axolotl (Ambystoma tigrinum). Tesis de licenciatura, Escuela de Ciencias Químicas. Benemérita Universidad Autónoma de Puebla. Denk, W., Holt, J.R., Shepherd, G.M.G. y Corey, D.P. (1995) Calcium imaging of single stereocilia in hair cells: localization of transduction channels at both ends of tip links. Neuron 15, 1311-1321. Diversé-Pierluissi, M. y Dunlap, K. (1993) Distinct, convergent second messenger pathways modulate neuronal calcium currents. Neuron 10, 753-760. Dunnebier, E.A., Segenhout, J.M., Kalicharan, D., Jongebloed, W.L., Wit, H.P. y Albers, F.W.J. (1995) Low-voltaje field-emission scanning electron microscopy of non-coated guineapig hair cell stereocilia. Hearing Research 90, 139-148. Eatock, R.A., Corey, D.P. y Hudspeth, A.J. (1987) Adaptation of mechanoelectrical trnsduction in hair cells of the bullfrog′s sacculus. The Journal of Neuroscience 7, 2821-2836. Eatock, R.A. y Hutzler, M.J. (1992) Ionic currents of mammalian vestibular hair cell. Annals of the New York Academy of Sciences 656, 58-74. Eatock, R.A. y Rüsh, A. (1997) Developmental changes in the physiology of hair cells. Cell & Developmental Biology 8, 265-275. Eatock, R.A. (2000) Adaptation in hair cells. Annual Reviews of Neuroscience 23, 285-314. Fedulova, S.A., Kostyuk, P.G. y Veselovsky, N.S. (1985) Two types of calcium channels in the somatic membrane of new-born rat dorsal root ganglion neurones. Journal of Physiology 359, 431-446. Ferrary, E., Bernard, C., Oudar, O., Sterkers, O. y Amiel, C. (1992) Secretion of endolymph by the isolated frog semicircular canal. Acta Otolaryngology 112, 294-298. Fettiplace, R. (1987) Electrical tuning of hair cells in the inner ear. Trends in NeuroScience 10. 421-425. Fettiplace, R., Crawford, A.C. y Evans, M.G. (1992) The hair cell´s mechanoelectrical transducer channel. Annals of the New York Academy of Sciences 656, 1-11. Flock, Å., Flock, B. y Murray, E. (1977) Studies on the sensory hairs of receptor cells in the inner ear. Acta Otolaryngology 83, 85-91. 68 Corrientes iónicas en células ciliadas Flock, Å., Cheung, H.C., Flock, B. y Utter, G. (1981) Three sets of actin filaments in sensory cells of the inner ear. Identification and functional orientation determined by gel electrophoresis, inmunofluorescence and electron microscopy. Journal of Neurocytology 10, 133-147. Fuchs, P.A., Evans, M.G. y Murrow, W. (1990) Calcium currents in hair cells isolated from the cochlea of the chick. Journal of Physiology 429, 553-568. Garcia, J.M. (1994) Ultraestructura e inervación de los órganos vestibulares no otolíticos y de la lagena en el Ambystoma tigrinum. Tesis de licenciatura, Escuela de Ciencias Químicas, Benemérita Universidad Autónoma de Puebla. Gillispie, P. y Corey, D. (1997) Myosin and adaptation by hair cells. Neuron 19, 955-958. Goldberg, J.M. y Fernández, C. (1984) The vestibular system. In: Handbook of Physiology Vol III. The Nervous System, Part I. (Ed) American Physiologycal Society 977-1022. Gudrun, S., Richter, C.P. y Klinke, R. (1999) Sodium, potassium, chloride and calcium concentrations measured in pigeon perilymph and endolymph. Hearing Research 129, 1-6. Guth, P.S., Perin, P., Norris, C.H. y Valli, P. (1998) The vestibular hair cells: posttransductional signal processing. Progress in Neurobiology 54, 193-247. Ha, T.S., Jeong, S.Y., Cho, S., Jeon, H., Roh, G.S., Choi, W.S. y Park, C. (2000) Functional characteristics of two BKCa channel variants differentially expressed in rat brain tissues. European Journal of Biochemistry 267, 910-918. Hackney, C.M. y Furness, D.N. (1995) Mechanotransduction in vertebrate hair cells: structure and function of the stereociliary bundle. American Journal of Physiology 268, C1-C13. Hille, B. (1984) Ionic channels of excitable membranes. Sinauer Assoc. Inc. Sunderland, Massachusetts. Hodgkin, A. y Huxley, A. (1952) A quantitative description of membrane current and its application to conduction and excitation in nerve. Journal of Physiology 117, 500-544. Holt, J.R. y Eatock, R.A. (1995) Inwardly rectifying currents of saccular hair cells from leopard frog. Journal of Neurophysiology 73, 1484-1502. Holt, J.R., Corey, D.P. y Eatock, R.A. (1997) Mechanoelectrical transduction and adaptation in hair cells of the mouse utricle, a low frecuency vestibular organ. The Journal of Neuroscience 17, 8739-8748. Holt, J.R., Vollrath, M.A. y Eatock, R.A. (1999) Stimulus processing by type II hair cells in the mouse utricle. Annals of the New York Academy of Sciences 871, 15-26. Holt, J.R. y Corey, D.P. (2000) Two mechanisms for transducer adaptation in vertebrate hair cells. Proceedings of the National Academy of Sciences 97, 11730-11735. 69 Angélica Almanza G Housley, G.D., Norris, C.H. y Guth, P.S. (1989) Electrophysiological properties and morphology of hair cells isolated from the semicircular canal of the frog. Hearing Research 38, 259-276. Hudspeth, A.J. (1983) The hair cells of the inner ear. Scientific American 248, 42-52. Hudspeth, A.J. (1986) The ionic channels of a vertebrate hair cell. Hearing Research 22, 2127. Hudspeth, A.J. y Corey, D.P. (1977) Sensitivity, polarity, and conductance change in the response of vertebrate hair cells to controlled mechanical stimuli. Proceedings of the National Academy of Sciences USA 74, 2407-2411. Hudspeth, A.J. y Lewis, R.S. (1988a) Kinetic analysis of voltaje- and ion-dependent conductances in saccular hair cells of the bull-frog, Rana catesbeiana. Journal of Physiology 400, 237-27. Hudspeth, A.J. y Lewis, R.S. (1988b) A model for electrical resonance and frequency tuning in saccular hair cells of the bull-frog, Rana catesbeiana. Journal of Physiology 400, 275-297. Hudspeth, A.J. y Gillispie, P.G. (1994) Pulling springs to tune transduction: adaptation by hair cells. Neuron 12, 1-9. Issa, N.P. y Hudspeth, A.J. (1996) The entry and clearance of Ca2+ at individual presynaptic active zones of hair cells from the bullfrog′s sacculus. Proceedings of the National Academy of Sciences 93, 9527-9532. Izquierdo, J. (1929) Primera memoria de las funciones laberínticas (experiencias en el axolotl, Ambystoma tigrinum). Revista Mexicana de Biología, órgano de la Sociedad Mexicana de Biología IV, 195-207. Jaramillo, F. (1995) Signal transduction in hair cells and its regulation by calcium. Neuron 15, 1227-1230. Jiménez, C., Bourinet, E., Leuranguer, V., Richard, S., Snutch, T.P. y Nargeot, J. (2000) Determinants of voltage-dependent inactivation affect mibefradil block of calcium channels. Neuropharmacology 39, 1-10. Kachar, B., Parakkal, M., Kurc, M., Zhao, Y. y Gillispie, P. (2000) High-resolution structure of hair-cell tip links. Proceedings of the National Academy of Sciences 97, 13336-13341. Kaczorowski, G.J. y García, M.L. (1999) Pharmacology of voltage-gated and calciumactivated potassium channels. Current Opinion in Chemical Biology 3, 448-458. Lang, D.G. y Correia, M.J. (1989) Studies of solitary semicircular canal hair cells in the adult pigeon. II. Voltage-dependent ionic conductances. Journal of Neurophysiology 62, 935-945. 70 Corrientes iónicas en células ciliadas Lederer, W.J. y Lewis, R.S. (1999) Local calcium signaling in cell physiology. Journal of Physiology 113, 153-159. Lee, J., Gomora, J.C., Cribbs, L.L. y Perez-Reyes, E. (1999a) Nickel block of three cloned Ttype calcium channels: low concentrations selectively block α1H. Biophysical Journal 77, 3034-3042. Lee, J., Daud, A.N., Cribbs, L.L., Lacerda, A.E., Pereverzev, A., Klöckner, U., Schneider, T. y Perez-Reyes, E. (1999) Cloning and expression of a novel member of the low voltageactivated T-type calcium channel family. The Journal of Neuroscience 19, 1912-1921. Lenzi, D. y Roberts, W. (1994) Calcium signalling in hair cells: multiple roles in a compact cell. Current Opinion in Neurobiology 4, 496-502. Lewis, R.S. y Hudspeth, A.J. (1983) Frequency tuning and ionic conductances in hair cells of the bullfrog´s sacculus. Hearing-Physiological Bases and Psychophysics 5-9, 17-24. Lowenstein, O.E. (1974) Comparative morphology and physiology. En: Handbook of Sensory Physiology Vol VI. Vestibular System. Part I. Basic Mechanisms, (Ed) H.H. Kornhuber. Berlin: Springer, 75-120. Lumpkin, E.A. y Hudspeth, A.J. (1995) Detection of Ca2+ entry through mechanosensitive channels localizes the site of mechanoelectrical transduction in hair cells. Proceedings of the National Academy of Sciences 92, 10297-10301. Marcotti, W., Russo, G. y Prigioni, I. (1999) Inactivating and non-inactivating delayed rectifier K+ currents in hair cells of frog crista ampullaris. Hearing Research 135, 113-123. Marcotti, W., Russo, G. y Prigioni, I. (1999) Position-dependent expression of inwardly rectifying K+ currents by hair cells of frog semicircular canals. Neuroreport 10, 601-606. Martini, M., Rossi, M.L., Rubbini, G. y Rispoli, G. (2000) Calcium currents in hair cells isolated from semicircular canals of the frog. Biophysical Journal 78, 1240-1254. Masetto, S. y Correia, M.J. (1997) Electrophysiological properties of vestibular sensory and supporting cells in the labyrinth slice before and during regeneration. Journal of Neurophysiology 78, 1913-1927. Masetto, S., Perin, P., Malusà, A., Zucca, G. y Valli, P. (1998) Electrophysiology of chick embryo canal hair cells during development. Abstracts Association for Research in Otolaryngology 21, 29. Masetto, S., Russo, G. y Prigioni, I. (1994) Differential expression of potassium currents by hair cells in thin slices of frog crista ampullaris. Journal of Neurophysiology 72, 443-455. Masetto, S., Weng, T., Valli, P. y Correia, M.J. (1999) Artifactual voltaje response recorded from hair cells with patch-clamp amplifiers. Neuroreport 10, 1837-1841. 71 Angélica Almanza G Meech, R. y Standen, B. (1975) Potassium activation in Helix aspersa neurones under voltage clamp: a component mediated by calcium influx. Journal of Physiology 249, 211-239. Meir, A., Ginsburg, S., Butkevich, A., Kachalsky, S., Kaiserman, I., Ahdut, R., Demirgoren, S. y Rahamimoff, R. (1999) Ion channels in presynaptic nerve terminals and control of tramitter release. Physiological Reviews 79, 1019-1065. Morsli, H., Choo, D., Ryan, A., Johnson, R. y Wu, D.K. (1998) Development of the mouse inner ear and origin of its sensory organs. The Journal of Neuroscience 18, 3327-3335. Neher, E. (1992) Correction for liquid junction potentials in patch clamp experiments. En: Methods in enzymology, Vol. 207 (Ed) Academic Press, 123-131. Norris, C., Ricci, A., Housley, G. y Guth, P. (1992) The inactivating potassium currents of hair cells isolated from the crista ampullaris of th frog. Journal of Neurophysiology 68, 16421653. Ohmori, H. (1984) Studies of ionic currents in the isolated vestibular hair cell of the chick. Journal of Physiology 350, 561-581. Ohmori, H. (1985) Mechano-electrical transduction currents in isolated vestibular hair cells of the chick. Journal of Physiology 359, 189-217. Ohmori, H. (1989) Mechano-electrical transduction of the hair cell. Japanese Journal of Physiology 39, 643-657. Oghalai, J.S, Holt, J.R., Nakagawa, T., Jung, T.M., Coker, N.J., Jenkins, H.A., Eatock, R.A. y Brownell, W.E. (1998) Ionic currents and electromotility in inner ear hair cells from humans. Journal of Neurophysiology 79, 2235-2239. Parsons, T.D., Lenzi, D., Almers, W. y Roberts, W.M. (1994) Calcium-triggered exocytosis and endocytosis in an isolated presynaptic cell: capacitance measurements in saccular hair cells. Neuron 13, 875-883. Perez-Reyes, E. (1999) Three for T: molecular analysis of the low volatge-activated calcium channel family. Cellular and Molecular Life Sciences 56, 660-669. Perez-Reyes, E., Cribbs, L.L., Daud, A.N., Lacerda, A.E., Barclay, J., Williamson, M.P., Fox, M., Rees, M. y Lee, J. (1998) Molecular characterization of a neuronal low-voltage-activated T-type calcium channel. Nature 391, 896-900. Perin, P., Soto, E., Vega, R., Botta, L., Masetto, S., Zucca, G. y Valli, P. (2000) Calcium channels functional roles in the frog semicircular canal. NeuroReport 11, 417-420 Pickles, J.O., Brix, J., Comis, S.D., Gleich, O., Köppl, C., Manley, G.A. y Osborne, M.P. (1989) The organization of tip links and stereocilia on hair cells of bird and lizard basilar papillae. Hearing Research 41, 31-42. 72 Corrientes iónicas en células ciliadas Pickles, J.O., Comis, S.D. y Osborne, M.P. (1984) Cross-links between stereocilia in the guinea pig organ of Corti, and their possible relation to sensory transduction. Hearing Research 15, 103-112. Pickles, J.O. y Corey, D.P. (1992) Mechanoelectrical transduction by hair cells. Trends in Neuroscience 15, 254-259. Prigioni, I., Masetto, S., Russo, G y Taglietti, V. (1992) Calcium currents in solitary hair cells isolated from frog crista ampullaris. Journal of Vestibular Research 2, 31-39. Protas, L. y Robinson, R.B. (2000) Mibefradil, an ICa,T blocker, effectively blocks I rabbit sinus node cells. European Journal of Pharmacology 401, 27-30. Ca,L in Randall, A.D. y Tsien, R.W. (1997) Contrasting biophysical and pharmacological properties of T-type and R-type calcium channels. Neuropharmacology 36, 879-893. Rennie, K.J. y Ashmore, J.F. (1991) Ionic currents in isolated vestibular hair cells from the guinea-pig crista ampullaris. Hearing Research 51, 279-292. Rennie, K.J. y Correia, M.J. (1994) Potassium currents in mammalian and avian isolated canal hair cells. Journal of Neurophysiology 71, 317-329. Rennie, K.J., Ricci, A.J. y Correia, M.J. (1996) Electrical filtering in gerbil isolated type I semicircular canal hair cells. Journal of Neurophysiology 75, 2117- 2123. Ricci, A.J., Erostegui, C., Bobbin, R.P. y Norris, C.H. (1994) Comparative electrophysiological properties of guinea pig (Cavia cobaya) outer hair cells and frog (Rana pipiens) semicircular canal hair cells. Comparative Biochemistry Physiology 107A, No. 1, 1321. Ricci, A.J., Rennie, K.J. y Correia, M.J. (1996) The delayed rectifier, IKI, is the major conductance in type I vestibular hair cells across vestibular end organs. European Journal of Physiology 432, 34-42. Rogawski, M.A. (2000) KCNQ2/KCNQ3 K+ channels and the molecular pathogenesis of epilepsy: implications for therapy. Trends in Neuroscience 23, 393-398. Rüsh, A. y Eatock, R.A. (1996) A delayed rectifier conductance in type I hair cells of the mouse utricle. Journal of Neurophysiology 76, 995-1004. Rüsh, A. y Eatock, R.A. (1996) Voltaje responses of mouse utricular hair cells to injected currents. Annals of the New York Academy of Sciences 781, 71-84. Rüsh, A. y Hummler, E. (1999) Mechano-electrical transduction in mice lacking the α-subunit of the epithelial sodium channel. Hearing Research 131, 170-176. 73 Angélica Almanza G Rüsh, A., Lysakowski, A. y Eatock, R.A. (1998) Postnatal development of type I and type II hair cells in the mouse utricle: acquisition of voltaje-gated conductances and diffentiated morphology. The Journal of Neuroscience 18, 7487-7501. Sakmann, B. y Neher, E. (1984) Patch clamp techniques for studying ionic channels in excitable membranes. Annual Reviews of Physiology 46, 455-472. Sakmann, B. y Trube, G. (1984) Conductance properties of single inwardly rectifying potassium channels in ventricular cells from guinea-pig heart. Journal of Physiology 347, 641657. Sauer, G., Richter, C. y Klinke, R. (1999) Sodium, potassium, chloride and calcium concentrations measured in pigeon perilymph and endolymph. Hearing Research 129, 1-6. Smotherman, M.S. y Narins, P.M. (1999a) The electrical properties of auditory hair cells in the frog amphibian papilla. The Journal of Neuroscience 19, 5275-5292. Smotherman, M.S. y Narins, P.M. (1999b) Potassium currents in auditory hair cells of the frog basilar papilla. Hearing Research 132, 117-130. Soto, E., Budelli, R. y Homgren, B. (1998) Sistema vestibular. En: Fisiología, Células, Organos y Sistemas Vol V, 159-169. Steel, K.P. y Kros, C.J. (2001) A genetic approach to understanding auditory function. Nature Genetics 27, 143-149. Steinacker, A., Monterrubio, J., Perez, R., Mesinger, A.F. y Marin, A. (1997) Electrophysiology and pharmacology of outward potassium currents in semicircular canal hair cells of toadfish, Opsanus tau. Hearing Research 109, 11-20. Steinacker, A. y Romero, A. (1991) Characterization of voltage-gated and calcium-activated potassium currents in toadfish saccular hair cells. Brain Research 556, 22-32. Su, Z.L., Jiang, S.C., Gu, R. y Yang, W.P. (1995) Two types of calcium channels in bullfrog saccular hair cells. Hearing Research 87, 62-67. Sugihara, I. y Furukawa, T. (1989) Morphological and functional aspects of two different types of hair cells in the goldfish sacculus. Journal of Neurophysiology 62, 1330-1343. Sugihara, I. y Furukawa, T. (1995) Potassium currents underlying the oscillatory response in hair cells of the goldfish sacculus. Journal of Physiology 489, 443-453. Thurm, U. (1983) Mechano-electric transduction. En: Biophysics (Ed) Hoppe, W., Lohmann, W., Markl, H. y Ziegler, H. Berlin: Springer, 666-671. Tianxiang, W. y Correia, M.J. (1999) Regional distribution of ionic currents and membrane voltage responses of type II hair cells in the vestibular neuroepithelium. Journal of Neurophysiology 82, 2451-2461. 74 Corrientes iónicas en células ciliadas Triggle, D.J. (1999) The pharmacolgy of ion channels: with particular reference to voltagegated Ca2+ channels. European Journal of Pharmacology 375, 311-325. Tucker, T. y Fettiplace, R. (1996) Monitoring calcium in turtle hair cells with a calciumactivated potassium channel. Journal of Physiology 494, 613-626. Vega, R. (2001) Papel fisiológico y mecanismo de acción de neuropéptidos en el oído interno. Tesis doctoral, UNAM. Vergara, C., Latorre, R., Marrion, N.V. y Adelman, J.P. (1998) Calcium-activated potassium channels. Current Opinion in Neurobiology 8, 321-329. Wallner, M., Meera, P. y Toro, L. (1999) Calcium-activated potassium channels in muscle and brain. Current Topics in Membranes 46, 117-140. Weng, T. y Correia, J.M. (1999) Regional distribution of ionic currents and membrane voltage response of type II hair cells in the vestibular neuroepithelium. Journal of Neurophysiology 82, 2451-2461. Wersäll, J. y Bagger-Sjöbäck, D. (1974) Morphology of the vestibular sense organ. In: Handbook of Sensory Physiology Vol VI. Vestibular System. Part I. Basic Mechanisms, (Ed) H.H. Kornhuber. Berlin: Springer, 124-170. Xu, H., Guo, W. y Nerbonne, J.M. (1999) Four kinetically distinct despolarization-activated K+ currents in adult mouse ventricular myocytes. Journal of General Physiology 113, 661677. Young, L.R. (1984 ) Perception of the body in the espace. In: Handbook of Physiology Brook Hart J.M and Mouncastle V.B. editors, section Y, the nervous system Vol III, (Ed) American Physiological Society, Maryland Bethesda USA, 1023-1062. Zidanic, M. y Fuchs, P.A. (1995) Kinetic analysis of barium currents in chick cochlear hair cells. Biophysical Journal 68, 1323-1336. 75