tejido muscular estriado esquelético
Anuncio

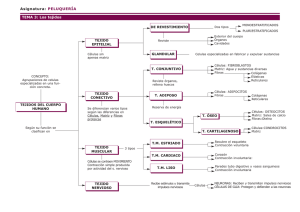
MUSCULO ESTRIADO Tomado y modificado de FAWCETT D. W.: Tratado de Histología – Bloom Fawcett (12ª edición−1995) − Editorial Mc Graw Hill Interamericana Las unidades de organización del músculo esquelético son las fibras musculares, que se corresponden con células multinucleadas largas y de configuración cilíndrica. Son mucho mayores que las fibras musculares lisas, con una longitud que oscila entre 10 y 30cm y un diámetro entre 0.1 y 0.5mm. Se disponen paralelamente entre sí y se agrupan en haces lo suficientemente grandes como para ser visibles a simple vista. Las fibras individuales, los fascículos de fibras y el músculo esquelético en su conjunto están rodeados por tejido conjuntivo que forma una estructura de sostén continua. No obstante, para facilitar su descripción, sus diferentes porciones se describen con términos distintos. El tejido conjuntivo denso que rodea a todo el músculo se llama epimisio. Los finos tabiques que se extienden hacia el interior del mismo y que rodean a cada fascículo de fibras se denominan en conjunto perimisio, y el delicado retículo que rodea a cada fibra individual es el endomisio (Figs. 10-7 y10-8). Aunque el tejido conjuntivo sirve para unir las distintas subunidades del músculo, permite un cierto grado de libertad de movimiento entre las mismas. Es posible un cierto movimiento longitudinal de los fascículos entre sí, y también cada fibra muscular se puede mover independientemente de las fibras adyacentes. Los vasos sanguíneos que irrigan el músculo esquelético se ramifican en el epimisio y se introducen siguiendo los tabiques del perimisio hasta formar en el endomisio una rica trama capilar que rodea a cada fibra muscular individual (Fig. 10-9). Los capilares tienen el suficiente grado de tortuosidad como para acomodarse a las modificaciones en la longitud de las fibras, estirándose durante la relajación y contorsionándose más durante la contracción. 1 2 3 La disposición de los fascículos varía en cada músculo. En algunos músculos relativamente cortos, los fascículos se orientan de forma paralela a la dirección de la contracción de la fibra, y pueden continuar sin 4 interrupción en toda su longitud. En los músculos muy largos, las fibras suelen ser más cortas que el músculo en toda su longitud, y están conectadas a una o más bandas transversales de tejido conjuntivo que se disponen a intervalos a lo largo del músculo. En otros músculos, que se llaman unipinnados, los fascículos se orientan oblicuamente con respecto a una banda longitudinal de tejido conjuntiva situada a uno de los lados del músculo. Los músculos denominados bipinnados presentan fascículos oblicuos que se originan en una zona central de tejido conjuntiva que existe en el interior de estos músculos, con un patrón similar al de las púas que se insertan de forma oblicua en el eje de una pluma. Finalmente, los músculos multipinnados muestran fascículos oblicuos que se originan en bandas longitudinales de tejido conjuntivo que presenta el músculo en su interior y que convergen en un tendón. La disminución de la eficacia que acompaña a la arquitectura fascicular oblicua queda compensada en estos músculos por el gran número de fibras que se pueden acoplar en este patrón arquitecturas, que se observa habitualmente en los músculos que desarrollan una fuerza considerable con un movimiento corto. DESARROLLO Y REPARACION En el embrión, el músculo esquelético se desarrolla a partir de precursores uninucleados llamados mioblastos. Estos precursores proliferan y se fusionan formando células multinucleadas que se suelen denominar miotubos, un término desgraciado que implica erróneamente que son estructuras huecas. Más tarde, estos sincitios alargados inducen en su citoplasma la aparición de miofibrillas, que constituyen los elementos contráctiles de las fibras musculares diferenciadas. Durante el crecimiento posnatal, las fibras musculares aumentan de longitud y grosor, alcanzando un diámetro que oscila entre 10 y 70µm y que depende del músculo que se considere y de la especie a la que pertenezca el animal. Las fibras del mismo músculo pueden presentar grandes variaciones en su diámetro. En los adultos es posible un aumento en el diámetro en respuesta a la actividad muscular intensa y prolongada, un fenómeno que se llama hipertrofia por uso. Por el contrario, las fibras pueden adelgazar en los músculos inmovilizados durante largos períodos de tiempo, como ocurre al aplicar una férula como tratamiento de una fractura ósea, lo que se denomina atrofia por falta de uso. En el músculo de los adultos se puede observar la presencia de ocasionales células de pequeño tamaño con el núcleo alargado y con un patrón cromatínico tosco, que ocupan unas depresiones poco profundas 5 que existen en la superficie de las fibras musculares. Estas son las células satélite, que están situadas ser dentro de la lámina externa que rodea a cada fibra muscular. Se supone que son una población residual de células madre de tipo mioblasto que persisten en el músculo diferenciado y que participan en la reparación del mismo tras una lesión. Sin embargo, la capacidad de reparación del músculo de los adultos es limitada. Después de una lesión de grado leve, y con el endomisio intacto, las células satélite se pueden dividir y fusionar para restablecer las fibras lesionadas. Si la lesión ha sido más intensa, no se produce la regeneración de las fibras musculares, sino que la zona lesionada es invadida por fibroblastos que depositan colágeno y dan lugar a una cicatriz fibrosa. El restablecimiento de la función muscular tras una lesión de este tipo depende principalmente de la hipertrofia de las fibras restantes no lesionadas. ESTRUCTURA DE LAS FIBRAS MUSCULARES Las fibras del músculo esquelético se pueden separar bajo el microscopio de disección, obteniéndose de esta forma las fibras musculares individuales. A mayor aumento, estas fibras muestran una estriación transversal que es característica de los músculos esquelético y cardíaco, y que ha llevado a la aplicación del término músculo estriado para distinguir a estos tipos musculares del músculo liso (Fig. 10-10). No obstante, también se puede observar en estas fibras una fina estriación longitudinal cuya base estructural se hace evidente al macerar muestras de músculo en ácido nítrico diluido. Esta forma de tratamiento destruye las membranas celulares y extrae las organelas y la matriz citoplásmica. Los componentes contráctiles quedan separados en miles de finas miofibrillas con estriación transversal que parecen estar constituidas por cortos segmentos alternados de diferente índice de refracción. Es evidente que la estriación transversal de la fibra muscular intacta se debe al hecho de que los segmentos correspondientes de las miofibrillas estrechamente apretadas en el interior de la fibra están escalonados en toda la anchura de la misma. 6 En la literatura histológica, la membrana plasmática de las fibras musculares se ha denominado tradicionalmente sarcolema, mientras que el citoplasma se ha llamado sarcoplasma. Aunque se ha mantenido su utilización, estos términos no implican que la membrana citoplásmica y el citoplasma de las 7 fibras musculares sean diferentes en lo fundamental de los correspondientes a otros tipos celulares. El sarcolema de las largas fibras cilíndricas está reforzado por una lámina externa comparable a la lámina basal de los epitelios. La columna de miofibrillas que ocupa la mayor parte del sarcoplasma desplaza hacia la periferia del mismo a los numerosos núcleos de la fibra muscular, que se disponen espaciadamente a lo largo de toda su longitud (Fig. 10 - 11). Los núcleos quedan aplastados contra el sarcolema y, por tanto, presentan un perfil alargado en los cortes histológicos. Su número no se puede especificar debido a que es variable en cada músculo, aunque en una fibra cuya longitud sea de varios centímetros pueden existir centenares de núcleos. La localización periférica de los núcleos es útil para distinguir el músculo esquelético del cardíaco, en el que los núcleos están localizados en la parte central de las fibras. La superficie citoplásmica del sarcolema está cubierta por una proteína de 400kD llamada distrofina que parece proporcionar refuerzo mecánico a la membrana, protegiéndola de la tensión que se produce durante contracción muscular. En la miopatía hereditaria ligada al cromosoma X llamada distrofia muscular de Duchenne los pacientes carecen de esta proteína en el sarcolema, lo que da lugar a la debilidad estructural del mismo. La enfermedad se suele iniciar clínicamente hacia los 5 años de edad, y cursa con la sustitución progresiva de las fibras musculares lesionadas por tejido conjuntiva y adiposo. Habitualmente, estos pacientes son incapaces de caminar hacia los 12 años de edad. En el sarcoplasma existen todas las organelas celulares más comunes. Se puede observar un pequeño complejo de Golgi en uno de los polos de la mayor parte de los núcleos. Las mitocondrias (sarcosomas) se agrupan en el sarcoplasma yuxtanuclear y también se pueden observar en hileras longitudinales entre las miofibrillas, en donde proporcionan la energía necesaria para la contracción. Entre las miofibrillas y entre las mitocondrias situadas en los polos de los núcleos, se encuentran pequeñas gotas de lípido. Tras la tinción con la reacción del ácido peryódico de Schiff, se demuestra la presencia de glucógeno en todo el sarcoplasma. Además de estos componentes microscópicamente demostrables, el sarcoplasma en solución contiene mioglobina, una proteína con afinidad por el oxígeno y que es la principal responsable del color ligeramente marrón del músculo. Según las necesidades, el oxígeno se separa de la mioglobina y queda disponible para las reacciones de oxidación. En los músculos relativamente pálidos del ser humano la mioglobina está presente en bajas concentraciones y posiblemente tiene un significado funcional escaso, aunque en los músculos intensamente oscuros de los pájaros y mamíferos es mucho más abundante y fisiológicamente más importante. 8 9 En los cortes transversales, las miofibrillas ocupan la mayor parte del interior de la fibra y aparecen como diminutos puntos distribuidos uniformemente o en áreas poligonales que anteriormente se llamaban campos de Cohnheim. Se ha debatido durante mucho tiempo la posibilidad de que estas imágenes representen la verdadera distribución de las miofibrillas o bien sean el resultado del encogimiento que sufren durante la preparación de la muestra, aunque en la actualidad la mayor parte de las pruebas apuntan hacia su interpretación como un artefacto por encogimiento. En los cortes longitudinales teñidos con hematoxilina férrica, las estriaciones transversales que son difícilmente detectables en el músculo en fresco se acentúan en gran medida y aparecen en forma de bandas intensamente teñidas alternando con bandas relativamente pálidas (Fig. 10-12). Las bandas oscuras en las preparaciones teñidas son anisotrópicas (birrefringentes) cuando se estudian con el microscopio de luz polarizada y, por ello, se llaman bandas A; por su parte, las bandas claras son isotrópicas y se denominan bandas I. Las longitudes relativas de estas bandas dependen del estado de contracción del músculo. Las bandas I son muy cortas durante la contracción, más largas durante la relajación y muy largas en los músculos estirados de forma pasiva. La longitud de las bandas A permanece constante en todas las fases del cielo de contracción y relajación. Cada banda I está dividida por una línea transversal, la línea Z o disco Z. Los segmentos de las miofibrillas que quedan entre dos líneas Z sucesivas se llaman sarcómeras, y todos los cambios morfológicos que se producen durante el cielo contráctil se describen con referencia a esta unidad estructural. La sarcómera incluye una banda A y la mitad de las dos bandas I contiguas. Las bandas A, las bandas I y los discos o bandas Z son habitualmente las únicas estriaciones transversales que se pueden observar con el microscopio óptico, pero en preparaciones excepcionalmente bien elaboradas se puede detectar una zona ligeramente más pálida, la banda H, atravesando el centro de cada banda A. La base estructural de las estriaciones transversales del músculo esquelético se hace aparente en las imágenes ultraestructurales del mismo que serán descritas más adelante en este capítulo. 10 11 HETEROGENEIDAD DE LAS FIBRAS MUSCULARES ESQUELETICAS Las fibras musculares o miofibras que forman un músculo concreto no presentan todas ellas las mismas características, sino que muestran variabilidad en sus diámetros y en sus propiedades citoquímicas y fisiológicas. Además, las proporciones relativas de los diferentes tipos de fibras también varían en cada músculo. Los fisiólogos distinguen dos de fibras musculares: fibras clónicas (fibras de contracción rápida) que propagan un potencial de acción y responden con una contracción del tipo «todo o nada», y fibras tónicas (fibras de contracción lenta) que son incapaces de propagar un potencial de acción y que requieren una serie de impulsos nerviosos. La contracción de estas últimas es más prolongada que la de las fibras clónicas. Según estos criterios, las fibras de contracción lenta son frecuentes en los músculos de anfibios y reptiles, pero infrecuentes en los de los mamíferos. Las descripciones que se realizan a continuación se refieren a la heterogeneidad que existe entre las fibras clónicas que constituyen el tipo fisiológico dominante en el músculo esquelético de los mamíferos. Las fibras musculares de los mamíferos presentan una estrecha gama de diámetros, aunque en los cortes histológicos de rutina es posible que no se observen otras diferencias entre las mismas. Sin embargo, los métodos citoquímicos de tinción permiten distinguir con facilidad tres tipos de fibras que se han denominado tradicionalmente fibras rojas, fibras blancas y fibras intermedias. Por desgracia, se ha producido una cierta confusión terminológica debido a que los fisiólogos han reconocido cuatro tipos de fibras y a que han utilizado elementos descriptivos según criterios diferentes de los utilizados por los histólogos. Las divergencias en la terminología quedan recogidas en la tabla de la Figura 10-13. Las fibras rojas (fibras oxidativas y de contracción lenta) tienen un diámetro relativamente pequeño y un color oscuro, atribuible a su mayor contenido en mioglobina y a su mayor abastecimiento de capilares. Presentan además numerosas mitocondrias de gran tamaño bajo el sarcolema y entre las miofibrillas. En el sarcoplasma de estas fibras es frecuente observar pequeñas gotas de lípido y, debido a su abundancia en mitocondrias, se tiñe intensamente con la reacción citoquímica para la demostración de la enzima succínico deshidrogenasa (Fig. 10-14). Las bandas Z suelen ser más anchas que las de los otros tipos de fibras. Las fibras rojas suelen estar inervadas por pequeños axones y poseen placas motoras relativamente simples y de pequeño tamaño. Las unidades motoras formadas por fibras rojas se contraen más lentamente que las constituidas por otros tipos de fibras, y son muy resistentes a la fatiga debido a su capacidad para la regeneración oxidativa del ATP, que es el compuesto de elevada energía necesario para el proceso contráctil. Estas propiedades hacen que las fibras rojas sean especialmente eficaces en el mantenimiento 12 de la postura. Figura 10-13. Características-estructurales, metabólicas e histoquímicas de los tres tipos de fibras musculares esqueléticas. En la cabecera de las columnas se incluyen los términos tradicionales (roja, blanca e intermedia) y los términos correspondientes que utilizan los fisiólogos. (Tabla modificada de Burke, R, E. 1981. En Handbook of Physiology, The Nervous System li, pp. 345-422. American Physiology Society, Bethesda; también Tabla 9-2 de Morieb, E. N. l9xx. En B. Cummins, ed. Human Anatomy and Physiology.) Las fibras blancas (fibras de contracción rápida y fugaz) son las de mayor tamaño. Las mitocondrias que presentan bajo el plasmalema son más pequeñas y escasas que las de las fibras rojas, y casi no existen en las zonas intermiofibrilares. Por tanto, la reacción citoquímica para la succínico deshidrogenasa es débil en 13 estas fibras (Fig. 10-14). La producción de ATP depende en las fibras blancas de la glucólisis anaerobia de la glucosa procedente de los abundantes depósitos de glucógeno que poseen en su sarcoplasma. Las fibras blancas están inervadas por axones de mayor calibre que dan lugar a placas motoras de tamaño doble a las que presentan las fibras rojas. Se contraen rápidamente y generan una fuerza importante, aunque se fatigan también con rapidez, por lo que son más adecuadas para los momentos breves de actividad muscular intensa. 14 La forma y disposición de las mitocondrias en los tres tipos de fibras musculares ha sido estudiada mediante microscopia electrónica de barrido con emisión por campos, tras la eliminación de la matriz citoplásmica (Fig. 10-16). En las fibras rojas, las mitocondrias esféricas y subsarcolemales son grandes y abundantes, y a cada lado de la banda Z se puede observar un par de mitocondrias delgadas orientadas transversalmente. En los espacios interfibrilares, las mitocondrias tienen la longitud de una sarcómera y forman columnas longitudinales que pueden ser gruesas, formadas por múltiples mitocondrias o finas las que están constituidas por filas de mitocondrias únicas (Fig. 10-16A). En las fibras blancas, las mitocondrias subsarcolemales son más escasas y no se suelen observar columnas longitudinales que, además, muestran interrupciones (Fig. 10-16B). La disposición de las mitocondrias en las fibras intermedias es similar a la que presentan las fibras rojas, pero no es frecuente observar columnas mitocondriales. Los fisiólogos han reconocido un subtipo de fibras de contracción rápida y fugaz, que es relativamente rico en mioglobina y que presenta capacidad para el metabolismo anaerobio mientras que es relativamente resistente a la fatiga. Estas fibras son clasificadas por algunos autores como fibras de contracción rápida y fugaz resistentes a la fatiga (FR), y por otros como fibras de contracción rápida y fugaz oxidativas y glucolíticas (FOG). Se ha descrito también un cuarto tipo intermedio entre estas últimas y las fibras de contracción rápida y fugaz sin resistencia a la fatiga. Sin embargo, no está totalmente claro cuántos de estos tipos caen en la categoría de fibras intermedias de los histólogos, que se define sencillamente como la constituida por fibras intermedias entre las rojas y las blancas con respecto al diámetro, al volumen mitocondrial y a la intensidad de la tinción histoquímica. Las fibras musculares no se contraen de forma individual sino en unidades motoras, que se definen a su vez como grupos de fibras del mismo tipo que están inervadas por ramas del mismo axón nervioso. El número de fibras inervadas por una única neurona motora oscila de 100 a 300 en los pequeños músculos de la mano, y de 600 a 1700 en los grandes grupos musculares del brazo y la pierna. Las fibras musculares de cualquier unidad motora no están juntas sino dispersas en una superficie considerable que puede ser compartida por otras 20 o más unidades motoras. Esta mezcla de fibras de muchas unidades motoras diferentes explica las diferencias que existen entre las fibras adyacentes con respecto a las reacciones de tinción (Fig. 10-15). Al estudiar los músculos a simple vista, se observan ciertas variaciones en la coloración de los mismos. La diferencia entre la carne blanca y la roja del pollo constituye un ejemplo apropiado, aunque en los músculos de los mamíferos también se pueden detectar ligeras diferencias en el color. Estas variaciones reflejan los 15 distintos grados de vascularización y las diferentes proporciones de los tipos de fibras. Aunque no es invariable, la proporción de fibras que presenta un músculo concreto suele permanecer bastante constante. Sabemos en la actualidad que las fibras de contracción rápida y fugaz se pueden transformar en fibras de contracción, lenta y viceversa. Al intercambiar las ramas nerviosas de un músculo postural lento y de uno locomotriz rápido, se produce una modificación gradual en las características estructurales y fisiológicas de cada uno de estos músculos hacia las que presentaba el otro. 16 ULTRAESTRUCTURA DE LAS FIBRAS MUSCULARES ESTRIADAS Nuestros conocimientos sobre los mecanismos de acortamiento y de generación de fuerza por parte del músculo esquelético han avanzado en gran medida por el estudio de las fibras musculares con el microscopio electrónico. La estructura de las organelas comunes no muestra diferencias fundamentales con las que se encuentran en otras células. Sin embrago, y en relación con las elevadas necesidades energéticas del mecanismo de contracción, las mitocondrias de la fibra muscular muestran numerosas crestas estrechamente agrupadas y su distribución en íntima relación con las miofibrillas permite que la fuente de energía (ATP) esté en la proximidad del lugar en el que va a ser utilizada. El retículo endoplásmico está muy organizado y ha adquirido propiedades fisiológicas que no son típicas de esta organela en otros tipos celulares. A finales del siglo pasado, un histólogo que estudiaba el músculo tras haberío impregnado con metal pesado describió la presencia de una trama de características cordonales formada por bandas de coloración oscura alrededor de cada miofibrilla, y la denominó retículo sarcoplásmico. Los intentos de otros histólogos para demostrar esta estructura fueron prácticamente infructuosos, por lo que se siguió dudando de su existencia real hasta que fue descubierta de nuevo con el microscopio electrónico en 1954. Desde el punto de vista ultraestructural, el retículo sarcoplásmico está formado por túbulos rodeados por membrana que constituyen una trama continua situada en los estrechos espacios que quedan entre las miofibrillas en toda la fibra muscular. A pesar de que se corresponde con el retículo endoplásmico de otra células, carece de ribosomas asociados y está especializado en una función diferente. Es el lugar en el que queda retenido el calcio durante la relajación muscular, y también a partir del cual se liberan hacia el sarcoplasma los iones libres de calcio que ponen en marcha el mecanismo de la contracción en respuesta a una estimulación nerviosa. Por tanto, esta organela de la fibra muscular es esencial para el inicio y la finalización de la contracción muscular. El retículo rodea a cada miofibrilla y muestra un patrón repetido de diferenciaciones locales relacionadas con regiones específicas de las sarcómeras. La orientación preponderante de los sarcotúbulos es la longitudinal, aunque en la zona H de cada banda A presentan ramificaciones laterales anastomosadas que forman una trama más densa alrededor de la miofibrilla. En la zona de unión de la banda A con la banda I, los sarcotúbulos longitudinales confluyen con un túbulo de mayor calibre y orientación transversal que se denomina cisterna transversal. Los túbulos longitudinales que abarcan las sucesivas bandas I y las líneas Z interpuestas finalizan también en una cisterna distinta localizada en la zona de unión A-I. De esta forma, en cada zona de unión A-I se puede observar un par de cisternas terminales paralelas en toda la longitud de la miofibrilla, lo que equivale a dos pares por cada sarcómera. 17 Entre cada par de cisternas terminales se sitúa un delgado túbulo transversal (túbulo T) que no forma parte integral del retículo sarcoplásmico sino que es un túbulo largo que se extiende hacia el interior de la fibra desde el sarcolema (Fig. 10-17). La membrana limitante de túbulo T se continúa con el sarcolema en la superficie de la fibra muscular, y su luz se abre al espacio extracelular. Por tanto, los túbulos T son finas invaginaciones del sarcolema que penetran en el interior de la fibra muscular atravesando múltiples miofibrillas. Las dos cisternas terminales paralelas y el túbulo T forman un complejo que se ha denominado tríada. De la misma forma que las sarcómeras, las tríadas se disponen en correspondencia a todo lo ancho de la fibra muscular. No obstante, la descripción que acabamos realizar sobre las tríadas se aplica únicamente al músculo esquelético de los mamíferos, dado que en los anfibios estas estructuras se localizan en la línea Z y no en la zona de unión entre las bandas A e I (Fig. 10-18). 18 19 El retículo sarcoplásmico es continuo en la fibra muscular, aunque presenta regiones con características funcionales diferentes. Las cisternas transversales expandidas que acompañan a los túbulos T para formar las tríadas se denominan retículo de la unión, y esta zona del retículo presenta propiedades que le permiten responder a un potencial de acción facilitando su propagación al túbulo T adyacente mediante la liberación de calcio hacia el sarcoplasma. Los túbulos que forman el resto del retículo se denominan habitualmente sarcotúbulos longitudinales, a pesar de que presentan ramificaciones laterales que forman una trama alrededor de las bandas A de las miofibrillas. En las preparaciones de microscopio electrónica con el método de criofractura, se observa que la membrana de estos túbulos muestra abundantes partículas en su interior que parecen contener la ATPasa de Ca+2 y Mg2+ responsable del retorno del calcio desde el sarcoplasma hasta la luz del retículo durante la relajación. El contenido de los sarcotúbulos longitudinales se extrae durante la preparación de la muestra, de manera que su luz suele aparecer vacía. Por otra parte, la luz de las cisternas del retículo de la unión contiene un material amorfo de baja densidad electrónica formado principalmente por calcisecuestrina, una proteína de 55kD que puede fijar 300nM de calcio por miligramo y que parece actuar como agente de retención para el almacenamiento de calcio en el interior del retículo. 20