Free Energy of Electron Transport
Anuncio

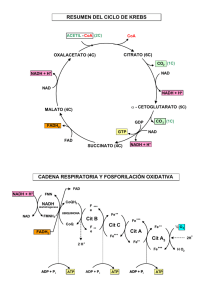
Fosforilación Oxidativa Carlos I. González, Ph.D. Catedrático Asociado Departamento de Biología Universidad de Puerto Rico – Río Piedras CHAPTER 19 Oxidative Phosphorylation and Photophosphorylation Key topics: – – – – Electron-transport chain in mitochondria Capture of light energy in photosynthesis Building up the proton-motive force Synthesis of ATP in mitochondria and chloroplasts Fosforilación Oxidativa Convergencia de rutas catabólicas - glucólisis, Ciclo de Krebs, β-oxidación, degradación de amino ácidos. Energía liberada de oxidación de estas moléculas→ síntesis ATP. En células eucarióticas ocurre en mitocondrio, envuelve reducción de O2 a H2O con electrones donados por NADH y FADH2. Fosforilación Oxidativa Se conoce también como cadena respiratoria transporte de e- por moléculas en la membrana del mitocondrio. Electrones vienen de dehidrogenasas en rutas metabólicas. Dehidrogenasas remueven e- de intermediarios. Donan e- a aceptadores (NAD y FAD) Energy Flow in Cellular Respiration Oxidative Phosphorylation • Electrons from the reduced cofactors NADH and FADH2 are passed to proteins in the respiratory chain • In eukaryotes, oxygen is the ultimate electron acceptor for these electrons • Energy of oxidation is used to phosphorylate ADP Oxidative Phosphorylation Photophosphorylation • In photosynthetic organisms light causes charge separation between a pair chlorophyll molecules • Energy of the oxidized and reduced chlorophyll molecules is used to drive synthesis of ATP • Water is the source of electrons that are passed via a chain of protein transporters to the ultimate electron acceptor, NADP+ • Oxygen is the byproduct of water oxidation Photophosphorylation Chemiosmotic Theory Peter Mitchell 1961 1978 Nobel Prize Mitocondrio Mitochondria – site of oxidative phosphorylation Origen endosimbiótico (mit.DNA, ribosomas, tRNAs) Structure of a Mitochondrion 1,100 proteins (300 still unknown function) Tipos de Transferencia de Electrones: 1) como electrones Fe3+ a Fe2+ 2) átomo de hidrógeno (H+ y e-) 3) hydride ion (2 e- y 1 H+) Aceptadores de electrones: Dehidrogenasas asociadas a NAD electrones transferidos como “hydride ion” a NAD+ y otro H+ es liberado al medio. Sust. red. + NAD+ H+ Sust. ox. + NADH + NAD+ también obtiene e- de NADPH: NADPH + NAD+ NADP+ + NADH NADH (catabolismo) y NADPH (anabolismo) - solubles, asociación a enzimas (reversible) Ninguno cruza membrana interna. Flavoproteínas - asociado, a veces covalente, nucleótido de flavina (FAD, FMN) FAD o FMN acepta 1 o 2 e- participan en rxns. de transferencia de 1 o 2 e-. Transferencia - Flavoproteína tiene más afinidad por e- que compuesto oxidado. Afinidad por e- de flavina depende de proteína asociada. FAD es parte de sitio activo de la enzima. Ubiquinona (Coenzima Q) – hidrofóbica, acepta 1 o 2 eCitocromos - contienen grupo prostético heme. Proteínas ferrosulfuradas - átomo de hierro NO en grupo heme Ubiquinona (coenzima Q) Como flavoproteínas, funciona en transferencias de donante de 2 e- y aceptador de 1 e-. Pequeña, hidrofóbica, difusible en membrana, transporta e- de otros transportadores menos móviles. Transporta e- y H+, imp. en acoplamiento. Citocromos Iron-containing heme prosthetic groups a y b asociado a su proteína, no covalente, integrales c – covalente, cisteínas, soluble Afinidad átomo de hierro por e- depende de su asociación a diferentes proteínas. Cytochromes • One electron carriers • Iron coordinating porphoryin ring derivatives • a, b or c differ by ring additions Proteínas Ferro – sulfuradas Hierro NO está presente en grupo heme, asociado a azufre inorgánico, azufre en residuos de cisteína de la proteína. Estructura puede ser compleja (1 Fe a 4 Cys, 4 Fe). Envueltos en transferencias de 1 e-. Un Fe es oxidado o reducido. Big Picture: Energía liberada en transporte de e(exergónica) es asociada a transporte de protones a través de la membrana impermeable del mitocondrio. Electrones se mueven de NADH, succinato u otros donantes a O2 a través de transportadores como flavoproteínas, ubiquinonas, citocromos y proteínas ferro-sulfuradas. Esta energía se conserva como potencial electroquímico transmembranal. El transporte de protones a favor de gradiente (hacia dentro) a través de canales de transporte se utiliza para sintetizar ATP. ATP sintetasa acopla transporte de protones a fosforilación de ADP. Chemiosmotic Theory Peter Mitchell 1961 1978 Nobel Prize Determinación de secuencia de la cadena respiratoria a) Determinación experimental de potencial de reducción (afinidad por e-) de cada uno de los transportadores. Electrones tienden a moverse espontáneamente de portadores con –E’o a portadores con +E’o. Free Energy of Electron Transport Reduction Potential (E) ∆Eo′ = Eo′(e- acceptor) – Eo′(e- donor) ∆Go′ = –nF∆Eo′ For negative G need positive E E(acceptor) > E(donor) Electrons are transferred from lower (more negative) to higher (more positive) reduction potential. Free Energy released is used to pump proton, storing this energy as the electrochemical gradient Qué tienen en común estos individuos? Jim Jones Adolf Hitler Rasputin b) Inhibidores de la cadena de transporte En presencia de O2 y donante inicial de e-, los portadores que funcionan antes del paso inhibido se reducen, los que funcionan después de la inhibición permanecen oxidados. Separación de Complejos Multienzimáticos de la Cadena Respiratoria Flow of Electrons from Biological Fuels into the Electron-Transport Chain NADH:ubiquinone oxidoreductase, a.k.a. Complex I • One of the largest macro-molecular assemblies in the mammalian cell • Over 40 different polypeptide chains, encoded by both nuclear and mitochondrial genes • NADH binding site in the matrix side • Noncovalently bound flavin mononucleotide (FMN) accepts two electrons from NADH • Several iron-sulfur centers pass one electron at a time toward the ubiquinone binding site Complex I IDENTIFIQUE EL ERROR DEL LIBRO! NADH:Ubiquinone oxidoreducase is a proton pump • Transfer of two electrons from NADH to ubiquinone is accompanied by a transfer of protons from the matrix (N) to the intermembrane space (P) • Experiments suggest that about four protons are transported per one NADH NADH + Q + 5H+N = NAD+ + QH2 + 4 H+P • Reduced coenzyme Q picks up two protons • Protons are transported by proton wires – A series of amino acids that undergo protonation and deprotonation to get a net transfer of a proton from one side of a membrane to another Complejo I: Transferencia de e- de NADH a Ubiquinona Positivo Negativo Cataliza 2 procesos simultáneos: 1) Transferencia de 2e- (hydride ion) – exergónica 2) Transferencia de 4H+ al exterior. Complejo I: Transferencia de e- de NADH a Ubiquinona Positivo Negativo Proton Pump - utiliza energía de transporte de e- para mover H+. Ubiquinona reducida (Ubiquinol) se mueve de Complejo I a III Complejo I: 42 polipéptidos, incluyendo 1 flavoproteína que contiene FMN y 6 FeS Amital (barbitúrico), rotenona (insecticida) y piericidin A (antibiótico) inhiben Complejo I Inhiben transporte de e- de Fe-S a ubiquinona. Complejo II: Transferencia de e- de Succinato a Ubiquinona Dehidrogenasa de succinato – única enzima del Ciclo de Krebs integrada en la membrana. 2 grupos prostéticos y 4 proteínas diferentes e- pasan de succinato a FAD, a centros Fe-S, a ubiquinona Complejo II - Succinato a Ubiquinona Otras formas de reducir CoQ pero no por Complejos I y II: β-oxidación - dehidrogenasa de acyl CoA glicerol - dehidrogenasa de glicerol 3P Complejo III: Ubiquinona a citocromo c (complejo citocromo bc1) La CoQ transfiere e- a citocromos (hierro en grupo heme). Citocromos aceptan e- en forma Fe3+ y se transforman a Fe2+. Citocromo c ha variado muy poco en evolución. Complejo III: Transferencia de e- de Ubiquinona a Citocromo c CoQ reducida transfiere e- a Cytocromo c.Transporte de H+ acoplado a transferencia de e-. CoQ dona 2e-, citocromos aceptan sólo 1e-. Resultado: CoQ se oxida, 2 citocromos c se reducen. Citocromo c es soluble y se mueve al Complejo IV para donar e-. Transferencia de electrones en el Complejo III 2 moléculas de QH2 se oxidan, 4 H+ salen al exterior, cada QH2 dona 1e- via Fe-S a citocromo c1 y otro e- (via cit.b) a Q, reduciendo a QH2. Esta reducción utiliza 2 H+ de la matriz. Complejo IV: Citocromo c a O2 (citocromo oxidasa), reduce O2 a H2O. Complejo de 13 subunidades, acopla transferencia de e- a transporte de H+ La reducción de O2 envuelve pasos intermedios que generan radicales de O2. Se mantienen unidos al complejo para evitar que reaccionen con componentes celulares. Citocromo a3 diferente - contiene Cu2+. Complejo IV: Transferencia de e- de Citocromo c a O2 Por cada 4e-, el complejo consume 4H+ de la matriz para convertir O2 en 2H2O. Por cada e- se transporta 1 H+ al exterior. Subunidad I – 2 heme, a y a3, CuB Subunidad II – 2 Cu2+ en complejo con SH de cisteína (CuA) Potencial de Reducción (E’o) - mide afinidad por electrones. Fuerza electromotriz (energía liberada) al moverse de estado oxidado a reducido. Negativo tiene menos afinidad por electrones. Positivo tiene más afinidad por electrones. Rxns. con ∆E’o positivo - exergónicas. Transportadores de electrones funcionan en orden de incremento en potencial de reducción. Electrones tienden a moverse espontáneamente de portadores con E’o a portadores con +E’o. Transporte de electrones - libera energía ∆G’o = -nF∆E’o Transferencia de 2e- de NADH a O2: NADH + H+ + ½ O2 → NAD+ + H2O Reaccion exergónica. Si calculamos ∆G’o vemos que: n= 2eF=constante ∆E’o = cambio en afinidad de e- de par Redox Para NAD+/NADH = -.32 Para O2/H20 = 0.816 ∆E’o = E aceptador - E donante = .816-(-.32) = 1.14 Calculamos ∆G’o = -220 kJ/mol NADH En cels. [NAD] y [NADH] no 1M, rxn. es más negativa (exergónica). Esta energía liberada se acopla a la salida de H+ al exterior (endergónica). Por cada 2e- transferidos a O2, 4H+ salen por medio de Complejo I, 4H+ por medio de Complejo III y 2 H+ por Complejo IV. La energía electroquímica en esta diferencia de [H+] y separación de cargas representa una conservación de la mayoría de la energía liberada en la transferencia de electrones. La energía almacenada en este gradiente - proton motive force (fuerza protón-motriz) PMF - 2 componentes 1) H+ afuera alto/ adentro es bajo ya que membrana es impermeable 2) cargas positivas afuera/negativas adentro Por cada H+ que sale afuera ∆G = 20kJ/mol Si por cada 2e- transportados de NADH a O2, salen 10 protones: ∆G total = 200kJ/mol Si el transporte de 2e- tiene ∆G = -220 kJ/mol, es termodinámicamente posible el transporte de 10 protones. Cuando los protones fluyen espontáneamente a favor del gradiente (de afuera hacia adentro) para nivelar las conc., la energía liberada se utiliza para sintetizar ATP. Modelo Quemiosmótico de Mitchell Energía liberada por el transporte de e- se acopla al transporte de H+ al espacio intermembranal formando un gradiente. La diferencia en cargas y pH se transforma en energía (PMF) que produce ATP cuando los H+ entran nuevamente a la matriz de forma pasiva y espontánea. Expts. que confirman Modelo Quemiosmotico 1) Requiere membrana intacta – sintesis de ATP 2) Memb. Impermeable a iones (H+, OH-, K+, Cl-) 3) Mitocondrios activos aumentan [H+] exterior 4) Inhibidores de transporte de e- (cianuro, CO) inhiben síntesis de ATP 5) Inhibidores de síntesis de ATP inhiben transporte de e-. 6) Ionóforos – evitan fosforilación oxidativa, transportan iones a través de la membrana y no permiten diferencia en cargas eléctricas en la membrana (Valinomicina) 7) Desacopladores – aumentan permeabilidad de membrana, liberan H+ y eliminan diferencia en H+ (DNP). ATP Sintetasa o F1ATPasa (Complejo V) Complejo multienzimático – formacion de ATP, acoplado a transporte de H+ a través de membrana 2 componentes: F1 – periferal, esencial para fosforilación Fo – integral, sensitivo a oligomicina, poro de [H+] hacia el interior F1 o Fo – no síntesis de ATP, necesita ambos complejos, ambos acoplan transferencia de e- y H+ a síntesis de ATP. F1 – hidrólisis de ATP Mitochondrial ATP Synthase Complex ADP + Pi ATP+H2O→ Rx. Reversible en superficie de enzima (no convencional). ATP se une más fuerte que los reactantes. ATP se estabiliza y Rx. Procede aunque es un proceso endergónico. La estabilización de ATP libera energía para nivelar costo de síntesis de ATP. La energía almacenada en PMF libera ATP de la superficie de la enzima. Binding-change Model for ATP Synthase Modelo de Mitchell: Por 2e- desde NADH, 10H+ son expulsados Por 2e- de succinato, 6H+ son expulsados 4H+ son requeridos/ 1ATP (1 de éstos es usado en transporte de Pi, ADP y ATP) Entonces: Desde NADH →P/2e- ratio 10/4 = 2.5 ATP Desde succinato→ P/2e- ratio 6/4 = 1.5 ATP Lo superamos! Cuántos ATP por O2 reducido? P/O o P/2e- ratio Expt. – Mitocondrios en presencia de NADH y O2 o succinato y O2 → se oxida el NADH, se sintetiza ATP y se reduce O2. P/O ratio -> 2-3 ATP – NADH P/O ratio -> 1-2 ATP – succinato Proteínas Transportadoras – Membrana Interna Mitocondrio 1) Translocasa de nucleótido de Adenina – ADP al matrix y ATP hacia afuera 2) Translocasa de fosfato – “symport” de Pi y H+ hacia adentro. Consume energía ya que consume H+ que pudo haberse utilizado para síntesis de ATP Malato - Aspartato NADH transfiere e- a Oxaloacetato→Malato, entra y transfiere e- a NAD+ y NADH entonces entra a cadena de transporte. Oxaloacetato en citoplasma se regenera por transaminación: Aspartato + ketoglutarato oxaloacetato + glutamato Regulación Fosforilación Oxidativa Produce mayoría de ATP en células aeróbicas Regulación coordinada en otros procesos: [ATP] bajas – aumenta actividad de glucólisis, oxidación de piruvato, ciclo de Krebs, cadena de transporte. [ADP] bajas – disminuye glucólisis (ATP inhibe PFK1), oxidación de piruvato, ciclo de Krebs, cadena de transporte. Citrato – activo ciclo de Krebs, inhibe PFK1 cuando sale al citoplasma Regulación Coordinada