El Aire
Anuncio

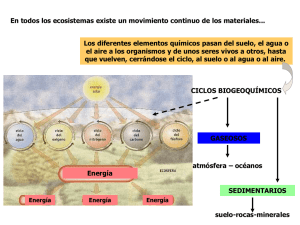
Profesora Glenda Torres P. Química LA ATMÓSFERA La atmósfera terrestre es una mezcla de gases que cubre nuestro planeta y está sostenida por la fuerza de gravedad; esta fuerza es la que hace que los gases no se pierdan en el universo. La atmósfera nos protege de agentes externos tales como meteoritos, radiaciones peligrosas que provienen del sol, temperaturas extremas, etc. Formar nuestra atmósfera fue un proceso que llevó unos 4.500 millones de años. La atmósfera se divide en cinco capas de distinto: espesor, composición, temperatura y presión, y estas son: troposfera, estratosfera, mesosfera, ionosfera y exosfera, nombradas a medida que se alejan de la tierra. Las capas de la atmósfera a) La Troposfera es la capa más cercana a la superficie de la tierra, en los primeros 12 Km. contiene el 90% de los gases atmosféricos y la temperatura disminuye 5,5 °C por cada mil metros de altura, sobre el nivel del mar a 1 medida que aumenta la altitud. En esta capa se producen todos los fenómenos climáticos, tales como: la formación de nubes, lluvia, viento, tormentas eléctricas, etc. Y la mayor parte de los fenómenos biológicos, tales como: vuelo de los pájaros e insectos, dispersión de semillas y polen. Su espesor varía con la latitud, siendo máximo en el Ecuador (16 Km.) y mínimo en los Polos (8 Km.). b) La Estratosfera, se extiende desde los 12 hasta los 55 Km. sobre la superficie terrestre. En ella se distinguen dos capas, una de 12 a 25 Km. en la cual la temperatura permanece constante alrededor de – 50 °C y otra de 25 a 55 Km. donde la temperatura aumenta hasta los 6 °C, en esta capa la temperatura aumenta con la altitud, esto debido en parte a reacciones exotérmicas entre los átomos de la tenue atmósfera y los rayos ultra violeta procedentes del Sol, éstas reacciones producen la capa de ozono. Aquí se ubica la capa de ozono y se realiza el tránsito aéreo. c) La mesosfera, se extiende desde los 55 hasta los 80 Km., la temperatura disminuye en forma continua hasta los – 93 °C, es una porción de atmósfera muy tenue, con bajísima densidad, en ella los meteoritos adquieren altas temperaturas y la gran mayoría se volatiliza y consume. Por ella viajan los globos sonda. d) La Termosfera o ionosfera, se extiende desde los 80 a los 500 Km., acá la temperatura aumenta gradualmente hasta los 1200 °C. La radiación electromagnética del sol ioniza los gases atmosféricos, produciéndose disociación de moléculas en átomos, ionización de átomos en iones positivos y electrones libres. Un fenómeno asociado a la ionosfera es la “aurora boreal”. e) La exosfera es la capa más externa de la atmósfera a partir de los 500 Km. hasta unos 1000 Km. y es el límite entre la atmósfera y el espacio interplanetario. Está formada por una capa de Helio y otra de Hidrógeno, más allá se extiende una enorme banda de radiaciones. Componentes del aire El aire es un fluido transparente, incoloro e inodoro, buen aislante térmico y eléctrico. El aire es una mezcla gaseosa sin olor y sin color ni sabor, que llena los pulmones del hombre y muchos animales cada vez que respira. Una persona adulta inhala entre 13.000 a 15.000 litros de aire por día. Gas Composición porcentual de aire seco Dependiendo de la ubicación geográfica, se encuentran otros compuestos a nivel de trazas, tales como: Hidrógeno (H2), Monóxido de dinitrógeno (N2O), Xenón (Xe), Nitrógeno (N2) Oxigeno (O2) Argón (Ar) Anhídrido Carbónico (CO2) Neón (Ne) Helio (He) Metano (CH4) Kriptón (Kr) Composición % en volumen 78.03 20.99 0.94 0.033 0.0015 0.000524 0.0002 0.00014 2 Ozono (O3), Dióxido de Azufre (SO2) Dióxido de Nitrógeno (NO2), Amoníaco (NH3), Monóxido de Carbono (CO), Iodo (I2), etc. Normalmente el aire no está seco, contiene H2O, en sus tres estados físicos, en cantidades que van desde trazas hasta un 4 % en volumen como máximo. Variando con la ubicación geográfica (zonas desérticas con 0 %, hasta zonas tropicales), con la estación del año (primavera, verano, otoño o invierno), altura y posición sobre la tierra, día o noche, etc. En el ciclo hidrológico, el agua influye fuertemente en la generación de diversos fenómenos meteorológicos y características del clima. La descripción normal del contenido de vapor de agua en el aire es a través de la Humedad Relativa del aire. Ejemplo Si la presión parcial de vapor de agua en el aire a 25 °C es 12,2 mmHg, la humedad relativa del aire es comparada con la presión del vapor de agua a esa temperatura (23,8 mmHg), valor sacado de tablas: Humedad relativa = Presión parcial de vapor de agua x100 = 12,2 mmHg x 100 = 51,3% Presión de vapor de agua 23,8 mmHg Otro componente siempre presente en el aire y en cantidad variable es el Polvo Atmosférico, constituido por: Humo, sal (zonas costeras), arena fina (desierto y viento), cenizas, esporas, polen (primavera), microorganismos, etc. CARACTERÍSTICAS DE LOS GASES QUE FORMAN LA ATMÓSFERA 1. El Nitrógeno, N2 , Es una molécula diatómica, incolora e insípida, poco reactiva (forma óxidos sólo a alta temperatura), no es tóxico y es el componente mayoritario del aire, 78,03 %. Como es un gas bastante inerte se usa en ambientes en que sea peligroso o indeseable la presencia de oxígeno (por ejemplo: producción de reactivos químicos, tratamiento de metales y componentes electrónicos, etc.). El nitrógeno se licua a –195 °C, propiedad que en medicina sirve para congelar muestras biológicas y se pueden conservar órganos durante un período suficiente como para que sean transportados a fin de realizar trasplantes. En la congelación rápida de alimentos para: su conservación, control de maduración, exportación, etc. 3 Criogenia: estudio y utilización de materiales a temperaturas muy bajas. El término ‘criogenia’ se usa para las temperaturas inferiores a -150 °C (123 K). Las temperaturas criogénicas se obtienen por la evaporación rápida de líquidos volátiles o por la expansión de gases confinados a presiones de entre 150 a 200 atmósferas. Los compuestos de Nitrógeno son componentes de alimentos, fertilizantes y explosivos (nitroglicerina). También forma parte constituyente de las proteínas. El nitrógeno se encuentra principalmente en la atmósfera y se obtiene por licuación del aire. En la corteza terrestre su abundancia es sólo de 0.002 %, proveniente de los minerales NaNO3 y KNO3 (Salitre). El nitrógeno va rotando en la atmósfera a través del ciclo del nitrógeno. La absorción de iones de nitrogenados por las plantas a través del suelo ocurre por la acción de bacterias que asimilan el nitrógeno a través del aire y lo convierten en proteínas. Los suelos pobres en nitrógeno se mejoran haciendo plantaciones de leguminosas. Los animales se comen las plantas (las proteínas), cuando mueren, se descomponen produciendo amoníaco (NH3) que por bacterias desnitrificadoras lo convierten en nitrógeno (N2) y otros compuestos nitrogenados reabsorbidos por las plantas. Las tormentas eléctricas hacen que el nitrógeno (N2) y el oxígeno (O2) atmosféricos, se combinen formando óxidos de nitrógeno que con las lluvias llegan al suelo. 4 2 . El Oxígeno, O2 , , Es una molécula diatómica, incolora, inodora e insípida, muy reactivo. Está presente en el aire en un 20.99 %. Forma compuestos con todos los elementos excepto los gases nobles de bajo peso atómico. En la atmósfera proviene de la fotosíntesis de las plantas verdes y del plancton marino, y es necesario para la respiración de las plantas y de los animales. Es poco soluble en agua (0.0057 % a 10 ºC), pero se incorpora en cantidad suficiente como para sobrellevar la vida acuática. En la corteza terrestre es el elemento más abundante, constituye un 45,5%. El oxígeno es un oxidante fuerte de amplia utilización en la industria, por ejemplo, se utiliza en el tratamiento de aguas negras, como agente blanqueador en la industria del papel, en medicina: para superar déficit respiratorio, como agente oxidante en sopletes, en la industria del acero, etc. Superación respiratorio déficit Encendedor Equipo para respiración en buceo Cuando el proceso de reacción de una sustancia con oxígeno ocurre lentamente y el calor se disipa sin aumento de la temperatura, se denomina oxidación. El oxígeno participa en todas las reacciones de combustión. Los compuestos combustibles, reaccionan con el oxígeno (comburente), generando los correspondientes óxidos con liberación de calor y /o luz. La respiración es una combustión. El procesamiento del azúcar en el organismo humano se realiza para producir energía. En la combustión de metano: CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g) Comburente: Él Oxígeno es el responsable de que ocurran las combustiones, éste gas “alimenta” la reacción de combustión, la que, sin la presencia de Oxígeno no puede existir. Combustible: El metano puede arder o tener tendencia a ello, en presencia de oxigeno y una chispa. Existen numerosos combustibles siendo los mas utilizados los hidrocarburos provenientes del petróleo. 5 Métodos de obtención del oxígeno a) El aire: Se licua el aire, se destila fraccionadamente, proceso del cual se obtiene primero el nitrógeno que hierve a – 196 °C, luego el Argón a –186 °C y el oxígeno a los – 183 °C. b) Del agua: Al hacer pasar una corriente eléctrica a través de agua que contenga ácido o un electrolito, ésta se descompone en O2 e H2. c) De sus compuestos. En general los compuestos oxigenados tienden a liberar O2 en forma total o parcial cuando se calientan: 2 HgO → 2 Hg + O2 2 BaO2 → 2 BaO + O2 3. Los Gases Nobles Los gases nobles son monoatómicos, incoloros, inodoros e insípidos y muy poco reactivos. La atmósfera es la única fuente que los contiene, excepto el Helio que además, algunas veces se ha extraído de pozos de gas natural. Nombre Z A Usos y características Helio He Neón Ne Argón Ar Gas de flotación en globos de investigación atmosférica o militares y zeppelines publicitarios. No es inflamable. Es el 2do elemento más abundante del universo La mezcla He + O2 es usada como mezcla respirable para 2 4.002 el buceo. El helio se congela a los 0,95 K, en estado líquido es usado en criogenia para mantener bajas temperaturas y en la obtención de imanes potentes. Es un superconductor Descargas eléctricas a través de tubos cargados con neón, producen luz de tonalidad rojo-anaranjado, y es 10 20.179 usado para fines publicitarios, indicadores de alto voltaje, testigos luminosos, tubos de TV. Es usado en criogenia, se congela a los 24,6 K. El Argón no reacciona a altas temperaturas y presiones, por lo cual es usado en lámparas incandescentes, ya que 18 39.948 no oxida los filamentos de Wolframio. En Soldaduras y Oxicorte. Para atmósferas inertes en la obtención de productos químicos. 6 Kriptón kr Xenón Xe Radón Rn Se usa en el llenado de lámparas eléctricas y aparatos electrónicos de varios tipos. Por ejemplo, mezclas de 36 83.800 Kriptón-Argón en lámparas fluorescentes, iluminación de aeropuertos, proyectores de cine, etc. El láser de kriptón es útil en la cirugía de retina en el ojo. Es usado en emisores de luz con características bactericidas, tubos luminosos, estroboscopios y flashes 54 131.300 fotográficos, así como tubos fluorescentes con capacidad de excitar el láser de rubí. Es no radiactivo y capaz de formar compuestos. Se genera a partir de la desintegración radiactiva del Uranio a Radio, es radiactivo, y es un gas que traspasa 86 (222) fácilmente el cuerpo a través de los pulmones. Se deben airear los edificios para evitar su acumulación. Se usa en Medicina y en la predicción de terremotos. 4. El Anhídrido Carbónico, CO2 El anhídrido carbónico, CO2, es triatómico, incoloro, inodoro y no es tóxico. Cuando se está en una habitación en la cual estamos consumiendo Oxígeno, O2, y liberando CO2, se puede provocar asfixia, pero sólo por falta de Oxígeno. Es producido por la combustión en presencia de exceso aire (oxígeno) de cualquier tipo de compuesto que contenga Carbono (incendios de bosques, combustión de parafina, bencina, azúcar, etc.) o por la respiración animal y vegetal (la fotosíntesis) y es reciclado en el ciclo del Carbono. El Ciclo del Carbono El consumo de CO2 (g) es extremadamente endotérmico, la energía necesaria procede de la luz solar con ayuda de la clorofila a través de la fotosíntesis. El océano participa en este ciclo atrapando el aire y generando fotosíntesis en su fitoplancton. De sus aplicaciones tenemos que un 50% del consumo de CO2 es usado como refrigerante en forma 7 de hielo seco, por ejemplo: para congelar, conservar y transportar alimentos y un 20 % en preparación de bebidas carbonatadas. Otras aplicaciones están en sistemas de extinción de incendios, recuperación de Petróleo en campos petrolíferos y por supuesto los principales consumidores son las plantas. Los principales métodos de obtención industrial de CO2 son: a) Descomposición de Piedra Caliza , CaCO3 , por calcinación a 900 °C CaCO3 (s) CO2 (g) + CaO b) Reacción de Piedra Caliza ( CaCO3 ) con ácidos CaCO3 (s) + 2 HCl Carbonato de calcio (ac) 2 CO2 (g) + CaCl2 (ac) Ácido clorhídrico + 2 H2O (l) Cloruro de calcio c) Combustión de cualquier tipo de Carbón o compuesto que lo contenga C (s) + O2 (g) CO2 (g) Carbón CH4 (g) + 2 O2 (g) CO2(g) + 2 H2O (g) Metano d) Subproducto de la Fermentación en la producción de etanol C6H12O6 + fermento 2 CO2 + 2 C2H5OH(ac) Glucosa C6H12O6 Etanol + 6 O2 6 CO2 + 6 H2O + ENERGÍA Cuando tengo una combustión con baja concentración de Oxígeno se produce CO2 y CO. 4.5 El Monóxido de carbono, CO Es un gas incoloro, inodoro, muy tóxico y peligroso. Su toxicidad se debe a la formación de un compuesto muy estable con la hemoglobina de la sangre, más estable que la unión oxígeno con hemoglobina, con lo cual se impide el transporte de O2 en el cuerpo y se produce envenenamiento. Su desintoxicación es muy lenta y lo más apropiado es una transfusión de sangre. CONTAMINACIÓN ATMOSFÉRICA La calidad del aire que inhalamos es importante para la salud de nuestros pulmones ya que de ello depende la pureza de nuestra sangre, la capacidad de nuestro organismo para sintetizar alimentos, la eliminación de los productos 8 tóxicos, la energía de nuestros músculos, la lucidez de nuestro cerebro y en definitiva la duración y la calidad de nuestra vida. La atmósfera ha ido variando su composición, tanto por fenómenos naturales como por la intervención del hombre, producto del rápido avance tecnológico, uso y explotación de combustibles fósiles, explotación de los recursos minerales de la tierra, rápido crecimiento de la población humana y por ende deforestación, menor calidad del agua y del aire. El estudio de la contaminación nos permite generar parámetros de comparación entre el aire limpio y el contaminado. Entre las causas naturales de contaminación del aire se pueden mencionar: emanaciones volcánicas, actividad de géiseres y partículas en suspensión. 1. Los volcanes De los volcanes emanan sólidos (nubes de cenizas), líquidos y gases. Los principales gases liberados a la atmósfera son: Nitrógeno (N2), Anhídrido carbónico (CO2), Cloruro de Hidrógeno (HCl), Sulfuro de Hidrogeno (H2S) y Vapor de agua. Se cree que el 75% del azufre del aire proviene de las emanaciones volcánicas. El sulfuro de hidrogeno liberado a la atmósfera reacciona con oxigeno del aire para generar anhídrido sulfuroso según la siguiente ecuación: 2 H2S(g) + 3 O2(g) → 2 SO2(g) + 2 H2O(g) Parte de este SO2 reacciona con el H2S: 2 H2S(g) + SO2 → 3 S(s) + 2 H2O(g) 2. Lluvia ácida Otra parte de este anhídrido sulfuroso reacciona con oxigeno para 9 generar anhídrido sulfúrico el que a su vez reacciona con agua para generar ácido sulfúrico. Existen grandes extensiones de bosques que se han perdido debido a la lluvia ácida. 2 SO2 + O2 Anhídrido sulfuroso → 2 SO3 →→ 2 SO3 + H2O Anhídrido sulfúrico → H2SO4 Ácido sulfúrico Los Geiser son otra forma de actividad volcánica atenuada, son verdaderos volcanes de vapor de agua hirviendo y que además emanan gases que contienen azufre. Otros aportes a la lluvia ácida son los provenientes del uso de combustibles fósiles, debido a la emisión de anhídridos de azufre y óxidos de nitrógeno, los cuales reaccionan con la luz del sol, la humedad y el oxígeno atmosférico produciendo ácidos sulfúrico y nítrico: 2 SO2 + O2 Anhídrido sulfuroso 2 NO2 → →→ 2 SO3 2 SO3 + H2O Anhídrido sulfúrico + H2O HNO3 → H2SO4 Ácido sulfúrico + Ácido Nítrico HNO2 Ácido Nitroso La lluvia normal también es levemente ácida, tiene un pH de 5,6: Lluvia normal CO2 + H2O → H2CO3 PH = 5,6 Ácido carbónico La lluvia en zonas industriales puede llegar a valores muy ácidos, aprox. pH 2,5, el cuál es mucho más ácido de lo normal y hace variar el pH del agua en ríos y lagos, afectando la vida acuática, en suelos: dañando y hasta matando los cultivos, y en edificaciones la acidez reacciona con los agentes básicos de las estructuras, destruyendo monumentos, edificios y corroyendo los metales. 3. SÓLIDOS EN SUSPENSIÓN Los sólidos en suspensión aportan bastantes problemas a la contaminación del aire ya que estas partículas actúan como catalizadores en reacciones fotoquímicas, aumentando la velocidad de formación de algunos contaminantes. Estas partículas en suspensión provienen de los vehículos motorizados, quema de carbón y actividades industriales y agrícolas. 4. CONTAMINACIÓN INDUSTRIAL Es producto de los procesos de combustión de algunas industrias, sus principales contaminantes son: SO2, ceniza, hollín y compuestos orgánicos volátiles. Las lluvias ácidas ocurren principalmente en las grandes ciudades, especialmente por la contaminación que producen los vehículos motorizados, las industrias y 10 los centros mineros. Las masas de aire contaminadas se desplazan a otros lugares, generando también en esos ambientes las llamadas "lluvias ácidas". En Chile, en 1995, en la comuna de Lo Espejo hubo un incendio en una industria química, que dio origen a un hongo de humo negro por varias horas y causó alarma en la población. Si bien se han hecho investigaciones y seguimientos a los vecinos de dicha industria, no se ha comprobado daño. Sin embargo, ese episodio desencadenó una toma de conciencia importante en la población y en las autoridades chilenas respecto a los accidentes tóxicos, su prevención y reparación. 5. CONTAMINACIÓN FOTOQUÍMICA El smog fotoquímico, se forma cuando la mezcla de óxidos de nitrógeno e hidrocarburos volátiles emitida por los automóviles y el oxígeno atmosférico reaccionan, inducidos por la luz solar, en un complejo sistema de reacciones que acaba formando ozono. El ozono es una molécula muy reactiva que sigue reaccionando con otros contaminantes presentes en el aire y forma un conjunto de varias decenas de sustancias, como nitratos de peroxiacilo (PAN), peróxido de hidrógeno (H2O2), radicales hidroxilo (OH), formaldehido, etc. Estas sustancias, en conjunto, pueden producir importantes daños en las plantas, irritación ocular, problemas respiratorios, etc. Como la reacción de combustión de la gasolina se realiza con aire, en lugar de oxígeno puro, se produce la siguiente reacción a altas temperaturas: N2 (g) + O2 (g) → 2 NO (g) El NO es precursor del de la nube de smog fotoquímico. Se oxida a NO2, el cual absorbe la radiación de la luz solar y se descompone: NO2 (g) + Luz UV → NO (g) + O•• Seguido de formación de ozono: O•• + O2(g) → O3(g) 6. LA CAPA DE OZONO Y LOS CFC EL Ozono, O3, forma alotrópica del Oxígeno, se produce normalmente en la estratosfera, por fotólisis en la atmósfera de la tierra entre los 25 y 35 Km. de altura. Alcanza una concentración de 8 ppm. Es una molécula muy reactiva, que está en constante proceso de formación y destrucción. Su función es vital, sirve de filtro de cierta radiación ultravioleta que en la superficie de la tierra produce cáncer a la piel y daña los ojos. 11 Sin embargo, el ozono producido en la troposfera, es muy tóxico, provoca irritación en la nariz, ojos garganta y bronquios, y forma parte del smog fotoquímico (ver punto 5). Se produce en las ciudades por reacción de la luz UV del sol con gases de Óxidos Nitrosos e Hidrocarburos, emitidos por motores de combustión interna, industrias y plantas productoras de energía en condiciones ambientales ideales: días cálidos, asoleados y sin viento. El agujero en la capa de ozono Sobre la Antártica y recientemente sobre el Ártico, el ozono estratosférico se ha reducido considerablemente y se ha comprobado que existe un agujero en la capa de ozono que se estaciona en la Antártica. Inicialmente se pensó que la capa de ozono se estaba adelgazando en forma homogénea. Los CFC Entre los años 1970 y 1980 se observó que la capa de ozono estaba siendo afectada por el uso creciente de los Clorofluorocarbono (CFC), utilizados principalmente porque se pensaba que eran no tóxicos e inertes. Sin embargo destruyen la capa de ozono estratosférico y permanecen en la atmósfera unos 100 a 120 años. Se estima que un sólo átomo de cloro puede destruir más de 100.000 moléculas de ozono antes de ser eliminado por alguna otra reacción. Los CFC son productos industriales, inicialmente usados en sistemas de refrigeración, sistemas de aire acondicionado, como expelentes en aerosoles, disolventes y en la producción de embalajes, etc. Las naciones industrializadas firmaron el acuerdo de Montreal, 1987, para disminuir hasta eliminar la fabricación de los CFC antes del año 2000. Se prevé que la capa de ozono podría restaurarse completamente en el año 2060, esto, si se detienen las emisiones de químicos dañinos a la capa que contengan cloro o bromo. 12 7. EFECTO INVERNADERO El Efecto Invernadero es un fenómeno natural, causado por la presencia de gases en la atmósfera, principalmente CO2, vapor de agua y metano. Los gases de Efecto Invernadero permiten el paso de las radiaciones solares de onda corta, calentando la superficie de la Tierra. A la vez absorben parte del calor que emana de la superficie en forma de radiaciones infrarrojas, de mayor longitud de onda que la luz solar. Como consecuencia, la superficie de la tierra experimenta una variación de temperatura aproximada de –18 ºC a 15 ºC, es decir unos 33ºC en total. A esto se le denomina Efecto Invernadero natural. Sin este efecto invernadero natural la temperatura de la tierra sería mucho menor y expuesta a condiciones de temperatura extremas. La vida en nuestro planeta sería distinta. Los problemas surgen por el aumento de la concentración de los gases que forman el invernadero natural. La cantidad de CO2 en la atmósfera había permanecido constante durante siglos, en unas 280 ppm (partes por millón), pero en el último siglo ya tenemos 350 ppm, lo que ha generado un incremento térmico de la tierra de 0,5 °C. 1ppm de incremento por año equivale a 9.109 toneladas de CO2 y de otros gases que contribuyen al calentamiento de la atmósfera tales como los clorofluorocarbono (CFC), metano (CH4) y los óxidos de nitrógeno ( NxOx ). La quema de combustibles fósiles como: petróleo, gas natural y hulla, y el desarrollo de procesos industriales han aumentado la concentración de CO2. Se estima que a este ritmo de crecimiento de los gases de invernadero, durante el siglo XXI la temperatura promedio de la tierra aumentará entre 1 y 3 °C. Lo cual podría traer graves consecuencias debidas al cambio climático. La deforestación en la tierra, según datos de Greenpeace, ocurre con pérdidas de 11,2 millones de hectáreas de bosque nativo cada año. Los factores de esta amenaza son: los incendios, la industria maderera, la expansión agrícola, la lluvia ácida y otros factores que ejercen un efecto negativo en el proceso fotosintético, ya que a través de la fotosíntesis, en nuestro país los bosques absorben 43 millones de toneladas de CO2 y retornan a la atmósfera 32 millones de toneladas de oxígeno. 13 Contribuyente al efecto invernadero Quema de combustibles Fugas y vertidos Agricultura Procesos Industriales Desechos Porcentaje 55.1 21.7 14.9 4.9 3.3 8. Inversión térmica La inversión térmica es un fenómeno meteorológico que se da en las capas bajas de la atmósfera terrestre. Normalmente, en la troposfera existe un gradiente térmico vertical negativo, es decir, según ascendemos, la temperatura del aire va descendiendo. Circulación atmosférica natural comparada con una inversión térmica La causa más común de inversión térmica es el enfriamiento nocturno de un estrato cercano a la tierra (causado por los cielos claros que permiten que el calor escape de la superficie) junto con vientos suaves que no permiten que los contaminantes se dispersen, la capa de aire frío comprime a los contaminantes contra el suelo, la concentración de los gases tóxicos puede llegar hasta equivaler a 14 veces más de su potencial inicial. Históricamente, la contaminación empezó a considerarse un problema que debía ser tomado en cuenta, solo a raíz de eventos en donde la contaminación se asoció a condiciones de inversión térmica ocasionando la muerte de centenares de personas. 9. Contaminación Acústica El ruido es un fenómeno acústico causante de una sensación auditiva considerada como molesta. Los ruidos someten al oído y al sistema nervioso del hombre a tensiones no menos peligrosas que el humo Aviones en el despegue 200 db de las chimeneas o el consumo de agua sirena de una ambulancia 150 db contaminada. Martillo neumático 120 db Entre los trastornos que está la disminución Voz humana 60 db de la capacidad auditiva, de la memoria, 14 problemas en el sueño, baja en el sistema inmunológico, disminución en la concentración y en la actividad creadora. El sonido se mide en decibeles, donde 120 es el umbral del dolor, para poder dormir confortablemente necesitamos que haya alrededor nuestro menos de 30 decibeles. PRINCIPALES CONTAMINANTES Y SUS EFECTOS EN SANTIAGO La composición y calidad del aire en Santiago, es diferente, según la estación del año que se trate. Debido a la situación geográfica de nuestra ciudad, existe ausencia de vientos en otoño e invierno lo que contribuye a intensificar los problemas de contaminación. Por este motivo podemos ver en invierno, una nube de smog que cubre Santiago y que alcanza la altura de la virgen del cerro San Cristóbal, debido al efecto de inversión térmica. En verano sin embargo la nube de smog se encuentra más arriba de este cerro y la limpieza del aire se ve favorecida por la presencia de vientos. Entre las alternativas utilizadas para evitar “en parte” la contaminación, está el fortalecer la utilización de energías renovables o que no sean contaminantes atmosféricos, como: la energía nuclear, la eólica, la solar y la mareomotriz, entre otras. El uso de gas natural El gas natural, está compuesto principalmente por metano, se utiliza como combustible domestico e industrial. Produce escasa contaminación y tiene un gran poder calorífico, se suministra por tubería y se ventila muy bien ya que es más liviano que el aire. El uso de gas natural presenta también algunas desventajas como por ejemplo: las instalaciones para su distribución son muy costosas, y muchas veces el traslado de gas natural significa la intervención o destrucción de algunos ecosistemas que trae como consecuencia la desaparición de poblaciones vegetales y animales y, en nuestro caso, dependencia extrema de los proveedores ya que no disponemos de esta materia prima y debemos importarla. Por lo tanto es nuestro deber aportar para que en un futuro cercano podamos descontaminar nuestra ciudad con nuevas energías no contaminantes. 15 Santiago de día Santiago de noche PROPIEDADES DE LOS GASES El aire es un fluido transparente, incoloro e inodoro, buen aislante térmico y eléctrico. Es una mezcla de gases, tiene las propiedades físicas que tienen los gases, tales como: masa, volumen y densidad. Una manifestación del peso del aire es la Presión Atmosférica. Para describir un gas se tiene cuatro variables: 1.1 Moles (n) Mol es una constante denominada número de Avogadro y corresponde al número de átomos que hay exactamente en 12 gramos de C-12. Sirve para contar, es decir, cuando se habla de 1mol se habla de: Mol = masa (gramos) PM (gramos/mol) 1.2 Volumen (V) = litros El volumen es el espacio que ocupa un sistema. Los gases ocupan todo el volumen disponible del recipiente en el que se encuentran. Si el volumen de un recipiente que contiene un gas cambia, cambia también el volumen del gas. Esta es una propiedad ligada a la presión y la temperatura. 1.3 Presión (P) atmósferas = 16 La presión atmosférica es el peso o fuerza que ejerce el aire sobre la superficie de la tierra. E. Torricelli inventó el barómetro de Mercurio y demostró que la presión atmosférica a nivel del mar es capaz de sostener una columna de mercurio de 760 mmHg que corresponde a la presión de la atmósfera, es decir la atmósfera standard (at.). 1.4 Temperatura, (T°) La temperatura en Kelvin, se refiere a una escala que define el Cero absoluto como la temperatura a la que cesaría el movimiento traslacional de las partículas. Se utiliza en ecuaciones de gases y se puede relacionar fácilmente con los grados Celsius y los grados Fahrenheit . T (K) = T ºC + 273,16 T (ºF)= 9/5 ºC + 32 TEORÍA CINÉTICA MOLECULAR DE LA MATERIA a. Un gas está compuesto de moléculas que están separadas por distancias mucho mayores que sus propias dimensiones. Las moléculas se consideran puntos, es decir, tienen masa pero su volumen es despreciable. b. Los gases están en continuo movimiento con dirección aleatoria y es frecuente que ocurran choques entre ellas. Estas colisiones son perfectamente elásticas pudiendo haber transferencia de energía entre moléculas pero permaneciendo inalterada la energía total del sistema. c. Las moléculas de los gases no ejercen entre sí fuerzas de atracción o de repulsión. d. La energía cinética promedio de las moléculas es proporcional a la temperatura absoluta del gas. 17 e. Debido a que las moléculas en estado gaseoso están muy separadas ocupando un gran volumen, son fáciles de comprimir para ocupar un volumen menor. f. Los gases pueden difundir, es decir, tienen la propiedad de mezclarse gradualmente con otro gas, debido al movimiento aleatorio de las moléculas. En la figura se observa como un gas difunde lentamente dentro de un compartimiento donde solo hay aire, hasta mezclarse completamente. Leyes de los Gases 2.1 Ley de velocidad de difusión velocidad de difusión del gas A = velocidad de difusión del gas B PM B PM A Las velocidades de difusión o efusión de dos gases distintos son inversamente proporcionales a las raíces cuadradas de sus masas molares, es decir, a mayor masa molar de un gas indica que es más lento en difundir. La difusión de los gases tiene muchas aplicaciones prácticas. El gas natural y el gas licuado (butano), son inodoros, y para comercializarlo se le añaden pequeñas cantidades de Metilmercaptano (CH3SH), el cual tiene un olor desagradable y muy fuerte. Cuando hay una fuga, puede significar un serio peligro de explosión, en un escape de gas podemos, percibir este oloroso compuesto. DIFUSIÓN: es la dispersión gradual de un gas el seno de otro. De este modo las moléculas una sustancia se esparcen por la región ocupada por otras moléculas, colisionando y moviéndose aleatoriamente. Este es un proceso muy rápido y también puede haber difusión en el vacío. en de Efusión: es el proceso que ocurre cuando un gas que está sometido a presión escapa de un recipiente hacia el exterior por medio de un pequeño orificio o de una membrana porosa 18 2.2 LEY DE LOS GASES IDEALES A partir de los postulados de la teoría cinética molecular de la materia y de la combinación de las leyes descritas anteriormente se puede escribir una ecuación maestra para el comportamiento de los gases: Donde: P = Presión (at.) V = Volumen (L) n = numero de moles R = constante de los gases, 0.0821 at. L / K mol T = Temperatura (K) 2.3 Ley de Boyle Boyle descubrió que “La presión de una cantidad fija de gas es inversamente proporcional al volumen que ocupa, siempre y cuando se mantenga la temperatura constante” lo que se expresa por la ecuación: P x V = constante y a esta relación se le denomina “ley de Boyle” Pudiendo establecerse la siguiente relación para distintos gases: P1 x V1 = P2 x V2 En el cuadro se ve claramente la dependencia inversa del volumen con la presión a temperatura constante. A medida que la presión aumenta, el volumen disminuye. 2.4 Ley de Charles - Gay-Lussac Ellos contribuyeron al estudio de los gases diciendo que “el volumen de una cantidad fija de gas, mantenida a presión constante, es directamente proporcional a la temperatura absoluta del gas”. Esto se expresa por medio de la siguiente ecuación: Pudiendo establecerse la siguiente relación para distintos gases: La figura muestra el proceso en que un aumento de temperatura, a presión constante, lleva a un aumento del volumen. Esto ocurre porque el aumento en la temperatura hace que las moléculas experimentan una mayor energía cinética (velocidad) generando así el aumento de volumen. 19 2.5 Ley de Gay – Lussac Gay – Lussac logró establecer la relación entre la presión de un gas y su temperatura concluyendo que “si un gas se somete a calentamiento a volumen constante, la presión del gas aumenta proporcionalmente a la temperatura. Esto se expresa de la siguiente manera: P1 = P2 Pudiendo establecerse la siguiente relación para distintos gases: T1 T2 Basándose en las tres leyes anteriormente descritas se puede establecer la ley combinada de los gases P1 x V1 = P2 x V2 Se expresa de la siguiente manera: T1 T2 20 2.6 LEY DE LAS PRESIONES PARCIALES DE DALTON Dalton dedujo que los gases es una mezcla actúan de manera mutuamente independiente. La presión que ejerce un componente determinado de la P a = na . R. T mezcla de gases, se llama presión parcial del componente. V Las presiones parciales se calculan aplicando la ley de los gases ideales a cada componente. Así la presión parcial, Pa, para una componente consistente en na moles está dada por: La presión total de una mezcla de gases es igual a la P T = P a + P b + P c + … suma de las presiones parciales de los gases individuales. Por ejemplo, para la reacción dada: N2 + 3 H2 2 NH3 Si se colocan tres gases en un recipiente de determinado volumen, V, se puede considerar que cada uno de los gases ocupa todo el volumen. Si temperatura del recipiente es constante, T, cada uno de los gases tendrá esta temperatura. La contribución a la presión de cada componente está directamente relacionada con el número de moles del componente y con la razón a la que las partículas chocan con las paredes del recipiente. Dado que cada componente tiene el mismo volumen y temperatura, las diferencias entre las presiones que ejercen se deberán a los distintos números de moles. La presión total es igual a la suma de las presiones parciales individuales de los gases que forman la mezcla: La presión parcial de un determinado gas es Px = PT * Xgas Fracción molar = Xgas = molesA / molesA+ moles B+ moles C+ … LICUACIÓN DE LOS GASES El paso por el cual un gas se convierte a líquido por efecto de la temperatura se llama condensación (Licuación de vapores). 21 Se denomina temperatura crítica a la temperatura límite para la licuación de un gas. Por encima de esta temperatura es imposible licuar a un gas, aunque se le someta a enormes presiones. Se llama presión crítica, a la presión que se necesita para licuar un gas cuando éste se encuentra en su temperatura crítica. SUSTANCIAS T° crítica Presión crítica Agua, H2O 356 °C -Anhídrido Sulfuroso, SO2 175 °C 78 at. Amoníaco, NH3 132 °C 112 at. Anhídrido carbónico, CO2 31 °C 73 at. Oxígeno, O2 -119 °C 50 at. Nitrógeno, N2 -147 °C 34 at. Éter, R-O-R -194 °C -Hidrógeno, H2 -240 °C 13 at. Helio, He -269 °C 23 at. Procedimientos para la licuación de los gases 1. Por simple enfriamiento Ejemplo a la presión ordinaria el anhídrido sulfuroso se licua a - 10°C. 2. Por comprensión y enfriamiento Consiste en calentar una sustancia que desprende el gas, el cual aumenta su presión por no poder expandirse en el interior del tubo cerrado, porque una de sus ramas está introducida en el hielo. Con el aumento de presión y una temperatura de 0°C el gas se licua, es decir, “para licuar un gas primero hay que comprimirlo y luego enfriarlo o viceversa”. 22