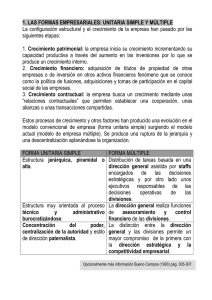
SUSTANCIAS MIMETICAS DE LA VITAMINA D3.(ES2207273)
Anuncio

19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS 11 Número de publicación: 2 207 273 51 Int. Cl. : C07C 49/255, C07C 43/23 7 C07D 303/22, A61K 31/12 A61K 31/085, A61K 31/09 A61K 31/336 ESPAÑA 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99941140 .8 86 Fecha de presentación: 12.08.1999 87 Número de publicación de la solicitud: 1107940 87 Fecha de publicación de la solicitud: 20.06.2001 54 Título: Sustancias miméticas de la vitamina D3. 30 Prioridad: 24.08.1998 US 139040 73 Titular/es: LIGAND PHARMACEUTICALS INCORPORATED 10275 Science Center Drive San Diego, California 92121, US 45 Fecha de publicación de la mención BOPI: 16.05.2004 72 Inventor/es: Allegretto, Elizabeth, A.; Boehm, Marcus, F. y Nadzan, Alex, M. 45 Fecha de la publicación del folleto de la patente: 74 Agente: Elzaburu Márquez, Alberto ES 2 207 273 T3 16.05.2004 Aviso: En el plazo de nueve meses a contar desde la fecha de publicación en el Boletín europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art. 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascículos: Oficina Española de Patentes y Marcas. C/Panamá, 1 – 28036 Madrid ES 2 207 273 T3 DESCRIPCIÓN Sustancias miméticas de la vitamina D3. 5 10 En un aspecto, la presente invención se refiere a la síntesis de compuestos no secoesteroideos que tienen actividad moduladora del receptor de la vitamina D3 (VDR). En otro aspecto, la invención se refiere a compuestos no secoesteroideos, sus sales farmacológicamente aceptables, y sus composiciones farmacológicamente aceptables, que presentan actividad moduladora de VDR en mamíferos in vivo e in vitro. En otro aspecto adicional, la invención se refiere a métodos para tratar y evitar procesos patológicos en mamíferos con características reguladoras del calcio anormales, de sensibilidad inmunitaria anormal, hiperproliferativas y/o neurodegenerativas. Antecedentes y técnica anterior 15 20 25 30 35 40 La forma activa de la vitamina D3 , 1,25-dihidroxivitamina D3 [1,25(OH)2 D3 ], es un secoesteroide largo reconocido como el principal regulador de la homeostasis del calcio y del desarrollo y remodelación óseos (M.R. Haussler et al. N. Engl. J. Med. 1977, 297, 974-983; H.F. DeLuca FASEB J. 1988, 2, 224-236). El trabajo comenzado a principios de los 80 descubrió que la 1,25(OH)2 D3 es un diferenciador potente de las células leucémicas (E. Abe et al. Proc. Natl. Acad. Sci. 1981, 76, 4990-4994; S. Dokoh et al. Cancer Res. 1984, 44, 2103-2109; D.J. Mangelsdorf et al. J. Cell. Biol. 1984, 98, 391-398), así como un inhibidor del crecimiento para células o cánceres como los de próstata, mama y colon (K. Colston et al. Endocrinology 1981, 108, 1083-1086; D. Bar-Shavitz et al. Proc. Natl. Acad. Sci. 1983, 80, 5907-5911; R. J. Skowronski et al. Endocrinology 1993, 132, 1952-1960). Los efectos inmunosupresores de la 1,25 (OH)2 D3 se han observado in vitro (D.D. Tsoukas et al. Science 1984, 224, 1438-1440; S.C. Manolagas et al. Mol. Cell. Endocrinol. 1985, 43, 113-122), y en modelos animales de lupus, diabetes, esclerosis múltiple y artritis reumatoide (C. Mathieu et al. Endocrinology 1995, 136, 866-872; J.M. Lemire et al. Autoimmunity 1992, 12, 143148; M.T. Cantora et al. Proc. Natl. Acad. Sci. 1996, 93, 7861-7864; M.T. Cantora et al. J. Nutrition 1998, 128, 6872). Se postula la hipótesis de que los niveles decrecientes de factor de crecimiento nervioso (NGF) en edad avanzada tienen un papel en la neurodegeneración y la enfermedad de Alzheimer. El VDR se localiza en las áreas del cerebro en las que se produce el NGF y en las que se piensa que se produce la neurodegeneración (hipocampo y cerebro anterior basal). La 1,25(OH)2 D3 induce NGF in vitro en cultivo celular (M.S. Saporito et al. Brain Res. 1994, 633, 189-196; I. Neveu et al. Brain Res. Mol. Brain Res. 1994, 24, 70-76) e in vivo en el hipocampo y el córtex de rata (Saporito et al. 1994; M.S. Saporito et al. Exp. Neurol. 1993, 123, 295-302). Adicionalmente, se ha descrito que un análogo de la 1,25 (OH)2 D3 es eficaz en un modelo de roedor de la enfermedad de Alzheimer (S. Carswell, resumen, IBC Conference, “The Potential of Vitamin D Analogs for the Treatment of Alzheimer’s Disease”, Philadelphia, PA, 1997). La 1,25(OH)2 D3 se une a su receptor intracelular, el VDR, con elevada afinidad y especificidad, produciendo una activación transcripcional de los genes diana de la vitamina D, como los de las proteínas óseas osteocalcina y osteopontina. El complejo 1,25(OH)2 D3 -VDR regula también una enzima metabólica clave de 25(OH)2 D3 y 1,25(OH)2 D3 , la 25-hidroxivitamina D3 -24-hidroxilasa. La activación en estos casos se produce a través de un receptor que se une a regiones reguladoras discretas dentro de los promotores de estos genes. Se ha demostrado que el VDR forma un heterodímero con el receptor del retinoide X (RXR); este heterodímero se une con afinidad elevada a elementos sensibles a vitamina D (VDRE’s) en las regiones reguladoras de los genes diana (M.R. Haussler , Ann. Rev. Nutr. 1986, 6, 527-562; K. Ozono J. Bone Min. Res. 1991, 6, 1021-1027). 45 50 Debido a que los estudios in vitro (G. Zugmaier et al. Br. J. Cancer 1996, 73, 1341-1346; Y. Higashimoto et al. Anticancer Res. 1996, 16, 2653-2660; S.E. Blutt et al. Endocrinology 1997, 138, 1491-1497) y en modelos animales (Y. Honma et al. Cell Biol. 1983, 80, 201-204; G.K. Potter et al. Exp. Hematol. 1985, 13, 722- 732; K.W. Colston et al. Biochem. Pharmacol. 1992, 44, 693-702; J.A. Eisman et al. Cancer Res.1987, 47, 21-25, A. Belleli et al. Carcinogenesis 1992, 13, 2293- 2298), muestran que la 1,25(OH)2 D3 es un agente efectivo para inhibir el crecimiento e inducir la diferenciación de diversos tipos de cáncer, este compuesto es un fármaco potencial para el tratamiento de estas enfermedades en seres humanos. Los análogos de la 1,25(OH)2 D3 también han mostrado efectividad en modelos animales de hipercalcemia humoral de malignidades (HHM) (M. Haq et al. J. Clin. Invest. 1993, 91, 2416-2422; K. Endo et al. J. Biol. Chem. 1994, 269, 32693-32699). 55 60 65 Se ha demostrado la eficacia de la 1,25(OH)2 D3 en el tratamiento de trastornos dermatológicos. Los análogos de la 1,25(OH)2 D3 son tratamientos efectivos para la psoriasis, un trastorno con componentes hiperproliferativos y autoinmunitarios (E.L. Smith et al. J. Amer. Acad. Dermatol. 1988, 19, 516-528) y pueden ser efectivo también en el tratamiento de otros trastornos cutáneos, incluyendo el acné y las arrugas (E.T. Binderup et al. patente de EE.UU. 5.190.935). Se ha demostrado también la eficacia de la 1,25(OH)2 D3 en la prevención de la pérdida del cabello inducida por quimioterapia (alopecia) (J.J. Jimenez et al. Cancer Res. 1992, 52, 5123; J.J. Jimenez et al. Clin. Res. 1994, 42, 128A; J.J. Jimenez et al. Am. J. Med. Sci. 1995, 310, 43). Las actividades conocidas de la vitamina D3 no están limitadas al tratamiento y curación de procesos patológicos, sino que incluyen también la quimioprevención: el uso profiláctico para la prevención de dichos procesos patológicos (cáncer de próstata: M.S. Lucia Cancer Res. 1995, 55, 5621-5627. Cáncer de mama: M.A. Anzano et al. Cancer Res. 1994, 54, 1653-1656. Modelos de enfermedad autoinmunitaria: Mathieu et al. 1995; Lemire et al. 1992). 2 ES 2 207 273 T3 5 10 15 20 25 Actualmente, la 1,25(OH)2 D3 , como Rocaltrol® (Hoffmann-La Roche), se administra a pacientes con insuficiencia renal, sometidos a diálisis renal crónica para tratar la hipocalcemia y la enfermedad ósea metabólica resultante. Aunque muchos pacientes no experimentan ningún efecto secundario provocado por este tratamiento, su utilidad es limitada, debido a que la función de movilización del calcio normal de la 1,25(OH)2 D3 se incrementa con la dosis, produciendo hipercalcemia (calcio sérico elevado) en animales y seres humanos. Este único efecto secundario conocido para la 1,25(OH)2 D3 puede producir calcificación del tejido blando que puede ser peligrosa para la vida. Recientemente, modificaciones químicas de la 1,25(OH)2 D3 han producido análogos con efectos de movilización del calcio atenuados (R. Bouillon et al. Endocrine Rev. 1995, 16, 200-257). Uno de tales análogos, MC903 o Dovonex® (Bristol-Myers Squibb), se usa actualmente en Europa y los Estados Unidos como tratamiento tópico para la psoriasis leve a moderada (K. Kragballe et al. Br. J. Dermatol. 1988, 119, 223-230). El potencial terapéutico de la 1,25(OH)2 D3 ha estimulado el desarrollo de análogos secoesteroideos de la 1,25(OH)2 D3 con efectos calcémicos reducidos y que mantengan las propiedades deseables y, de hecho, todos los compuestos que se sabía previamente que activaban el VDR son análogos secoesteroideos de la 1,25(OH)2 D3 original. Aunque se ha logrado algún grado de separación entre los efectos beneficiosos y de incremento del calcio (calcémicos) en estos análogos, hasta la fecha la separación ha sido insuficiente para permitir la administración oral para tratar enfermedades como cánceres, leucemias y psoriasis grave. Por tanto, el desarrollo de compuestos en los que la actividad moduladora del VDR esté totalmente separada de la actividad de movilización del calcio, puede conducir a tratamientos efectivos para procesos patológicos sensibles a la vitamina D3 y sus análogos, incluyendo aquellas con características reguladoras del calcio anormales, sensibilidad inmunitaria anormal, hiperproliferativas y/o neurodegenerativas, como leucemia, cánceres, psoriasis, osteodistrofia renal, insuficiencia renal, osteoporosis, hipercalcemia humoral de malignidades, acné, alopecia, rechazo del injerto contra el hospedador, lupus, esclerosis múltiple, diabetes inducida autoinmunitaria, escleroderma, artritis reumatoide, acné, arrugas, secreción de sebo insuficiente, hidratación dérmica insuficiente, firmeza dérmica insuficiente y enfermedad de Alzheimer. Bisfenoles 30 35 40 45 50 55 60 65 Los bisfenoles son una familia muy conocida de compuestos formados por dos unidades de fenol, cuyas posiciones para- están unidas geminalmente a un grupo de puente, como un alquilideno, cicloalquilideno, átomo de azufre, etc. Estos bisfenoles y sus derivados se usan normalmente en polímeros y como plastificantes. Se han seleccionado el bisfenol-C y algunos derivados para actividad antimicrobiana y antifúngica; los compuestos nitrados en el anillo tenían las mayores actividades antifúngicas (H.H. Garchar et al. Asian J. Chem. 1993, 5, 340-347). También se han estudiado las actividades antibacterianas, antifúngicas e hipotensoras de algunos derivados de bisfenol sustituidos por propanolamina (H.H. Garchar et al. Indian J. Pharm. Sci. 1993, 55, 141-144). Ninguna referencia describe ninguna actividad de VDR. Los derivados de bisfenoles son muy conocidos en la técnica de los polímeros. Se han estudiados particularmente bien los éteres de bisglicidilo de bisfenoles, como precursores poliméricos, según se describe en las patentes de EE.UU. 3.298.998 y 3.410.825, y en la patente checoslovaca CS 145895 para la producción de resinas epoxídicas y de poliéter. La patente de EE.UU. 5.128.491, describe un método para la preparación de éteres de bisglicidilo de bisfenoles sustituidos, con gran contenido de monómeros. Se han descrito las síntesis y reactividades de varios bisglicidil-bisfenol-éteres para el curado rápido de resinas epoxídicas (A.L. Cupples et al. Epoxy Resins, Advances in Chemistry Series, 92, capítulo 15, American Chemical Society: Washington DC, 1970, págs. 173-207). Se ha descrito la efectividad de una serie de compuestos, incluyendo el éter de bisglicidilo de 4,4’-isopropilidendi(2-metilfenil), como estabilizadores para PVC irradiado con radiación γ, en una serie de artículos (I. Lerke et al. J. Appl. Polym. Sci. 1977, 21(8), 2067-2075 ; I. Lerke et al. J. Appl. Polym. Sci. 1983, 28(2), 501-511; I. Lerke et al. J. Appl. Polym. Sci. 1983, 28(2), 513-518). Se ha realizado un estudio del potencial sensibilizador de varios bisglicidil-bisfenol-éteres (S. Fregert et al. Contact Dermatitis 1984, 10(1), 47-48). Ninguna de estas referencias describe ninguna actividad VDR. La patente de EE.UU. 4.093.555 y la patente de GB 1.489.659 describen derivados bisaziridinilo de bisfenoles bromados, que son útiles en la producción de modelos dentales y piezas de sustitución de dientes. La patente de EE.UU. 5.334.772, describe éteres alquenílicos de bisfenoles susceptibles de polimerización catiónica. Estas patentes de bisfenol no describen ninguna actividad VDR. Los investigadores rusos han sido también muy activos en las síntesis de derivados de bisfenol como precursores poliméricos. Los derivados puenteados de norbornilideno se han convertido en sus éteres de bisglicidilo (N.S. Dokhturishvili Chem. Abstracts 1977, 87:136680a) y bis(2-hidroxietil)-éteres (G. Sh. Papava Chem. Abstracts 1986, 104:6199j). Los éteres de bisglicidilo de una serie de bisfenoles se utilizaron como precursores de resinas epoxídicas (M.F. Sorokin et al. Chem. Abstracts 1985, 102:63647m). Los bis(2-hidroxietil)-éteres de bisfenoles sustituidos por adamantilideno puenteado se sintetizaron como plastificantes potenciales (Z.L. Zarkua et al. Chem. Abstracts 1986, 105:225929w). Se han descrito di(carboximetil)-éteres de bisfenoles sustituidos (G.S. Kazakova et al. Chem. Abstracts 1984, 101:191261x). Ninguna de estas referencias describe ninguna actividad VDR. 3 ES 2 207 273 T3 Todas las patentes y publicaciones citadas se incorporan expresamente mediante referencia, como si dichas patentes y publicaciones se reprodujesen aquí en su totalidad, hasta el punto necesario para comprender o completar la descripción de la presente invención. 5 10 15 Breve descripción de los dibujos Las figuras 1A y 1B representan la eficacia in vivo del compuesto 4 en la inhibición del crecimiento del tumor LNCaP en ratones inmunosuprimidos sin hipercalcemia. La fig. 1A muestra que los tumores (formados en ratones inmunosuprimidos mediante inyección de células LNCaP, vide infra) eran menores a los 10 y 15 días tras la dosificación con el compuesto 4, comparados con ratones que recibían un vehículo. B: la Fig. 1B muestra que los ratones tratados con el compuesto 4 tenían niveles normales de calcio sérico, medidos mediante colorimetría (Sigma Kit) en los días 10 y 15 tras la dosificación. La Figura 2 es un esquema general para la síntesis de compuestos éter y tioéter de fórmula I y II. En esta figura, (i) e (ii) se definen como sigue: (i) sustitución aromática catalizada por ácido; (ii) alquilación. La Figura 3 es un esquema general para la síntesis de compuestos amina de fórmula I y II. En esta figura, (i) y (ii) se definen como sigue: (i) oxidación y cuaternización de la posición doblemente bencílica; (ii) alquilación. 20 Sumario de la invención La presente invención se refiere a compuestos no secoesteroideos que se unen a VDR y lo activan, preferiblemente sin efectos calcémicos significativos relativos a la 1,25(OH)2 D3 . 25 En el curso de su investigación, los inventores han descubierto también compuestos no secoesteroideos desconocidos hasta el momento, que se unen al VDR y modulan su actividad. Por tanto, la presente invención proporciona un compuesto de fórmula II: 30 35 40 en la que: X e Y se seleccionan cada uno independientemente del grupo formado por O, S y NR7 ; 45 Z se selecciona del grupo formado por C=O, CH(OR8 ) y CH(NR9 R10 ); R1 y R2 se seleccionan independientemente del grupo formado por grupos alquilo, alilo, bencilo, 7-norbornilo y 3pirrolidinilo, opcionalmente fluorados; o R1 y R2 forman conjuntamente un cicloalquilideno que tiene de 3 a 8 átomos de carbono, opcionalmente fluorado; 50 55 60 65 R3 y R4 se seleccionan independientemente del grupo formado por halógeno; n-alquilo de C1 a C10 , opcionalmente fluorado; y alcoxi de C1 a C10 , opcionalmente fluorado; R5 se selecciona del grupo formado por H, grupos alquilo opcionalmente sustituidos; grupos alquenilo opcionalmente sustituidos; grupos alquinilo opcionalmente sustituidos; grupos arilo opcionalmente sustituidos; OR11 ; NR12 R13 ; y grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo, opcionalmente sustituidos; o junto con R8 , R9 o R10 , forma un grupo cíclico de 3 a 12 miembros, en el que dicho grupo cíclico se selecciona del grupo formado por amidinas, aminas, éteres, lactamas, lactonas, cetales, hemicetales, aminales, hemiaminales, carbonatos, carbamatos, ureas y sus combinaciones; R6 se selecciona del grupo formado por H y grupos alquilo, alilo, bencilo, 7-norbornilo y 3-pirrolidinilo, opcionalmente sustituido; R7 se selecciona del grupo formado por H y grupos alquilo, alilo, bencilo, 7-norbornilo y 3-pirrolidinilo, opcionalmente sustituidos; 4 ES 2 207 273 T3 R8 se selecciona del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupo arilo opcionalmente sustituido, grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo opcionalmente sustituidos y grupos acilo opcionalmente sustituidos; 5 R9 y R10 se seleccionan independientemente del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupo arilo opcionalmente sustituidos, grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo opcionalmente sustituidos y grupos acilo opcionalmente sustituidos; 10 R11 se selecciona del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupo arilo opcionalmente sustituidos, grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo opcionalmente sustituidos y grupos acilo opcionalmente sustituidos; y 15 R12 y R13 se seleccionan independientemente del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupos arilo opcionalmente sustituidos, grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo opcionalmente sustituidos y grupos acilo opcionalmente sustituidos; y sus sales farmacéuticamente aceptables; con las condiciones de que: 20 a. cuando X e Y son ambos O, Z es C=O, y R5 se selecciona del grupo formado por OH y alcoxi C1 -C4 , entonces r6 no es carboximetilo ni sus ésteres C1 -C4 alquílicos ; 25 b. cuando X e Y son ambos O, y Z se selecciona del grupo formado por CH(OR8 ) y CH(NR9 R10 ), entonces R5 no es H ni alquilo primario; c. cuando X e Y son ambos O, y Z es CH(OR8 ), entonces R6 y R8 no comprenden ambos aziridinas. 30 d. cuando X e Y son ambos O, y Z es CH(OR8 ), entonces R5 , R6 y R8 no comprenden simultáneamente éteres alquenílicos; y e. cuando X e Y son ambos O, y Z es CH(OR8 ), entonces R5 y R6 no comprenden ambos éteres glicidílicos. La invención proporciona también el uso de un compuesto de fórmula I: 35 40 45 en la que: 50 55 60 65 X, Y, Z y R1 a R13 se definen como anteriormente, pero sin las limitaciones de las condiciones; o de una de sus sales farmacéuticamente aceptables, en la fabricación de un medicamento para el tratamiento o profilaxis de procesos patológicos con características reguladoras de calcio anormales, de sensibilidad inmunitaria anormal, hiperproliferativas y/o neurodegenerativas, en mamíferos. Se pueden producir composiciones farmacéuticas que contengan cantidades farmacéuticamente efectivas de compuestos de fórmulas I o II o sus sales farmacéuticamente aceptables, bien solos o en combinación, junto con vehículos farmacéuticamente aceptables y/o aditivos. La preparación de tales composiciones para uso tópico, parenteral y oral, así como para administración en forma de dosis unitaria, es muy conocida en el estado de la técnica farmacéutica. Estas composiciones se pueden usar para tratar procesos patológicos de mamíferos. Los inventores han descubierto que los compuestos de fórmulas I y II, presentan los efectos antiproliferativos y de diferenciación celular deseables de la forma activa de la vitamina D3 , 1,25-dihidroxivitamina D3 [1,25(OH)2 D3 ], con efectos de movilización de calcio (calcémicos) reducidos. Por tanto, estas composiciones se pueden usar en el tratamiento y prevención (quimioprevención o profilaxis) de procesos patológicos caracterizadas por regulación de calcio, proliferación celular o respuesta inmunitaria anormales, dermopatías y/o enfermedades neurodegenerativas. 5 ES 2 207 273 T3 Definiciones De acuerdo con la presente invención y según se usan aquí, se atribuye a los siguientes términos los siguientes significados, a menos que se indique explícitamente otra cosa: 5 El término “acilo” se refiere a radicales orgánicos -C(O)R, en los que R es H, un grupo alifático o aromático; el grupo unido puede estar opcionalmente sustituido. Ejemplos de grupos acilo incluyen grupos acetilo y benzoílo. Los grupos acilo adecuados tienen de 1 a aproximadamente 20 átomos de carbono. 10 El término “alquenilo” se refiere a grupos alifáticos en los que el punto de unión es una unión doble carbono-carbono, por ejemplo vinilo, 1-propenilo y 1-ciclohexenilo. Los grupos alquenilo pueden ser de cadena lineal, ramificada, cíclica o sus combinaciones, y pueden estar opcionalmente sustituidos. Los grupos alquenilo adecuados tienen de 2 a 20 átomos de carbono. 15 Los términos “alcoxi” y “alcóxido” se refieren a -OR, en el que R es un grupo alifático o aromático que puede estar opcionalmente sustituido. Ejemplos de grupos alcoxi son metoxi, etoxi y fenoxi. 20 El término “alquilo” se refiere a grupos alifáticos saturados que incluyen grupos de cadena lineal, ramificada, cíclica y sus combinaciones. Los grupos alquilo se pueden dividir además en grupos alquilo “primarios”, “secundarios” y “terciarios”. En los grupos alquilo primarios, el átomo de carbono de unión está sustituido por cero (metilo) o un radical orgánico. En los grupos alquilo secundarios, el átomo de carbono de unión está sustituido por dos radicales orgánicos. En los grupos alquilo terciarios, el átomo de carbono de unión está sustituido por tres radicales orgánicos. Ejemplos de grupos alquilo incluyen metilo, etilo y ciclohexilo. Los grupos alquilo adecuados tienen de 1 a aproximadamente 20 átomos de carbono; y pueden estar opcionalmente sustituidos. 25 El término “alquilideno” se refiere a dirradicales alquilo geminales como metileno, 2-propilideno y ciclohexilideno. 30 35 40 45 50 55 60 El término “alquinilo” se refiere a grupos alifáticos que tienen una unión triple carbono-carbono unida en el punto de unión; por ejemplo etinilo. Los grupos alquinilo pueden comprender porciones de cadena lineal, cadena ramificada y/o cíclica, y pueden estar opcionalmente sustituidos. Los grupos alquinilo adecuados tienen de 2 a 20 átomos de carbono. El término “alifático” se refiere a compuestos orgánicos y radicales que pueden ser de cadena lineal, ramificada, cíclica no aromática y sus combinaciones. Los grupos alifáticos incluyen grupos alquilo, alquenilo y alquinilo, así como sus variantes cíclicas, y pueden estar opcionalmente sustituidos. El término “amida” se refiere a derivados de ácidos en los que uno o más grupos hidroxilo están reemplazados por grupos amino. Los grupos amino están sustituidos opcionalmente pro uno o más radicales orgánicos que pueden ser alifáticos o aromáticos. Las amidas pueden ser cíclicas. El término “carboxamida” se refiere a una amida de un ácido carboxílico. El término “aminocarbonilo” se refiere a radicales carboxamida en los que el punto de unión es el carbono del carbonilo. El término “acilamido” se refiere a radicales carboxamida en los que el punto de unión es el átomo de nitrógeno. El término “amidina” se refiere a amidas de ácidos imídicos. El término “amidinilo” se refiere a radicales amidina, en los que el punto de unión es el átomo de carbono requerido. El término “aminal” se refiere a derivados de aldehídos o cetonas, en los que el oxígeno del carbonilo se reemplaza por dos grupos amino. Los aminales pueden ser cíclicos. El término “amina” se refiere a compuestos neutros de nitrógeno trivalente que comprenden sustituyentes seleccionados independientemente de H y radicales orgánicos, con la condición de que ninguno de los radicales orgánicos sean grupos acilo. El término “amino” se refiere a radicales nitrógeno derivados de aminas. Las aminas pueden ser cíclicas y las aminas cíclicas pueden ser aromáticas. Ejemplos de aminas son trietilamina, morfolina, anilina, purina y piridina. Los términos “arilo” y “aromático” se refieren a compuestos carbocíclicos y heterocíclicos y radicales con sistemas pi- conjugados. Cada núcleo aromático comprende típicamente un anillo de 5 a 7 miembros sobre el cual se pueden fusionar núcleos aromáticos adicionales. Los grupos arilo pueden estar opcionalmente sustituidos. Ejemplos de grupos arilo incluídos son tales como fenilo, naftilo, furanilo, imidazolilo y quinolinilo. Los grupos arilo adecuados tienen de 5 a aproximadamente 20 carbonos y heteroátomos en total. El término “aziridina” se refiere a monoaminas cíclicas, de tres miembros, saturadas. El término “carbamato” se refiere a ésteres del ácido carbámico, en los que el nitrógeno de la amida puede estar también sustituido. Los carbamatos pueden ser cíclicos. Un ejemplo de un carbamato es el carbamato de etilo. 65 El término “carbocíclico” se refiere a compuestos y radicales mono- y policíclicos, en los que los átomos del anillo son átomos de carbono. Los compuestos carbocíclicos pueden ser alifáticos, aromáticos o sus combinaciones. Ejemplos de grupos carbocíclicos son fenantrilo, fenilo, ciclooctilo, norbornadienilo, acenaftilo y adamantilo. 6 ES 2 207 273 T3 El término “carbonato” se refiere a diésteres del ácido carbónico. Los carbonatos pueden ser cíclicos. Ejemplos de carbonatos incluyen dietil-carbonato y propilen-carbonato. 5 Los términos “quimioprevención” y “quimiopreventivo” se refieren al uso profiláctico de un agente para evitar procesos patológicos y a dicho agente, respectivamente. El término “cicloalquilideno” se refiere a dirradicales alquílicos cíclicos geminales, como ciclopropilideno, ciclopentilideno, ciclohexilideno y cicloheptilideno, que pueden estar sustituidos adicionalmente por alquilo. 10 El término “DMF” se refiere a N,N-dimetilformamida. Los términos “epóxido” y “epoxi” se refieren a monoéteres cíclicos saturados, de tres miembros. 20 El término “éster” se refiere a compuestos en los que un grupo hidroxi de un ácido está reemplazado por un grupo alcóxido. Por ejemplo, un éster carboxílico es aquel en el que el grupo hidroxi de un ácido carboxílico está reemplazado por un alcóxido. Los ésteres pueden derivar de cualquier ácido que comprenda uno o más grupos hidroxi: por ejemplo, ácido carbónico, ácidos carbámicos, ácidos fosfónicos, ácidos sulfónicos y ácidos borónicos. Los términos “alcoxicarbonilo” y “carboalcoxi” se refieren a radicales de éster carboxílico, en los que el punto de unión es el carbono del carbonilo. El término “aciloxi” se refiere a radicales de éster carboxílico, en los que el punto de unión es el átomo de oxígeno no carbonílico. 25 El término “éter” se refiere a compuestos en los que un átomo de oxígeno está unido a dos radicales orgánicos, con la condición de que ningún radical orgánico sea un grupo acilo. El término “oxa” se refiere también a éteres e indica que el átomo de carbono indicado está reemplazado por un átomo de oxígeno. Los éteres pueden ser cíclicos. Ejemplos de éteres incluyen éter dietílico, morfolina, tetrahidrofurano, y óxido de etileno. 15 El término “glicidilo” se refiere al grupo 2,3-epoxipropilo. Los términos “halógeno” y “halo” se refieren a flúor, cloro, bromo y yodo. 30 El término “hemiaminal” se refiere a derivados de aldehídos o cetonas, en los que el oxígeno del carbonilo está reemplazado por un grupo amino y un grupo hidroxi. Los hemiaminales pueden ser cíclicos. 35 El término “hemicetal” se refiere a derivados de cetonas, en los que el oxígeno del carbonilo está reemplazado por un alcóxido y un hidróxido. Los hemicetales pueden ser cíclicos. El término se usa de forma intercambiable con “hemiacetal”, que es el derivado correspondiente de un aldehído. 40 El término “heterocíclico” se refiere a compuestos y radicales mono- y policíclicos, en los que el anillo o anillos comprenden uno o más heteroátomos. Heteroátomos adecuados incluyen oxígeno, nitrógeno, azufre, fósforo y boro. Los radicales heterocíclicos pueden estar unidos a un átomo de carbono o un heteroátomo. Los grupos heterocíclicos pueden ser alifáticos, aromáticos o sus combinaciones. Ejemplos de grupos heterocíclicos son furanilo, epoxi, tiazolilo, pirimidilo, imidazolilo, quinolinilo, indolinilo, quinuclidinilo y morfolinilo. 45 El término “cetal” se refiere a derivados de cetonas, en los que el oxígeno del carbonilo está reemplazado por dos grupos alcóxido. Los cetales pueden ser cíclicos. El término se usa de forma intercambiable con “acetal”, que es el derivado correspondiente de un aldehído. El término “lactama” se refiere a carboxamidas cíclicas, en las que el anillo comprende tanto los átomos de carbono como de nitrógeno de la carboxamida. 50 El término “lactona” se refiere a ésteres carboxílicos cíclicos, en los que el anillo comprende tanto el carbono del carbonilo como el átomo de oxígeno no carbonílico. 55 El término “inferior”, cuando modifica a radicales orgánicos, se refiere a aquellos radicales orgánicos que tienen hasta 10 átomos de carbono, incluídos, preferiblemente hasta seis, incluidos, y ventajosamente desde uno hasta cuatro átomos de carbono. 60 Los términos “opcionalmente sustituido” y “sustituido” indican que el grupo en cuestión está sustituido por entre uno y aproximadamente cuatro sustituyentes orgánicos convencionales seleccionados independientemente, como acilo, aciloxi, alquenilo, alcoxi, alcoxicarbonilo, alquilo, alquinilo, amidinilo, amino, aminocarbonilo, arilo, azido, carboalcoxi, carboxamido, carboxi, ciano, epoxi, halo, hidroxi, nitro, oxa, oxo, perhaloalquilo, perhaloarilo, fosfino, fosfinilo, fosfonilo, sulfinilo, sulfonilo, tia, tio, y sus combinaciones y derivados protegidos. 65 El término “perhalo”, cuando modifica a un radical orgánico, significa que cada átomo de hidrógeno unido a un átomo de carbono está reemplazado por un átomo de halógeno. “Perhalo” puede modificar tanto a grupos alifáticos como aromáticos. Ejemplos de grupos perhaloalquilo son trifluorometilo, bromodifluorometilo, pentacloroetilo y heptafluoroisopropilo. Ejemplos de grupos perhalo aromáticos son tetrafluoro-4-yodofenilo y heptafluoro-2-naftilo. El 7 ES 2 207 273 T3 prefijo “per” se usa a menudo en vez de un prefijo numérico cuando todos los grupos halo son idénticos: por ejemplo, perfluoronaftilo y perfluoroheptilo. 5 El término “sal farmacéuticamente aceptable” incluye sales de los compuestos de la presente invención, derivadas de la combinación del compuesto y un ácido o base orgánico o inorgánico. En la práctica, los miembros ácidos de los compuestos de fórmulas I y II se combinarían con una base o bases, los miembros básicos de los compuestos de fórmulas I y II se combinarían con un ácido o ácidos, y los miembros de los compuestos de fórmulas I y II con ambas funcionalidades ácido y base se combinarían con uno o más ácidos, bases, o cualquiera de sus combinaciones. Tanto las formas neutras como las sales se incluyen dentro del alcance de la presente invención. 10 El término “urea” se refiere a diamidas del ácido carbónico. Las ureas pueden ser cíclicas. La urea es la urea prototipo. Descripción detallada de la invención 15 Los compuestos de la presente invención con actividades moduladoras de VDR, tienen la fórmula I: 20 25 en la que: 30 X e Y se seleccionan cada uno independientemente del grupo formado por O, S y NR7 ; Z se selecciona del grupo formado por C=O, CH(OR8 ) y CH(NR9 R10 ); 35 40 45 50 R1 y R2 se seleccionan independientemente del grupo formado por grupos alquilo, alilo, bencilo, 7-norbornilo y 3pirrolidinilo, opcionalmente fluorados; o R1 y R2 forman conjuntamente un cicloalquilideno que tiene de 3 a 8 átomos de carbono, opcionalmente fluorado; R3 y R4 se seleccionan independientemente del grupo formado por halógeno; n-alquilo de C1 a C10 , opcionalmente fluorado; y alcoxi de C1 a C10 , opcionalmente fluorado; R5 se selecciona del grupo formado por H, grupos alquilo opcionalmente sustituidos; grupos alquenilo opcionalmente sustituidos; grupos alquinilo opcionalmente sustituidos; grupos arilo opcionalmente sustituidos; OR11 ; NR12 R13 ; y grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo, opcionalmente sustituidos; o junto con R8 , R9 o R10 , forma un grupo cíclico de 3 a 12 miembros, en el que dicho grupo cíclico se selecciona del grupo formado por amidinas, aminas, éteres, lactamas, lactonas, cetales, hemicetales, aminales, hemiaminales, carbonatos, carbamatos, ureas y sus combinaciones; R6 se selecciona del grupo formado por H y grupos alquilo, alilo, bencilo, 7-norbornilo y 3-pirrolidinilo, opcionalmente sustituido; R7 se selecciona del grupo formado por H y grupos alquilo, alilo, bencilo, 7-norbornilo y 3-pirrolidinilo, opcionalmente sustituidos; 55 60 65 R8 se selecciona del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupo arilo opcionalmente sustituido, grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo opcionalmente sustituidos y grupos acilo opcionalmente sustituidos; R9 y R10 se seleccionan independientemente del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupo arilo opcionalmente sustituidos, grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo opcionalmente sustituidos y grupos acilo opcionalmente sustituidos; R11 se selecciona del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupo arilo opcionalmente sustituidos, grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo opcionalmente sustituidos y grupos acilo opcionalmente sustituidos; y 8 ES 2 207 273 T3 R12 y R13 se seleccionan independientemente del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupos arilo opcionalmente sustituidos, grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo opcionalmente sustituidos; grupos acilo opcionalmente sustituidos y sus sales farmacéuticamente aceptables. 5 Los compuestos de fórmulas I y II son también potencialmente útiles en el tratamiento y prevención de procesos patológicos de mamíferos, caracterizados por regulación del calcio, proliferación celular y respuesta inmunitaria anormales; dermopatías y/o enfermedades neurodegenerativas. 10 15 20 Ejemplos de procesos patológicos caracterizados por una regulación del calcio anormal incluyen osteoporosis, hipercalcemia humoral de malignidades, osteodistrofia renal y ciertos tipos de insuficiencia renal. Ejemplos de procesos patológicos caracterizados por una proliferación celular anormal incluyen leucemia, cánceres y psoriasis. Ejemplos de procesos patológicos caracterizados por una respuesta inmunitaria anormal incluyen psoriasis, rechazo del injerto por el hospedador, lupus, esclerosis múltiple, diabetes inducida autoinmunitaria, escleroderma y artritis reumatoide. Ejemplos de procesos patológicos caracterizados por dermopatías incluyen acné, alopecia, arrugas, secreción de sebo insuficiente, hidratación dérmica insuficiente y firmeza dérmica insuficiente. Un ejemplo de un estado neurodegenerativo es la enfermedad de Alzheimer. Además de las actividades moduladoras de VDR de los compuestos de fórmula I, los inventores han descubierto también compuestos no secoesteroideos hasta ahora desconocidos, de fórmula II: 25 30 en los que: 35 X e Y se seleccionan cada uno independientemente del grupo formado por O, S y NR7 ; Z se selecciona del grupo formado por C=O, CH(OR8 ) y CH(NR9 R10 ); 40 R1 y R2 se seleccionan independientemente del grupo formado por grupos alquilo, opcionalmente fluorados; o R1 y R2 forman conjuntamente un cicloalquilideno que tiene de 3 a 8 átomos de carbono, opcionalmente fluorado; R3 y R4 se seleccionan independientemente del grupo formado por halógeno; n-alquilo inferior, opcionalmente fluorado; y alcoxi inferior, opcionalmente fluorado; 45 50 R5 se selecciona del grupo formado por H, grupos alquilo opcionalmente sustituidos; grupos alquenilo opcionalmente sustituidos; grupos alquinilo opcionalmente sustituidos; grupos arilo opcionalmente sustituidos; OR11 ; NR12 R13 ; o junto con R8 , R9 o R10 , forma un grupo cíclico de 3 a 12 miembros, en el que dicho grupo cíclico se selecciona del grupo formado por amidinas, aminas, éteres, lactamas, lactonas, cetales, hemicetales, aminales, hemiaminales, carbonatos, carbamatos, ureas y sus combinaciones; R6 se selecciona del grupo formado por H y grupos alquilo, opcionalmente sustituidos; R7 se selecciona del grupo formado por H y grupos alquilo, opcionalmente sustituidos; 55 60 65 R8 se selecciona del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupo arilo opcionalmente sustituido, y grupos acilo opcionalmente sustituidos; R9 y R10 se seleccionan independientemente del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupos arilo opcionalmente sustituidos y grupos acilo opcionalmente sustituidos; R11 se selecciona del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupos arilo opcionalmente sustituidos, y grupos acilo opcionalmente sustituidos; y 9 ES 2 207 273 T3 R12 y R13 se seleccionan independientemente del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupos arilo opcionalmente sustituidos, y grupos acilo opcionalmente sustituidos; y sus sales farmacéuticamente aceptables; 5 con las condiciones de que: a. cuando X e Y son ambos O, Z es C=O, y R5 se selecciona del grupo formado por OH y alcoxi C1 -C4 , entonces R6 no es carboximetilo ni sus ésteres alquílicos; 10 b. cuando X e Y son ambos O, y Z se selecciona del grupo formado por CH(OR8 ) y CH(NR9 R10 ), entonces R5 no es H ni alquilo primario; c. cuando X e Y son ambos O, y Z es CH(OR8 ), entonces R6 y R8 no comprenden ambos aziridinas. 15 d. cuando X e Y son ambos O, y Z es CH(OR8 ), entonces R5 , R6 y R8 no comprenden simultáneamente éteres alquenílicos; y e. cuando X e Y son ambos O, y Z es CH(OR8 ), entonces R5 y R6 no comprenden ambos éteres glicidílicos. 20 25 Compuestos preferidos En los compuestos preferidos de fórmulas I y II, los grupos alquilo adecuados incluyen aquellos de 1 a aproximadamente 20 átomos de carbono. Los grupos alquenilo adecuados incluyen aquellos de 2 a aproximadamente 20 átomos de carbono. Los grupos alquinilo adecuados incluyen aquellos de 2 a aproximadamente 20 átomos de carbono. Los grupos acilo adecuados incluyen aquellos de 1 a aproximadamente 20 átomos de carbono. Los grupos arilo adecuados incluyen aquellos de 5 a aproximadamente 20 átomos de carbono y heteroátomos en total. Los grupos R1 y R2 preferidos incluyen etilo o, cuando R1 y R2 forman conjuntamente un cicloalquilideno, incluyen ciclohexilideno. 30 Los grupos R3 y R4 preferidos incluyen metilo y cloro. Un grupo R3 y R4 particularmente preferido es metilo. Los grupos R5 preferidos incluyen alquilo e hidroxi. Un grupo R5 particularmente preferido es t-butilo. 35 Los grupos R6 preferidos incluyen alquilo sustituido con oxígeno, por ejemplo: 40 45 50 Los grupos R6 particularmente preferidos son 2,3-epoxipropilo, 2-oxo-3,3-dimetilbutilo y 2-hidroxi-3,3-dimetilbutilo. Los grupos X e Y preferidos incluyen O. Los grupos Z preferidos incluyen C=O y CH(OR8 ). Los grupos Z particularmente preferidos son C=O y CH(OH). 55 Los grupos de máxima preferencia incluyen: 60 65 10 ES 2 207 273 T3 5 10 1,1-bis[3-metil-4-(3,3-dimetil-2-oxobutoxi)fenil]ciclohexano (compuesto 4, Ejemplo 2); 15 20 25 30 3,3-bis[3-metil-4-(3,3-dimetil-2-oxobutoxi)fenil]pentano (compuesto 7, Ejemplo 4); 35 40 45 3-[3-metil-4-(2,3-epoxipropoxi)fenil]3-[3-metil-4-(3, 3-dimetil-2-oxobutoxi)fenil]pentano (compuesto 9, Ejemplo 6); 50 55 60 65 3-[3-metil-4-(2-hidroxi-3,3-dimetilbutoxi)fenil]-3-[3-metil-4-(3, 3-dimetil-2-oxobutoxi)fenil]pentano (compuesto 11, Ejemplo 8); 11 ES 2 207 273 T3 5 10 15 3-[3-metil-4-(2,3-dihidroxipropoxi)fenil]3-[3-metil-4-(2-hidroxi-3, 3-dimetilbutoxi)fenil]pentano (compuesto 13, Ejemplo 10). 20 Será obvio para el experto en la técnica que muchos de los compuestos de fórmulas I y II existen como estereoisómeros, es decir isómeros E/Z, enantiómeros y/o diastereoisómeros; la presente invención incluye tanto los compuestos estereoisoméricamente puros de fórmulas I y II, como cualquiera de sus mezclas estereoisoméricas. El alcance de la presente invención abarca tautómeros de compuestos de fórmulas I y II, en su caso. La presente invención incluye también mezclas de compuestos de fórmulas I y II. El experto en la técnica apreciará también que la familia de compuestos de fórmulas I y II incluye miembros ácidos y básicos, y que la presente invención incluye sus sales farmacéuticamente aceptables. 25 Preparación de compuestos preferidos 30 Los compuestos de fórmulas I y II se pueden sintetizar convenientemente como se muestra en las Figuras 2 y 3. En la Figura 2, dos fenoles o tiofenoles sustituidos en posición 2, sufren secuencialmente sustitución electrófila, aromática, para proporcionar difenoles o ditiofenoles. Se conoce un amplio conjunto de fenoles y tiofenoles sustituidos en posición 2, y sus métodos de síntesis están bien establecidos (Fenoles: Houben-Weyl Methoden der organischen Chemie, V6, parte 1c. Tiofenoles: Houben-Weyl Methoden der organischen Chemie, V9, E11.); muchos están disponibles en el comercio (de, por ejemplo, the Aldrich Chemical Company). El primer electrófilo deriva de la protonación de cetona; el segundo es el ion carbenio, derivado de la protonación del producto de alcohol terciario de la primera reacción. 35 40 45 50 55 Estos difenoles o ditiofenoles se pueden alquilar posteriormente hasta éteres o tioéteres en una etapa única, para producir compuestos dispuestos simétricamente, o en dos etapas, para producir compuestos asimétricos. Tales reacciones de alquilación son muy conocidas en la técnica y se pueden lograr convenientemente, por ejemplo, con hidruro sódico seguido por un haluro de alquilo, o mediante apertura de epóxido o aziridina. Estas añadiduras se pueden modificar posteriormente según se desee, usando metodologías muy conocidas en la técnica. La Figura 3 muestra la preparación de los miembros amina de fórmulas I y II. La 4,4’-metilendianilina disponible comercialmente (Aldrich Chemical Company) se elabora mediante oxidación en la posición doblemente bencílica, seguida de conversión en un centro cuaternario, usando cualquier número de métodos conocidos en la técnica. Por ejemplo, la dianilina se puede oxidar con dióxido de selenio hasta el alcohol bencílico, que se puede oxidar hasta la cetona. Esta cetona se puede convertir en un carbono cuaternario en una única etapa, por ejemplo, con el reactivo de titanio de Reetz o, alternativamente, en varias etapas, por ejemplo mediante condensación de aldol seguida de adición conjugada, o mediante otros métodos muy conocidos en la técnica. Las alquilaciones de átomos de nitrógeno son también muy conocidas en la técnica. Tales alquilaciones se logran fácilmente con haluros de alquilo, por ejemplo. Otro método de alquilación muy conocido es la alquilación reductiva usando un aldehído o cetona y un agente reductor, por ejemplo, cianoborohidruro sódico. Otro método adicional es la acilación seguida de reducción. El experto en la técnica es totalmente consciente de que las etapas de alquilación y cuaternización se pueden transponer o incluso interponer, dependiendo del compuesto particular de interés. Las síntesis específicas de los compuestos 4, 7, 9, 11 y 13 se describen en detalle en los Ejemplos. Selección de compuestos preferidos 60 65 La presente invención se refiere a compuestos no secoesteroideos con actividad de vitamina D3 . La forma activa de la vitamina D3 , la 1,25-dihidroxivitamina D3 [1,25(OH)2 D3 ], muestra tanto efectos inmunosupresores como antiproliferativos in vitro e in vivo, y se ha usado para tratar la insuficiencia renal y la psoriasis en seres humanos. El único efecto secundario conocido de la 1,25(OH)2 D3 es la movilización del calcio; dosis superiores pueden conducir a la hipercalcemia, una enfermedad potencialmente peligrosa para la vida. Los activadores de VDR no secoesteroideos pueden presentar diferentes perfiles de actividad que la 1,25(OH)2 D3 y sus análogos secoesteroideos, incluyendo los efectos calcémicos reducidos que los harían atractivos como productos farmacéuticos tanto orales como tópicos y quimiopreventivos para diversos procesos patológicos. Los inventores han 12 ES 2 207 273 T3 comparado las actividades de los compuestos de la presente invención con la 1,25(OH)2 D3 en la inhibición del crecimiento de células cancerosas y queratinocitos in vitro, diferenciación de células leucémicas en cultivo y regulación in vivo del gen diana de la vitamina D y de los niveles de calcio sérico. Estos experimentos se detallan en el Ejemplo A y se resumen en las Tablas 1 y 2. 5 10 Adicionalmente, estas sustancias miméticas de la vitamina D no se unen a la DBP del suero in vitro. La capacidad de varios análogos de la 1,25(OH)2 D3 para unirse a la proteína que se une a la vitamina D del suero (DBP) se ha asociado con su capacidad para elevar el calcio sérico in vivo: análogos con afinidad reducida para DBP mostraban un potencial de calcio reducido en modelos animales (A.S. Dusso et al Endocrinology 1991, 128, 1687-1692). En los ensayos de unión de DBP, ninguna de las sustancias miméticas de la vitamina D ensayadas se unió de forma apreciable, ni a DBP de rata ni humana, mostrando valores de CI50 superiores a 10 µM. Estos resultados implican que esta serie de sustancias miméticas de la vitamina D puede ser menos calcémica in vivo que la 1,25(OH)2 D3 . Estos experimentos se detallan también en el Ejemplo A y se resumen en la Tabla 1, en los Ejemplos. 15 Los experimentos in vivo en ratones de los efectos del compuesto 4 y de la 1,25(OH)2 D3 sobre los niveles de RNA de 24(OH)asa renal y los niveles de calcio séricos, se describen en el Ejemplo B y los resultados se resumen en la Tabla 2 en los Ejemplos. La mayor proporción de inducción de gen diana frente a concentración de calcio, indica una separación de estos efectos superior para 4 que para la 1,25(OH)2 D3 . 20 Uno de los compuestos (4), que mostraba una buena separación de la regulación del gen diana respecto a la elevación del calcio del suero, se ensayó en un modelo de cáncer de próstata en un ratón inmunosuprimido, cuyos resultados se resumen en la Figura 1. En el Ejemplo C, se estudió el efecto del compuesto 4 sobre ratones inmunosuprimidos a los que se les inyectaron subcutáneamente células de cáncer de próstata LNCaP. La Figura 1 presenta los resultados del compuesto 4 frente al vehículo en estos experimentos. Como se muestra en la Figura 1a, los ratones tratados con el compuesto 4 mostraban velocidades de crecimiento tumoral reducidas frente al grupo testigo. La figura 1b muestra que no se observó hipercalcemia a estos niveles de dosificación del compuesto 4. 25 30 35 La vitamina D3 o las sustancias miméticas de la vitamina D de la invención se pueden usar solas o en combinación con otros fármacos o tratamientos. En particular, los compuestos de la invención se pueden usar en combinación con retinoides, particularmente retinoides selectivos de RXR (“rexinoides”; véase, p.ej, patente de EE.UU. Nº 5.780.676 y la solicitud internacional publicada WO 97/12853) o con moduladores de receptores de andrógenos (véanse, p.ej., las patentes de EE.UU. Nos 5.677.336, 5.696.133, 5.696.130 y 5.693.646) para tratar el cáncer, particularmente el cáncer de próstata. Composiciones farmacéuticas En otro aspecto, la presente invención abarca composiciones farmacéuticas preparadas para almacenamiento o administración, que comprenden una cantidad terapéuticamente efectiva de uno o más compuestos de la presente invención en un vehículo farmacéuticamente aceptable. 40 45 La cantidad terapéuticamente efectiva de un compuesto de la presente invención estará en el intervalo de aproximadamente 1 µg/kg a aproximadamente 50 mg/kg. La dosificación particular dependerá de la vía de administración, el tipo de mamífero que se esté tratando, y las características físicas del mamífero específico que se esté considerando, así como las características del compuesto específico, por ejemplo, actividad, biodisponibilidad, características metabólicas, etc. Estos factores y su relación para determinar esta cantidad son muy conocidos para los médicos expertos en la técnica médica. Esta cantidad y la forma de administración se pueden diseñar para lograr una eficiencia óptima y dependerán de innumerables factores reconocidos por los expertos en la técnica médica, incluyendo el peso, la dieta y la medicación concurrente. La cantidad terapéuticamente efectiva de los compuestos de la presente invención puede variar ampliamente dependiendo de los efectos deseados y de la indicación terapéutica. 50 55 60 65 Los vehículos farmacéuticamente aceptables para uso terapéutico son muy conocidos en la técnica farmacéutica, y se describen, por ejemplo, en Remington’s Pharmaceutical Sciences (Editor A.P. Genaro; Mack, 1985). Por ejemplo, se pueden usar solución salina estéril o solución salina tamponada con fosfato a pH fisiológico. en la composición farmacéutica se pueden proporcionar conservantes, estabilizadores, colorantes e incluso saborizantes. Por ejemplo, se pueden añadir benzoato sódico, ácido sórbico y ésteres del ácido p-hidroxibenzoico como conservantes (Id en 1449). También se pueden usar antioxidantes y agentes de suspensión (Id). Las composiciones farmacéuticas de la presente invención se pueden formular y usar como comprimidos, cápsulas o elixires para administración oral; supositorios para administración rectal o vaginal; soluciones y suspensiones estériles para administración parenteral; cremas, lociones o geles para administración tópica; aerosoles o insuflaciones para administración intratraqueobronquial; y similares. Las preparaciones de tales formulaciones son muy conocidas para los expertos en la técnica farmacéutica. La dosis y el método de administración se pueden diseñar para lograr una eficacia óptima y dependerán de factores que reconocerán los expertos en la técnica médica. Cuando la administración va a ser parenteral, p.ej. intravenosa de forma diaria, se pueden preparar sustancias farmacéuticas inyectables de formas convencionales, bien como suspensiones o soluciones líquidas; formas sólidas adecuadas para solución o suspensión en líquido antes de la inyección; o como emulsiones. Excipientes adecuados son, por ejemplo, agua, solución salina, dextrosa, manitol, lactosa, lecitina, albúmina, glutamato sódico, hidrocloruro 13 ES 2 207 273 T3 de cisteína, o similares. Además, si se desea, las composiciones farmacéuticas inyectables pueden contener cantidades secundarias de sustancias aditivas atóxicas, como agentes humectantes, tamponadores del pH, y similares. Si se desea, se pueden utilizar preparaciones mejoradoras de la absorción (p.ej. liposomas). 5 10 Los compuestos de esta invención y su preparación se pueden entender mejor mediante los ejemplos que ilustran algunos de los procesos mediante los cuales se preparan estos compuestos. Sin embargo, los ejemplos no se debe considerar que limitan específicamente la invención, y las variaciones de la invención, conocidas ahora o desarrolladas posteriormente, se considera que están incluidas dentro del alcance de la invención como se reivindica más adelante. Ejemplos Ejemplo 1 Preparación de 1,1-bis[4-hidroxi-3-metilfenil]ciclohexano (3) 15 20 25 30 Se añadió H2 SO4 concentrado (4 ml), a una solución de o-cresol (5 g, 46,3 mmoles) y ciclohexanona (2g, 20,4 mmoles) en ácido acético (20 ml). La mezcla de reacción se agitó a temperatura ambiente durante 3 días, se vertió sobre hielo y se diluyó con acetato de etilo/hexanos 1:5. La fracción orgánica se separó, se lavó con agua y salmuera, se secó sobre MgSO4 y se concentró al vacío. La cromatografía (sílice, acetato de etilo en hexanos al 5%) produjo 1,8 g de difenol 3. 1 HNMR (CDCl3 ) δ: 6,98 (d, J = 2 Hz, 2H, Ar-H), 6,95 (dd, J = 2 Hz, J = 8,6 Hz, 2H, Ar-H), 6,64 (d, J = 8,6 Hz, 2H, Ar-H), 2,19 (s, 6 H, Ar-CH3 ), 2,19 (m, 4 H, CH2 ), 1,27-1,52 (m, 6 H, CH2 ). Ejemplo 2 35 Preparación de 1,1-bis[3-metil-4-(3,3-dimetil-2-oxobutoxi)fenil]ciclohexano (4) 40 45 50 Se añadió NaH (306 mg, 8,00 mmoles) a una solución del compuesto del Ejemplo 1 (1,0 g, 3,37 mmoles) en DMF (10 ml). La mezcla de reacción se agitó durante 5 min y se añadió cloropinacolona (1,07 g, 8,00 mmoles). La mezcla de reacción se agitó durante 30 min, luego se detuvo la reacción con agua y se diluyó con acetato de etilo. La fracción orgánica se separó, se lavó con agua y salmuera, se secó sobre MgSO4 y se concentró al vacío. La cromatografía (sílice, acetato de etilo en hexanos al 10%), produjo 820 mg (1,66 mmoles) de 4. 1 HNMR (CDCl3 ) δ: 7,09 (d, J = 2 Hz, 2H, Ar-H), 6,96 (dd, J = 2 Hz, J = 8,6 Hz, 2H, Ar-H), 6,51 (d, J = 8,6 Hz, 2H, Ar-H), 4,82 (s, 4H, CH2 O), 2,25 (s, 6H, Ar-CH3 ), 2,19 (m, 4 H, CH2 ), 1,27-1,52 (m, 6 H, CH2 ), 1,25 (s, 18H, t-Bu). 55 Ejemplo 3 Preparación de 3,3-bis[4-hidroxi-3-metil]pentano (6) 60 65 14 ES 2 207 273 T3 5 Se añadió H2 SO4 concentrado (4 ml), a una solución de o-cresol (5 g, 46,3 mmoles) y 3-pentanona (2 g, 23,2 mmoles). La mezcla de reacción se agitó a temperatura ambiente durante 3 días, se vertió sobre hielo, y se diluyó con acetato de etilo/hexanos 1:5. La fracción orgánica se separó, se lavó con agua y salmuera, se secó sobre MgSO4 y se concentró al vacío. La cromatografía (sílice, acetato de etilo en hexanos al 5%) produjo 2,2 g de difenol 6. 1 HNMR (CDCl3 ) δ: 6,90 (d, J = 2 Hz, 2H, Ar-H), 6,95 (dd, J = 2 Hz, J = 8,6 Hz, 2H, Ar-H), 6,64 (d, J = 8,6 Hz, 2H, Ar-H), 2,21 (s, 6 H, Ar-CH3 ), 2,0 (q, J = 7,3 Hz, 4H, CH2 CH3 ), 0,60 (t, J = 7,3 Hz, 4H, CH2 CH3 ). Ejemplo 4 10 Preparación de 3,3-bis[3-metil-4-(3,3-dimetil-2-oxobutoxi)fenil]pentano (7) 15 20 25 El compuesto 7 se preparó de forma análoga al compuesto 4, excepto porque se usó el compuesto del Ejemplo 3 (6) en vez del compuesto del Ejemplo 1 (3). 1 HNMR (CDCl3 ) δ: 6,89 (m, 4H, Ar-H), 6,49 (d, J = 8,3 Hz, 2H, Ar-H), 4,82 (s, 4H, CH2 O), 2,23 (s, 6 H, Ar-CH3 ), 2,00 (q, J = 7,3 Hz, 4H, CH2 CH3 ), 1,23 (s, 18H, t-Bu), 0,58 (t, J = 7,3 Hz, 6H, CH2 CH3 ). Ejemplo 5 Preparación de 3-[4-hidroxi-3-metilfenil]-3-[3-metil-4-(2,3-epoxipropoxi)fenil]pentano (8) 30 35 40 45 Se añadió NaH (8,4 mg, 3,5 mmoles) a una solución del compuesto del Ejemplo 3 (1,0 g, 3,5 mmoles) en DMF (10 ml). La mezcla de reacción se agitó durante 5 min, luego se añadió cloropinacolona (471 mg, 3,5 mmoles). La mezcla de reacción se agitó durante 30 min, luego se detuvo la reacción con agua y se diluyó con acetato de etilo. La fracción orgánica se separó, se lavó con agua y salmuera, se secó sobre MgSO4 , y se concentró al vacío. Se observaron tres compuestos mediante TLC, correspondiendo el producto deseado al producto intermedio. La cromatografía (sílice, acetato de etilo en hexanos al 10%) produjo 250 mg (0,57 mmoles, 16%) de 8. Ejemplo 6 Preparación de 3-[3-metil-4-(2,3-epoxipropoxi)fenil]-3-[3-metil-4-(3,3-dimetil-2-oxobutoxi)fenil]pentano (9) 50 55 60 65 Se añadió NaH (5,5 mg, 0,23 mmoles) a una solución del compuesto del Ejemplo 5 (80 mg, 0,21 mmoles) en DMF anhidro (1 ml). La mezcla de reacción se agitó durante 30 min a temperatura ambiente, luego se añadió epiclorohidrina (22,0 mg, 0,23 mmoles). La reacción se calentó hasta 120ºC durante 1 h o hasta completar la reacción por TLC (acetato de etilo en hexanos al 20%). La mezcla de reacción se enfrió, se detuvo la reacción con agua y se diluyó con acetato de etilo. La fracción orgánica se separó, se lavó con agua y salmuera, se secó sobre MgSO4 , y se concentró al vacío. La cromatografía (sílice, acetato de etilo en hexanos al 10%) produjo 30 mg (0,07 mmoles, 33%) de 9. 1 HNMR (CDCl3 ) δ: 6,89 (m, 4H, Ar-H), 6,66 (d, J = 8,3 Hz, 1H, Ar-H), 6,49 (d, J = 8,3 Hz, 1H, Ar-H), 4,83 (s, 2H, CH2 ), 4,18 (dd, J = 11,3 Hz, J = 3,3 Hz, 1H, CH2 ), 3,95 (dd, J = 11,3 Hz, J = 3,3 Hz, 1H, CH2 ), 3,35 (m, 1H, CH), 2,90∼2,76 (m, 2H, 15 ES 2 207 273 T3 CH2 ), 2,23 (s, 3H, Ar-CH3 ), 2,18 (s, 3H, Ar-CH3 ), 2,00 (q, J = 7,3 Hz, 4H, CH2 CH3 ), 1,24 (s, 18H, t-Bu), 0,59 (t, J = 7,3 Hz, 6H, CH2 CH3 ). Ejemplo 7 5 Preparación de 3-[4-hidroxi-3-metilfenil]-3-[3-metil-4-(2-hidroxi-3,3-dimetilbutoxi)fenil]pentano (10) 10 15 20 25 El compuesto del Ejemplo 5 (240 mg, 0,63 mmoles) se disolvió en metanol (2,5 ml) y la solución se enfrió hasta 0ºC. A esta solución se le añadió NaBH4 (24,0 mg, 0,63 mmoles) y la reacción se agitó durante 20 min. La reacción se detuvo con NH4 Cl acuoso, saturado, y se extrajo con acetato de etilo. La fracción orgánica se separó, se lavó con agua y salmuera, se secó sobre MgSO4 y se concentró al vacío. La cromatografía (sílice) produjo 160 mg (0,42 mmoles) de 10. Ejemplo 8 Preparación de 3-[3-metil-4-(2-hidroxi-3,3-dimetilbutoxi)fenil]-3-[3-metil-4-(3,3-dimetil-2-oxobutoxi)fenil]pentano (11) 30 35 40 45 50 Se añadió NaH (7,0 mg, 0,29 mmoles) a una solución del compuesto del Ejemplo 7 (100 mg, 0,26 mmoles) en DMF (2,5 ml). La mezcla de reacción se agitó a temperatura ambiente durante 30 min, luego se añadió pinacolona (39 mg, 0,29 mmoles). La reacción se agitó a temperatura ambiente durante 1 h o hasta que se consideró que se había completado por TLC (acetato de etilo en hexanos al 20%). La mezcla de reacción se detuvo con agua y se diluyó con acetato de etilo. La fracción orgánica se separó, se lavó con agua y salmuera, se secó sobre MgSO4 y se concentró al vacío. La cromatografía (sílice, acetato de etilo en hexanos al 10%) produjo 117 mg (0,24 mmoles, 92%) de 11. 1 HNMR (CDCl3 ) δ: 6,91 (m, 4H, Ar-H), 6,69 (d, J = 8,3 Hz, 1H, Ar-H), 6,49 (d, J = 8,3 Hz, 1H, Ar-H), 4,83 (s, 2H, CH2 ), 4,09 (dd, J = 11,3 Hz, J = 3,3 Hz, 1H, CH2 ), 3,85 (t, J = 11,3 Hz, 1H, CH2 ), 3,69 (d, J = 11,3 Hz, 1H, CH2 ), 2,23 (s, 3H, Ar-CH3 ), 2,18 (s, 3H, Ar-CH3 ), 2,00 (q, J = 7,3 Hz, 4H, CH2 CH3 ), 1,24 (s, 9H, t-Bu), 1,00 (s, 9H, t-Bu), 0,58 (t, J = 7,3 Hz, 6H, CH2 CH3 ). Ejemplo 9 Preparación de 3-[3-metil-4-(2,3-dihidroxipropoxi)fenil]-3-[3-metil-4-(3,3-dimetil-2-hidroxibutoxi)fenil]pentano (12) 55 60 65 Se añadió NaH (14,0 mg, 0,58 mmoles) a una solución del compuesto del Ejemplo 5 (200 mg, 0,52 mmoles) en DMF anhidro (4 ml). La reacción se agitó durante 20 min, luego se añadió glicidol (43,0 mg, 0,58 mmoles). La mezcla de reacción se templó hasta 80ºC durante 1 hora y se enfrió. Se detuvo la reacción de la mezcla de reacción con agua, y se diluyó con acetato de etilo. La fracción orgánica se separó, se lavó con agua y salmuera, se secó sobre MgSO4 16 ES 2 207 273 T3 y se concentró al vacío. La cromatografía (sílice, acetato de etilo en hexanos al 10%) produjo 117 mg (0,26 mmoles, 50%) de 12. Ejemplo 10 5 Preparación de 3-[3-metil-4-(2,3-dihidroxipropoxi)fenil]-3-[3-metil-4-(2-hidroxi-3,3-dimetilbutoxi)fenil]pentano (13) 10 15 20 25 El compuesto del Ejemplo 9 (70 mg, 0,15 mmoles) se disolvió en metanol (2,5 ml) y la solución se enfrió hasta 0ºC. A esta solución se le añadió NaBH4 (5,7 mg, 0,15 mmoles) y la reacción se agitó durante 20 min. La reacción se detuvo con NH4 Cl acuoso saturado y se extrajo con acetato de etilo. La fracción orgánica se separó, se lavó con agua y salmuera, se secó sobre MgSO4 y se concentró al vacío. La cromatografía (sílice) produjo 23 mg (0,05 mmoles, 33%) de 13. 1 HNMR (CDCl3 ) δ: 6,94 (m, 4H, Ar-H), 6,69 (d, J = 8,3 Hz, 2H, Ar-H), 4,12-4,02 (m, 4H), 3,88-3,67 (m, 4H), 2,17 (s, 3H, Ar-CH3 ), 2,16 (s, 3H, Ar-CH3 ), 2,04 (q, J = 7,3 Hz, 4H, CH2 CH3 ), 1,00 (s, 9H, t-Bu), 0,59 (t, J = 7,3 Hz, 6H, CH2 CH3 ). Ejemplo A Ensayos in vitro y basados en células 30 35 40 45 Propiedades de cotransactivación Se cotransfectaron células Hep G2 (hepatoma humano, ATCC) con un plásmido que codificaba VDR humano (A.R. Baker et al. Proc. Natl. Acad. Sci. 1988, 85, 3294-3298; A. Zou et al. J. Biol. Chem. 1997, 272, 19027-19034) dirigido por un promotor constitutivo fuerte (RSV) y un plásmido indicador que codificaba luciferasa, dirigido por el VDRE natural, localizado dentro del promotor de h24(OH)asa (Zou et al., 1997). Los vectores que contenían el indicador y el receptor se transfectaron junto con el DNA portador y el plásmido de control interno de β-galactosidasa como se describió previamente, excepto porque se usaron células Hep G2 (Id). En resumen, se realizaron transfecciones por triplicado en placas de 96 pocillos recubiertas con gelatina, con un total de 20 µg/l de DNA (0,5 µg de vector de expresión de receptor, 5 µg de plásmido indicador, 5 µg de plásmido de β-galactosidasa, y DNA portador de pGEM hasta 20 µg) de solución de transfección de fosfato cálcico-HEPES. Seis horas después, se añadieron 1,25(OH)2 D3 o compuestos de fórmula I (10−12 -10−5 M), y las células se incubaron durante 40 h. Las células se lisaron y se midieron las actividades luciferasa y β-galactosidasa como se describió previamente (Id). Los valores de luciferasa se normalizaron con los valores de β-galactosidasa a controlar, para eficiencias de transfección variables. No se observó actividad luciferasa dirigida por indicador sin cotransfección de VDR, indicando la dependencia de VDR de los compuestos. La concentración de ligando que producía una inducción del 50% de la actividad luciferasa (CE50 ) de 1,25(OH)2 D3 fue 2-10 nM para 1,25(OH)2 D3 , mientras que CE50 para los compuestos de la invención varía de 3 µM-20 nM. Unión a VDR 50 55 60 65 La VDR humana (Baker et al. 1988) se construyó dentro de un plásmido de expresión de levadura, como se describió previamente (D.P. McDonnell et al. Mol Cell Biol. 1989, 9, 3517-3523). Se prepararon extractos celulares de transformantes de levadura y se confirmó la expresión de la totalidad de VDR por transferencia Western. Se usaron extractos de proteína de células de levadura brutas que contenían hVDR (4 µg/tubo) para análisis de saturación y de Scatchard, usando 1,25(OH)2 D3 tritiado (Amersham). Se usó resina de hidroxilapatita para separar el ligando unido del no unido como se describió previamente (E.A. Allegretto et al. J. Biol. Chem. 1993, 268, 26625-26633). El valor de Kd resultante de ∼ 0,5 nM está de acuerdo con los valores publicados para la unión de 1,25(OH)2 D3 a VDR. Se realizaron análisis competitivos a 2 nM de 1,24(OH)2 D3 tritiado y 0,1 nM-10 µM de los compuestos de la invención. El tampón de unión contenía Tris 10 mM, pH 7,5, DTT 1 mM y KCl 0,4 M; el tampón de lavado contenía Tris 10 mM, KCl 100 mM y detergente CHAPS 10 mM. Inhibición del crecimiento de células cancerosas y análisis Se cultivaron en placa células de cáncer de mama humano SK-BR-3 (ATCC) y células de cáncer de próstata humano LNCaP (ATCC), en placas de microtitulación de fondo plano, de 96 pocillos (CoStar) con 50 µl de medio que contenía suero/pocillo. Todos los ensayos de crecimiento se realizaron en medios que contenían FBS al 5-7,5%. Los números de células cultivados (células/pocillo) fueron como sigue: SK-BR-3, 3000 (ensayos de 3 días); LNCaP, 1000 (ensayos de 4 días). El número de células sembrado se determinó por la velocidad de crecimiento de cada línea celular 17 ES 2 207 273 T3 y duración del ensayo. Las células tratadas con vehículo fueron confluentes en ∼ 80% hacia el final de cada ensayo. Se dejó que las células se adhirieran durante 24 h antes de la adición del compuesto, como sigue: 5 10 15 Se realizaron diluciones seriadas de diez veces cambiando los extremos de las pipetas entre cada dilución. Luego se añadieron los compuestos diluidos a las células (50 µl/pocillo) hasta las concentraciones finales de 1 x 10−5 - 1 x 10−11 (etanol al 1%) por triplicado. Las células y ligandos se incubaron a 37ºC durante 3-4 días. La incorporación de BrdU (5-bromo-2’-desoxiuridina) se analizó como una medición de la replicación del DNA (kit ELISA de Proliferación Celular, Boehringer) y se midió la absorbancia a 450 nm. Una fila de pocillos contenía sólo medio y se calculó el promedio de estos valores de absorbancia como fondo y luego se restó de los valores de absorbancia de cada pocillo individual que contenía células. Los valores promedio se determinaron luego para cada triplicado y se representaron gráficamente frente a la concentración de ligando. Se determinó el valor de vehículo promedio (etanol al 1%) menos el promedio de fondo. Este valor se representa en gráficos como un único punto a 0 M y se marca como un rombo lleno. La eficacia (% de inhibición del crecimiento) se determinó como [1-(D.O. a la respuesta máxima con el compuesto/D.O del vehículo promedio)] x 100. La actividad (CE50 ) se determinó como la concentración de compuesto que provocaba una respuesta de la mitad del máximo. Diferenciación de células leucémicas 20 25 30 Se cultivaron células leucémicas promielocíticas humanas HL60 (ATCC) en medios que contenían FBS al 15% y se cultivaron en placa a razón de 100.000 células/ml en placas de 10 cm o en placas de 6 pocillos. Se añadieron ligandos en un vehículo de etanol (1%) a diversas concentraciones durante 5 días, sin cambiar el medio. En el quinto día, las células se recogieron y se ensayaron para marcadores de diferenciación. La capacidad de las células para reducir el colorante de nitroazul de tetrazolio (NBT) es el método estándar de determinación de la diferenciación de estas células (S.J. Collins et al. J. Exp. Med. 1979, 149, 969-974). Las células que biorreducen el colorante se vuelven azulesnegras y representan células diferenciadas, y se cuentan. Las células indiferenciadas son claras y también se cuentan; a continuación, se determina el porcentaje de células diferenciadas a partir de los dos números. Para determinar que las células se diferenciaban en macrófagos/monocitos (vía inducida por la vitamina D), se ensayó el marcador proteico de la superficie celular, CD14, mediante análisis FACS (F. Oberg et al. J. Immunol. 1993, 150, 3487-3495). Los valores de CE50 representan la concentración de ligando que inducía al 50% de las células a ser positivas para NBT formazán, o CD14. Inhibición del crecimiento de queratinocitos 35 40 45 50 Los queratinocitos epidérmicos humanos normales (NHEK) se cultivaron según las instrucciones del vendedor (Clonetics, San Diego). Se realizaron ensayos de BrdU como anteriormente, excepto porque las células se cultivaron en placa a razón de 200 células por pocillo (placas de 96 pocillos) y se añadieron medios recién preparados con ligandos en el día 0 y el día 2; los ensayos de BrdU se realizaron en el día 4. Unión a DBP sérico Se realizaron ensayos de unión competitivos de DBP mediante un método de la literatura (Dusso et al. 1991). La fuente de DBP fue, bien suero humano (Scantibodies) o suero de rata (Gibco-BRL) diluido 1:10.000 en tampón de fosfato sódico (pH 7,4). Los sueros se incubaron durante 2 h a 4ºC con [3 H]-25(OH)D3 2 nM (Amersham), con y sin 25(OH)D3 o 1,25(OH)2 D3 sin marcar (0,01 nM-1 µM), o compuestos miméticos de la vitamina D sin marcar (10 nM10 µM). El ligando unidos se separó del ligando sin unir con carbón vegetal revestido con dextrano en gelatina-tampón fosfato. La Tabla 1 resume los resultados experimentales para los compuestos 4, 7, 9, 11 y 13 en ensayos de unión de VDR in vitro y de unión de proteína que se une a la vitamina D sérica (DBP) y diversos ensayos basados en células: cotransactivación de células Hep G2, diferenciación de células leucémicas, inhibición del crecimiento de células de cáncer de mama y próstata, e inhibición del crecimiento de queratinocitos primarios. 55 60 65 18 ES 2 207 273 T3 TABLA 1 Actividad de los compuestos 4, 7, 9, 11 y 13 en ensayos in vitro y basados en células 5 10 15 20 25 30 35 a 40 45 50 55 Valores de Ki (nM) determinados mediante unión competitiva in vitro a hVDR frente a [3 H]-1,25(OH)2 D3 . Valores de CI50 (nM) a partir de unión in vitro a DBP sérica de rata (r) o humana (h), mediante competición con [3 H]25(OH)D3 . c Valores de CE50 (nM) determinados mediante ensayos de cotransactivación con indicador cotransfectado de VDREluciferasa (Zou et al. 1997) y VDR humano en células Hep G2. d Valores de CE50 (nM) determinados por ensayos de nitroazul de tetrazolio y CD14, de diferenciación de células premielocíticas HL60 en macrófagos/monocitos. e Valores de CE50 (nM) determinados por inhibición del crecimientos de células de cáncer de próstata LNCaP mediante incorporación de BrdU. f Valores de CE50 (nM) determinados por inhibición del crecimiento de células de cáncer de mama SK-BR-3 mediante incorporación de BrdU. g Valores de CE50 (nM) determinados por inhibición del crecimientos de células de queratinocitos epidérmicos humanos mediante incorporación de BrdU. h Sin determinar. b Estos resultados muestran que las sustancias miméticas de la vitamina D provocan la transcripción dependiente de VDR en un ensayo de cotransfección. Estos resultados muestran también que las sustancias miméticas de la vitamina D no secoesteroideas de la invención, no se unen a la DBP sérica, lo cual indica que los compuestos pueden tener un potencial reducido para producir efectos de movilización del calcio no deseados. Estos resultados muestran también que las sustancias miméticas de la vitamina D no secoesteroideas de la invención inhibían el crecimiento de células cancerosas y queratinocitos y provocaban la diferenciación monocítica de las células de leucemia HL60 in vitro. 60 Ejemplo B Regulación génica in vivo y potencial de calcio 65 Se alimentó a ratones Balb/c (machos 6-8 semanas de edad, ∼ 20 g) con una dieta deficiente en vitamina D y rica en calcio (Purina Mills) durante 7-14 días antes de recibir tratamiento con compuestos. Los animales se alojaron bajo iluminación normal. Los compuestos se administraron en un vehículo de aceite de sésamo con etanol al 4% mediante 19 ES 2 207 273 T3 5 alimentación oral forzada (volumen de dosis 0,1 ml). La dosificación fue diaria durante 3-5 días (3-4 animales/grupo de dosificación). En el día final de dosificación, 4-6 h después de la dosis final, los animales se sacrificaron, se extrajeron los riñones y se recogió la sangre. Se preparó suero a partir de la sangre y se realizó la determinación del calcio mediante ensayo colorimétrico (Sigma). Los riñones se homogeneizaron en tampón que contenía guanidina y el RNA se preparó como se describió anteriormente (E.A. Allegretto et al. J. Biol. Chem. 1995, 270, 23906-23909). Se utilizaron 15-20 µg de RNA total en análisis de transferencia Northern, usando una sonda de 24(OH)asa de rata; se usó una sonda de GAPDH para normalizar para la carga de RNA, como se describió previamente (Id). La cuantificación se realizó mediante análisis de PhosphorImager. Los resultados se resumen en la Tabla 2. TABLA 2 10 Análisis de la inducción del gen diana de la vitamina D y de los niveles de calcio sérico en ratones tratados con 1,25 (OH)2 D3 , 4 ó 7 15 20 25 30 35 40 45 50 55 60 65 a Corregida con GAPDH; error dentro de grupos ∼ 10%. Calcio sérico normal ∼ 7,9-10,5 mg/dl. c Diferente estadísticamente del vehículo (ANOVA, p<0,01). b 20 ES 2 207 273 T3 Estos resultados muestran que las sustancias miméticas de la vitamina D3 no secoesteroideas: 1) inducen el RNA de la 24(OH)asa, un gen diana de VDR conocido, y 2) tienen una proporción mayor de actividad de tipo vitamina D relativa a la elevación no deseada de los niveles de calcio sérico. 5 Ejemplo C Eficacia in vivo 10 15 Se alojaron ratones inmunosuprimidos (6 semanas de edad) bajo iluminación normal y se alimentaron con una dieta deficiente en vitamina D, rica en calcio (Purina Mills) durante 7-10 días, antes de la inyección con células LNCaP. Se dejó crecer los tumores 2-3 semanas antes de la dosificación. Los compuestos o el vehículo se administraron en aceite de sésamo mediante alimentación oral forzada (volumen de dosis 0,1 ml). La dosificación fue diaria durante la duración del estudio. Se tomaron mediciones del tumor en los días 10 y 15. Después, los animales se sacrificaron y se recuperaron los riñones y la sangre. Se tomaron mediciones del calcio sérico del sangrado final e intermedio en el día 10. La Figura 1 presenta los resultados para 3 mg/kg y 10 mg/kg del compuesto 4 frente al vehículo en estos experimentos. Como se muestra en la Figura 1a, los ratones tratados con el compuesto 4 mostraban velocidades de crecimiento tumoral reducidas, comparados con el grupo testigo. La Figura 1b muestra que no se observó hipercalcemia a estos niveles de dosificación del compuesto 4. El cambio promedio de peso del animal por grupo fue como sigue: Vehículo, -7,2%; Compuesto 4 (3 mg/kg), -2,1%; Compuesto 4 (10 mg/kg), -8,9%. 20 25 30 35 40 45 50 55 60 65 21 ES 2 207 273 T3 REIVINDICACIONES 1. Un compuesto de fórmula II: 5 10 15 en la que: X e Y se seleccionan cada uno independientemente del grupo formado por O, S y NR7 ; 20 Z se selecciona del grupo formado por C=O, CH(OR8 ) y CH(NR9 R10 ); 25 R1 y R2 se seleccionan independientemente del grupo formado por grupos alquilo, alilo, bencilo, 7-norbornilo y 3pirrolidinilo, opcionalmente fluorados; o R1 y R2 forman conjuntamente un cicloalquilideno que tiene de 3 a 8 átomos de carbono, opcionalmente fluorado; R3 y R4 se seleccionan independientemente del grupo formado por halógeno; n-alquilo de C1 a C10 , opcionalmente fluorado; y alcoxi de C1 a C10 , opcionalmente fluorado; 30 35 R5 se selecciona del grupo formado por H, grupos alquilo opcionalmente sustituidos; grupos alquenilo opcionalmente sustituidos; grupos alquinilo opcionalmente sustituidos; grupos arilo opcionalmente sustituidos; OR11 ; NR12 R13 ; y grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo, opcionalmente sustituidos; o, junto con R8 , R9 o R10 , forma un grupo cíclico de 3 a 12 miembros, seleccionándose dicho grupo cíclico del grupo formado por amidinas, aminas, éteres, lactamas, lactonas, cetales, hemicetales, aminales, hemiaminales, carbonatos, carbamatos, ureas y sus combinaciones; R6 se selecciona del grupo formado por H y grupos alquilo, alilo, bencilo, 7-norbornilo y 3-pirrolidinilo, opcionalmente sustituidos; 40 45 50 R7 se selecciona del grupo formado por H y grupos alquilo, alilo, bencilo, 7-norbornilo y 3-pirrolidinilo, opcionalmente sustituidos; R8 se selecciona del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupo arilo opcionalmente sustituido, grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo opcionalmente sustituidos y grupos acilo opcionalmente sustituidos; R9 y R10 se seleccionan independientemente del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupo arilo opcionalmente sustituidos, grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo opcionalmente sustituidos y grupos acilo opcionalmente sustituidos; R11 se selecciona del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupo arilo opcionalmente sustituidos, grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo opcionalmente sustituidos y grupos acilo opcionalmente sustituidos; y 55 R12 y R13 se seleccionan independientemente del grupo formado por H, grupos alquilo opcionalmente sustituidos, grupos alquenilo opcionalmente sustituidos, grupos alquinilo opcionalmente sustituidos, grupos arilo opcionalmente sustituidos, grupos alilo, bencilo, 7-norbornilo y 3-pirrolidinilo opcionalmente sustituidos y grupos acilo opcionalmente sustituidos; y sus sales farmacéuticamente aceptables; 60 con las condiciones de que: a. cuando X e Y son ambos O, Z es C=O, y R5 se selecciona del grupo formado por OH y alcoxi C1 -C4 , entonces R no es carboximetilo ni sus ésteres alquílicos ; 6 65 b. cuando X e Y son ambos O, y Z se selecciona del grupo formado por CH(OR8 ) y CH(NR9 R10 ), entonces R5 no es H ni alquilo primario; 22 ES 2 207 273 T3 c. cuando X e Y son ambos O, y Z es CH(OR8 ), entonces R6 y R8 no comprenden ambos aziridinas. d. cuando X e Y son ambos O, y Z es CH(OR8 ), entonces R5 , R6 y R8 no comprenden simultáneamente éteres alquenílicos; y 5 e. cuando X e Y son ambos O, y Z es CH(OR8 ), entonces R5 y R6 no comprenden ambos éteres glicidílicos. 2. Un compuesto según la reivindicación 1, en el que R3 y R4 son cada uno metilo; X e Y son cada uno O; y R5 es t-butilo. 10 3. Un compuesto según la reivindicación 2, en el que Z es C=O o CH(OH). 4. Un compuesto según la reivindicación 3, en el que R1 y R2 son conjuntamente ciclohexilideno, o en el que cada uno es etilo. 15 5. Un compuesto según la reivindicación 4, en el que R6 es 2-oxo-3,3-dimetilbutilo o 2,3-epoxipropilo o 2-hidroxi3,3-dimetilbutilo. 6. Uso de un compuesto de fórmula I: 20 25 30 en la que: 35 X, Y, Z y R1 a R13 son como se definieron en la reivindicación 1, pero sin las limitaciones de las condiciones, o de una de sus sales farmacéuticamente aceptables, en la fabricación de un medicamento para el tratamiento o profilaxis de procesos patológicos con características reguladoras del calcio anormales, de sensibilidad inmunitaria anormal, características hiperproliferativas y/o neurodegenerativas en mamíferos. 40 7. El uso de la reivindicación 6, en el que el proceso patológico es leucemia, cáncer, psoriasis, osteoporosis, artritis reumatoide, enfermedad de Alzheimer, una enfermedad autoinmunitaria, una dermopatía, osteodistrofia renal, insuficiencia renal, desarrollo óseo anormal, hipercalcemia humoral de malignidades, acné, alopecia, rechazo del injerto por el hospedador, esclerosis múltiple, diabetes inducida autoinmunitaria o escleroderma. 45 8. Uso de un compuesto de fórmula I según la reivindicación 6 o de una de sus sales farmacéuticamente aceptables, para la fabricación de un medicamento para la modulación de un receptor de la vitamina D3 . 50 9. Uso de una sustancia mimética de la vitamina D, no secoesteroidea, para la fabricación de un medicamento destinado a activar la transcripción de un gen diana de la vitamina D, sin incrementar significativamente los niveles de calcio sérico. 10. El uso de la reivindicación 9, en el que dicha sustancia mimética de la vitamina D, no secoesteroidea, tiene una proporción de actividad 24(OH)asa frente a niveles de calcio, de al menos 3,0. 55 11. El uso de la reivindicación 9, en el que dicha sustancia mimética de la vitamina D es un compuesto de fórmula I según la reivindicación 6, o una de sus sales farmacéuticamente aceptables. 60 65 NOTA INFORMATIVA: Conforme a la reserva del art. 167.2 del Convenio de Patentes Europeas (CPE) y a la Disposición Transitoria del RD 2424/1986, de 10 de octubre, relativo a la aplicación del Convenio de Patente Europea, las patentes europeas que designen a España y solicitadas antes del 7-10-1992, no producirán ningún efecto en España en la medida en que confieran protección a productos químicos y farmacéuticos como tales. Esta información no prejuzga que la patente esté o no incluida en la mencionada reserva. 23 ES 2 207 273 T3 24 ES 2 207 273 T3 25 ES 2 207 273 T3 26