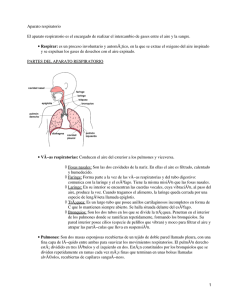
uso de fluorocarbonos liquidos para facilitar la aportacion de
Anuncio

k OFICINA ESPAÑOLA DE PATENTES Y MARCAS 19 k kInt. Cl. : A61K 9/12 11 Número de publicación: 6 51 ESPAÑA k 2 136 315 A61K 9/00 TRADUCCION DE PATENTE EUROPEA 12 kNúmero de solicitud europea: 95939052.7 kFecha de presentación : 02.11.1995 kNúmero de publicación de la solicitud: 0 789 558 kFecha de publicación de la solicitud: 20.08.1997 T3 86 86 87 87 k 54 Tı́tulo: Uso de fluorocarbonos lı́quidos para facilitar la aportación de medicamentos a los pulmones. k 73 Titular/es: ALLIANCE PHARMACEUTICAL k 72 Inventor/es: Rosenberg, Gwen H. k 74 Agente: Curell Suñol, Marcelino 30 Prioridad: 04.11.1994 US 334688 CORPORATION 3040 Science Park Road San Diego California 92121, US 45 Fecha de la publicación de la mención BOPI: 16.11.1999 45 Fecha de la publicación del folleto de patente: ES 2 136 315 T3 16.11.1999 Aviso: k k k En el plazo de nueve meses a contar desde la fecha de publicación en el Boletı́n europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art◦ 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascı́culos: Oficina Española de Patentes y Marcas. C/Panamá, 1 – 28036 Madrid 1 ES 2 136 315 T3 DESCRIPCION Uso de fluorocarbonos lı́quidos para facilitar la aportación de medicamentos a los pulmones. La presente invención se refiere a un método para la entrega de medicamentos y, especı́ficamente, se refiere al uso de fluorocarbonos lı́quidos biocompatibles para facilitar la entrega de medicamentos en forma de micropartı́culas, especialmente para el tratamiento de enfermedades, estados o condiciones pulmonares y otras condiciones o estados fisiológicos. Antecedentes de la invención Se halla disponible una gran variedad de sistemas de entrega para la administración preventiva o terapéutica de medicamentos. Unos métodos bien conocidos en este campo incluyen la inyección (subcutánea, intravenosa, intramuscular o intraperitoneal), la entrega a través de un catéter, la difusión a partir de un parche aplicado a la piel o de un bolo implantado debajo de la piel, la entrega intraocular por medio de gotas de lı́quido, la ingestión de una pı́ldora, una cápsula o una cápsula de gel, y la inhalación de un aerosol. Los sistemas de entrega por aerosol confı́an de manera general en una mezcla del agente terapéuticamente activo con uno o más propulsores e ingredientes inactivos para aumentar la dispersión y la estabilidad del agente activo. La inhalación del aerosol puede realizarse tanto a través de la nariz como de la boca y frecuentemente es autoadministrada. Debido al pequeño volumen de cada dosis, el propulsor se evapora de manera general simultáneamente o poco después de la entrega del ingrediente activo. Los fluorocarbonos son compuestos de hidrocarburos substituidos por fluor que son biocompatibles. Los fluorocarbonos bromados y otros fluorocarbonos son también conocidos como substancias seguras biocompatibles cuando se utilizan adecuadamente en aplicaciones médicas. Además de su uso como propulsores de aerosol, se han utilizado en aplicaciones médicas como agentes de formación de imágenes y como substitutos de la sangre. La patente U.S. n◦ 3.975.512 concedida a Long utiliza fluorocarbonos, incluyendo perfluorocarbonos bromados, como medio de mejora del contraste en la formación de imágenes radiológicas. Los gases en general, incluyendo el oxı́geno y el dióxido de carbono, son muy solubles en algunos fluorocarbonos. Esta caracterı́stica ha permitido que los investigadores desarrollaran fluorocarbonos emulsionados como substitutos de la sangre. Para una visión general del uso de los fluorocarbonos como substitutos de la sangre véase “Reassessment of Criteria for the Selection of Perfluorochemicals for Second-Generation Blood Substitutes: Analysis of Structure/Property Relationship”, de Jean G. Riess, Artificial Organs 8: 34-56, 1984. Los fluorocarbonos oxigenables actúan como disolvente del oxı́geno. Disuelven el oxı́geno a las tensiones superiores y lo liberan a medida que disminuye la presión parcial; el dióxido de carbono es almacenado y liberado de una manera similar. Cuando se utiliza un fluorocarbono intravascularmente, la oxigenación del fluorocarbono se pro2 5 10 15 20 25 30 35 40 45 50 55 60 65 2 duce de manera natural a través de los pulmones. Sin embargo, el fluorocarbono puede oxigenarse antes del uso en aplicaciones tales como angioplastia coronaria transluminal percutánea, terapia de choque y conservación de órganos. En varias ocasiones se ha demostrado la respiración de lı́quido utilizando fluorocarbonos oxigenados. Por ejemplo, un animal sumergido en un lı́quido de fluorocarbono oxigenado puede intercambiar oxı́geno y dióxido de carbono normalmente cuando los pulmones se llenan con el fluorocarbono. Aunque aumenta el trabajo de respiración en experimentos de inmersión total, el animal puede extraer el adecuado oxı́geno para la supervivencia por respiración del lı́quido de fluorocarbono oxigenado. La respiración total de lı́quido, como terapia, presenta problemas importantes. La respiración de lı́quido en un ambiente hospitalario requiere un equipo dedicado de ventilación capaz de manipular lı́quidos. Además, la oxigenación del fluorocarbono que se respira debe realizarse por separado. Los costes de inversión asociados con la respiración de lı́quido son considerables. Las técnicas de ventilación parcial de lı́quido, como las reveladas en la solicitud de patente U.S. relacionada n◦ de serie 07/695.547 son una aplicación clı́nica segura y cómoda de respiración de lı́quido utilizando fluorocarbonos oxigenados. Existe una gran variedad de condiciones, estados o enfermedades pulmonares en las personas que pueden tratarse con medicamentos. Algunas condiciones resultan de defectos congénitos, ya sea como resultado de un nacimiento prematuro y de un desarrollo inadecuado de los pulmones, ya sea por anormalidades genéticas. Una de estas condiciones es el sı́ndrome de enfermedad respiratoria (RDS, de las siglas en inglés) que se produce en los niños prematuros. Otras condiciones de enfermedad resultan de los traumas en los pulmones inducidos por exposición a materia en partı́culas, agentes infecciosos o daños. El sı́ndrome de enfermedad respiratoria de los adultos (ARDS, de las siglas en inglés) resulta de traumas pulmonares en los adultos. Los agentes infecciosos (bacterianos, vı́ricos y fúngicos) pueden dañar los pulmones por infecciones locales y es bien conocido el tratamiento de tales enfermedades. Los pacientes inmunocomprometidos, tales como las personas que sufren del sı́ndrome de inmunodeficiencia adquirida (SIDA) o las personas que sufren tratamiento con fármacos para suprimir el rechazo inmunológico de órganos trasplantados tienen también mayor susceptibilidad a las infecciones de pulmón. El cáncer de pulmón afecta también a millares de personas en todo el mundo y frecuentemente origina su muerte. Estas enfermedades reflejan solo algunas de una gran variedad de condiciones o estados médicos asociados con la enfermedad pulmonar. Condiciones de surfactante del pulmón El surfactante del pulmón actúa para reducir la tensión superficial dentro de los alvéolos permitiendo ası́ que los alvéolos se mantengan abiertos bajo menor presión (The Pathologic Basis of Disease, Robbins y Cotran eds., W.B. Saunders Co., New York, NY 1979). El surfactante del pulmón cubre las superficies de los pulmones, fomenta 3 ES 2 136 315 T3 la dilatación alveolar y permite la transferencia de oxı́geno y de dióxido de carbono. La suplementación con surfactante es beneficiosa en varias terapias médicas incluyendo, por ejemplo, la de individuos con deficiencias congénicas de surfactante del pulmón. Algunos procesos médicos requieren que se añadan fluidos a los pulmones, por ejemplo como lavaje para eliminar materia endógena o exógena en pacientes con asma, fibrosis quı́stica o bronquiectasia. El lavaje con lı́quidos no surfactantes, tales como una disolución salina fisiológica, puede eliminar el surfactante natural del pulmón, aumentando ası́ el trauma en el pulmón. La suplementación de surfactante del pulmón puede aliviar este trauma. Actualmente, se utilizan suplementos de surfactantes terapéuticos en niños, cuando la cantidad de surfactante del pulmón presente es insuficiente para permitir la adecuada función respiratoria. La suplementación de surfactante se utiliza lo más comúnmente en sı́ndrome de enfermedad respiratoria (RDS), una forma especı́fica de la cual se conoce como enfermedad de la membrana hialina, cuando las deficiencias de surfactante comprometen la función pulmonar. La membrana hialina contiene fluido edematoso rico en proteı́nas y rico en fibrina mezclado con residuos celulares que impiden el intercambio gaseoso en los pulmones. Aunque la RDS es principalmente una enfermedad de niños neonatos, el sı́ndrome de la enfermedad respiratoria de los adultos (ARDS), una forma de la enfermedad en los adultos, tiene muchas caracterı́sticas similares y se presta a terapias similares. La RDS afecta hasta 40.000 niños por año en los Estados Unidos, siendo responsable anualmente de hasta 5.000 muertes de niños. La etiologı́a principal de la RDS se atribuye a insuficientes cantidades de surfactante pulmonar. Los niños prematuros nacidos antes de la semana 36 de gestación tienen el máximo riesgo debido al insuficiente desarrollo del pulmón. Los neonatos nacidos a menos de 28 semanas de la gestación tienen una probabilidad de 60-80 % de desarrollar RDS que puede ser una condición de amenaza de la vida. En el nacimiento, se requieren altas presiones inspiratorias para dilatar los pulmones. Cuando se hallan presentes cantidades normales de surfactante del pulmón, los pulmones retienen hasta el 40 % del volumen de aire residual después de la primera respiración. Con las respiraciones siguientes, menores presiones inspiratorias airean adecuadamente los pulmones debido a que los pulmones permanecen ahora parcialmente hinchados. Con bajos niveles de surfactante, tanto en niños como en adultos, los pulmones están prácticamente desprovistos de aire después de cada respiración. Los pulmones se aplastan con cada respiración y el individuo debe continuar esforzándose en cada respiración siguiente como si lo hiciera por primera vez. Ası́, se requiere una terapia exógena para facilitar la respiración y minimizar el daño al pulmón. Un niño prematuro no tiene el suficiente surfactante necesario para respirar independientemente al nacer. Debido a que los pulmones maduran rápidamente después del nacimiento, fre- 5 10 15 20 25 30 35 40 45 50 55 60 65 4 cuentemente sólo se requiere terapia durante tres o cuatro dı́as. Después de este perı́odo crı́tico el pulmón ha madurado suficientemente para dar al neonato una excelente probabilidad de recuperación. El sı́ndrome de enfermedad respiratoria de los adultos (ARDS) puede producirse como complicación de un trauma de pulmón inducido por choque, infección, quemadura o daño directo al pulmón, reacciones de inmunohipersensibilidad, hemorragia o por inhalación de irritantes que dañan el epitelio y el endotelio del pulmón. Histológicamente, el ARDS se presenta como un daño difuso de la pared alveolar acompañado por daño de capilaridad. Además, la posterior formación de membrana hialina crea una barrera al intercambio gaseoso que origina nueva pérdida del epitelio del pulmón conduciendo a una menor producción de surfactante y a focos de alvéolos colapsados o aplastados (atelectasia). Esto inicia un ciclo vicioso de hipoxia y daño al pulmón. Los tumores, los tapones mucosos o los aneurismos pueden también inducir atelectasia. En los casos avanzados de enfermedad respiratoria, tanto en neonatos como en adultos, los pulmones son macizos y están exentos de aire. Los alvéolos son pequeños y arrugados, mientras que los conductos alveolares proximales y los bronquios están sobredistendidos. Unas membranas hialinas forran los conductos alveolares y algunos alvéolos proximales dispersos. La amenaza crı́tica a la vida en enfermedades respiratorias es el inadecuado intercambio pulmonar de oxı́geno y de dióxido de carbono que origina acidosis metabólica. En los niños, la acidosis junto con el mayor esfuerzo requerido para llevar aire a los pulmones, es una combinación letal en aproximadamente el 20-30 % de los bebés afectados. Enfermedades quı́sticas Las enfermedades quı́stias son enfermedades crı́ticas del pulmón que producen espacios anormalmente grandes de aire en el parenquima del pulmón. En general son enfermedades quı́sticas broncógenas congénitas o quistes alveolares. Los quistes broncógenos son raras malformaciones congénicas frecuentemente asociadas con la enfermedad quı́stica del hı́gado, el riñón y el páncreas. Las cavidades quı́sticas están llenas o bien de secreciones mucinosas o de aire como consecuencia del hinchado bajo el continuo empuje de la presión respiratoria. La infección de los quistes, especialmente los que contienen secreciones, puede conducir a la metaplasia progresiva del epitelio que recubre el quiste, lo que puede originar necrosis y un absceso de pulmón. Los quistes alveolares son más comunes y pueden resultar de un desarrollo congénito anormal o de una enfermedad inflamatoria con fibrosis, envejecido y deterioro de la pared alveolar. Las paredes de los quistes alveolares son delgadas y frágiles mientras que el tejido pulmonar circundante está comprimido y es atelectático. De hecho, los quistes alveolares que pierden elasticidad estallan como un balón con cada inspiración. Las cavidades de los quistes están frecuentemente llenas de secreciones mucinosas que sirven de puntos de inicio para el desarrollo de infeccio3 5 ES 2 136 315 T3 nes que pueden fomentar la formación de abscesos originando el aplastado o colapso del pulmón o los enfisemas pulmonares intersticiales. Debido a que se acumulan excesivas secreciones en los pulmones, pueden requerir tratamientos de lavaje para limpiarlos del exceso de secreciones mucinosas a fin de facilitar la respiración menos fatigosa e impedir infecciones. Las enfermedades quı́sticas son de naturaleza progresiva conduciendo al deterioro de las fibras elásticas y de reticulina, lo que predispone el tejido a la rotura. Ası́, es importante tratar la enfermedad quı́stica tanto por alivio del esfuerzo de inhalación sobre el tejido quı́stico como por tratamiento de las frecuentes infecciones asociadas con los quistes. Cáncer de pulmón El cáncer de pulmón implica una parte significativa (5-8 %) de muertes en los Estados Unidos y en todo el mundo industrializado. Los cánceres que se originan en los pulmones son de manera general de uno de cuatro tipos: carcinoma de células escamosas (aproximadamente 30-40 % de todos los tumores de pulmón), adenocarcinoma (aproximadamente 30-40 %), carcinoma anaplástico de células grandes (menos de 10 %) y carcinoma anaplástico de células pequeñas (aproximadamente el 20 %). De éstos, los adenocarcinomas y los cánceres de células pequeñas son los más peligrosos debido a que tienden a metastizar a otros puntos del cuerpo. La mayor parte de los cánceres de pulmón se producen en las paredes bronquiales o sobre las mismas, cerca del punto de ramificación hacia la tráquea aunque los adenocarcinomas se producen frecuentemente entre los tercios medio y exterior del pulmón. Debido a que todas estas zonas están expuestas a los carcinógenos del aire, son susceptibles de desarrollo neoplástico. La exposición al aire también los hace tratables por administración de agentes quimioterapéuticos directamente en los pulmones por inhalación. Sin embargo, la terapia de inhalación tiene una aplicación limitada debido a que expone tanto al tumor como al tejido sano a reactivos quimioterapéuticos altamente tóxicos. Además, puesto que los tumores crecen dentro del pulmón, unas partes del tejido del pulmón pueden quedar relativamente blindadas por el tumor y por lo tanto inaccesibles a la terapia de inhalación. Debido a la gran variedad de enfermedades y desórdenes pulmonares que se producen en las personas, existe necesidad de formas eficaces para entregar medicamentos a los pulmones. Debido a que los pulmones sirven de punto principal de intercambio de compuestos con la sangre, la entrega o suministro pulmonar también puede utilizarse para entregar fármacos a la corriente o circulación sanguı́nea. La presente invención tiene la ventaja, sobre los métodos actuales de entrega de fármacos, de que es un sistema de entrega de medicamentos relativamente rápido, particularmente para la entrega a un tejido pulmonar seleccionado. Ası́, la presente invención tendrá una amplia aplicación terapéutica. Sumario de la invención Según un aspecto de la invención, se proporciona un juego o “kit” como se reivindica en las reivindicaciones 1-24, útil para la entrega pulmo4 5 10 15 20 25 30 35 40 45 50 55 60 65 6 nar de fármacos. La entrega pulmonar de fármacos incluye la introducción, en los pasos pulmonares de aire de un huésped o anfitrión mamı́fero, de un volumen de lı́quido de perfluorocarbono substancialmente equivalente a la capacidad residual funcional pulmonar del anfitrión o inferior a la misma. El método incluye además introducir un medicamento en polvo o un medicamento en otras micropartı́culas dispersado en un gas en los pasos pulmonares de aire del anfitrión, de modo tal que dicho lı́quido de perfluorocarbono y dicho medicamento en micropartı́culas se hallen simultáneamente presentes en los pasos pulmonares de aire del mamı́fero. Preferentemente, en dicho uso, se introduce un segundo volumen de un lı́quido de fluorocarbono después de la introducción de dicha suspensión gaseosa. Según una realización preferida de la presente invención, el lavaje con un lı́quido de fluorocarbono se realiza antes de la introducción de dicha suspensión gaseosa. Según otra realización preferida de la presente invención, dicho uso comprende las etapas de eliminar el lı́quido de fluorocarbono de los pasos pulmonares de aire. Ventajosamente, el lı́quido de perfluorocarbono comprende 1-bromo-heptadecafluo-octano (C8 F17 Br) perfluodecalina o fluorocarbono cı́clico. La presente invención también se refiere al uso de un medicamento en micropartı́culas y de un lı́quido de perfluorocarbono en la fabricación de una preparación farmacéutica para el tratamiento de una condición o estado pulmonar en un mamı́fero, en el cual uso dicho medicamento en micropartı́culas está dispersado en un gas respirable para formar una suspensión gaseosa, siendo introducida dicha suspensión gaseosa en los pasos pulmonares de aire de dicho mamı́fero después de la introducción pulmonar de un volumen de dicho lı́quido de fluorocarbono substancialmente equivalente a la capacidad residual funcional pulmonar del mamı́fero o inferior a la misma, de modo tal que dicho lı́quido de fluorocarbono y dicho medicamento en micropartı́culas se hallen simultáneamente presentes en los pasos pulmonares de aire del mamı́fero. Preferentemente, según dicho uso, se introduce un segundo volumen de un lı́quido de fluorocarbono después de la introducción de dicha suspensión gaseosa. Dicho uso comprende además la etapa de eliminar el lı́quido de fluorocarbono de los pasos pulmonares de aire. Preferentemente, el lı́quido de perfluorocarbono se elimina de los pasos pulmonares de aire por evaporación. En otra realización preferida, el lı́quido de perfluorocarbono se elimina de los pasos pulmonares de aire por medios mecánicos tales como aspiración o manipulación fı́sica. En una realización preferida, el volumen de lı́quido de perfluorocarbono introducido es equivalente a 0,01 % a 100 % de la capacidad residual funcional pulmonar del huésped o anfitrión. En otra realización, el volumen de lı́quido de perfluorocarbono es por lo menos de unos 1 %, 2 % o 5 % de la capacidad residual funcional pulmonar del anfitrión. Alternativamente, el volumen de lı́quido de perfluorocarbono es por lo menos el 10 % de 7 ES 2 136 315 T3 la capacidad residual funcional pulmonar del anfitrión. En otra realización preferida, el volumen de lı́quido de perfluorocarbono es por lo menos el 20 % de la capacidad residual funcional pulmonar del anfitrión. En una realización, el volumen de lı́quido de perfluorocarbono no es superior a unos 60 % o 75 % de la capacidad residual funcional pulmonar del anfitrión. En otra realización preferida, el volumen de lı́quido de perfluorocarbono no es superior a unos 40 % o 50 % de la capacidad residual funcional pulmonar del anfitrión. En aún otra realización, el volumen de lı́quido de perfluorocarbono no es superior a unos 15 %, 20 %, 25 % o 30 % de la capacidad residual funcional pulmonar del anfitrión. En una realización, el medicamento es un antibiótico. En otra realización, el medicamento es un antivı́rico. Preferentemente, el medicamento es un antibacteriano. En una realización preferida, el medicamento es un agente anticáncer. En una realización, el medicamento es un suplemento de surfactante. En otra realización, el medicamento es por lo menos una enzima. Preferentemente, la enzima es una proteinasa. En otra realización, la enzima es una desoxirribonucleasa. El medicamento, en otra realización, mejora la actividad del sistema inmunológico del anfitrión. En una realización preferida, el medicamento es un inmunosupresor. En otra realización preferida, el medicamento es un descongestionante. Descripción detallada de la invención El método de la presente invención provee a la entrega de un medicamento a los pasos pulmonares de aire de un huésped o anfitrión mamı́fero por medio de un procedimiento de varias etapas que implica la introducción de un lı́quido de perfluorocarbono en los pulmones y la introducción de un medicamento en forma de micropartı́culas. En una realización, la primera etapa es la introducción de un lı́quido de perfluorocarbono en los pulmones, seguida por una segunda etapa de introducción de un medicamento en micropartı́culas. En otra realización, la primera etapa es la introducción de un medicamento en micropartı́culas que se distribuye adicionalmente en los pulmones por medio de una segunda etapa de introducción de un lı́quido de perfluorocarbono en los pulmones. Otra realización del método implica, primero, introducir un lı́quido de perfluorocarbono en los pulmones, luego introducir un medicamento en micropartı́culas en los pulmones del anfitrión y luego introducir un segundo volumen de lı́quido de perfluorocarbono en los pulmones. En todas estas realizaciones, el lı́quido de perfluorocarbono puede sacarse de los pulmones por evaporación o por medios mecánicos tales como los tı́picamente utilizados en los procesos normales de lavaje, incluyendo la aspiración o la manipulación fı́sica del paciente tal como el bajar la cabeza del paciente para permitir que el lı́quido se drene hacia el exterior bajo la influencia de la gravedad. Por “pasos pulmonares de aire” se designan las partes de los pulmones ocupadas normalmente por aire, incluyendo los canales pulmonares, los espacios del interior de la tráquea, los bronquios izquierdos y derechos, los bronquiolos y los alvéolos. Por “anfitrión o huésped mamı́fero” se desig- 5 10 15 20 25 30 35 40 45 50 55 60 65 8 nan las personas y otros mamı́feros, con finalidades veterinarias o de investigación, incluyendo corderos, cerdos, conejos, gatos y perros. Por “medicamento en micropartı́culas” se designa un medicamento en forma de polvo, en suspensión microcristalina, en un clatrado con otros compuestos, en un aerosol, en una fase gaseosa, en una suspensión nebulizada o en cualquier otra forma de pequeñas partı́culas que pueden estar suspendidas en un gas que es bien conocido en la técnica, con la condición de que, en una realización preferida, no incluye un fármaco dispersado en un perfluorocarbono aerosolizado que es lı́quido a la temperatura corporal. Por “introducción de un medicamento en micropartı́culas” se designa o bien la inhalación activa por parte del anfitrión de un medicamento en suspensión gaseosa o bien la introducción pasiva en los pulmones del anfitrión por forzamiento del medicamento en micropartı́culas dispersado en un gas en el interior de los pasos pulmonares de aire. Por “lı́quido de perfluorocarbono” se designa cualquier compuesto de carbono fluorado con adecuadas propiedades fı́sicas de biocompatibilidad. Estas propiedades son de manera general poseı́das por los perfluorocarbonos que tienen baja viscosidad, baja tensión superficial, baja presión de vapor y alta solubilidad respecto al oxı́geno y al dióxido de carbono, que les hace capaces de fomentar fácilmente el intercambio de gases mientras están en los pulmones. El lı́quido de perfluorocarbono puede estar constituido por átomos de carbono y de fluor o puede ser un producto fluoquı́mico que tenga átomos distintos de exactamente el carbono y el fluor, por ejemplo bromo u otros substituyentes distintos del fluor. Sin embargo, se prefiere que el perfluorocarbono tenga por lo menos 3 o 4 átomos de carbono y/o que su presión de vapor a 37◦ C sea inferior a 760 torr. Los productos perfluoquı́micos representativos incluyen bis(F-alquil) etanos tales como C4 F9 CH=CH4 CF9 (designado a veces “F-44E”), i-C3 F9 CH=CHC6 F3 (“F-i36E”) y C6 F13 CH=CHC6 F3 (“F-66E”); fluorocarbonos cı́clicos, tales como C10 F18 (“F-decalina”, “perfluodecalina” o “FD C”), F-adamantano (“FA”), F-metiladamantano (“FMA”), F-1,3-dimetiladamantano (“FDMA”), F-di o F-trimetilbiciclo[3,3,1]nonano (“nonano”); aminas perfluoradas, tales como F-tripropilamina (“FTPA”) y F-tri-butilamina (“FTBA”), F-4-metiloctahidroquinolizina (“FMOQ”) F-n-metil-decahidroisoquinolina (“FMIQ”), F-n-metildecahidroquinolina (“FHQ”), F-n-ciclohexilpurrolidina (“FCHP”) y F-2-butiltetrahidrofurano (“FC-75” o “RM101”). Los perfluorocarbonos bromados incluyen 1-bromo-heptadecafluo-octano (C8 F17 Br, designado a veces como perfluooctilbromuro o “PFOB”), 1-bromopentadecafluoheptano (C7 F15 Br) y 1-bromotridecafluohexano (C6 F13 Br, conocido a veces como perfluohexilbromuro o “PFH B”). Otros fluorocarbonos bromados se revelan en la patente US n◦ 3.975.512 concedida a Long. También se contemplan los perfluorocarbonos que tienen substituyentes distintos del fluor, tales como cloruro de perfluooctilo, hidruro de perfluooctilo y compuestos similares que contienen diferentes números de átomos de carbono. 5 9 ES 2 136 315 T3 Los perfluorocarbonos adicionales contemplados de conformidad con esta invención incluyen éteres o poliéteres perfluoalquilizados, tales como (CF3 )2 CFO(CF2 CF2 )2 OCF(CF3 )2 , (CF3 )2 CFO (CF2 CF2 )3 OCF(CF3 ), (CF3 )CFO(CF2 CF2 )F, (C F3 )2 CFO(CF2 CF2 )2 F, (C6 F3 )2 O. Además, compuestos hidrocarbúricos de fluorocarbono, tales como por ejemplo compuestos que tienen la fórmula general Cn F2n+1 , Cn0 F2n0+1 , Cn F2n+1 OCn0 F2n0+1 , o Cn F2n+1 CF=CHCn0 F2n0+1 , en donde n y n’ son iguales o diferentes y son de unos 1 a unos 10 (en tanto el compuesto sea lı́quido a temperatura ambiente). Tales compuestos, por ejemplo, incluyen C8 F17 C2 H5 y C6 F13 CH=CHC6 H3 . Se observará que los ésteres, tioéteres y otros compuestos hidrocarbúricos de fluorocarbono mezclados modificados de varias maneras quedan comprendidos también dentro de la definición amplia de lı́quidos de “fluorocarbono” adecuados para el uso en la presente invención. Se contemplan también las mezclas de fluorocarbonos y se considera que caen dentro del significado de “lı́quidos de fluorocarbono” tal como se utiliza aquı́. Otros “fluorocarbonos” contemplados son los que tienen propiedades que se prestarı́an a intercambio pulmonar de gases incluyendo FC-75, FC-77, RM101, Hostinert 130, APF-145, APF-140, APF125, perfluodecalina, perfluooctilbromuro, perfluobutil-tetrahidrofurano, perfluopropil- tetrahidropirano, dimetil-adamantano, trimetil-biciclononano y sus mezclas. Los perfluorocarbonos preferidos están caracterizados por tener: (a) una franja media de peso molecular de unos 350 a 570; (b) una viscosidad inferior a unos 5 centipoises a 25◦C; (c) un punto de ebullición superior a unos 55◦C; (d) una presión de vapor de la franja de unos 5 a unos 75 torr y, más preferentemente, de unos 5 a unos 50 torr, a 25◦ C; (e) una densidad de la franja de unos 1,6 a unos 2 g/cm3 ; y (f) tensiones superficiales (con aire) de unas 12 a unas 20 dinas/cm. El lı́quido de perfluorocarbono se introduce tı́picamente en los pasos pulmonares de aire después de un perı́odo de por lo menos diez a quince minutos de respirar oxı́geno puro. El perfluorocarbono puede introducirse convencionalmente por simple inyección del lı́quido en un tubo endotraqueal y a través del mismo entre respiraciones. Alternativamente, puede entregarse como lı́quido bajo presión, como se hace durante la respiración de lı́quido. Además, un aerosol de prefluorocarbono lı́quido puede inhalarse o bien a través de la nariz o bien de la boca. En la solicitud de patente U.S. relacionada n◦ de serie 07/695.547 se describen técnicas de ventilación parcial de lı́quido utilizando fluorocarbonos oxigenados. El volumen de lı́quido de perfluorocarbono introducido en los pasos pulmonares de aire debe ser substancialmente equivalente a 0,01 % a 100 % de la capacidad residual funcional pulmonar normal (FRC, de las siglas en inglés) del huésped o anfitrión. Por “capacidad residual funcional pulmonar” se designa el volumen del espacio de los pasos pulmonares de aire al final de la espiración. Para diferentes aplicaciones, se prefieren diferentes cantidades de perfluorocarbono. En una realización, el volumen de lı́quido de perfluorocarbono es por lo menos el 1 %, 2 %, 3 % o 5 % de la FRC 6 5 10 15 20 25 30 35 40 45 50 55 60 65 10 pulmonar del anfitrión. Preferentemente, el volumen de lı́quido de perfluorocarbono es por lo menos el 10 % de la FRC pulmonar del anfitrión. En otra realización, el volumen de lı́quido perfluorocarbono es de por lo menos el 20 % de la FRC pulmonar del anfitrión. En otras realizaciones preferidas, el volumen de lı́quido de perfluorocarbono no es superior al 30 %, 50 % o 75 % de la FRC pulmonar del anfitrión. Alternativamente, el volumen de lı́quido de perfluorocarbono no es superior al 20 % de la FRC pulmonar del anfitrión. La FRC pulmonar normal del anfitrión se calcula por métodos bien conocidos en la técnica. Los entendidos en la técnica observarán que los volúmenes preferidos de llenado de los pulmones con perfluorocarbonos pueden hallarse dentro de ciertas franjas en vez de ser porcentajes determinados. Ası́, realizaciones preferidas de la invención incluyen la administración de perfluorocarbono de 0,01-1 %, 0,01-10 %, 1-10 %, 1-20 %, 5-50 %, 10-70 %, 50-75 %, 50-100 % y 75-100 % de la FRC pulmonar del anfitrión, calculada utilizando métodos normales conocidos en la técnica. El llenado parcial del pulmón con perfluorocarbono: (a) mantiene la FRC e impide el cierre alveolar inducido por la tensión superficial durante la espiración; (b) reduce la tensión superficial en gran parte de la superficie alveolar en que el perfluorocarbono queda contra el forro alveolar, y (c) proporciona un medio de baja tensión superficial para el intercambio del fármaco en polvo u otras micropartı́culas entregado por inhalación o por forzamiento de una suspensión gaseosa hacia el interior de los pulmones. En una realización, la suspensión gaseosa se introduce por medio de un aparato respirador convencional de ventilación con gas. Por no exceder la FRC del paciente, se evita el barotrauma asociado con la respiración de lı́quido y se impide el esfuerzo mecánico añadido causado por la inhalación o introducción forzada del fármaco en polvo. La entrega del perfluorocarbono a un solo lóbulo (unilateral) o a una parte local (lobar, segmentaria) se contempla también. Junto con el tratamiento con perfluorocarbono y medicamento, puede también emplearse una respiración de presión positiva continua utilizando un ventilador convencional. Esto es particularmente deseable cuando el perfluorocarbono se mantiene en los pulmones para facilitar la entrega de fármaco durante perı́odos relativamente largos (hasta de unas 3 horas). Esto puede lograrse utilizando un volumen de perfluorocarbono de unos 100 % de la FRC del paciente y/o utilizando un perfluorocarbono de una presión de vapor relativamente baja, debido a que ambas cosas impiden la rápida evaporación del perfluorocarbono. Algunos fluorocarbonos que tienen una presión de vapor relativamente alta pueden ser útiles para la terapia con fármacos en la cual una sola dosis de fármaco es rápidamente administrada, tal como para los fármacos que son rápidamente absorbidos a través del tejido del pulmón. Sin embargo, las altas presiones de vapor los hacen menos adecuados para el uso en entrega facilitada de fármacos, en la cual el fármaco debe permanecer en los pulmones durante un perı́odo de tiempo más largo (horas). Los lı́quidos de fluorocarbo- 11 ES 2 136 315 T3 no contemplados para tal entrega de fármaco a largo plazo incluyen PFOB, F-nonmamo, FDMA, F-adamatano, F66E, Fi36E, PFoCl y PFoH. Las presiones de vapor inferiores son además importantes desde el punto de vista económico debido a que unos considerables porcentajes de fluorocarbono, que tiene una alta presión de vapor, se perderı́an debido a la evaporación durante las terapias a largo plazo. Después de la entrega de medicamento facilitada por el perfluorocarbono, el lı́quido de perfluorocarbono puede eliminarse de los pasos pulmonares de aire. La técnica preferida para esta particular finalidad es simplemente permitir que el perfluorocarbono se evapore de los pasos pulmonares de aire. Puede utilizarse una ventilación por gas de presión positiva utilizando un ventilador convencional para facilitar la evaporación durante o después del tratamiento, lo que origina una evaporación substancialmente completa desde los pulmones en un perı́odo de tiempo (determinado por la presión de vapor del perfluorocarbono) del orden de horas en los casos en los que el perfluorocarbono llena una fracción importante de la FRC del paciente. El fluorocarbono preferido debe tener caracterı́sticas funcionales que permitan su temporalidad de uso para la entrega facilitada de medicamento debido a que permite además el hinchado de las partes aplastadas del pulmón, el intercambio gaseoso (oxı́geno y dióxido de carbono) y/o sirve como surfactante del pulmón. Los fluorocarbonos son biocompatibles y la mayorı́a pueden ser sometidos a técnicas de esterilización. Por ejemplo, pueden ser esterilizados con calor bajo presión (utilizando un autoclave) o ser esterilizados por radiación. Además, se contempla también la esterilización por ultrafiltración. Pueden utilizarse muchos medicamentos distintos como terapéuticos con el uso del método de la presente invención. Todos deben ser en una forma tal que sea una suspensión en micropartı́culas para la inhalación o para la introducción forzada en los pulmones. Preferentemente, se introduce medicamento en polvo. El polvo puede ser obtenido por métodos normales de secado y de trituración o por secado por congelación y dispersión del medicamento en un gas. La inhalación o la introducción forzada (presión positiva), ya sea nasal, ya sea oral, de los medicamentos pueden lograrse por cualquier método de varios métodos conocidos en la técnica. Estos métodos incluyen la suspensión mecánica por agitación del medicamento en una cámara cerrada, seguida por inhalación, o la introducción forzada de la suspensión a partir de una abertura de la cámara. Las micropartı́culas pueden inhalarse a partir de sistemas normales de entrega de aerosoles que son bien conocidos en la técnica. El anfitrión puede recibir una suspensión en partı́culas que esté dispuesta en una corriente de aire, tal como por inyección del fármaco en polvo en un tubo de ventilación de presión positiva o en un tubo endotraqueal en el momento de la inspiración o cuando el aire es forzado hacia el interior de los pulmones. Pueden inyectarse mecánicamente dosis medidas en tales dispositivos. El medicamento en polvo puede dispersarse en el aire utilizando el efecto 5 10 15 20 25 30 35 40 45 50 55 60 65 12 Venturi, en el cual el aire es movido en ángulo recto a través de un tubo Venturi causando que el fármaco en polvo sea aspirado a través del tubo y dispersado en el aire que es inhalado o introducido mecánicamente en los pulmones. La entrega pulsante de medicamento en un volumen de gas y la inhalación del bolo aerosolizado es también conocida en la técnica como se describe en la solicitud publicada PCT WO 9407514 y las técnicas de entrega descritas en dicha solicitud pueden utilizarse en la presente invención. Los perfluorocarbonos pueden servir como surfactante temporal del pulmón debido a que son biológicamente compatibles, disminuyen la tensión superficial suficientemente dentro de los alvéolos, cubren fácilmente la superficie del pulmón y fomentan el intercambio de oxı́geno y de dióxido de carbono. Cuando se utilizan conjuntamente con la introducción de un medicamento en polvo u otra forma de micropartı́culas, el perfluorocarbono puede facilitar la entrega del medicamento a los pulmones en donde es absorbido por el tejido del pulmón o en donde actúa sobre las substancias que cubren el tejido del pulmón tales como la membrana hialina o las infecciones fúngicas. La entrega de fármacos mejorada con perfluorocarbono puede también utilizarse para entregar fármacos sistémicamente por administración del fármaco a los pulmones en donde tiene lugar la translocación a través de las membranas pulmonares, permitiendo que el fármaco entre rápidamente en el sistema sanguı́neo. Los suplementos de surfactante terapéuticos entregados por medio de perfluorocarbono, un lı́quido oxigenable biocompatible, beneficiarı́a a los individuos a los cuales, por cualquiera de varias razones, les faltan los niveles normales de surfactante del pulmón. Utilizando la presente invención, puede entregarse directamente surfactante suplementario en polvo a la zona afectada de los pulmones al tiempo que permitir que prosiga el normal intercambio de oxı́geno/dióxido de carbono. Debido a que el perfluorocarbono tiene por lo menos alguna de las propiedades funcionales de un surfactante de pulmón puede utilizarse en lavaje. Cuando se combina con la introducción de cualquiera de varias substancias medicinales en polvo u otras micropartı́culas, el lavaje puede ser adicionalmente ventajoso. El método descrito aquı́ es particularmente adecuado para el tratamiento de enfermedades quı́sticas debido a que el lı́quido de perfluorocarbono llena los quistes y los mantiene abiertos en una posición relativamente estática aliviando ası́ el esfuerzo mecánico sobre el tejido quı́stico. La introducción de antibióticos en polvo en los pulmones, ya sea por inhalación ya sea por introducción forzada del fármaco, se utiliza entonces para tratar directamente cualquier infección de los quistes. El método no sólo alivia el esfuerzo durante la inhalación sino que también concentra el fármaco directamente en el punto de la infección. Debido a que los perfluorocarbonos son relativamente densos comparados con los fluidos corporales, el perfluorocarbono tenderá a hundirse y a llenar la cavidad del quiste, manteniéndolo ası́ abierto para 7 13 ES 2 136 315 T3 la entrega del antibiótico con la inhalación. La administración directa del fármaco a los quistes también evita la necesidad de la administración sistémica de antibióticos que conduce a la pérdida de flora intestinal. Esto es especialmente importante en individuos con enfermedad quı́stica crónica que corren constantemente el peligro de desarrollar infecciones de pulmón debido a la presencia de secreciones mucinosas en los quistes y están ası́ expuestos a un tratamiento repetido con antibióticos. Puede utilizarse perfluorocarbono en un volumen suficiente para combinar la entrega facilitada de fármaco con el lavaje del pulmón para el tratamiento de la enfermedad quı́stica. Si se acumulan secreciones mucinosas dentro de los quistes, puede administrarse perfluorocarbono en un volumen que se aproxime al 100 % de la capacidad residual funcional pulmonar. El antibiótico en polvo se administra entonces por inhalación o por introducción forzada de una suspensión gaseosa de micropartı́culas. Después de un tiempo suficiente para permitir la absorción del fármaco por el tejido del pulmón, puede eliminarse cualquier perfluorocarbono restante utilizando lavaje u otras técnicas bien conocidas en el campo del tratamiento pulmonar. Debido a que el perfluorocarbono es relativamente denso en comparación con las secreciones mucinosas, el perfluorocarbono tenderá a desplazar las secreciones de los quistes, y la posterior eliminación del perfluorocarbono facilitará la eliminación simultánea de las secreciones mucinosas acumuladas. La introducción de agentes anticáncer directamente en los pulmones por inhalación o introducción de presión positiva de una suspensión gaseosa de micropartı́culas puede utilizarse para tratar tumores del pulmón. Este tipo de terapia deja expuesto tanto el tejido sano como el tumoroso al fármaco anticáncer, la mayorı́a de los cuales son citotóxicos. El tejido sano del pulmón puede ser blindado respecto al agente anticáncer tóxico tratando primero al paciente con suplementos de surfactante utilizando el método mejorado de entrega con perfluorocarbono. Entonces, puede administrarse selectivamente el agente anticáncer a la zona del tumor utilizando el método mejorado de entrega con perfluorocarbono. Debido a que los perfluorocarbonos son más densos que el agua y el tejido corporal tienden a hundirse o a estancarse en ciertas partes de los pulmones según la orientación del paciente. Orientando el paciente hacia una posición que favorezca la acumulación del perfluorocarbono administrado cerca del tejido canceroso del pulmón, los fármacos anticáncer en polvo introducidos se localizan selectivamente en la zona afectada por el tumor. El método de combinar el tratamiento con perfluorocarbono lı́quido y la inhalación o introducción forzada de una suspensión gaseosa de compuestos terapéuticos tiene varias ventajas respecto a otras formas de entrega de fármaco. La entrega mejorada con perfluorocarbono puede utilizarse para medicamentos que de otra forma serı́an ineficaces o se destruirı́an por entrega sistémica. Por ejemplo, las proteı́nas usualmente no pueden administrarse oralmente debido a que son destruidas en el tracto alimentario. Algu8 5 10 15 20 25 30 35 40 45 50 55 60 65 14 nas proteı́nas pueden inducir graves reacciones alérgicas y causar shock en el anfitrión mamı́fero si se administran sistémicamente, por ejemplo intramuscular o intravenosamente. Además, utilizando perfluorocarbono conjuntamente con un medicamento, el medicamento puede ser dirigido a partes particulares del pulmón debido a la densidad relativa del perfluorocarbono en comparación con el tejido corporal. Orientando el paciente de manera apropiada, el perfluorocarbono puede acumularse selectivamente en ciertos alvéolos manteniéndolos abiertos y haciéndolos ası́ relativamente más accesibles a la suspensión de medicamento introducida. En cada caso, la cantidad de fármaco utilizada debe ser una cantidad eficaz para el tratamiento local o sistémico de la condición o estado que se desea tratar. Pueden determinarse fácilmente las cantidades eficaces de los productos farmacéuticos ya sea empı́ricamente ya sea consultando publicaciones normales de referencia. Además de para la entrega mejorada de fármacos, pueden utilizarse lı́quidos de perfluorocarbono para eliminar el material endógeno o extraño del interior de los pulmones. Las disoluciones salinas fisiológicas convencionales utilizadas en los lavajes pueden substituirse por lı́quido de perfluorocarbono. Debido a que los perfluorocarbonos son oxigenables, proporcionan oxı́geno a la persona durante el tratamiento permitiendo un proceso de lavaje más largo y menos peligroso. Además, debido a que algunos perfluorocarbonos tienen propiedades de surfactante del pulmón, se minimiza la eliminación del surfactante natural del pulmón. La densidad de los lı́quidos de perfluorocarbono es de manera general el doble de la densidad del agua y del tejido corporal lo que permite que el perfluorocarbono se hunda hacia abajo y desplace el material a eliminar. Entonces, cuando el perfluorocarbono se elimina por medios mecánicos bien conocidos en la práctica del lavaje, el material desplazado flotará y será simultáneamente eliminado. Estas propiedades son particularmente importantes cuando el lavaje se combina con entrega de fármacos mejorada con perfluorocarbono como tratamiento completo, por ejemplo, de un paciente con fibrosis quı́stica cuyos pulmones acumulan un exceso de secreciones mulcinosas. Los principios generales de la presente invención pueden apreciarse más completamente con referencia a los siguientes ejemplos no limitativos. Ejemplo 1 Entrega de suplementos de surfactante Los suplementos de surfactante en polvo son beneficiosos para tratar individuos con deficiencias de surfactante del pulmón incluyendo niños prematuros con RDS (nacidos antes de 36 semanas de gestación) y adultos con ARDS que resulte de traumas del pulmón. Un adulto que tenga ARDS debido a daños por quemaduras e inhalación de humo resultantes de hallarse en un edificio incendiado tiene gravemente dañado el epitelio y el endotelio del pulmón, junto con daños de capilaridad. Debido al daño del epitelio el paciente ha disminuido también la producción de surfactante y tiene focos de alvéolos colapsados o aplastados (atelectasia) que conducen a una hipo- 15 ES 2 136 315 T3 xia localizada. El paciente se trata utilizando el método de entrega mejorada con perfluorocarbono en el cual el medicamento inhalado o introducido por forzamiento de una suspensión gaseosa de micropartı́culas es un suplemento de surfactante en forma de polvo. El paciente se coloca en un ventilador convencional y se le deja respirar oxı́geno puro durante aproximadamente diez a quince minutos. Entonces se introduce lı́quido de perfluorocarbono en los pasos pulmonares de aire inyectando el lı́quido en un tubo endotraqueal y a través del mismo entre respiraciones de aire suministrado por ventilación continua de presión positiva. El volumen de lı́quido de perfluorocarbono introducido en los pasos pulmonares de aire es substancialmente equivalente al 100 % de la capacidad residual funcional pulmonar normal (FRC) del paciente, calculada por métodos conocidos en la técnica. El lı́quido de perfluorocarbono introducido es un lı́quido que tiene una presión de vapor relativamente baja debido a que el suplemento de surfactante debe permanecer en los pulmones durante un perı́odo mayor de tiempo (horas). Ası́, se administra uno de los siguientes o una combinación de los mismos: PFOB, F-nonmamo, FDMA, F-adamatana, F66E, Fi36E, PFoCl y PFoH. Suplementos de surfactante compuestos por proteı́nas (SP-A, SP-B y SP-C) derivadas de extractos preparados a partir de lavaje de pulmón humano o animal se administran por inhalación de una forma en polvo del suplemento. Otro agente terapéutico en micropartı́culas que sirve como surfactante del pulmón incluye mezclas sintéticas de fosfolı́pidos, incluyendo una mezcla de difosfatidilcolina y de fosfoglicerol en una relación de 7:3. El surfactante en polvo se administra por inhalación en la cual el material en micropartı́culas se inyecta periódicamente como suspensión fina en la tuberı́a de ventilación de presión positiva o a través del tubo endotraqueal en el momento de la inspiración. El surfactante es o bien del tipo proteináceo o bien del tipo fosfolipı́dico o una mezcla de ambos, según el grado del daño del pulmón tal como lo determina el médico que efectúa el tratamiento. Después de la inhalación de la suspensión de suplemento de surfactante, se administra un segundo volumen de lı́quido de perfluorocarbono para garantizar una dispersión completa del surfactante por todas las superficies del tejido del pulmón. El segundo volumen de perfluorocarbono garantizará también que los alvéolos permanezcan abiertos debido a la presencia de lı́quido de perfluorocarbono en los alvéolos entre los tratamientos con suplemento de surfactante. Según el grado de daño del tejido, la entrega mejorada con perfluorocarbono del suplemento de surfactante se repite periódicamente. A medida que progresa la curación y el surfactante natural del paciente es substituido por surfactante suplementario, puede dejarse que el perfluorocarbono se evapore completamente entre dosificaciones del surfactante suplementario. A medida que progresa la curación y los alvéolos permanecen abiertos incluso sin perfluorocarbono intraalveolar, las posteriores dosificaciones de surfactante suplementario pueden inhalarse después de la adminis- 5 10 15 20 25 30 35 40 45 50 55 60 65 16 tración de menores volúmenes de lı́quido de perfluorocarbono (0,01 % a 10 % de la FRC normal del paciente) y/o uso de perfluorocarbonos con una presión de vapor relativamente alta, incluyendo F44E, FDC, FTPA, FMOQ, FMIQ, FHQ, FCHP, FC-75, RM-101, C7 F15 Br y C6 F3 Br. Además de la entrega de productos terapéuticos para el tratamiento de tejido de pulmón dañado, el método puede utilizarse también para administrar fármacos anticáncer a un paciente que sufra de cáncer de pulmón. Puede entregarse cualquiera de varios fármacos anticáncer que pueda formularse para dar una forma en micropartı́culas, incluyendo fármacos quimioterapéuticos (por ejemplo, adriamicina), un radionúclido (solo o enlazado a un anticuerpo especı́fico del cáncer) y una toxina tal como una ricina (sola o enlazada con un anticuerpo especı́fico del cáncer). Ejemplo 2 Entrega de un fármaco anticáncer Un paciente que sufre de adenocarcinoma en la mitad de los tercios de medio a exterior del pulmón, que no se ha metastasado a otros puntos del cuerpo, se trata con doxorrubicina-HCl en R ), un agente cipolvo (por ejemplo, Adriamycin totóxico activo contra varios tumores sólidos. La doxorrubicina es un antibiótico que destruye selectivamente células malignas y causa la regresión del tumor por enlazado a ácidos nucléicos. El paciente se orienta primero en una posición en la cual la zona afectada por el tumor está situada en un punto gravitatoriamente bajo, de modo que el perfluorocarbono lı́quido se estanque selectivamente alrededor de la zona. Se deja que el paciente respire oxı́geno puro durante aproximadamente diez a quince minutos antes de que se introduzca lı́quido de perfluorocarbono en los pasos pulmonares de aire bajo presión como en la respiración de lı́quido. Se introduce un volumen de lı́quido de perfluorocarbono substancialmente equivalente a 0,1 % a 50 % de la FRC pulmonar normal del paciente (calculada por métodos bien conocidos en la técnica). La cantidad dependerá del tamaño y de la ubicación del tumor, de modo que el perfluorocarbono introducido tienda a estancarse alrededor del tejido canceroso. Puede preferirse la entrega unilateral o local (lobar, segmentaria) según la ubicación del tumor. Se utiliza un lı́quido de perfluorocarbono con una presión de vapor relativamente baja debido a que debe permanecer en los pulmones durante un perı́odo más largo (horas) para la administración eficaz de quimioterapéutico. Los perfluorocarbonos preferidos incluyen PFOB, F-nonmamo, FDMA, F-adamatano, F66E, Fi36E, PFoCl y PFoH, administrados solos o en combinación. Entonces se inhala doxorrubicina en polvo secada por congelación, con una dosificación determinada por el médico según el tamaño del tumor a tratar. De manera general, se inhalan 10 mg o menos por dosificación y las dosis acumulativas no deben sobrepasar nunca los 550 mg/m2 debido a que una sobredosificación aumenta el peligro de cardiomiopatı́a y del resultante fallo cardı́aco. Debido a que la doxorrubicina también provoca graves necrosis del tejido local, debe tenerse cui- 9 17 ES 2 136 315 T3 dado en limitar la exposición del tejido sano al fármaco. La inhalación de suplementos de surfactante (véase el Ejemplo 1) puede combinarse con el tratamiento de quimioterapia. Administrando suplementos de surfactante a toda la superficie del pulmón antes de la administración de la doxorrubicina, puede protegerse el tejido sano respecto a la citoxicidad del fármaco anticáncer. Administrando suplementos de surfactante a toda la superficie del pulmón después de la administración de doxorrubicina, puede substituirse en el pulmón el surfactante perdido debido al ataque quı́mico del tejido normal. El paciente permanece orientado en la posición que fomenta la entrega mejorada por perfluorocarbono al tumor hasta que todo el perfluorocarbono se ha disipado por evaporación. Entonces se deja que el paciente permanezca de manera normal. Se contemplan también, para el uso como quimioterapéuticos con este método, otros antimetabolitos antineoplásticos, solos o en combinación. Incluyen 5-fluor-2,4-(1H,3H)-pirimidinadiona (“5-FU”), sulfato de vinblastina (especialmente para carcinomas que son resistentes a otros agentes quimioterapéuticos) y metotrexato (particularmente para cánceres de pulmón de célula escamosa y de célula pequeña). Debido a que todos los antimetabolitos antineoplásticos son altamente tóxicos, la administración debe ser cuidadosamente supervisada por un médico cualificado con experiencia en quimioterapia del cáncer. La administración de productos quimioterapéuticos utilizando este método debe realizarse, por lo menos inicialmente, mientras el paciente está hospitalizado para vigilar el paciente en cuanto a existencia de toxicidad, especialmente hemorragias del punto tratado. Un paciente con bronquitis, asociada con condiciones o estados de gripe, de costipado o condiciones crónicas incluyendo enfisema, tiene un exceso de secreción mucosa en el árbol bronquial. Las secreciones mucosas acumuladas sirven de puntos principales para el desarrollo de bacterias u hongos en los pulmones infectados. Las infecciones que se producen conjuntamente con la enfermedad respiratoria pueden tratarse también utilizando el método de entrega mejorada de antibióticos. Ejemplo 3 Entrega de antibiótico para el tratamiento de la infección asociada con la bronquitis Un niño hospitalizado con una grave bronquitis resultante de la gripe se trata con trihidrato de amoxicilina (“amoxicilina”), un antibiótico semisintético de actividad bactericida de espectro amplio contra organismos gram-positivos y gramnegativos incluyendo estreptococos, neumococos y estafilococos que no producen penicilinasa. El niño se coloca en un ventilador de presión positiva del que respira oxı́geno puro durante unos diez a quince minutos. Entonces, se introduce perfluorocarbono en los pulmones bajo presión como en la respiración de lı́quido. Se introduce un volumen de lı́quido de perfluorocarbono substancialmente equivalente a 0,1 % a 50 % de la capacidad residual funcional pulmonar normal del niño (calculada por métodos bien conocidos en la técnica). 10 5 10 15 20 25 30 35 40 45 50 55 60 65 18 Se prefieren perfluorocarbonos con una presión de vapor relativamente alta, incluyendo F44E, FDC, FTPA, FMOQ, FMIQ, FHQ, FCHP, FC-75, RM101, C7 F5 Br y C6 F3 Br, debido a que se evaporarán más fácilmente por respiración normal o asistida con ventilador después de que se acabe el tratamiento. Después de que se ha administrado el perfluorocarbono, se introduce en los pulmones del niño una dosificación de amoxicilina en polvo de aproximadamente 1 a 10 mg/kg bajo presión suministrada por el ventilador de presión positiva. La evaporación del perfluorocarbono se produce durante la respiración asistida con el ventilador después del tratamiento con antibiótico. Debido a que el antibiótico se entrega en el punto o lugar de la infección, la cantidad de antibiótico utilizado disminuye en comparación con las dosificaciones orales normales (40 mg/kg/dı́a en dosificaciones divididas cada 8 horas). El mismo tratamiento se repite en una segunda dosificación aproximadamente 8 horas más tarde y después a intervalos de 8 horas hasta que la infección resulta estar controlada por el fármaco. Después de un tratamiento o unos pocos tratamientos utilizando entrega de antibiótico mejorada con perfluorocarbono, el niño puede mantenerse con dosificaciones orales normales de amoxicilina. Además de los antibióticos, pueden incluirse descongestionantes (por ejemplo efedrina HCl) en forma de micropartı́culas en la dosificación introducida de antibiótico para limitar las secreciones mucosas. Además, si existen pruebas de daños por infección del tejido del pulmón, pueden incluirse suplementos de surfactante (véase el Ejemplo 1) durante la inhalación del antibiótico. Los pacientes inmunocomprometidos tales como los afectados por SIDA o los que toman fármacos inmunosupresores para evitar el rechazo de trasplantes son más susceptibles que lo habitual a las infecciones que incluyen las infecciones pulmonares. El método de entrega de fármacos mejorada por perfluorocarbono puede utilizarse para tratar tales pacientes. Ejemplo 4 Tratamiento de la infección del pulmón de un paciente inmunocomprometido Un adulto con SIDA se presenta en un local de urgencias con un alto grado de fiebre y congestión bronquial indicando que tiene una infección pulmonar. Se le trata con amoxicilina utilizando la entrega mejorada con perfluorocarbono como en el Ejemplo 3, excepto que el lı́quido de perfluorocarbono se introduce antes y después de la introducción de una dosificación para adultos de amoxicilina en polvo de aproximadamente 10 a 100 mg cada 8 horas. Debido a su estado inmunocomprometido y a su mayor probabilidad de colapso o aplastado alveolar que resulta de su estado debilitado, la introducción del lı́quido de perfluorocarbono antes de la introducción del antibiótico garantizará que los alvéolos están abiertos. La introducción de lı́quido de perfluorocarbono después de la introducción del antibiótico garantizará una dispersión completa del antibiótico a todo el tejido del pulmón. Se introduce en ambos casos un volumen de lı́quido de perfluorocarbono substancialmente equivalente al 50 % de su capacidad re- 19 ES 2 136 315 T3 sidual funcional pulmonar normal (calculada por métodos bien conocidos en la técnica). Después de uno o dos dı́as de entrega de amoxicilina mejorada con fluorocarbono, se pasa a dosificaciones orales de 500 mg cada 8 horas durante aproximadamente 8 a 10 dı́as. Los macrófagos alveolares son células fagocı́ticas que migran hacia los pulmones en respuesta a la irritación, en donde rodean y eliminan objetos extraños tales como bacterias o partı́culas extrañas. El tratamiento mejorado con perfluorocarbono mediante agentes que aumentan la actividad de los macrófagos alveolares acelera la eliminación de irritantes extraños en los pulmones. Ejemplo 5 Entrega de factores inmunológicamente activos para mejorar la actividad de los macrófagos pulmonares La inmunidad mediada por células depende de las células denominadas macrófagos que atacan los objetos extraños y los patógenos rodeándolos y eliminándolos del cuerpo por medio de digestión proteolı́tica y eliminación fı́sica hacia el sistema linfático. Los macrófagos migran hacia los pulmones cuando se hallan presentes irritantes extraños. Los macrófagos son activados por las linfocinas que son proteı́nas producidas por ciertas clases de células T. Desgraciadamente, este proceso puede ser lento debido a que implica una cascada de eventos: los macrófagos rodean al invasor extraño y lo digieren parcialmente; los macrófagos presentan antı́genos derivados del invasor en su superficie de célula; estos antı́genos son entonces reconocidos por las células T especı́ficas del antı́geno que a su vez producen linfocinas para solicitar la migración de otras células fagocı́ticas al punto en cuestión. Por entrega a los pulmones de linfocinas identificadas de activación de los macrófagos, poco después de la exposición a irritantes bacterianos o en partı́culas, se aumenta el proceso de eliminación mediada por los macrófagos y la eliminación del irritante se produce más rápidamente. La interleucina-2 (IL-2) es una linfocina multifuncional que mejora la actividad de los macrófagos. Un trabajador de una planta de procesado de productos quı́micos que ha estado expuesto a una gran cantidad de irritante en partı́culas como resultado de un accidente industrial presenta una grave enfermedad respiratoria. Primero los pulmones del paciente se tratan por lavaje con lı́quido de perfluorocarbono (utilizando un volumen igual al 100 % de la FRC pulmonar del paciente) utilizando técnicas de lavaje bien conocidas en el sector para eliminar la mayorı́a de los materiales en partı́culas que se sueltan fácilmente. El lı́quido de perfluorocarbono es eliminado mecánicamente utilizando técnicas normales de lavaje. Entonces el paciente se trata con IL-2 en polvo utilizando el método de entrega mejorada con perfluorocarbono. El paciente se coloca en un ventilador convencional y se le deja respirar oxı́geno puro durante aproximadamente diez a quince minutos antes de introducir lı́quido de perfluorocarbono en los pasos pulmonares de aire por inyección del lı́quido en un tubo endotraqueal y a través del mismo, entre respiraciones. El volumen de lı́qui- 5 10 15 20 25 30 35 40 45 50 55 60 65 20 do de perfluorocarbono introducido es substancialmente equivalente al 100 % de la FRC pulmonar normal del paciente, calculada por métodos bien conocidos en la técnica. El lı́quido de perfluorocarbono introducido es un lı́quido que tiene una presión de vapor relativamente baja debido a que el suplemento de surfactante puede permanecer en los pulmones durante un perı́odo de horas. Ası́, se administra un agente o una combinación de agentes de entre PFOB, F-nonmamo, FDMA, F-adamatano, F66E, Fi36E, PFoCl y PFoH. Se administra IL-2 por introducción de una forma en micropartı́culas que se inyecta como una suspensión fina en la tuberı́a de ventilación de presión positiva o a través del tubo endotraqueal durante una ventilación de presión positiva. Otros agentes terapéuticos en micropartı́culas que pueden servir como suplementos de surfactante del pulmón (véase el Ejemplo 1) pueden incluirse también si el médico que efectúa el tratamiento sospecha daños en el surfactante o en el tejido subyacente causados por la inhalación de las partı́culas de productos quı́micos o por el posterior lavaje. Pueden realizarse múltiples inhalaciones de IL-2 y de suplementos de surfactante mientras el perfluorocarbono permanece en el pulmón. Alternativamente, una sola inhalación de IL-2 puede ir seguida por varias inhalaciones de suplemento de surfactante para mantener la superficie alveolar durante la fagocitosis de las partı́culas extrañas. Después del tratamiento, el perfluorocarbono se disipa por evaporación durante la respiración normal. La inflamación aguda de los pulmones que se produce después de la exposición a partı́culas nocivas que producen una reacción alérgica puede tratarse con la entrega mejorada con perfluorocarbono de fármacos inmunosupresores. Ejemplo 6 Tratamiento de reacción inflamatoria aguda por entrega de fármaco inmunosupresor Cuando los macrófagos y las células polimorfonucleares invaden rápidamente el tejido pulmonar en respuesta a la exposición a una partı́cula nociva o virulenta, los pulmones se inflaman conduciendo a una gran incomodidad y dificultad de respiración. Los fármacos inmunosupresores incluyendo esteroides antiinflamatorios se utilizan frecuentemente para disminuir la inflamación. La dispersión de los esteroides antiinflamatorios en los pulmones es crı́tica para aliviar los sı́ntomas. Una persona expuesta a una dosis masiva de polen sufre una grave reacción alérgica y una extraordinaria dificultad de respiración. La persona se presenta en un local de urgencias y se trata con flunisolido en micropartı́culas (6α-fluo-11β, 16α, 17, 21-tetrahidroxipregna-1, 4-dieno-3, 20 dona ciclic-16, 17-acetilo con acetona) utilizando el método de entrega mejorada con perfluorocarbono. Debido a que la inflamación aguda origina una capacidad gravemente limitada de respirar, el paciente se dispone en un ventilador de presión positiva del cual respira oxı́geno puro durante diez a quince minutos. Entonces se introduce en los pulmones, con perfluorocarbono, bajo presión suministrada por el ventilador, como se ha descrito en el Ejemplo 5, una dosificación de 0,25-0,5 mg 11 21 ES 2 136 315 T3 de flunisolido, un córticoesteroide con marcada actividad antiinflamatoria y antialérgica. Entonces se introduce lı́quido de perfluorocarbono en los pulmones bajo presión como en la respiración de lı́quido o a través de un tubo endotraqueal entre respiraciones de aire suministrado por ventilación de presión positiva continua. Se introduce un volumen de lı́quido de perfluorocarbono substancialmente equivalente a 0,1 % a 100 % de la capacidad residual funcional pulmonar normal del paciente (calculada por métodos bien conocidos en la técnica), según el grado de constricción alveolar. Se prefieren perfluorocarbonos con una presión de vapor relativamente alta, incluyendo F44E, FDC, FTPA, FMOQ, FMIQ, FHQ, FCHP, FC-75, RM-101, C7 F5 Br y C6 F3 Br, debido a que se evaporarán más fácilmente por respiración normal o asistida con el ventilador después de acabado el tratamiento. La dosificación de flunisolido administrada es de 0,25-0,5 mg y puede repetirse aproximadamente 10-12 horas después, si es necesario. Debido a que el fármaco se dispersa fácilmente hacia los alvéolos por introducción del lı́quido de perfluorocarbono, la dosificación requerida de flunisolido es inferior que la requerida por los pacientes que utilizan sistemas de inhalador de aerosol autoadministrado normal. Después de acabada la terapia, el paciente se mantiene con perfluorocarbono durante hasta 3 horas para mantener abiertos los alvéolos si la inflamación no cede rápidamente. Cuando cede la inflamación, se deja que el perfluorocarbono se disipe por evaporación durante la respiración. También se contempla el uso del método con otros agentes antiinflamatorios incluyendo triamcinolona (9-fluo-11β, 16α, 17,21-tetrahidroxipregna-1,4-dieno-3,20-diona), acetonuro de triamcinolona (9-fluo-11β,16α, 17,21-tetrahidroxipregna-1, 4-dieno-3,20-diona cı́clic-16, 17-acetal), beclometasona dipropionato (9-cloro-11β, 17, 21-trihidroxi-16β-metilpregna-1,4-dieno-3,20-diona 17, 21 dipropionato), fosfato de sodio de betametasona (9- fluo-11β, 17,21-trihidroxi-16β-metilpregna-1, 4-dieno-3,20-diona 21-sodio fosfato), hidrocortisona (pregna-4-eno-3,20-diona, 21 (acetiloxi)-11, 17-dihidroxi-acetato), fosfato de sodio de dexametasona (9-fluo-11β,17-dihidroxi-16α-metil- 21 (fosfonooxi)pregna-1,4-dieno-3,20-diona 17,21-sal disódica) y acetonuro de triamcinolona (9-fluo11β,16α,17,21-tetrahidroxipregna-1,4-dieno-3,20diona-ciclic-16,17-acetal). Debido a que las membranas hialinas se interfieren substancialmente con el intercambio gaseoso en los pulmones afectados de ARDS y la enfermedad de las membranas hialinas en los niños, la disolución de las membranas hialinas aumenta la capacidad de los pacientes a utilizar oxı́geno y a excretar dióxido de carbono. Ejemplo 7 Entrega de enzimas para disolver membranas hialinas Las membranas hialinas contienen fluido edematoso rico en proteı́nas y rico en fibrina mezclado con residuos celulares. Ası́, son degradadas por las enzimas que disuelven las proteı́nas y los residuos celulares incluyendo los ácidos nucléicos. La entrega mejorada con perfluorocarbono de proteinasas y desoxirribonucleasa disuelve las 12 5 10 15 20 25 30 35 40 45 50 55 60 65 22 membranas hialinas haciendo que se eliminen más fácilmente por medio de la acción celular normal (es decir, de los macrófagos). Un adulto con ARDS acompañado por la formación de membranas hialinas y focos de alvéolos aplastados (atelectasia) se dispone en un ventilador de presión positiva utilizando prácticas normales. Después de haberle permitido respirar oxı́geno puro durante aproximadamente diez a quince minutos, se introduce lı́quido de perfluorocarbono en los pasos pulmonares de aire por medio de la inyección del lı́quido en un tubo endotraqueal y a través del mismo entre respiraciones de aire suministrado por la ventilación de presión positiva continua. Se introduce lı́quido de perfluorocarbono equivalente aproximadamente al 100 % de la FRC pulmonar normal del paciente (calculada por métodos bien conocidos) en los pasos pulmonares de aire. El lı́quido de perfluorocarbono introducido es un lı́quido que tiene una presión de vapor relativamente baja debido a que el suplemento de surfactante debe permanecer en los pulmones durante un perı́odo más largo de tiempo (horas). Ası́, se administra un agente o una combinación de agentes de entre PFOB, Fnonmamo, FDMA, F-adamatano, F66E, Fi36E, PFoCl y PFoH. Se introduce por inhalación de las micropartı́culas una combinación de proteinasa, fibrinolisina y desoxirribonucleasa, todas en forma de polvo. La fibrinolisina se deriva de plasma bovino y digiere primariamente los exudatos fibrosos; la desoxirribonucleasa se deriva de páncreas bovino y ataca al ácido desoxirribonucleico (ADN) para producir polinucleóticos grandes. La dosificación de la combinación de enzimas es de 5-25 unidades (Loomis) de fibrinolisina y 3.000-15.000 unidades (Christensen) de desoxirribonucleasa, según el grado de formación de membrana hialina en los pulmones del paciente. Las enzimas en polvo se administran por inhalación en la cual el polvo es periódicamente inyectado como una fina suspensión en la tuberı́a de ventilación de presión positiva o a través del tubo endotraqueal. Si el paciente también sufre de pérdida de surfactante debida a la hipoxia inducida por la membrana hialina, puede incluirse suplemento de surfactante (véase el Ejemplo 1) en la mezcla de inhalación de enzimas. Se prefiere el tipo fosfolipı́dico sintético de suplemento de surfactante debido a que el tipo proteináceo servirı́a como inhibidor competitivo de la proteinasa de la mezcla de enzimas. Alternativamente, puede utilizarse el tipo de proteı́nas o de fosfolı́pidos de suplemento de surfactante después de la inhalación de la combinación de enzimas. El suplemento de surfactante proteináceo podrı́a utilizarse para “detener” la actividad de la mezcla de enzimas por inhibición competitiva de la fibrinolisina. Según el grado del daño del tejido por hipoxia, el lı́quido de perfluorocarbono se substituye periódicamente para abrir los alvéolos aplastados durante la curación debido a que la evaporación disminuirá el volumen de perfluorocarbono retenido. A medida que progresa la curación, se deja que el perfluorocarbono se evapore completamente por medio de la respiración normal, con o sin ventilación mecánica. 23 ES 2 136 315 T3 La entrega de fármacos mejorada por perfluorocarbono puede utilizarse para tratar tuberculosis, enfermedad cuya frecuencia aumenta en los Estados Unidos. Ejemplo 8 Tratamiento de tuberculosis por entrega localizada de antibacteriano antiinflamatorio El método mejorado con perfluorocarbono se utiliza para la entrega de la sal de sodio de mefenamina en forma de micropartı́culas. El fármaco sirve de antiinflamatorio local con actividades bacteriostáticas y bactericidas, incluyendo bacteriostasis de bacilus de tubérculo. Puede también incluirse en la terapia inhalada sulfato de estreptomicina en polvo, eficaz contra la mayor parte de las formas de tuberculosis resistentes a los fármacos. El paciente al que se le ha diagnosticado tuberculosis se orienta primero en una posición en la cual la zona afectada (determinada por rayos X u otros medios de diagnóstico no invasivos) se sitúa en un punto gravitatoriamente bajo de modo que el perfluorocarbono se estanque selectivamente alrededor de la zona. Se deja que el paciente respire oxı́geno puro durante aproximadamente diez a quince minutos antes de que se introduzca el lı́quido de perfluorocarbono en los pasos pulmonares de aire bajo presión como en la respiración de lı́quido. Se introduce un volumen de lı́quido de perfluorocarbono substancialmente equivalente a 0,1 % a 100 % de la FRC normal del paciente (calculada por métodos bien conocidos en la técnica). La cantidad dependerá de la ubicación y de la zona afectada por la infección, de modo que el perfluorocarbono introducido tienda a estancarse alrededor del tejido infectado. Puede preferirse la entrega unilateral o la local (lobar, segmentaria) según el grado de la infección. Se utiliza un lı́quido de perfluorocarbono con una presión de vapor relativamente baja debido a que debe permanecer en los pulmones durante un perı́odo más largo (horas) para la administración eficaz de los agentes antibacterianos. Los perfluorocarbonos preferidos incluyen PFOB, Fnonmamo, FDMA, F-adamatano, F66E, Fi36E, PFoCl y PFoH, administrados solos o en combinación. El paciente inhala un agente terapéutico en polvo compuesto por uno o más antibacterianos (por ejemplo, mefenamina sódica combinada con sulfato de estreptomicina). El paciente no se mueve durante un perı́odo de hasta tres horas para permitir que los antibacterianos sean absorbidos por el tejido afectado. Durante este tiempo, la respiración normal originará la evaporación del lı́quido de perfluorocarbono. El tratamiento puede repetirse semanalmente durante un perı́odo de meses con antibióticos sistémicos administrados entre los tratamientos para ayudar a liquidar la infección. Además de las enfermedades que afectan directamente a los pulmones, el método de entrega de fármacos mejorada con perfluorocarbono puede utilizarse para entregar fármacos para otras finalidades terapéuticas. Ejemplo 9 Tratamiento de trombos o émbolos pulmonares por inhalación de urocinasa en polvo después de 5 10 15 20 25 30 35 40 45 50 55 60 65 24 infusión de perfluorocarbono La oclusión de una arteria pulmonar por un grumo de sangre conduce a la obstrucción arterial. La obstrucción puede conducir al infarto del parenquima subyacente del pulmón. Puede producirse la muerte súbita en el caso de un trombo en silla en el cual la obstrucción se halla en las ramas principales de las arterias pulmonares y cesa la circulación sanguı́nea a través de los pulmones. Frecuentemente se utiliza urocinasa inyectada intravenosamente para fomentar la lisis de los émbolos o trombos pulmonares. La urocinasa, una enzima producida por el riñón, actúa sobre el sistema fibrinolı́tico endógeno. Convierte plasminógeno en la plasmina enzimática que degrada los grumos de fibrina ası́ como el plasminógeno y otras proteı́nas del plasma. Sin embargo, la urocinasa inyectada intravenosamente tiene una semivida de unos 20 minutos o menos debido a que es degradada rápidamente por el hı́gado. Además, la inyección sistémica de urocinasa está contraindicada en los casos en los cuales se ha practicado recientemente una quirurgia o ha existido hemorragia gastrointestinal. Un paciente con trombosis pulmonar puede tratarse utilizando el método de entrega de fármacos mejorada con perfluorocarbono en el cual la urocinasa es inhalada como polvo (la forma de bajo peso molecular que puede contener también vehı́culos inertes tales como manitol, albúmina y cloruro de sodio). Según la ubicación del trombo, el paciente se orienta de modo que el trombo quede situado en un punto gravitatoriamente bajo. Entonces se deja que el paciente respire oxı́geno puro durante aproximadamente diez a quince minutos. Se introduce lı́quido de perfluorocarbono en los pasos pulmonares de aire bajo presión como en la respiración de lı́quido. El volumen de lı́quido de perfluorocarbono introducido en los pasos pulmonares de aire es substancialmente equivalente a 0,1 % a 100 % de la FRC pulmonar normal del paciente calculada por métodos bien conocidos en la técnica. La cantidad dependerá del tamaño y de la ubicación del trombo de modo que el perfluorocarbono introducido tienda a estancarse en la zona próxima al trombo. La entrega unilateral o la local (lobar, segmentaria) puede preferirse según la ubicación en la cual debe fijarse el perfluorocarbono. El lı́quido de perfluorocarbono introducido es un lı́quido que tiene una presión de vapor relativamente alta debido a que la urocinasa se introducirá rápidamente. Si ya se ha producido infarto pulmonar y los alvéolos están aplastados, puede utilizarse un perfluorocarbono de baja presión de vapor para abrir simultáneamente los alvéolos. Después de que el perfluorocarbono se ha depositado en la zona del trombo, se inhala una sola dosis de urocinasa en polvo y el paciente se deja respirar normalmente de modo que el perfluorocarbono restante se evapore. El paciente se vigila en cuanto a hemólisis en el pulmón y pueden incluirse suplementos de surfactante (véase el Ejemplo 1) en la dosificación de urocinasa para proteger el tejido pulmonar durante la administración. Debido a que la entrega mejorada de la urocinasa se produce en una zona próxima al 13 25 ES 2 136 315 T3 trombo, la concentración es mayor en la proximidad del punto en el que es necesaria la actividad. Por lo tanto, se superan los problemas asociados con la hemorragia interna que resulta de la entrega sistémica. Estados o condiciones crónicas tales como acumulación de secreciones mucinosas en los pulmones de las personas afectadas por fibrosis quı́stica pueden tratarse también utilizando el método en el cual el lı́quido de perfluorocarbono realiza la función adicional de eliminar el exceso de secreciones por lavaje antes de la entrega del fármaco. Ejemplo 10 Tratamiento de fibrosis quı́stica por eliminación de exceso de secreciones mucinosas de los pulmones y administración de enzimas en polvo Una adolescente con fibrosis quı́stica experimenta periódicamente dificultad respiratoria debido a que las cavidades de sus pulmones están llenas de secreciones mucinosas. Esta condición o estado conduce frecuentemente a la infección de los quistes, especialmente por bacterias Streptococcus. La acumulación de secreciones también hace que su forro epitelial del pulmón sea susceptible de metaplasia progresiva que puede originar necrosis y un absceso de pulmón. Por ello es ventajoso limpiar periódicamente sus pulmones de las secreciones mucinosas en exceso para hacer la respiración más fácil e impedir infecciones y para administrar dosificaciones de enzimas como en el Ejemplo 7 para eliminar las secreciones residuales acumuladas. Debido a que la fibrosis quı́stica conduce al deterioro de las fibras elásticas y de reticulina de los pulmones, lo cual predispone el tejido a la rotura, también es importante aliviar el esfuerzo de inhalación en el tejido quı́stico. La adolescente que actualmente experimenta dificultad respiratoria debida a la acumulación de secreciones mucinosas en sus pulmones se trata primero con lı́quido de perfluorocarbono como lavaje para eliminar parte de las secreciones en ex- 5 10 15 20 25 30 35 40 45 50 55 60 65 14 26 ceso. Se coloca en un ventilador convencional y se deja respirar oxı́geno puro durante aproximadamente diez a quince minutos. Entonces se introduce lı́quido de perfluorocarbono oxigenado en sus pasos pulmonares de aire bajo presión como para la respiración de lı́quido. El volumen de lı́quido de perfluorocarbono introducido en los pasos pulmonares de aire es substancialmente equivalente al 100 % de su FRC pulmonar normal, calculada por métodos bien conocidos en la técnica. El lı́quido de perfluorocarbono introducido es un lı́quido que tiene una presión de vapor relativamente baja debido a que se eliminará mecánicamente y debe minimizarse la evaporación. Ası́, se administra un agente o una combinación de agentes de entre PFOB, Fnonmamo, FDMA, F-adamatano, F66E, Fi36E, PFoCl y PFoH. Después de un tiempo suficiente para que el lı́quido de perfluorocarbono se difunda por sus pulmones (hasta una hora) y desplace las secreciones acumuladas, el perfluorocarbono y las secreciones desplazadas se eliminan mecánicamente utilizando procesos convencionales de lavaje. Después de acabado el lavaje, la adolescente recibe una administración de un segundo volumen de lı́quido de perfluorocarbono bajo presión como para la respiración de lı́quido. El volumen y el tipo de lı́quido de perfluorocarbono son substancialmente como los utilizados en el proceso de lavaje. Entonces, se introduce una dosificación de enzimas proteolı́ticas y de desoxirribonucleasa en polvo como en el Ejemplo 7 utilizando presión positiva suministrada por un ventilador. Las enzimas eliminarán todas las secreciones mucinosas residuales que permanezcan después del lavaje. Se deja que la paciente repose mientras se asiste su respiración por medio de un ventilador de presión positiva hasta que se ha evaporado todo el perfluorocarbono restante (hasta unas tres horas). 27 ES 2 136 315 T3 REIVINDICACIONES 1. Juego o “kit” que comprende un lı́quido de perfluorocarbono y un medicamento en micropartı́culas, caracterizado porque dicho medicamento en micropartı́culas está disperso en un gas respirable para formar una suspensión gaseosa para el uso en el tratamiento de un estado o condición pulmonar de un mamı́fero. 2. Juego según la reivindicación 1, caracterizado porque el volumen de lı́quido de perfluorocarbono es equivalente a 0,01 % a 100 % de la capacidad residual funcional pulmonar del mamı́fero. 3. Juego según la reivindicación 1, caracterizado porque el volumen de lı́quido de perfluorocarbono es por lo menos el 1 % de la capacidad residual funcional pulmonar del mamı́fero. 4. Juego según la reivindicación 1, caracterizado porque el volumen de lı́quido de perfluorocarbono es por lo menos el 2 % de la capacidad residual funcional pulmonar del mamı́fero. 5. Juego según la reivindicación 1, caracterizado porque el volumen de lı́quido de perfluorocarbono es por lo menos el 5 % de la capacidad residual funcional pulmonar del mamı́fero. 6. Juego según la reivindicación 1, caracterizado porque el volumen de lı́quido de perfluorocarbono es por lo menos el 10 % de la capacidad residual funcional pulmonar del mamı́fero. 7. Juego según la reivindicación 1, caracterizado porque el medicamento es un antibiótico. 8. Juego según la reivindicación 1, caracterizado porque el medicamento es un agente antivı́rico. 9. Juego según la reivindicación 1, caracterizado porque el medicamento es un agente antibacteriano. 10. Juego según la reivindicación 1, caracterizado porque el medicamento es un agente anticáncer. 11. Juego según la reivindicación 1, caracterizado porque el medicamento es un suplemento de surfactante. 12. Juego según la reivindicación 1, caracterizado porque el medicamento es por lo menos una enzima. 13. Juego según la reivindicación 12, caracterizado porque dicha enzima es una proteinasa. 14. Juego según la reivindicación 12, caracterizado porque dicha enzima es una desoxirribonucleasa. 15. Juego según la reivindicación 1, caracterizado porque el medicamento mejora la actividad del sistema inmunológico del mamı́fero. 16. Juego según la reivindicación 1, caracterizado porque el medicamento es un inmunosupresor. 17. Juego según la reivindicación 1, caracterizado porque el medicamento es un descongestionante. 18. Juego según la reivindicación 1, caracterizado porque la condición o estado pulmonar es una condición o estado de surfactante de pulmón. 19. Juego según la reivindicación 1, caracterizado porque la condición o estado pulmonar es una enfermedad quı́stica. 20. Juego según la reivindicación 1, caracte- 5 10 15 20 25 30 35 40 45 50 55 60 65 28 rizado porque la condición o estado pulmonar es un cáncer de pulmón. 21. Juego según la reivindicación 1, caracterizado porque la condición o estado pulmonar es una infección. 22. Juego según la reivindicación 1, caracterizado porque el lı́quido de perfluorocarbono comprende 1-bromo-heptadecafluo-octano (C8 F17 Br). 23. Juego según la reivindicación 1, caracterizado porque el lı́quido de perfluorocarbono comprende perfluodecalina. 24. Juego según la reivindicación 1, caracterizado porque el lı́quido de perfluorocarbono comprende fluorocarbono cı́clico. 25. Uso de un medicamento en micropartı́culas y de un lı́quido de perfluorocarbono en la fabricación de una preparación farmacéutica para el tratamiento de una condición o estado pulmonar en un mamı́fero, caracterizado porque dicho medicamento en micropartı́culas está dispersado en un gas respirable para formar una suspensión gaseosa que se introduce en los pasos pulmonares de aire de dicho mamı́fero a lo que sigue la introducción pulmonar de un volumen de dicho lı́quido de fluorocarbono substancialmente equivalente a la capacidad residual funcional pulmonar del mamı́fero o inferior a la misma, de modo tal que dicho lı́quido de fluorocarbono y dicho medicamento en micropartı́culas se hallen simultáneamente presentes en los pasos pulmonares de aire del mamı́fero. 26. Uso según la reivindicación 25, caracterizado porque un segundo volumen de un lı́quido de fluorocarbono es introducido antes de la introducción de dicha suspensión gaseosa. 27. Uso según la reivindicación 25, caracterizado porque el lavaje con un lı́quido de fluorocarbono se realiza antes de la introducción de dicha suspensión gaseosa. 28. Uso según la reivindicación 25, caracterizado porque comprende además la eliminación del lı́quido de fluorocarbono de los pasos pulmonares de aire. 29. Uso de un medicamento en micropartı́culas y de un lı́quido de perfluorocarbono en la fabricación de una preparación farmacéutica para el tratamiento de una condición o estado pulmonar en un mamı́fero, caracterizado porque dicho medicamento en micropartı́culas está dispersado en un gas respirable para formar una suspensión gaseosa, introduciéndose dicha suspensión gaseosa en los pasos pulmonares de aire de dicho mamı́fero después de la introducción pulmonar de un volumen de dicho lı́quido de fluorocarbono substancialmente equivalente a la capacidad residual funcional pulmonar del mamı́fero o inferior a la misma, de modo tal que dicho lı́quido de fluorocarbono y dicho medicamento en micropartı́culas se hallen simultáneamente presentes en los pasos pulmonares de aire del mamı́fero. 30. Uso según la reivindicación 29, caracterizado porque un segundo volumen de un lı́quido de fluorocarbono se introduce después de la introducción de dicha suspensión gaseosa. 31. Uso según la reivindicación 29, caracterizado porque comprende además la eliminación del lı́quido de fluorocarbono de los pasos pulmo15 29 ES 2 136 315 T3 nares de aire. 32. Uso según cualquiera de las reivindicaciones 25 a 31, caracterizado porque el medicamento es un antibiótico. 33. Uso según cualquiera de las reivindicaciones 25 a 31, caracterizado porque el medicamento es un agente antivı́rico. 34. Uso según cualquiera de las reivindicaciones 25 a 31, caracterizado porque el medicamento es un agente anticáncer. 35. Uso según cualquiera de las reivindicaciones 25 a 31, caracterizado porque el medicamento es un suplemento de surfactante. 36. Uso según cualquiera de las reivindicaciones 25 a 31, caracterizado porque el medicamento comprende por lo menos una enzima. 37. Uso según la reivindicación 36, caracterizado porque dicha enzima es una proteinasa. 38. Uso según la reivindicación 36, caracterizado porque dicha enzima es una desoxirribonucleasa. 39. Uso según cualquiera de las reivindicaciones 25 a 31, caracterizado porque el medicamento mejora la actividad del sistema inmunológico del mamı́fero. 40. Uso según cualquiera de las reivindicaciones 25 a 31, caracterizado porque el medica- 5 10 15 20 25 30 mento es un inmunosupresor. 41. Uso según cualquiera de las reivindicaciones 25 a 31, caracterizado porque el medicamento es un descongestionante. 42. Uso según cualquiera de las reivindicaciones 25 a 41, caracterizado porque el estado pulmonar es un estado de surfactante del pulmón. 43. Uso según cualquiera de las reivindicaciones 25 a 41, caracterizado porque el estado pulmonar es una enfermedad quı́stica. 44. Uso según cualquiera de las reivindicaciones 25 a 41, caracterizado porque el estado pulmonar es un cáncer de pulmón. 45. Uso según cualquiera de las reivindicaciones 25 a 41, caracterizado porque el estado pulmonar es una infección. 46. Uso según cualquiera de las reivindicaciones 25 a 45, caracterizado porque el lı́quido de perfluorocarbono comprende 1-bromo-heptadecafluo-octano (C8 F17 Br). 47. Uso según cualquiera de las reivindicaciones 25 a 45, caracterizado porque el lı́quido de perfluorocarbono comprende perfluodecalina. 48. Uso según cualquiera de las reivindicaciones 25 a 45, caracterizado porque el lı́quido de perfluorocarbono comprende fluorocarbono cı́clico. 30 35 40 45 50 55 60 NOTA INFORMATIVA: Conforme a la reserva del art. 167.2 del Convenio de Patentes Europeas (CPE) y a la Disposición Transitoria del RD 2424/1986, de 10 de octubre, relativo a la aplicación del Convenio de Patente Europea, las patentes europeas que designen a España y solicitadas antes del 7-10-1992, no producirán ningún efecto en España en la medida en que confieran protección a productos quı́micos y farmacéuticos como tales. 65 Esta información no prejuzga que la patente esté o no incluı́da en la mencionada reserva. 16