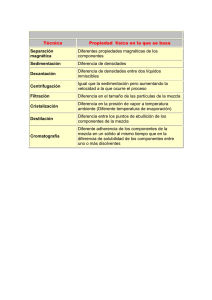
Hilda Montero L. de Guevara
Anuncio

Hilda Montero L. de Guevara 1 CONTENIDO 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. INTRODUCCIÓN……………………………………………………………………………………..……1 TEORIA DE LA SEDIMENTACIÓN………………………………………………………………..…….2 FUERZA CENTRÍFUGA RELATIVA……………………………………………………………..………3 COEFICIENTE DE SEDIMENTACIÓN…………………………………………………………..……… 3 COEFICIENTE DE SEDIMENTACIÓN ESTÁNDAR…………………………………………...……… 4 DEPENDENCIA DE S CON RESPECTO A LA CONCENTRACIÓN………………………..………….4 SEDIMENTACIÓN DEPENDIENTE DE LA VELOCIDAD…………………………………………..….6 EFECTO DE LA CARGA EN LA SEDIMENTACIÓN………………………………………………..…..7 MEDICIÓN EXACTA DEL COEFICIENTE DE SEDIMENTACIÓN………………………………..…...7 CENTRÍFUGAS……………………………………………………………………………………..………8 CENTRÍFUGAS DE BAJA VELOCIDAD………………………………………………………….……...8 CENTRÍFUGAS DE ALTA VELOCIDAD…………………………………………………………..……..8 ULTRACENTRÍFUGAS……………………………………………………………………………….……8 CENTRÍFUGA TUBULAR………………………………………………………………………………..11 CENTRÍFUGA DE CAMARA MULTIPLE……………………………………………………………….11 CENTRÍFUGAS DECANTADORAS O DE TORNILLOS……………………………………………….12 CENTRÍFUGAS DE DISCOS……………………………………………………………………………...12 TIPOS DE ROTORES……………………………………………………………………………………...13 ROTORES DE COLUMPIO……………………………………………………………………………….13 ROTORES DE ÁNGULO FIJO…………………………………………………………………………....14 ROTORES VERTICALES………………………………………………………………………………....14 ROTORES ZONAL……………………………………………………………………………………..….15 FACTOR K Y K’………………………………………………………………………………………..….16 TIPOS DE CENTRIFUGACIÓN…………………………………………………………………………..17 CENTRIFUGACIÓN DIFERENCIAL O PELLETING………………………………………………...…18 CENTRIFUGACIÓN ZONAL……………………………………………………………………………..18 MATERIALES PARA GENERAR UN GRADIENTE DE DENSIDAD…………………………….20 FORMAS DE GRADIENTES………………………………………………………………………...22 CENTRIFUGACIÓN AL EQUILIBRIO………………………………………………………………...…23 GRADIENTES DE DENSIDAD AUTOGENERADOS…………………………………………..…24 MATERIALES PARA FORMAR GRADIENTES AUTOGENERADOS…………………………..24 PREPARARACIÓN DE GRADIENTES………………………………………………………..……25 GRADIENTES DISCONTINUOS………………………………………………………...….25 GRADIENTES CONTINUOS…………………………………………………………….….26 GRADIENTES PREFORMADOS…………………………………………………………....26 GRADIENTES AUTOGENERADOS………………………………………………………..27 DETERMINACIÓN DE LA FORMA DE UN GRADIENTE AUTOGENERADO….…….29 GRADIENTES ISOSMÓTICOS……………………………………………………….……..29 ANÁLISIS DE LA DISTRIBUCIÓN DE LA MUESTRA EN EL GRADIENTE…………………..…….29 INSPECCIÓN VISUAL………………………………………………………………………………...…..29 ANÁLISIS RADIOQUIMICOS DE LA MUESTRA ………………………………………………….…..30 APLICACIONES…………………………………………………………………………………………...31 CROMATOGRAFÍA DE PRECIPITACIÓN CENTRÍFUGA…………………………………………….31 MICROSCOPIO DE POLARIZACIÓN CENTRÍFUGA………………………………………………….32 SEPARACIÓN DE DNA, RNA Y PROTEINAS DE NUCLEOS FIBROBLASTOS DE HAMSTER…...33 SEPARACIÓN DE DNA EN BASE ALA COMPOSICIÓN GC, CON USO DE BAMD………………..33 SEPARACIÓN DE DNA NATIVO Y DESNATURALIZADO CON GRADIENTES DE DENSIDAD DE TRICLOROACETATO DE RUBIDIO………………………………………………………………...33 FRACCIONAMIENTO DE RNA………………………………………………………………………….34 SEPARACIÓN DE DNA PLASMÍDICO, EN ROTORES DE TUBO VERTICAL…………………..…..34 FRACCIONAMIENTO CELULAR POR CENTRIFUGACIÓN DIFERENCIAL………………………..35 BIBLIOGRAFÍA……………………………………………………………………………………………36 APÉNDICE …………………………………………………………………………………………….…..37 2 INTRODUCCIÓN La separación de líquidos y partículas insolubles se ha dado en la naturaleza desde que se formó el universo. La aplicación de una fuerza centrífuga ayuda a la separación y este proceso se ha venido aplicando recientemente. La separación de partículas por medio de la centrifugación tuvo aplicaciones en procesos industriales hasta hace aproximadamente 100 años. Los primeros usos fueron en la manufactura del azúcar y en separar la crema de la leche. Las primeras separaciones de partículas usando centrifugación fueron probablemente inventadas en 1877 por el ingeniero sueco Carl Gustaf Patrik DeLaval para separar crema de leche, estas centrífugas funcionaban a velocidades de hasta 3 000 r.p.m. El desarrollo de la ultracentrífuga se le atribuye a Svedberg quien trabajó entre 1920 y 1930, el fue quien introdujo el termino de ultracentrífuga y debido a que era un químico coloidal, estudiaba la estructura de las proteínas ( en esa época todas las proteínas eran consideradas coloides); su grupo utilizaba la ultracentrífuga para determinar el peso molecular y la subunidad estructural de la hemoglobina, sus estudios cambiaron las ideas concernientes a la estructura de las proteínas que se tenían en aquel tiempo. El grupo de Svedberg desarrollo algunas centrífugas y los primeros modelos funcionaban a velocidades de hasta 900 000 g y cuyos rotores eran pequeños; otros modelos funcionaban a velocidades de hasta 260 000 g. SPINCO produjo en 1940 la primera centrífuga comercial, el modelo original es mostrado en la siguiente figura. Una de las técnicas más comúnmente utilizadas en la actualidad para caracterizar las macromoléculas es la sedimentación. Utilizando las variantes adecuadas de esta técnica, se pueden obtener el peso molecular, la densidad y la forma general de la macromolécula; además, se puede detectar cambios en estos parámetros y cualquiera de ellos se puede aprovechar como base para la separación de los componentes de una mezcla con propósitos preparativos o analíticos. Debido a la facilidad con la que se obtienen los resultados en los modernos instrumentos automáticos, hacen de la ultracentrifugación una técnica especialmente útil. En realidad, con una ultracentrífuga solamente se hace una cosa: mover a las partículas por la fuerza centrífuga y medir, una o varias veces a lo largo del tiempo, la distribución de la concentración de las partículas a lo largo del tubo de la centrifugadora. La medición realizada mientras las moléculas se están moviendo a lo largo del eje de la fuerza centrífuga, se denomina determinación de la velocidad de sedimentación y el resultado es un coeficiente de sedimentación, cifra que proporciona información sobre el peso molecular y la forma de la partícula. Cuando se mide la distribución de concentraciones bajo condiciones en las que la distribución ya no cambia con el tiempo, se dice que las partículas han alcanzado el equilibrio de sedimentación; este segundo tipo de medida proporciona datos sobre los pesos moleculares, la densidad y la composición de las partículas. 3 Teoría de la Sedimentación Las partículas en disolución pueden sufrir alteración espacial, es decir, pueden cambiar de posición con el tiempo. Esto puede ser debido a procesos de difusión (en un gradiente de concentración, las partículas tienden a ir de la zona de mayor concentración a la de menor concentración) o bien a procesos de sedimentación. En un proceso de sedimentación la velocidad a la cual sedimentan las partículas en una suspensión, no sólo depende de su naturaleza, depende también de la naturaleza del medio en el cual están suspendidas así como, de la fuerza aplicada a las partículas. Intuitivamente, uno especularía que las partículas más grandes sedimentarán más rápido que las más pequeñas. Un factor que afecta la sedimentación de las partículas es la viscosidad del medio. En 1856 Sir Gabriel Stokes propuso que la fuerza friccional, F, que actúa en una partícula esférica de radio rp es relacionada a la viscosidad, h, por la siguiente ecuación: F= 6 p h rp dr/dt Donde dr/dt es la velocidad de la partícula. La fuerza que experimenta una partícula no está sólo determinada por la fuerza gravitacional, g, sino también, por los efectos de flotación que reflejan las diferencias en la densidad del medio dm y de la partícula dp, por lo que tenemos: (dm - dp) V g = 6 p h rp dr/dt V= volumen de la partícula Como se asume que la partícula es esférica, el volumen puede ser expresado en términos del radio: (dm - dp) ( 4/3 p rp3) g = 6 p h rp dr/dt en la práctica, la fuerza centrífuga que mueve a la partícula sobre su eje de rotación es mucho mayor que la fuerza de gravedad, se puede expresar la fuerza centrífuga de la siguiente manera: Fuerza centrífuga = w2r / g Donde r es la distancia radial de la partícula del eje de rotación y w es la velocidad angular en radianes / segundo, haciendo una sustitución en esta fórmula y simplificando la expresión en términos de la velocidad de la partícula, tenemos: dr = 2rp2 (dp - dm) w2 r dt 9h Esta expresión es cierta para partículas esféricas. Las partículas no esféricas tienen altos coeficientes de fricción, por lo que, la expresión se puede modificar en base a los coeficientes de fricción de una molécula dada, f (f= 2phmD), con relación al coeficiente de fricción de una partícula esférica, fo. dr = 2rp2 (dp - dm) w2 r dt 9h (f/fo) 4 Por la anterior ecuación, podemos deducir que: 1) Una partícula con mayor masa tiende a moverse más de prisa que una de menos masa 2) Una partícula más densa se mueve más de prisa que otra menos densa 3) Cuanto más densa sea la disolución, más lentamente se moverá la partícula 4) A mayor coeficiente de fricción, más lento será el movimiento de la partícula Fuerza Centrifuga Relativa La fuerza centrífuga (RCF) es dependiente de la velocidad de rotación (N) en r.p.m. y la distancia de la partícula (r) al centro de rotación. Cuando la distancia es expresada en cm tenemos que: RCF = 1.18 x r x (r.p.m / 1000)2 ó RCF = 1.18 x r x (N)2 La fuerza centrifuga es dada en términos de g y N esta dada en miles de r.p.m.. Si la fuerza centrifuga es conocida, entonces la velocidad (N) requerida en r.p.m. para obtener esa fuerza centrífuga a un punto r (cm) de el centro de rotación puede ser calculada con solo despejar la ecuación anterior. Coeficiente de Sedimentación Como la velocidad de una molécula es proporcional a la magnitud del campo centrífugo (w2r) es común discutir las propiedades de sedimentación en términos de la velocidad por unidad de campo, o sea: s = (dt/dr) / w2 r Donde s es el coeficiente de sedimentación; el objetivo inmediato de muchos de los experimentos de velocidad de sedimentación es la determinación del valor del coeficiente de sedimentación. Dado que la velocidad de sedimentación es mucho mas pequeña que la velocidad angular, para la mayoría de macromoléculas biológicas la magnitud de s es alrededor de 10-13 seg y es por ello que la unidad de sedimentación Svedberg (S) ha sido definida como 10-13 S = 10-13 seg Así por ejemplo, tenemos que la constante de sedimentación de los ribosomas de eucarotes es 80S, o sea, s = 80 x 10-13 seg. 5 Coeficiente de Sedimentación Estándar En una centrifugación, el valor del coeficiente de sedimentación no depende sólo de la velocidad o tipo de rotor, depende también del tamaño y densidad de la partícula, así como, de la densidad y viscosidad del medio utilizado para la centrifugación. La dependencia de la viscosidad del medio se puede descartar siempre que se utilice el mismo medio para la centrifugación. El medio más utilizado es el agua, cuya densidad y viscosidad son conocidas a 20 0C. El coeficiente de sedimentación de una partícula en agua a esta temperatura se denotará s20,w y como las condiciones de viscosidad y densidad del medio se descartan por ser siempre las mismas, ahora, el coeficiente de sedimentación dependerá sólo de las parámetros de la partícula. Entonces tenemos: s20,w = k´ [D2 (d - d20,w)] / h20,w Donde k´ es 1.18 para una partícula esférica y 1.12 para una partícula cilíndrica, D es el diámetro en cm, d es la densidad de la partícula (g/cm3) , d20,w y h20,w son la densidad y viscosidad del agua. Para determinar la constante de sedimentación no es necesario realizar la centrifugación con agua como medio, los datos de la centrifugación pueden obtenerse con otro medio cuya densidad y viscosidad sean conocidas. Para transformar el coeficiente de sedimentación de una partícula de un experimento dado a la constante de sedimentación estándar, s20,w es dividida entre s, así, se obtiene la eliminación de k´ y D2 : s20,w = s [ (d - d20,w) hm ] / [ (d - dm ) h20,w] Sustituyendo s en la ecuación, tenemos: s20,w = v w2r . (d - d20,w) hm (d - dm ) h20,w Donde d es la densidad de la partícula (g/cm3), v es la velocidad de sedimentación, r es la distancia de la partícula al eje de rotación (cm) y w es la velocidad angular (rad/seg). El coeficiente de sedimentación de las macromoléculas depende de toda una serie de factores, puesto que las moléculas tienen una forma que depende de la composición del disolvente, muchas de ellas pueden estar eléctricamente cargadas, son muy grandes comparadas con las moléculas del disolvente y se deforman a medida que se mueven. Estos efectos se manifiestan en la dependencia que s presenta respecto a la concentración, la velocidad de centrifugación y la fuerza iónica del disolvente. Dependencia de s con Respecto a la Concentración Considérese una disolución de macromoléculas de un tamaño tal que chocan frecuentemente unas con otras. Ésta es una característica de las moléculas muy grandes y muy extendidas en disolución (proteínas y ácidos nucleicos), porque a medida que giran sobre sí mismas, ocupan un volumen efectivo de la disolución realmente grande. Cuando se aproximan entre sí, es más fácil para las moléculas del disolvente el moverse en dirección opuesta, es decir, la viscosidad del disolvente se incrementa efectivamente en la vecindad de las macromoléculas. Esto reduce la velocidad hacia adelante de la partícula en un campo centrífugo dado y por 6 consiguiente se reduce s. Como la probabilidad de colisión aumenta tanto con el volumen como con el grado de extensión de la molécula, la magnitud de la dependencia respecto a la concentración también aumenta a medida que lo hacen dichos parámetros. En la siguiente figura se ejemplifica este punto con varias curvas de s en función de la concentración de DNA o de proteína. Proteínas pequeñas y globulares Fago FX 174 s/s0 T7 DNA T6 DNA Concentración mg/ml Dependencia de s con respecto a la concentración expresada como s/so donde s0 es el valor de s extrapolado a concentración cero. En la gráfica se puede observar que la dependencia respecto a la concentración aumenta a medida que aumenta el peso molecular y a medida que la molécula es más extendida. Las proteínas pequeñas son más pequeñas que Fago fx 174, este es más pequeño que el DNA del fago T7. Nota: El valor de so se obtiene experimentalmente midiendo s a varias concentraciones y representando gráficamente 1/s frente a la concentración para determinar 1/s0 por extrapolación a concentración de cero. Esto se deduce de la siguiente ecuación 1/sc= 1/s0 + k/s0. Si las moléculas de una disolución tienen diferentes s y la concentración es relativamente alta, surge un nuevo problema. En este caso, las moléculas no solamente interfieren con la sedimentación de las de su misma clase, sino también con las de otros tipos. Es más, la molécula con el mayor s y mayor dependencia respecto a la concentración, tiene que sedimentar a través de la disolución de las moléculas de movimiento más lento . A concentraciones elevadas, las moléculas más veloces resultan tan impedidas en su movimiento que sedimentan a la misma o similar velocidad que las lentas, lo cual puede enmascarar el hecho de que, en realidad, se trata de una mezcla y dar la información errónea de que el material que se está analizando es homogéneo. Este fenómeno se conoce como efecto de Jhonston-Ogston. De hecho, con ácidos nucleicos de gran tamaño se hace necesario utilizar pequeñísimas concentraciones antes de que los dos tipos de moléculas puedan diferenciarse e, incluso a estas concentraciones, los datos indican a menudo que hay menos cantidad del componente rápido de la que realmente hay. Cabe mencionar que este problema queda muy reducido con el uso de la técnica de centrifugación zonal. 7 60 DE 50 40 PORCENTAJE DNA En la siguiente figura hay un ejemplo que ilustra este punto. 30 20 10 0 0 20 40 60 Concentración 80 100 (mcg/ml) Sedimentación Dependiente de la Velocidad La sedimentación dependiente de la velocidad se refiere a dos fenómenos independientes: la agregación de las moléculas, dependiente de la velocidad, que se produce a grandes concentraciones, y la reducción real de s a elevadas velocidades. En ninguno de los dos casos se comprende completamente el fenómeno, pero gracias a los trabajos de Bruno Zimm y sus colaboradores, se tiene una idea de cuáles pueden ser las causas. La agregación dependiente de la velocidad se refiere a la pérdida aparente de material de la disolución, que disminuye la concentración efectiva de la macromolécula (aumentando el s aparente). La explicación que normalmente se da de este fenómeno es que, a elevadas velocidades, las moléculas dejan atrás de sí una estela que aumenta la velocidad de la molécula que está justamente detrás de ella. El resultado es la formación de agregados moleculares que tienen valores de s muy elevados y que forman rápidamente un sedimento en el fondo del tubo de la centrífuga. Este proceso continua hasta que la concentración es demasiado baja para que se produzcan agregados. El segundo tipo de dependencia con respecto a la velocidad, se produce con las grandes moléculas a bajas concentraciones. En el caso del DNA de T4 (peso molecular = 106 x 106 daltones) el aumento de s es del 9% al pasar de 65 000 a 10 000 r.p.m.. Con moléculas de DNA de mayor tamaño (con pesos moleculares mayores a 500 x 106 daltones), la dependencia respecto a la velocidad se hace significativa y puede conducir a errores de entre tres y ocho veces al estimar el peso molecular. Este fenómeno tiene importancia, puesto que el ADN del cromosoma de bacterias y de los eucariotes poseen pesos moleculares que van de 2 x 109 a 10 x 109 daltones. En la siguiente gráfica podemos ver como por encima de una cierta velocidad se pierde la dependencia de s respecto al peso molecular. Zimm ha propuesto que esto se debe a una alteración de la forma (un agrandamiento) de las moléculas de DNA, debido a que el arrastre creciente provocado por la fricción distiende los extremos de la molécula. 8 Peso molecular Efecto de la Carga en la Sedimentación Cuando la sedimentación se lleva a cabo en disoluciones de baja fuerza iónica (menores 0.01 M) y la molécula esta eléctricamente cargada, lo que suele ocurrir con la mayoría de las macromoléculas biológicas, se presenta un fenómeno en el disolvente que no implica ningún cambio de conformación. Debido a los elevados valores de s para las macromoléculas, comparándolos con los de los iones neutralizantes, como Na+ y Mg+2, la macromolécula ionizada sedimenta mucho más rápidamente que los iones estabilizadores. Esta separación de las cargas crea un gradiente de potencial contrario a la dirección de sedimentación, con el resultado de disminuir s. Para evitar esta complicación, se realiza la centrifugación con un exceso de iones estabilizadores, por ejemplo, utilizando una fuerza iónica mayor a 0.05. Medición Exacta del Coeficiente de Sedimentación En primer lugar, habría que mantener la fuerza iónica entre 0.05 y 1.0 para evitar efectos de la carga y el pH debería quedar regulado por una disolución tampón. Debe efectuarse las medidas a varias velocidades, difiriendo entre ellas en un 50%, para asegurarse que los efectos de la velocidad no estén presentes. A cada velocidad debe usarse como mínimo cuatro concentraciones distintas, incluyendo la solución más diluida posible, para asegurarse de que o bien solamente hay un tipo de moléculas o que se esta observando la proporción real entre las distintas moléculas. Por último, debe calcularse s20,w con las ecuaciones dadas anteriormente. 9 CENTRÍFUGAS Los experimentos de centrifugación requieren aparatos que funcionan a velocidades exactamente conocidas con pequeñas variaciones y sin fluctuaciones de temperatura. Existen varios criterios para clasificar las centrífugas, uno de ellos es por la máximo velocidad a la que operan, así tenemos: Centrífugas de Baja Velocidad Estas centrífugas son capaces de centrifugar hasta 6 litros de muestra a la vez, mantienen la muestra fría por un flujo de aire que pasa a través del fondo de la centrifuga. Estas máquinas son utilizadas rutinariamente para procesos iniciales de muestras biológicas; puede ser utilizadas para separar células, y con mayores velocidades, separar organelos así como núcleo y cloroplastos que también pueden ser separados por gradientes de densidad. Centrífugas de Alta Velocidad Estas centrífugas , usualmente con máximas velocidades de 18 000 – 25 000 r.p.m.,son máquinas que pueden generar cerca de 60 000 g, son muy baratas comparadas con las ultracentrífugas. Estas centrífugas tienen sistema de refrigeración y algunos tipos tienen también sistema de vacío, sin embargo, las maquinas que cuentan con sistema de vacío son mas caras pero tienen la ventaja que controlan con mayor exactitud la temperatura. Al igual que las centrífugas de baja velocidad las centrífugas de alta velocidad son muy utilizadas para el fraccionamiento subcelular. La ventaja de los rotores verticales ha facilitado el uso de centrífugas de alta velocidad para las separaciones por gradiente. Ultracentrífugas La fuerza generada por las ultracentrífugas pueden ser significativamente mayor de los 600,000 g, los cuales son suficientes para separar proteínas pequeñas. Las ultracentrífugas son subdivididas en dos tipos: analíticas y preparativas. La ultracentrífuga analítica a menudo es confundida con la ultracentrífuga preparativa. Sin embargo, los experimentos con la analítica son diferentes en varios aspectos. El más importante es que cuenta con un sistema óptico, por lo que, la muestra es visualizada en tiempo real durante la sedimentación, permitiendo la determinación exacta de parámetros hidrodinámicos y termodinámicos. Además, el propósito del experimento es para caracterizar las propiedades claves de la muestra o para purificar la muestra para un uso posterior. 10 En contraste a muchas técnicas biofísicas, las biomoléculas son caracterizadas durante la ultracentrifugación analítica en su estado nativo bajo condiciones biológicas importantes. En el siguiente esquema se pueden observar las diferencias entre un rotor de una centrífuga analítica y una centrífuga preparativa. Analítica Preparativa Las ultracentrífugas analíticas Beckman se componen esencialmente de un motor, de un rotor de centrifugación, que esta en una cámara blindada protectora y de un sistema fotográfico para registrar la distribución de las concentraciones de la muestra en la celda de centrifugación, o bien, de una computadora. El rotor esta suspendido en el centro del motor mediante un cable. Uno de los agujeros del rotor contiene la celda de centrifugación; el otro sirve para equilibrar el peso y contiene un agujero de referencia para determinar la distancia al centro de rotación. Las paredes de la celda están diseñadas de modo que si se orientan con cuidado al colocar la celda en el rotor, tales paredes serán paralelas a las líneas del campo centrífugo, lo cual impide la acumulación de materiales en las paredes de la celda. La celda consta de una pieza central que contiene la muestra líquida, dos ventanas, un cilindro soporte en el que se introduce la pieza central y las ventanas; y una compuerta de alimentación. Las ventanas suelen estar hechas de cuarzo, aunque a veces se utiliza zafiro para centrífugas de velocidades muy altas puesto que se deforma menos cuando se opera a fuerzas elevadas. La pieza central suele estar hecha de metal (aluminio) o de plástico, las primeras tienen la ventaja de que el equilibrio térmico queda establecido rápidamente, reduciendo al mínimo la convección producida por los gradientes térmicos. La desventaja del metal es que a veces reacciona con el disolvente o el soluto por lo que, hay que utilizar el plástico. Una ultracentrífuga analítica es una ultracentrífuga preparativa complementada con un sistema de detección óptico que es capaz de medir directamente la concentración de la muestra durante la sedimentación. La introducción de la ultracentrífuga analítica Beckman Coulter XL-A fue en 1992 y en contraste a la versión anterior (modelo E), el modelo XL-A es compacto y fácil de utilizar. Los parámetros de centrifugación (velocidad del rotor, temperatura.) y adquisición de datos son bajo control computarizado y experimentos largos, de horas o días, se llevan a cabo con la mínima intervención del operador y si se desea, los datos pueden ser vistos o analizados en tiempo real. El modelo XL-A utiliza un sistema óptico de absorbancia basado en una lámpara de xenón, un rastreador monocromático que permite la medición de la concentración de la muestra en un rango de longitud de onda de 200 a 800 nanómetros. El sistema óptico de interferencia Rayleigh fue adicionado al modelo XLA creando la ultracentrifuga analítica XL-I que puede obtener datos simultáneamente con ambos tipos de sistemas ópticos. El sistema óptico de interferencia Rayleigh mide la concentración de la muestra basado en cambios en el índice de refracción. 11 Cada sistema óptico tiene ciertas ventajas y desventajas. La óptica de absorción es sensible para la detección de macromoléculas que contienen fuertes grupos cromóforos. Por ejemplo, tomando la ventaja de la intensa absorción del grupo amida en el lejano ultravioleta (230 nm), las proteínas pueden ser caracterizadas con una buena señal a concentraciones de 10 mg/ml. Similarmente, los ácidos nucleicos pueden ser estudiados en la misma concentración por su absorbancia a 260 nm. Para muestras que contienen dos a más componentes con diferente espectro de absorción (por ejemplo proteínas y ácidos nucleicos) los datos pueden ser obtenidos a múltiples longitudes de onda para detectar selectivamente las diferentes especies en solución. El sistema óptico de interferencia Rayleigh es utilizado para el análisis de macromoléculas que carecen de cromóforos intensos (ejemplo polisacáridos) y muestras que contienen moléculas que absorben fuertemente (ejemplo ATP, GTP, DTTOXIDADO). Este sistema óptico es utilizado para la caracterización de muestras muy concentradas. Existe otro tipo de sistema óptico utilizado en las centrífugas analíticas llamado sistema Schlieren, en el cual la luz que atraviesa las regiones de concentración uniforme prosigue su camino sin desviarse, mientras que la que atraviesa regiones de concentración cambiante se desvía debido al cambio del índice de refracción que varía con la concentración. El sistema óptico de las modernas centrífugas convierte estas desviaciones en una curva que muestra el gradiente de concentración. Se puede ajustar el sistema de modo que las curvas sean más o menos agudas; sin embargo, al realizar estos ajustes, el área rodeada por la curva Schlieren y la línea de base debe permanecer constante y proporcional a la concentración. Midiendo estas áreas y utilizando ciertas constantes ópticas del aparato, se puede determinar la concentración. A medida que disminuye la 12 concentración del material en la celda, también disminuye el área englobada por el pico hasta que apenas puede diferenciarse de la línea de base. En la práctica, el limite inferior del sistema Schlieren es una concentración de algunos miligramos por milímetro. El valor del sistema Schlieren reside en su gran capacidad para examinar el perfil del frente de sedimentación y para detectar la presencia de heterogeneidades en s. Se ha utilizado muy ampliamente, sobre todo para la determinación del coeficiente de sedimentación de las proteínas. Otras variantes de centrífugas utilizadas ampliamente, son descritas a continuación. Centrífuga Tubular Las centrifugas tubulares (CT) consisten básicamente de un tubo vertical esbelto que gira a altas velocidades por la acción de un motor eléctrico, o una turbina de aire o vapor. Este tipo de centrífuga es una de los más eficientes y sencillos, capaz de separar partículas hasta de 0.1 mm. Las CT pueden contar con un sistema de enfriamiento por lo que son empleadas en el manejo de caldos con enzimas o proteínas. Durante la operación de la CT la suspensión es alimentada por la parte inferior y los sólidos sedimentan en la pared del tubo. El líquido claro se recolecta por rebosamiento en la parte superior. Conforme se forma la precipitado el área de flujo se reduce y el tiempo de residencia del liquido disminuye. Esto se traduce en un aumento gradual del contenido de sólidos en el sobrenadante que puede ser determinado por mediciones de turbidez. Un modelo típico de laboratorio consta de un tubo de 4.5 cm de diámetro por 25 cm de longitud, el cual puede girar a una velocidad de hasta 50 000 r.p.m., desarrollando campos de hasta 62 000 g, con una capacidad de hasta 100 l/h. En la siguiente imagen se muestra una centrífuga tubular. Centrifugas de Cámara Múltiple Las centrífugas de cámara múltiple fueron creadas para incrementar la capacidad de manejo de sólidos de las centrífugas tubulares. Estas centrífugas consisten en una serie de tazones concéntricos con deflectores que provocan un flujo en serie de la suspensión. Su operación permite la clasificación de las partículas conforme pasan de una cámara a otra. El líquido claro se obtiene por rebosamiento en la última cámara. Este arreglo genera un mayor tiempo de residencia del líquido, en relación al de la centrífuga tubular, así como mayor capacidad de manejo de sólidos. 13 El diámetro de los equipos de cámara múltiple varía de 335 a 615 mm, con velocidades de rotación entre 5 000 y 8 400 r.p.m., produciendo campos entre 5 000 y 9 000 g, respectivamente. La capacidad de manejo de sólidos varía entre 2.5 y 60 litros dependiendo del material y del número de cámaras. La descarga de sólidos y el mantenimiento de estos equipos es más difícil que el de las centrífugas tubulares, ya que la centrífuga tiene que ser desarmada para sacar los sólidos. Centrífugas Decantadoras o de Tornillo Las centrífugas decantadoras se caracterizan por un tazón horizontal con una sección cilíndrica y una sección cónica, con una relación de longitud a diámetro entre 1.5 - 3.5. el tazón contiene un tornillo transportador que gira en la misma dirección, pero a una velocidad ligeramente superior o inferior que el tazón (entre 5 – 100 r.p.m.) de diferencia. Las velocidades de rotación son de 1 600 a 6 000 r.p.m. por lo que los campos centrífugos son menores que los de los otros equipos. En las centrífugas decantadoras la suspensión es introducida a través de perforaciones por un tubo axial concéntrico a la flecha del tornillo, al final de la sección cónica o de compresión de sólidos. Los sólidos que se depositan en la pared son transportados y descargados continuamente por el extremo cónico de la centrífuga, donde escurren antes de salir. El líquido claro se obtiene por rebosamiento en el extremo opuesto a través de orificios de descarga que fijan el nivel del líquido en la centrifuga. Existen diversos diseños de centrifugas decantadoras. Los diámetros de los tazones varían de 15 a 140 cm. Para los modelos piloto e industriales. La descarga de los sólidos varía de 30 Kg/h hasta 60 Ton/h, con alimentaciones entre 308 y 1890 l/min, respectivamente. En Internet se encuentra un movie del funcionamiento de este tipo de centrífuga, la dirección es: http://www.diquima.upm.es/docencia/tqg/eq_tqg.html Centrífuga de Discos La centrífuga de discos consta de un eje vertical sobre el cual se montan un conjunto de discos en forma de conos truncados, uno sobre otro. El rotor de la centrifuga provoca el giro tanto de los discos como del tazón de la centrifuga. Los discos constan de bordes internos que permiten mantener pequeñas separaciones entre ellos, del orden de 0.5 a 2.0 mm. El ángulo que forman los conos con la vertical varía entre 35 y 500 dependiendo de la aplicación particular. Entre la pila de discos y el tazón existe un espacio que permite la acumulación de sólidos. Durante la operación de la centrifuga de discos la suspensión es alimentada continuamente en el fondo del tazón a través de la parte central de la flecha, y fluye hacia arriba entre las placas hacia la salida en la parte central superior del equipo. Debido a la fuerza centrífuga, los sólidos se depositan en la cara interna de los discos, resbalando hacia la cámara colectora debido al ángulo de los discos. La siguiente imagen muestra una centrífuga de discos. En Internet, se encuentra un archivo del funcionamiento de este tipo de centrífugas en la dirección: te://www.diquima.upm.es/docencia/tqg/eq_tqg.html 14 TIPOS DE ROTORES Los rotores para centrífugas preparativas pueden ser clasificados en cuatro tipos principalmente: rotores de columpio, rotores de ángulo fijo, rotores verticales y rotores zonales. Rotores de Columpio En el caso de estos rotores la muestra están en una cubeta individual el cual se mueve de forma perpendicular al eje de rotación del rotor, por lo tanto, en estos rotores, la fuerza centrífuga es ejercida a lo largo del eje del tubo, y a pesar de que la fuerza centrífuga es axial, algunas partículas son sedimentadas sobre la pared del tubo; esto se puede evitar con la sedimentación zonal. Estos rotores llevan de tres a seis tubos fijados a un soporte de metal que esta libremente suspendido, la suspensión libre sirve solo para fijar la posición de inicio del tubo con la muestra, cuando el rotor comienza a girar, el bucket se pone de forma horizontal. Todos los buckets de un rotor son de igual masa por lo que sólo se necesita balancear los tubos con la muestra. La superficie de los buckets debe de estar seca y limpia Los rotores de columpio Beckman tiene un número que designa la máxima velocidad permitida (r.p.m. x 1000) y por Ti si esta hecho de titanio, el digito adicional que sigue a la marca mencionada indica la variante del rotor con la misma velocidad máxima ( 50 Ti, 50.2 Ti, etc.) seguido de las letras SW. Estos rotores pueden ser divididos en tres grupos. 1.- Rotores de alta velocidad con tubos de 4.4 y 5 ml. Tipo SW 50.1, SW 55 Ti, SW 60 Ti y SW 65 Ti. Estos rotores son convenientes para centrifugación zonal y al equilibrio donde no es necesaria una fina resolución. 2.- Rotores de velocidad moderada para tubos de 13.2 a 17 ml de capacidad, son convenientes para la separación de partículas de masa similar por medio de centrifugación zonal en gradientes de densidad de sacarosa. Este grupo incluye rotores del tipo SW 20.1, SW 40 Ti y SW 41 Ti. 3.- Rotores para tubos largos y de baja velocidad de rotación. Incluye rotores del tipo SW 25.1 que contiene tres tubos de 34 ml, el tipo SW 25.2 (3x 60 ml) y SW 28 con seis tubos de 38.5 ml. A continuación, la imagen corresponde a un rotor de columpio. 15 Rotores de Ángulo Fijo Como su nombre lo indica los tubos tienen un ángulo fijo y cuando el rotor gira la solución se reorienta en el tubo. El ángulo del tubo en el rotor puede variar de 140 a 400 . En los modelos comerciales existe una gran variedad de capacidades, rango de velocidades y ángulos de inclinación. Los rotores con bajo ángulo son más eficientes para sedimentación porque el trayecto de las partículas que sedimentan es corto. Los rotores de ángulo fijo están diseñados para soportar altas fuerzas centrífugas, por arriba de 600 000 g . Las siguientes imágenes muestran dos modelos de rotores de ángulo fijo. Eje de rotación rmin rmax Rotores Verticales Estos rotores se utilizan en la mayoría de centrífugas de alta velocidad y ultracentrífugas. En estos rotores, los tubos están en posición vertical y se podría considerar que es una forma extrema de un rotor de ángulo fijo, sin embargo, las características del rotor vertical son lo suficientemente diferentes para considerarse otra categoría. Cuando el rotor gira la solución se reorienta 900, esta reorientación se lleva a cabo debajo de las 1000 r.p.m. y si la aceleración es suficientemente lenta la reorientación no rompe el gradiente. La característica importante de los rotores verticales es la corta trayectoria de sedimentación de las partículas (que equivale al diámetro del tubo). El diseño de los rotores verticales permite muy altas fuerzas centrífugas. 16 Los rotores verticales no son convenientes para sedimentación pero pueden ser utilizados para centrifugación isopícnica. La siguiente imagen muestra un rotor vertical. Rotores Zonal Los procesos de sedimentación que se llevan a cabo en un rotor zonal son similares a los que ocurren en los rotores de bucket, sin embargo, en lugar de tubos hay cuatro sectores en el cuerpo del rotor zonal formados por la inserción de una cilindro de cuatro sectores que esta hecha de Noryl, un químico inerte y suave. El ensamble del aspa asegura la rotación del liquido junto con el rotor y consecuentemente la formación de una fuerza centrífuga. La dirección de la sedimentación es hacia la periferia del rotor. En el interior del centro de las aspas hay canales que conectan la parte central y la región periférica del rotor con un dispositivo transicional que se encuentra arriba del rotor. Esto permite que el rotor pueda ser llenado y descargado mientras esta girando a baja velocidad (2000 a 3000 r.p.m.), esto es necesario para crear un gradiente de densidad al inicio de la corrida y prevenir la ruptura del mismo después del fraccionamiento. La densidad del gradiente aumenta del centro a la periferia del rotor haciendo que la fuerza centrífuga sea mantenida a lo largo de la corrida. La siguiente imagen ilustra la carga de la muestra: la solución es bombeada o inyectada con una jeringa por un canal central, mientras el exceso de muestra es desalojado del sistema. Para asegurar la eficiencia de separación el volumen no debe de exceder el 10 % de la cavidad del rotor. La inyección de la muestra debe de ser en forma lenta y uniforme. El siguiente esquema muestra el paso final de una centrifugación zonal. El rotor es cerrado con una tapa y gira a altas velocidades, las partículas están distribuidas a lo largo del gradiente de acuerdo a sus respectivas constantes de sedimentación. 17 Carga y fraccionamiento de un gradiente: Mientras el rotor está girando lentamente el líquido de mayor densidad que será usado en la formación de gradiente se carga a través de una conexión hacia el centro del rotor, seguida por las demás soluciones de densidad decreciente. El siguiente esquema muestra la salida de las soluciones del gradiente, esta es a través de una línea central donde la salida de la solución menos densa precede a la más densa. La solución es monitoreada por un densitómetro, fluorímetro o medidor de la radioactividad para que las fracciones puedan ser colectadas individualmente. Se han desarrollado diferentes diseños de este tipo de rotores a los que se las ha agrupado en diferentes series, de tal manera que hay de la serie A, B, C, D, F, K y J. Cada serie agrupa a rotores que comparten características en cuanto a su velocidad. En la siguiente tabla se muestran las aplicaciones de los rotores en los diferentes tipos de centrifugación. Tipos de rotores y sus aplicaciones. Tipo de separación Tipo de rotor Ángulo fijo. Vertical. De columpio. Zonal. sedimentación zonal excelente Pobre Ineficiente Pobre isopícnica pobre buena buena excelente buena excelente adecuado adecuado Factor k y k´ Un concepto para la selección o funcionamiento de un rotor es el factor k y el factor k´. Estos factores pueden ser utilizados para comparar la eficiencia de varios rotores para el material con el que se esta trabajando. El factor k provee una estimación del tiempo t en horas, requerido para separar la partícula de interés con un coeficiente de sedimentación conocido s (en unidades Svedberg), a la máxima velocidad del rotor, por lo que tenemos: t= k / S20,w Si se conoce el coeficiente de sedimentación de la partícula en el medio utilizado y el factor k del rotor, es posible estimar el tiempo de separación de la partícula. 18 El factor k se calcula de la siguiente manera k= ln (rmax/rmin) x 1013 w2 3600 donde, w es igual a 0.104720x r.p.m., rmax es la máxima distancia radial de el eje centrifugo (en cm) y rmin es la distancia mínima radial de el eje centrífugo (en cm). A menor valor de k, más eficiente es el rotor, puesto que varia directamente proporcional al tiempo en que tarda la partícula en separarse. El factor k´ es utilizado para estimar el tiempo requerido para mover una zona de partículas a el fondo del tubo a través de un gradiente lineal de sacarosa a la máxima velocidad del rotor. K´ = I Z2 – I Z1 x 1013 W2 3600 Donde Z2 es el máximo porcentaje de el gradiente de sacarosa, Z1 es el mínimo porcentaje de el gradiente de sacarosa, I es el valor integral obtenido en unas tablas (ver tabla I del apéndice), después de calcular Z0. Z0 = Z1 rmax – Z2 rmin rmax – rmin El tiempo t (en hrs) para que una partícula (que se conoce su coeficiente de sedimentación), alcance el fondo del tubo en un gradiente lineal de sacarosa se puede calcular por la siguiente ecuación: t = k´/s20,w. Frecuentemente el tiempo de corrida que se utiliza es el que se encuentra en la literatura, o bien, es determinado arbitrariamente hasta que se completa la separación. El utilizar los factores k y k´ podría ahorrar tiempo en la centrifugación. Estos factores pueden ser utilizados para convertir un tiempo de corrida de un tipo de rotor a otro. Por ejemplo si el rotor tipo 40 tiene una máxima velocidad de 40 000 r.p.m. se lleva 4 horas en realizar la separación, el tiempo de corrida que se lleva un rotor tipo 60 Ti a 60 000 r.p.m. puede ser determinado por la siguiente relación: t1 = k1 x t2 / k2 donde t1 es el tiempo de corrida de el rotor tipo 60 Ti, k1 es el factor k del rotor 60 Ti, t2 es el tiempo observado en el rotor tipo 40 y k2 es el factor k para el rotor tipo 40. Para el ejemplo anterior el tiempo de corrida para el rotor 60 Ti es aproximadamente de dos horas TIPOS DE CENTRIFUGACIÓN El objetivo de la centrifugación es la separación de partículas especificas en una solución. El término partícula involucra sustancias disueltas y partículas de tamaño microscópico y macroscópico que se encuentran suspendidas en un fluido que usualmente es agua. En biología las partículas suelen ser células, organelos subcelulares o moléculas grandes; en química, usualmente son solutos macromoleculares disueltos. Existen tres tipos principales de centrifugación: Centrifugación diferencial, centrifugación zonal y centrifugación al equilibrio. 19 Centrifugación Diferencial o Pelleting En este método, el tubo de la centrífuga es llenado inicialmente con una mezcla uniforme de la solución de la muestra, a través de la centrifugación se obtiene una separación de dos fracciones: Un pellet (sedimento) que contiene la partícula sedimentada y un sobrenadante con la fracción no sedimentada de la solución. Un particular componente puede terminar en el sobrenadante o en el pellet, o podría estar distribuido en ambas fracciones, dependiendo de su tamaño y/o de las condiciones de centrifugación. El pellet es una mezcla de todos los componentes sedimentados y esta contaminado con cualquier partícula no sedimentada que estuviera en el fondo de el tubo. Las dos fracciones son recuperadas por decantación de la solución sobrenadante del pellet. El sobrenadante puede ser recentrifugado a altas velocidades para obtener una mayor purificación con la formación de nuevo pellet y sobrenadante. El pellet puede ser resuspendido en un pequeño volumen y recentrifugado dependiendo de lo que se desee separar. Otro método de separación es por gradiente de densidad, un método que es más complicado que la centrifugación diferencial pero tiene algunas ventajas: el método de gradiente de densidad permite la completa separación de algunos o todos los componentes de la mezcla y también permite que se puedan realizar mediciones analíticas. Hay dos métodos básicos de centrifugación por gradiente de densidad: La centrifugación zonal y la centrifugación isopícnica o al equilibrio. Centrifugación Zonal Cuando se coloca una pequeña cantidad de la disolución con las moléculas que se quieren caracterizar sobre la superficie de un gradiente de densidad previamente formado a lo largo de un tubo de centrifugación, en la superficie siempre hay una densidad menor que la existente en la parte superior de el gradiente y cuando se centrifuga el tubo las moléculas de la capa superior sedimentan a través de el gradiente. Si todas ellas tienen el mismo coeficiente de sedimentación sedimentarán en una estrecha franja, sin embargo, si hay moléculas con distintos coeficientes de sedimentación, se separaran unas de otras a medida que se produzca la centrifugación y finalmente los diferentes componentes se resolverán en una serie de zonas o bandas, de ahí el nombre de centrifugación zonal. Una vez completada la centrifugación, se fracciona el contenido del tubo generalmente por recolección de las gotas cuando se hace un orificio en el fondo del tubo y el goteo es lo suficientemente lento para no producir turbulencias. Cada gota representa una lamina del tubo y una fracción está representada por una o varias gotas. 20 Se pueden utilizar una gran variedad de técnicas para medir la cantidad de los materiales y, a partir de éstas, determinar la distribución de las concentraciones. En la centrifugación analítica se depende totalmente de técnicas ópticas para detectar las moléculas. En cambio, las porciones obtenidas de un tubo fraccionado por goteo, pueden titularse radiactivamente por reacciones químicas, por actividad enzimática, por absorción, fluorescencia o por una combinación de todas estas técnicas. La necesidad de un gradiente de concentración para la centrifugación zonal se debe a lo siguiente: considérese las consecuencias de colocar una disolución de baja densidad sobre otra de alta densidad en la que no existe gradiente de concentración. Inicialmente, el sistema es estable, debido a la diferencia de densidades en la interfase, supóngase que hay pequeñas fluctuaciones de temperatura en la disolución, como la densidad de la mayoría de las disoluciones disminuye al aumentar la temperatura, estas fluctuaciones crearán inversiones locales de la densidad lo que se traducirá en un flujo local de líquido, flujo que recibe nombre de convección. Esta convección tendrá un efecto nulo sobre la interfase inicial, ya que la diferencia de densidades en dicha interfase suele ser lo suficientemente grande como para que no se produzcan mezclas a través de ellas, a menos que la diferencia de temperatura sea enorme (10 oC a 20 oC). Por el contrario, tras la sedimentación, las moléculas que se pretenden estudiar se habrán movido hacia el interior de las capas inferiores más densas, donde la convección comentada puede distorsionar cualquier tipo de banda que pudiera formarse. La introducción de un gradiente de densidad pronunciado asegura que los cambios de temperatura tengan que ser muy grandes para poder crear las diferencias de densidad suficientemente grandes para provocar convección en el interior del gradiente. Una segunda función importante del gradiente es el impedir las mezclas debidas a perturbaciones mecánicas; cualquier perturbación sería contrarrestada por la tendencia a restablecer el equilibrio en el que la densidad baja esta por encima de la alta. El gradiente tiene una tercera función. Considérese un sistema sin gradiente en el que no existieran ni fluctuaciones de temperatura ni perturbaciones mecánicas, en el que las moléculas que están sedimentando han entrado en la capa inferior y formado una banda. En esta zona, la propia presencia de las moléculas incrementa la densidad de la disolución, normalmente un efecto muy pequeño, pero que es muy importante cuando se utilizan concentraciones elevadas. De modo que la densidad de la banda es superior a la de la capa inmediatamente por debajo de ella, lo que se traduce en el flujo convectivo de la zona hacia el fondo del tubo. 21 Si, por el contrario, se realiza la sedimentación a través de un gradiente de concentración previamente formado, las moléculas en sedimentación estarían constantemente entrando en una zona de mayor densidad . Su llegada aumentaría la densidad de la región, pero si el gradiente fuera suficientemente fuerte, el soporte de las moléculas recién llegadas sería insuficiente para ocasionar una inversión de la densidad y el sistema permanecería estable. El material más comúnmente utilizado para formar gradientes de densidad es la sacarosa, debido a su pureza, su bajo costo y su no interferencia con la mayoría de las mediciones químicas, ópticas o enzimáticas. Si la macromolécula en estudio es una enzima o una proteína inestable se usa frecuentemente el glicerol, puesto que muchas proteínas son más estables y se desnaturalizan más difícilmente en presencia de glicerol. La separación zonal es ideal para separar partículas de tamaño definido (ejemplo: proteínas, RNA y ribosomas), sin embargo, las partículas del mismo tipo son heterogéneas; en este caso, la separación por centrifugación zonal no es eficiente y es mas apropiado separar las partículas en base a otro parámetro como la densidad; por lo tanto se recurre a la separación isopícnica. Materiales para Generar un Gradiente de Densidad Sacarosa: La sacarosa posee propiedades para ser un ideal medio para la formación de gradiente y es el más utilizado en la centrifugación zonal. Este material tiene aplicación en el fraccionamiento de organelos celulares y virus. La razón de su gran utilidad es su comportamiento inerte ante la presencia del material biológico, su bajo costo y su naturaleza estable. Debido a su gran uso, se han caracterizado las propiedades de la sacarosa y de sus soluciones con respecto a sus relaciones de concentración y viscosidad, densidad e índice de refracción en un gran rango de temperaturas, y es posible encontrar las descripciones de los gradientes disponibles y condiciones de centrifugación para la separación de un gran tipo de muestras biológicas. La principal desventaja de la sacarosa son algunas de sus propiedades fisicoquímicas. Las soluciones de sacarosa tienen alta fuerza osmótica y las soluciones por arriba del 9% (p/V) son hipertónicas y solo tienen una densidad de 1.03 g/cm3 lo que reduce su uso en la separación de partículas osmóticamente sensibles. Las soluciones concentradas de sacarosa requeridas para separaciones isopícnicas son muy viscosas, por lo que, las partículas pequeñas son incapaces de alcanzar su posición isopícnica en el gradiente. La sacarosa es muy susceptible a hidrólisis de los enlaces glicosílicos a pH menores a 3. Cuando se calientan, y a menos que se ajuste el pH a 5-6, las soluciones concentradas tienden a caramelizarse por arriba de los 100 0C. Esta caramelización provoca cambios en las propiedades de la solución de sacarosa. Como regla general, es mejor esterilizar por filtración o bien, esterilizar la solución de sacarosa con 0.1% de dietilpirocarbonato; el exceso de dietilpirocarbonato puede ser removido calentando la solución a 60 0C por varias horas. La ventaja de tratar la solución de sacarosa con dietilpirocarbonato es que inactiva a la mayoría de las enzimas y por ello es utilizado para remover actividad ribonucleasa en las soluciones de sacarosa. Los gradientes de sacarosa pueden ser preformados para fraccionamiento zonal de macromoléculas y complejos macromoleculares, por ejemplo, proteínas, ácidos nucleicos, ribosomas y polisomas, también se utiliza gradientes de sacarosa para la separación isopícnica de virus, organelos celulares y de células si la viabilidad no es esencial. 22 Glicerol: El glicerol está disponible como reactivo puro y sus gradientes han sido utilizados en lugar de soluciones de sacarosa en centrifugación zonal. Las soluciones de glicerol son menos densas y menos viscosas que las correspondientes soluciones de sacarosa, sin embargo, las soluciones de glicerol de la misma densidad de una solución de sacarosa es mucho más viscosa que la solución equivalente de sacarosa. La ventaja de utilizar glicerol es que ayuda a conservar la actividad de un gran número de enzimas además de ser muy barato. Polisacáridos: Para evitar el problema que se puede originar en el fraccionamiento de partículas osmóticamente sensibles (células y organelos) en altas fuerzas osmóticas en las soluciones de sacarosa, se han utilizado un gran número de polisacáridos como medio para la formación de gradientes. Se han utilizado polisacáridos como glucógeno, dextrán y otros materiales, sin embrago, el más utilizado es el Ficoll. El Ficoll es producido por la copolimerización de moléculas de sacarosa con epiclorohidrina para dar un polisacárido con un peso molecular promedio de 400 KDa. La soluciones de Ficoll por debajo del 20% (P/V) equivalente a una densidad de 1.07 g/cm3 son inertes osmóticamente pero la desventaja que presentan es que a altas concentraciones, la osmolaridad aumenta abruptamente. El otro problema al trabajar con estas soluciones de Ficoll es su alta viscosidad. Su aplicación ha sido en separaciones zonal e isopícnica. La muestra se puede separar de la solución de ficoll por pelleting de la fracción diluida. Gradientes de iodinato: la mayoría de los compuestos iodinatos usados como medio para generar gradientes tienen una estructura basada en el ácido tri-iodobenzoico, en el que los grupos hidrofílicos están unidos para aumentar la solubilidad de estos compuestos en agua. La metrizamida y Nycodenz son solubles en medio acuoso y son estables en un rango de pH 2 a 12.5. Las soluciones de metrizoato de sodio y Nycodenz no son termolábiles por lo que pueden ser esterilizadas en autoclave, sin embargo, el grupo glucosamida de la metrizamida la hace inestable a temperaturas por arriba de los 55 0C , por lo que, deben ser esterilizadas por filtración. En comparación con otros medios para generar gradientes, los compuestos iodinatos tienen grandes ventajas. Por ejemplo, a todas las densidades, los gradientes de iodinato presentan menor viscosidad y osmolaridad que los de sacarosa. Los gradientes de iodinatos pueden ser preformados y la muestra se carga en la parte superior del gradiente. Este método es preferible para la preparación de gradientes isopícnicos y para la separación de partículas grandes (células, organelos et.) los cuales necesitan ser centrifugados por corto tiempo (2 horas o menos). Alternativamente, para partículas pequeñas es posible realizar gradientes autogenerados durante la centrifugación, en este caso, la muestra es mezclada con la solución del gradiente haciendo posible el uso de un mayor volumen de la muestra. Suspensiones coloidales de sílica: las suspensiones coloidales de sílica contienen partículas en el rango de 3-15 milimétros de diámetro y son extensamente usadas para varias aplicaciones industriales y para separaciones centrífugas. El Percoll tiene algunas ventajas sobre las preparaciones de sílica de las que deriva. Las partículas coloidales están cubiertas con polivinilpirrolidona (PVP) la cual minimiza sus interacciones con material biológico. Las suspensiones de sílica coloidal son desestabilizadas por condiciones que tienden a neutralizar las cargas de las partículas, por lo tanto, el Percoll precipita a bajo pH y las altas fuerzas iónicas también desestabilizan la suspensión coloidal. El Percoll interfiere con la mayoría de los tipos de los análisis de proteínas y para algunos tipos de análisis de ácidos nucleicos y polisacáridos. El uso de gradientes de Percoll es restringido para separaciones isopícnicas y estos gradientes pueden ser usados para células, organelos y algunos virus. La sílica coloidal puede ser removida de las fracciones por centrifugación diferencial para retirar el material fraccionado de la mayoría de las partículas de sílice. 23 Formas de Gradientes La forma del gradiente se refiere al perfil de concentración, es decir, a la variación de la concentración en el gradiente a lo largo del tubo. Hay dos tipos básicos de gradientes que son representados con funciones matemáticas simples y son fáciles de preparar con equipo de laboratorio, estos son: 1) Continuos que pueden tener forma lineal, convexo, cóncavo y 2) discontinuo. La siguiente imagen muestra ambos gradientes. Los gradientes continuos pueden ser producidos por adición continua de una solución de alta densidad CD desde un reservorio a un compartimento que contiene una solución de baja densidad CL, mientras al mismo tiempo se desplaza la mezcla al tubo que contiene el gradiente. El gradiente producido es lineal si los dos compartimentos tienen el mismo diámetro. Cuando los compartimentos tienen diferentes diámetros se pueden producir gradientes convexos o cóncavos como se puede observar en las siguientes figuras. a) Gradiente lineal, b) Gradiente convexo y c) Gradiente cóncavo 24 La forma del gradiente es importante para lograr la separación deseada, y para determinar propiedades tales como densidad de flotación y coeficiente de sedimentación. Los gradientes lineales en densidad son los mas utilizados y a menudo dan la mejor resolución de componentes de proteínas, enzimas, hormonas, subunidades ribosomales y algunos virus de plantas. En un gradiente lineal la densidad incrementa linealmente conforme aumenta la distancia del centro de rotación. Cuando se diseña un gradiente lineal en un rotor vertical o de columpio, la densidad en la superficie del gradiente debe “soportar” la muestra, mientras que la densidad en el fondo del tubo no debe exceder la densidad de las partículas a ser separadas y en general, a mayor pendiente del gradiente (más pronunciado), mayor resolución. Para algunas aplicaciones es necesario generar gradientes cóncavos o convexos. Cuando el gradiente necesita un cambio pronunciado en la superficie para soportar la muestra y no tener un cambio abrupto conforme se acerque al fondo, es necesario utilizar un gradiente de forma convexa. Si es necesario que en la terminación del gradiente haya un cambio abrupto, se puede realizar un gradiente de forma cóncavo. Este tipo de gradiente es preferido cuando se necesita un cambio brusco en la viscosidad cerca del fondo del tubo, el cual puede ser utilizado para disminuir la sedimentación de partículas de un tamaño determinado mientras las zonas de menor viscosidad siguen separando a las otras partículas. Los gradientes cóncavos son utilizados para separación de lipoproteínas. En los gradientes discontinuos, el cambio de concentración de las soluciones en el gradiente no es gradual. Los gradientes discontinuos se utilizan para separar células u organelos subcelulares de plantas u homogenados de tejidos animales y para la purificación de algunos virus. Centrifugación al Equilibrio En la separación isopícnica las partículas son separadas en base a su densidad, el tamaño solo afecta la velocidad con la que las partículas alcanzan su posición isopícnica. Estas separaciones se llevan a cabo en un gradiente de densidad en el que las partículas se mueven hasta el punto en el que su densidad es la misma que el medio. La técnica de centrifugación al equilibrio fue desarrollada por Matthew Meselson, Franklin Stahl y Jerome Vinograd. En esta técnica la densidad del disolvente es casi la misma que la de la molécula que se está estudiando. Esta técnica requiere un tercer componente (normalmente una sal de cesio), de bajo peso molecular y elevada densidad. Cuando se centrifuga la disolución, las sal se redistribuye y alcanza un equilibrio, formando, un gradiente de concentración que es menos denso en la parte superior y más denso en el fondo del tubo obteniéndose como resultado un gradiente de densidad. Las macromoléculas también sedimentan, pero el material en la parte superior del tubo se mueve centrífugamente a través del gradiente, mientras que el mismo material en la parte baja del tubo se mueve centrípetamente. Este movimiento continua hasta que las macromoléculas forman una banda en una posición determinada del gradiente de concentración, posición en la que la densidad de la macromolécula iguala a la de la disolución. La anchura de la banda está determinada por el equilibrio entre la fuerza centrífuga (que tiende a estrechar la banda), la difusión (que tiende a ensancharla) y el gradiente de densidad (un gradiente más pronunciado dará una banda más estrecha). Como se mencionó anteriormente, la muestra se mezcla con la solución del gradiente y conforme se lleva a cabo la centrifugación se genera el gradiente (gradiente autogenerado) a la vez que se separan las partículas de la muestra. Sin embargo, la muestra puede ser colocada en la superficie de un gradiente preformado de igual forma que en la centrifugación zonal. 25 Gradientes de Densidad Autogenerados Tal como se indicó anteriormente, si se extiende una capa de la muestra sobre una disolución más densa sin gradiente de densidad, la convección acabará destruyendo o dilatando el límite de sedimentación. Vinograd se dio cuenta de que si la muestra estaba en una disolución de muy baja densidad, debido a la difusión del soluto utilizado para incrementar la densidad de la disolución más densa, al cabo de un cierto tiempo la discontinuidad de la densidad generada en la interfase se propagaría lentamente hacia el fondo del tubo de centrifugación, formando un gradiente suave. Por debajo del frente generado por el gradiente que se va propagando, no existe gradiente y puede producirse la convección. Por el contrario, en el gradiente en propagación y por encima de él, hay una estabilización frente a la convección. Obviamente el material en estudio no sedimenta con mayor velocidad que la de propagación del gradiente, el material se hallará en un gradiente de densidad y la sedimentación será completamente normal, es más, si el soluto de la disolución más densa tiene una densidad muy elevada, como ocurre con el cloruro de cesio, la sal también sedimentará ligeramente formando un gradiente estabilizador adicional. Se ha denominado a esta técnica sedimentación en gradientes de densidad autogenerados. Materiales para formar Gradientes Autogenerados Sales de cesio Los gradientes de sales de cesio fueron primero utilizados para la separación isopícnica de ácidos nucleícos y se han establecido como los más extensamente utilizados para la formación de gradientes isopícnicos. Todas estas soluciones son altamente iónicas, son no viscosas pero, tienen alta osmolaridad. Los gradientes de soluciones de sales de cesio se pueden generar in situ por centrifugación. Lo abrupto del gradiente formado depende del campo centrífugo aplicado y del soluto utilizado; por ejemplo, para una fuerza centrifuga dada el sulfato de cesio forma gradientes mas abruptos que los que se forman con cloruro de cesio. 26 Los gradientes de cloruro de cesio son utilizados para separar diferentes especies de DNA de acuerdo a su composición de bases. Las especies de DNA que son enriquecidas en citosina y guanina bandean denso. El grado de separación de diferentes especies puede ser utilizado por la adición de drogas como la distamicina la cual se une selectivamente a regiones del DNA que son ricas en adenina y timina y disminuye la densidad de este DNA. En suma, en la presencia de bromuro de etidio, es posible separar DNA de diferentes conformaciones (ejemplo, superhelicoidal y lineal) incluso teniendo la misma composición de bases. Los gradientes de sulfato de cesio son utilizados para separar diferentes especies de DNA, sin embargo, la composición de bases tiene un efecto pequeño en la densidad de flotación de DNA y los gradientes deben de ser abruptos. Una ventaja de los gradientes de sulfato de cesio comparado con el gradiente de cloruro de cesio es que ellos pueden ser utilizados para bandear RNA. Algunas especies de alto peso molecular de RNA tienden a agregarse y precipitar en gradientes de sulfato de cesio, sin embargo, estos se pueden minimizar adicionando urea 4 M al gradiente. Cuando se utiliza un gradiente abrupto es posible bandear proteínas, DNA y RNA en un solo gradiente de sulfato de cesio. Un problema con los gradientes de sulfato de cesio es que los iones de sulfato reaccionan y se precipitan con la mayoría de los fluidos de centelleo. El cloruro de cesio y el sulfato de cesio son las sales de cesio mas utilizadas para la separación de ácidos nucleicos, sin embargo, hay otras sales de cesio que pueden ser utilizadas para obtener mejores separaciones. Por ejemplo, las sales de tricloroacetato y trifluoroacetato se han utilizado para buenas separaciones de ácidos nucleícos. En el caso del trifluoroacetao de cesio es posible obtener una buena separación de plásmidos superhelicoidal y DNA lineal sin la adición de bromuro de etidio. Sales de sodio y potasio. El cloruro de sodio y el cloruro de potasio son soluciones poco densas para bandear la mayoría de las macromoléculas, el bromuro de sodio, el yoduro de sodio, el bromuro de potasio y el yoduro de potasio forman soluciones densas no viscosas y han sido utilizadas para el bandeo de lipoproteínas, proteínas y ácidos nucleicos. Una ventaja de los gradientes de yoduro de potasio y de yoduro de sodio es que el RNA no se agrega y precipita como en los gradientes de sulfato de cesio. Sin embargo, las sales de yodo tienen la desventaja de que son propensas a la oxidación y se pueden adicionar algunos agentes reductores para prevenir la formación de yodo libre. Sales de rubidio. Estas sales han sido utilizadas para fraccionamientos isopícnicos, en particular se han utilizado gradientes de cloruro de rubidio en lugar de gradientes de cloruro de cesio para separaciones isopícnicas de proteínas, sin embargo el uso de esta sal para la formación de gradientes no presenta mas ventajas que las que se obtienen al utilizar gradientes con cloruro de cesio. PREPARACIÓN DE GRADIENTES Preparación de Gradientes Discontinuos Los gradientes discontinuos pueden ser hechos simplemente colocando una solución de baja densidad sobre otra mas densa, sin embargo una mejor interfase puede ser obtenida si la solución mas densa es colocada bajo la solución menos densa utilizando una jeringa con una aguja larga o una pipeta. El principal problema es que algunos solutos (ejemplo: cloruro de cesio) difunde rápidamente así que la 27 interfase desaparece rápidamente. La siguiente imagen muestra las dos formas de hacer un gradiente discontinuo. A) Cargando por arriba, B) Cargando por abajo Preparación de Gradientes Continuos Este tipo de gradientes incluye a los gradientes autoformados y los gradientes preformados. Los gradientes también pueden ser divididos en normales e isoosmóticos. Los últimos son importantes para la separación de células. Con la excepción de gradientes de Percoll, los gradientes autoformados no pueden ser isoosmóticos. Generación de Gradientes Preformados Los gradientes continuos pueden ser preparados simplemente adicionando las soluciones de diferentes concentraciones para que puedan difundir. Por ejemplo, para un gradiente de sacarosa de 5-20%, se agregan cantidades iguales de cada solución 5, 10, 15 y 20 %, una tras otra (en orden descendiente de concentración) y se dejan difundir de 12-18 h si el tubo es vertical y de 1-2 h si el tubo es colocado horizontalmente. Este método es aplicable para la mayoría de los solutos para realizar gradientes, sin embargo, existen dispositivos para preparar gradientes con diferentes perfiles. En la siguiente imagen se describe la formación de un gradiente continuo a partir de un discontinuo. 28 El dispositivo utilizado para la formación de gradientes se esquematiza en la siguiente imagen . El líquido denso en la cámara A se mezcla continuamente con el líquido menos denso en la cámara B. El flujo es producido por una bomba peristáltica (P) la cual coloca el líquido cada vez más denso en el fondo del tubo de centrifuga. La llave (T) controla el flujo del liquido de A a B . La mezcla en la cámara B se da con un agitador magnético (SB). Gradientes Autogenerados En un gradiente autogenerado, las soluciones son centrifugadas y las moléculas del medio tienden a sedimentar formando un gradiente de densidad. En algunos casos, los gradientes como los de Percoll, forman muy rápidamente un gradiente (20,000 g x 30 min.) sin embargo, hay otras soluciones como el cloruro de cesio que toma muchas horas para alcanzar el equilibrio. Existen una serie de ecuaciones que permiten conocer algunos parámetros útiles en una corrida de centrifugación. En el caso de metales alcalinos (ej. CsCl) es posible predecir el rango del gradiente y el tiempo en que alcanza el equilibrio. Estos cálculos son basados en el valor de b0 (ver valores en el apéndice) que es la constante de proporcionalidad del gradiente de densidad cuyo valor ha derivado de trabajos experimentales. Utilizando este valor, el rango del gradiente de densidad en el equilibrio puede ser calculado como sigue. Primero es necesario encontrar el punto de isoconcentración de el gradiente. Este es el punto (rc) donde la concentración del gradiente es constante independientemente de su forma: rc= [1/3 (rmin2 + r min x rmax + rmax2)] 1/2 Donde rmin y respectivamente. rmax son la distancia radial (cm) de la parte superior y del fondo del gradiente 29 La densidad (dr) en cualquier punto r de el centro de rotación relativo a la densidad en el punto de isoconcentración puede ser calculada con la siguiente ecuación: dr = 1.1 x 10-2 x N2 (rc2 – r2) 2 b0 donde N es la velocidad del rotor en miles de r.p.m.. Por lo tanto, conociendo la densidad inicial de la solución (di), es posible calcular la densidad máxima (en el fondo del tubo) y la densidad mínima (parte superior del tubo) del gradiente en el equilibrio utilizando las siguientes ecuaciones: dmax = di - 1.1 x 10-2 x N2 (rc2 – rmax2) 2 b0 dmin = di - 1.1 x 10-2 x N2 (rc2 – rmin2) 2 b0 Una vez teniendo los valores de dmax y d min , por diferencia podemos conocer el valor del rango de densidad (Dd) que está presente a lo largo del tubo del gradiente, o bien, rearreglando las anteriores ecuaciones, tenemos que: Dd = 0.545 x 104 x N2 (rmax2 – rmin2) = dmax- dmin b0 Alternativamente podemos utilizar esta ecuación para conocer la velocidad del rotor siempre que se conozca el valor de Dd. Es muy importante conocer el valor de la d max de el soluto con el que estamos formando el gradiente, este parámetro nos informa si el soluto cristaliza en el fondo del tubo. Por ejemplo, cuando la densidad del cloruro de cesio en el fondo del tubo es mayor a 1.8 g/cm3 (1.75 g/cm3 a bajas temperaturas), se encuentra formando cristales y puede ocasionar daño en el rotor. Por otra parte, el tiempo para llegar al equilibrio es muy grande, típicamente 100 hrs. para un gradiente de 12 ml, sin embrago, la velocidad a la que se forma el gradiente es exponencial, y una buena separación se puede obtener en una tercera parte del tiempo calculado. El tiempo requerido para que las partículas alcancen la posición isopícnica puede ser calculado para gradientes no viscosos (CsCl) usando la siguiente ecuación: t (h) = 9.83 x 1013 x b0 (dp – 1) Q4 x rp2 x sp Donde dp y sp son la densidad y coeficiente de sedimentación de la partícula, y rp es la distancia radial de la banda de partículas en el equilibrio. 30 Determinación de la Forma de un Gradiente Autogenerado Para saber la forma de un gradiente autogenerado, es necesario seguir la siguiente formula para saber el valor de la pendiente (dd/dr): dd = w2 r = 1.1 x 10-2 N2 r dr b0 b0 Donde w es la velocidad angular (rad/seg), r es la distancia (cm) de el eje de rotación, N es la velocidad del rotor (r.p.m.). Esta ecuación puede predecir la pendiente del gradiente para la región central que abarca. Gradientes Isoosmóticos La separación de células animales y otras partículas sensibles osmóticamente requieren que el gradiente para la centrifugación sea conveniente osmóticamente, es decir, mantengan constante la osmolaridad a través del gradiente. Las soluciones utilizadas son: suspensiones de sílica coloidal como el Percoll, iodonidatos como el Nycodenz y metrizamida. Análisis de la Distribución de la Muestra en el Gradiente Inspección visual, análisis flourométricos y espectrofotométricos: En algunos casos, la inspección visual simple podría revelar la posición de la banda de interés, por ejemplo, las bandas mitocondriales tienen un color café que las distingue y el DNA en gradientes de cloruro de cesio y con bromuro de etidio presenta un color rosa. Estas bandas pueden ser removidas utilizando una jeringa o una pipeta para su análisis posterior. En otros casos, las partículas absorben o dispersan la luz, así que, su posición puede ser determinada por medición de la densidad óptica en un espectrofotómetro. Los ácidos nucleícos y las proteínas absorben en la región ultravioleta del espectro sin embargo, hay algunos medios (NaI, Nycodenz) que absorben fuertemente en la región ultravioleta y otros medios que dispersan la luz (Percoll) haciendo que sea muy difícil la medida de la absorción de la luz. A menudo los problemas asociados con la medida directa pueden eliminarse utilizando análisis colorimétrico o fluorimétrico para diferentes tipos de macromoléculas, sin embargo, en estos ensayos no es fácil remover la fracción del gradiente lo que involucra perdida de materiales, en el peor de los casos puede ser no selectivo y dar un fraccionamiento falso. Es posible utilizar marcadores para fraccionamiento subcelular (ver tabla 5 Apéndice) para poder distinguir su banda después de una centrifugación. A continuación se muestra un tubo de centrifuga después de un fraccionamiento por centrifugación zonal, en donde podemos ver claramente las diferentes fracciones. 31 Fotografía de un fraccionamiento de hepatocito de rata utilizando centrifugación zonal con rotor vertical. Análisis Radioquímicos de Muestras Los análisis radioisotópicos son convenientes para analizar un gran número de partículas biológicas, si los isótopos son 125I o 32P, las muestras pueden ser contadas en un contador de centelleo. Este método tiene la ventaja de que las fracciones de interés pueden ser identificadas y recuperadas después de contarse para procedimientos analíticos posteriores, sin embargo, el uso de estos isótopos exponen al usuario a la radiación. Los isótopos mas utilizados son 3H, 14C y 35S y en todos los casos las muestras pueden ser mezcladas con fluidos de centelleo antes de medir su actividad en un contador. Los ensayos radioisotópicos pueden ser afectados por extinción en el gradiente y puede variar de una muestra a otra. La mayoría de las sustancias con las que se hace un gradiente actúan como agentes extinguidores y el sulfato de cesio precipita casi todos los tipos de fluidos de centelleo. La extinción de isótopos de baja energía tiende a ser mucho mayor que la de isótopos de mayor energía, por ejemplo las muestras que están marcadas con 3H se extinguen mas fácilmente que las muestras que tienen 14C. 32 APLICACIONES Cromatografía de Precipitación Centrífuga Un nuevo sistema de cromatografía introduce un gradiente de concentración generado internamente con sulfato de amonio a través de un conducto de separación bajo un campo de fuerza centrífuga. Las muestras de proteínas son expuestas a un incremento gradual de concentración de sulfato de amonio y precipitado a lo largo del conducto, entonces se inicia la elusión cromatográfica disminuyendo gradualmente la concentración de sulfato de amonio en el gradiente que causa que las proteínas se disuelvan y precipiten a través del canal; consecuentemente, las proteínas salen de acuerdo a su solubilidad en la solución de sulfato de amonio. La columna de separación consiste en un par de discos equipados que tienen dentro una membrana de diálisis de tal manera que se forman dos canales divididos por esta membrana. El disco es ensamblado en una centrífuga de flujo continuo. Cuando una solución concentrada de sulfato de amonio es eluída a través de un canal y el agua a través de otro canal en dirección opuesta, se forma un gradiente exponencial de sulfato de amonio. Este nuevo método elimina varias complicaciones tales como pérdida de la muestra por absorción y desactivación causada por el soporte sólido y el arrastre de los precipitados finos a través de la columna cromatográfica. En suma el método ofrece varias ventajas incluyendo: la capacidad de concentrar la muestra dentro del canal, la manipulación mas flexible del gradiente a través del canal y la completa eliminación de impurezas de bajo peso molecular. En la siguiente figura se muestra la separación de suero humano bajo las siguientes condiciones experimentales: 0.05 ml en un ml de solución de buffer, gradiente de sulfato de amonio de 95 a 0 % x 1600 min, se utiliza una centrífuga de flujo continuo a 2 000 r.p.m., la velocidad de flujo de elusión del gradiente de sulfato de amonio de 1 ml x min y la detección fue a 275 nm. 33 Microscopio de Polarización Centrífuga La razón del desarrollo de este tipo de microscopio centrífugo es que permite utilizar luz polarizada y observar estructuras finas dinámicas en células vivas que están expuestas a aproximadamente 11 500 veces la fuerza de gravedad de la tierra. El espécimen se coloca en un rotor conectado a un motor, la imagen es apreciada en un microscopio externo y aunque el objeto esté girando, la imagen es capturada por una cámara CCD que esta sincronizada al rotor de la centrífuga, la imagen tiene una resolución menor a una micra y es detectada con una sensibilidad de retardo menor que un nanómetro. En la siguiente figura podemos ver la imagen de un microscopio polarizado centrífugo. La siguiente figura muestra un huevo de erizo de mar (Arbacia punctulata) observado en un microscopio de polarización centrífugo en donde se utilizó un gradiente isopícnico y después de haber centrifugado 15 min a 5 200 r.p.m. 34 Separación de DNA, RNA y Proteínas de Núcleos de Fibroblastos de Hamster. Los núcleos purificados fueron suspendidos en 6 M de cloruro de guanidino y 10 mM EDTA (pH = 7), después de este tratamiento las uniones entre ácidos nucleicos y proteínas son disociadas. La mezcla fue sonicada para reducir la viscosidad. Los carbohidratos fueron extraídos con acetato de etilo y 2.2 ml de lisado fue centrifugado en un rotor SW 50.1 con 2.8 ml de 2.2 M de sulfato de cesio que contiene 10 mM de EDTA y 9 % de DMSO. La centrifugación se llevo a cabo a 35 000 r.p.m. a 20 0C por 40 hrs. Tres bandas muy bien separadas fueron colectadas. Los ácidos nucleicos fueron monitoreados por absorción ultravioleta y las proteínas fueron detectadas por tinción con fluoresceína. Separación de DNA en Base a la Composición GC con uso de BAMD La aplicación de un compuesto órgano mercurial conocido con el nombre de BAMD (3,6 – bis (acetoximercuriometil) dioxano), es más eficiente que los iones de mercurio. El BAMD interactúa principalmente con regiones ricas de GC del DNA, la formación del complejo BAMD-DNA ocurre bajo vigorosa agitación de las soluciones en 0.1 M de sulfato de sodio que contiene 5 mM de buffer de borato de sodio pH 9.2. La densidad de inicio de la solución de sulfato de cesio debe de ser 1.47 g / cm3. La región rica del DNA satélite del timo de ternero fue purificado con BAMD, la centrifugacion se llevó acabo en un rotor Spinco 65 a 35 000 r.p.m. x 60 h y en rotor Spinco 30 a 25 000 r.p.m. x 110 h. El DNA fue parcialmente separado y sólo la región rica en GC formó una banda separada cerca al menisco del tubo. Un tercer paso para la separación fue por centrifugación isopícnica en gradientes de cloruro de cesio. Separación de DNA Nativo y Desnaturalizado con Gradientes de Densidad de Tricloroacetato de Rubidio La densidad de flotación del DNA desnaturalizado en solución de tricloroacetato de rubidio es 1.675 g / cm3 y del DNA nativo es 1.48 g / cm3 entonces, la diferencia entre las densidades del DNA nativo y desnaturalizado es 0.177 g / cm3 , esto es 10 veces la diferencia de densidad que se presenta en cloruro de cesio (0.016 g / cm3). La centrifugación fue llevada en un rotor SW Ti x 36 hrs a 45 000 r.p.m. y 250 C. El gradiente fue preformado con cinco soluciones de diferentes densidades: 1.695 g / cm3, 1.635 g / cm3, 1.575 g / cm3, 1.515 g / cm3 y 1.455 g / cm3. La separación de DNA nativo y desnaturalizado fue tan eficiente que uno puede esperar separar moléculas con regiones únicas entrelazadas (híbridos de DNA imperfectos) de perfectas moléculas de doble cadena; también es posible separar moléculas circulares intactas de moléculas con rupturas en una de las cadenas o en base a sus diferentes propiedades de desnaturalización. 35 Fraccionamiento de RNA Si es necesario separar un rango completo de moléculas de RNA desde s20,w = 4S a s20,w = 28S (1:7) en una corrida de centrifugación se puede utilizar un gradiente abrupto con una diferencia de concentración de 25 %, por ejemplo 10 – 35 % de sacarosa a la máxima velocidad del rotor SW 40 Ti. Se utilizó una centrifugación a 30 000 r.p.m. x 14 hrs a 0 0C. Utilizando nomogramas ( d = 1.5) dan una posición de x / L = 0.45 para RNA 28 S y x / L = 0.06 para RNA 4 S. Nota: los nomogramas son gráficas que representan unas constantes (a , S ) en el eje de las ordenadas y x/L (longitud del gradiente) en el eje de las absisas. Estas gráficas ayudan a obtener los parámetros para realizar una centrifugación. Separación de DNA Plasmídico en Rotores de Tubo Vertical Se utilizaron cultivos de E. coli en donde los ácidos nucleícos fueron separados utilizando un procedimiento alcalino. Se llevó a cabo una centrifugación a 5 000 r.p.m. a 4 0C en una centrifuga J-6 usando un rotor JS-5.2 con varios adaptadores. El Pellet de ácidos nucleícos (plásmido y fragmentos cromosomales, RNA y algunas proteínas ), fue resuspendido en buffer TE (10 mM Tris, 1 mM EDTA, pH 7.4). El cloruro de cesio fue adicionado a una densidad final de 1.55 g / ml, y bromuro de etidio a una concentración final de 0.06 mg / ml. Se centrifugó 4.2 hrs a 55 000 r.p.m. en un rotor VTi. Después de la centrifugación, la banda del plásmido fue colectada, el bromuro de etidio fue removido con n – butanol saturado con agua y cloruro de cesio y finalmente, los ácidos nucleícos fueron precipitados 2 veces con etanol. 36 Fraccionamiento Celular por Centrifugación Diferencial Condiciones: primera centrifugación: 600 g por 5 min segunda centrifugación: 3000 g por 20 min tercera centrifugación: 15 000 g por 1 h La centrifugación es una técnica que no sólo se utiliza en el laboratorio, sino que también se usa a nivel industrial. Por ejemplo es utilizada para purificar y recuperar aceites, fluidos hidráulicos y enfriadores ahorrando miles de dólares a la industria. Otra aplicación es en la industria de alimentos en donde las centrífugas son utilizadas en muchas operaciones. Por ejemplo en la extracción de proteínas comestibles de productos vegetales y animales; en la industria farmacéutica cada vez tienen más auge en procesos de control automatizados. Las impurezas del café, té y jugos de fruta son eliminadas con la ayuda de centrífugas. Cabe mencionar que cada vez son más las aplicaciones de la centrifugación en micro y macro escala, ésto es debido a los nuevos diseños automatizados que proporcionan mayor eficiencia y nuevas aplicaciones en los procesos de separación de moléculas. 37 BIBLIOGRAFÍA Ito, Y., (2000) Centrifugal Precipitation Chromatography :Principale, Apparatus, and Optimization of Key Parameters for Protein Fractionation by Ammonium Sulfate Precipitation. Analytical Biochemistry. 277. 143-153. Inoué, S., Knudson, R.A., Goda, M., Suzuki, K., Nagano, C., Okada, N., Takahashi, H., Ichie, K., Iida, M., Yamanaka, K., (2000) Centrifuge polarizing microscope. I. Rationale, design and instrument performance. Journal of Microscopy. 201. 341-356. Inoué, S., Knudson, R.A., Goda, M., (2000) Centrifuge polarizing microscope. II. Sample biological applications. Journal of Microscopy. 201. 357-367. Little, S.E., (1989) Plasmid DNA Separations in High Performance Vertical Tube Rotors. Effect of Speed on Run Times. Beckman Instruments, Inc. DS-726. Griffith, O. M., Techniques of Preparative, Zonal, and Continuous Flow Ultracentrifugation. Beckman Instruments, Inc. 50 pp. Wen Hsu, H.,(1981) Separations by Centrifugal Phenomena, Techniques of Chemistry Volume XVI. John Wiley & Sons, Inc. 466 pp. Tejeda, A., Montesinos, R.M., Guzmán, R., (1995) Bioseparaciones. Unison. Capitulo 4 Centrifugación. Rickwood, D., Ford, T.C., Steensgaard, J., (1994) Centrifugation Essential Data. John Wiley & Sons, Inc. 114 pp. Ford, T.C., Graham, J.G., (1991) An Introduction to Centrifugation, BIOS Scientific Publishers, Oxford. 118 pp. Rickwood, D., (1984) Centrifugation: a Practical Approach. 2nd edition IRL Press, Oxford. Cole, J.L., Hansen, J.C., (1999) Analytical Ultracentrifugation as a Contemporary Biomolecular Research Tool. Journal of Biomolecular Techniques. 10. 163-176. 38 APÉNDICE En el siguiente apéndice se encuentran algunas tablas con información relevante en el tema de la centrifugación, cada una tiene un encabezado que permite identificar su uso. 39 40 41 42 43