Clase C.Krebs y Bioenergetica
Anuncio

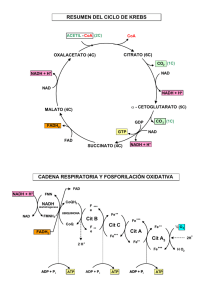
BIOQUÍMICA Año 2015 GLS Las 3 Etapas de la Respiración Oxidación metabólica de sustratos orgánicos 1. Generación de grupo acetilo del ACETIL~CoA, desde PIRUVATO, ÁCIDOS GRASOS (mitocondria), o AMINOÁCIDOS (citoplasma/mitocondria). 2. Oxidación de los C del acetilo (Acetil-CoA) en el CICLO DE KREBS (mitocondria). 3. Pasaje de electrones de la oxidación en un segundo paso a través del sistema de TRANSPORTE DE ELECTRONES para obtener ATP en la FOSFORILACIÓN OXIDATIVA. PROTEÍNAS POLISACÁRIDOS GLICÉRIDOS 1° Etapa AMINOÁCIDOS GLICEROL + AG GLUCOSA 2° Etapa PIRUVATO ACETIL-CoA CO2 H+ 3° Etapa (NADH, FADH2) ADP + Pi Fosforilación Oxidativa ½O2 H2O ATP 3° ETAPA 4° ETAPA Grupo alimenticio Unidad Transformación convergente metabolizada Carbohidratos Glucosa Grasas (Lípidos) Ácidos grasos Proteínas Aminoácidos ENERGÍA en ATP - O2 - O2 + O2 Fermentación a Alcohol en levaduras Fermentación a Lactato en esfuerzos musculares, eritrocitos, otras células y algunos microorganismos Animales, plantas y muchos microorganismos en condiciones aeróbicas ACETIL-CoA VIDEO 1 http://www.youtube.com/watch?v=NS9uHH-oZNw Transaminaciones, Βetaoxidación, Ciclo de Krebs, Cad. Respiratoria y Síntesis de ATP Glucólisis, Pentosas-P, Transaminaciones CÓMO SE MANTIENE LA RELACIÓN NADH /NAD+ ? TRENES DE H+ para NADH CITOPLASMÁTICO - REOXIDACIÓN Malato Oxalacetato Aspartato NADH + H+ NAD+, NADH, FAD HS-CoA AA, Malato, Succinato, Piruvato Ca++ [200mM] +K+ Acil-S-CoA (+) ADP ATP (-) Translocasas CICLO DE LOS ACIDOS TRICARBOXILICOS Papel central en el metabolismo. Reacciones individuales. Estequiometría y rendimiento energético. Regulación. Las Enzs que actúan s/ el Piruvato son: Piruvato Quinasa (EC 2.7.1.40) Piruvato Descarboxilasa (EC 4.1.1.1) Piruvato Deshidrogenasa PIRUVATO Lactato Deshidrogenasa (EC 1.2.4.1) (EC 1.1.1.27) Piruvato Carboxilasa (EC 6.4.1.1) Transaminasas (EC 2.6.1.2 – GPT/ALT) Final de la glucolisis Inicio de la gluconeogénesis. Fermentación = a lactato, etanol, AGV…. Algunos AA se degradan a Piruvato; y éste da origen a: alanina, cisteína, glicina, serina, treonina, y triptofano. Enzimas que actúan s/ el Piruvato Pir-quinasa Enzimas que actúan s/ el Piruvato LDH ALT/GPT Bicarbonato Piruvato OTRO DESTINO DEL PIRUVATO Piruvato Carboxilasa a Descarboxilación Oxidativa del Piruvato 1) Descarboxilación exergónica y fijación del resto acilo a la TPP-Enz 2) Formación de sulfoester de alta Energía con Lipoato 3) Transtiolación isoergónica del acetilo desde el Lipoato a la HS-CoA Enzima Cosustrato prostético Sustrato soluble Piruvato deshidrogenasa ó Pir. descarboxilasa E1 TPP = Tiamina pirofosfato Dihidrolipoil transacetilasa E2 Lipoamida Dihidrolipoil deshidrogenasa E3 FAD Otras enzimas con igual mecanismo: a)Alfa-cetoglutarato DH, b)Alfa-cetobutirato DH, c)cadena ramificada cetoácido DH Coenzima A NAD+ Piruvato Deshidrogenasa Fuente de acetil-CoA para el ciclo del ácido cítrico Cataliza la descarboxilación oxidativa del piruvato. Se usan 4 Vitaminas diferentes como coenzimas Piruvato + NAD + + CoA-SH <-> Acetyl~CoA + NADH + CO2 Energéticamente muy favorable ( ΔG = -33.5 kJ/mol) y esencialmente irreversible in vivo. Todo el complejo puede inactivarse con compuestos con arsénico que se unen a sulfhidrilos (como en dihidrolipoamida) – Napoleón y Darwin - El enlace tioester posee una alta energía libre de hidrólisis Acetil-CoA Origen: oxid. De Glc, AG y AA. Es precursor de: ácidos grasos, colesterol, aminoácidos. Aporta los dos C que se van a oxidar en el ciclo del Acetil~CoA + H2O acetato + HS-CoA + H+ ∆G°’ = -32,2 kJ/mol ácido cítrico. ORIGEN DEL ACETIL~CoA - Oxidación de Ácidos Grasos. - A partir de Aminoácidos cetogénicos. - Descarboxilación del Piruvato. Estrategia General y objetivos del Ciclo del Acido Cítrico (C. de Krebs) En cada vuelta se introducen 2 carbonos (AcetilCoA), y su equivalente será totalmente oxidado. Se liberan 2 moléculas de CO2. La energía libre de la oxidación se conserva en forma de coenzimas reducidas (NADH y FADH2) y GTP. Los intermediarios se reciclan y pueden dar AA, AG, Colesterol, Glc, Porfirinas, oxidar esqueletos de AA. Ciclo de Krebs ó de los ácidos tricarboxílicos En el ciclo entra una molécula de acetato (dos átomos de C) salen dos moléculas de CO2 y cuatro pares de hidrógenos. 1 molécula de glucosa -> 2 de acetato (4 C), que se degrada en un proceso cíclico. Una serie de sustancias del ciclo ceden H por pares (2H) a otra (NAD, FAD) reduciéndola (a NADH, FADH2). En cierta forma, el proceso equivale a tener átomos de H que se pueden unir con el O durante la respiración para formar agua. 1 - CITRATO SINTASA Adición de un grupo acetilo (transportado por HS-CoA) al Oxalacetato = Citrato 2 - ACONITASA Cambio de un grupo -OH del Citrato de la posición 3 a la 2, dando Isocitrato 3 - ICDH + NAD+: Deshidrogenación y descarboxilación. Oxidación del -OH del Isocitrato de la posición 2, debilitación y pérdida del -COO- central, dando Oxalosuccinato (alfa-cetoglutarato) 4 - α-CETOGLUTARATO DH + NAD+: Deshidrogenación , descarboxilación y síntesis (Similar a reacción de Piruvato-DH) Por la oxidación se debilita y pierde el –COO- . Ingresa 1 HS-CoA que transporta el Succinato, central, dando Oxalosuccinato (alfa-cetoglutarato) 5 - SUCCINIL-CoA SINTETASA: Hidrólisis del Succinil-CoA, c/liberación de suficiente E p/síntesis de GTP 6 - SUCCINATO DH + FAD+: Oxidación con insaturación del Succinato 7 - FUMARASA + H2O: Hidratación del Fumarato 8 ENZIMAS PIZARRÓN 8 - MALATO DH + NAD+: Oxidación del Malato en su grupo alcohol (a carbonilo) reconstituyendo Oxalacetato. EC 2.3.3.1. EC 4.2.1.3. [[Cis-Aconitato] EC 1.1.1.37. EC 1.1.1.41/42. E1- 1.2.4.2. E1- 2.3.1.12. E1- 1.6.4.3. EC 4.2.1.2. EC 6.2.1.4. EC 1.3.99.1. Moléculas: Simétrica Asimétricas (quiral) Balance Glucosa + 2ATP + 4ADP + 2Pi + 2NAD+ 2 Ácido pirúvico + 2ADP + 4ATP + 2NADH + 2H+ + 2 H2O 2 Piruvatos + 2 HS-CoA + 2 NAD + 2 Ácetil~S-CoA + 2CO2 + 2NADH + 2H+ + 180 g (1 mol) Glucosa son oxidados por 192 g (6 moles) de oxígeno y se forman 264 g (6 moles) de CO2 C6H12O6 + 6O2=> 6CO2 + 6H2O G = -686 kcal/mol La metabolización de la Glc libera E que es capturada en moléculas de ATP 2 ATP 36-38 ATP (ó 30-32) La velocidad de la Glucólisis y la del Ciclo de Krebs (que consume Acetil-CoA) están integrados (bajo condiciones normales) por: a) Inhibición por altos niveles de ATP y NADH (componentes comunes de ambas vías); y b) Por la concentración de Citrato (producido en Krebs que inhibe la Fosfofructoquinasa 1 de la Glucólisis) Se metaboliza tanta Glc COMO requiera el Ciclo de Krebs Retiro de intermediarios hacia vías anabólicas Reposición anaplerótica de intermediarios agotados. Las reacciones de transaminación y desaminación de AA son reversibles, por lo que su dirección varía en función de la demanda metabólica. Tips del Ciclo de Krebs – biosintético – ahorro de energía • Remoción de intermediarios – puede saturarse. • Única vía enzimática saturable – azúcares – ácidos grasos En la respiración aeróbica se conserva aprox. el 42 % de la energía de la glucosa en forma de ATP. 288 Kcal * mol-1 (1205 KJ* mol-1 ) Es una reacción fuertemente exergónica, con una energía libre ( G°) negativa. Se puede calcular el rendimiento de la siguiente forma: 288/ 686 x 100= 42 %. Termodinámica: Campo de la física que describe y relaciona las propiedades físicas de la materia de los sistemas macroscópicos, así como sus intercambios energéticos. Sistemas macroscópicos: Conjunto de materia que se puede aislar espacialmente y que coexiste con un entorno infinito e imperturbable. Bioenergética: leyes de la termodinámica -Estudia las transformaciones de energía que tienen lugar en la célula. -Naturaleza y función de los procesos químicos en los que se transforma la energía en seres vivos. CÉLULAS Necesitan de energía p/sus actividades (desarrollo, crecimiento, renovación de estructuras, síntesis de moléculas, etc). Según la fuente de carbonos: Autótrofos: Pueden utilizar el CO2 como fuente de C (bacterias, vegetales). Heterótrofos: obtienen C de moléculas orgánicas complejas (animales, microorganismos). CÉLULA ANIMAL Energía química para realizar trabajo proviene de la oxidación de sustancias incorporadas como alimentos (carbohidratos, grasas). Metabolismo: suma de las reacciones químicas que ocurren en la célula (organizadas en series de reacciones catalizadas) = “rutas metabólicas” Fase de síntesis Fase de degradación Catabolismo: ATP ADP Las moléculas nutrientes se convierten en otras mas pequeñas y simples. NADPH+H+ NADP+ Anabolismo: moléculas pequeñas reaccionan para convertirse en otras más grandes y complejas. En una transformación química, generalmente se rompen enlaces y el contenido de energía (E) de las moléculas aumenta o disminuye (G aumenta o disminuye). “Moneda” de intercambio de Energía en los procesos biológicos = ATP Beta-Oxidación y Krebs NADH, NADPH y FADH2 Analogías Naturales son los principales transportadores de electrones, ya que sufren oxidaciones y/o reducciones reversibles. Sus reducciones, permiten la conservación de la Energía Libre que se produce en la oxidación de los sustratos BIOQUÍMICA DEFINICIONES ENERGÍA: Es la “capacidad para producir un trabajo”. SISTEMA: “ toda porción del universo que se somete a estudio” Tipos de sistemas: Abiertos: intercambio de materia y energía. Cerrados: intercambio de energía, no de materia. Aislados: impide intercambio de energía y materia. MEDIO: “es lo que rodea al sistema” UNIVERSO = SISTEMA + MEDIO DEFINICIONES Estado de un sistema: Se puede describir mediante propiedades medibles que se conocen como variables de estado. Algunos ejemplos de variables son: Temperatura Presión Volumen Entropía (S) Entalpía (H) DEFINICIONES ENTALPÍA (H): es la energía en forma de calor, liberada o consumida en un sistema, a T y P constantes. ENTROPÍA (S): energía no degradada, no utilizada para realizar trabajo. ENERGÍA LIBRE (G): Representa la energía intercambiada en una reacción química. Es la energía disponible para realizar trabajo. PRINCIPIOS DE LA TERMODINÁMICA PRIMER PRINCIPIO: “ LA ENERGÍA TOTAL DEL UNIVERSO PERMANECE CONSTANTE” Equivale a decir: la energía del universo no se crea ni se destruye, permanece invariante. Solo se transforma. SEGUNDO PRINCIPIO: “ LA ENTROPÍA DEL UNIVERSO AUMENTA” Equivale a decir que el grado de desorden en el universo aumenta. ENTALPÍA (H): contenido de E calórica de un sistema. Cambio de entalpía (ΔH) = calor de reacción Calor desprendido o consumido en el curso de una reacción (a presión constante). ΔH = Hf – Hi (Hf y Hi son NO determinables; pero si ΔH) Si se rompen los enlaces más débiles y se forman enlaces más fuertes se desprende calor, y la reacción es exotérmica (valor negativo de ΔH°). A + B C + calor -ΔH° (Hf<Hi) Si se rompen enlaces fuertes y se forman enlaces más débiles, entonces se consume energía calórica en la reacción, y ésta es endotérmica (valor positivo de ΔH°). A + B + calor C +ΔH°(Hf>Hi) Termoquímica Si una reacción absorbe (o libera) calor en una dirección, es decir, es endotérmica (ó exotérmica), en la dirección contraria (o inversa) liberará (ó absorberá) calor, siendo por lo tanto exotérmica (ó endotérmica). Por ej.: N2(g) + O2(g) 2NO(g) ΔH° = +43 kcal 2NO(g) N2(g) + O2(g) ΔH° = -43 kcal Entropía (S) Segundo principio: El desorden o entropía de un sistema aislado nunca puede decrecer. Dirección de una reacción A una temperatura dada la espontaneidad de una reacción dependerá del balance entre dos tendencias, pudiendo determinarse relacionando las propiedades termodinámicas de entalpia (∆H) y entropía (∆S). ∆H = está en relación a la energía requerida para romper enlaces químicos (tendencia a formar los enlaces más fuertes posible). ∆S = está relacionado con el grado de dispersión de la materia y la energía (tendencia a dispersarse, al mayor desorden). ∆S = Q (ó calor absorbido)/T (°K de temp.) Dirección de una reacción De acuerdo a la termodinámica, la dirección preferencial para una reacción está determinada por el compromiso entre las tendencias hacia enlaces más fuertes (∆H) y mayor desorden (∆S). Se dice, entonces, que la diferencia entre ∆H y T∆S equivale a una cierta cantidad de energía útil para hacer trabajo, propiedad del sistema que se conoce comúnmente como energía libre de Gibbs (G). Si ∆G°´ de una reacción química es negativo (la energía libre del sistema disminuye) = Reacciones exergónicas, espontáneas en la dirección escrita. G°´ disminuye (-∆G°´ ) Exergónica Espontánea Reversible Si ∆G°´ es positivo (la energía libre del sistema aumenta) = Reacciones endergónicas, no son espontáneas en la dirección en que se escriben. G°´ aumenta (+∆G°´ ) Endergónica No espontánea Reversible La ecuación que relaciona ∆G y Keq es: ∆G°´ = -RT lnKeq R = 1.99 x 10-3 kcal/kelvin-mol T = temperatura absoluta en kelvins El valor de RT a 25°C es 0,593 kcal/mol EQUILIBRIO QUÍMICO Keq = [C][D] / [A][B] Keq de c/reacción química es característico a una Tº dada. Si Keq >1, la reacción está desplazada hacia (1) Si Keq <1, la reacción está desplazada hacia (2) Si Keq =1, la reacción está en Equilibrio (no hay desplazamiento neto). En seres vivos las reacciones se desplazan del equilibrio. CAMBIOS DE ENERGÍA LIBRE EN LAS REACCIONES QUÍMICAS Fundamentalmente sólo hay dos razones por la que ocurre una reacción química: (1) la tendencia a lograr el mínimo de energía (2) la tendencia a lograr el máximo desorden Medir el contenido de energía de un sistema es muy difícil, generalmente se mide el cambio de energía entre dos estados. La variación de energía (G) para ir de A hacia B es: GBA = GB - GA Para ir de B hacia A: GAB = GA – GB = - GBA 1 B A 2 CAMBIOS DE ENERGÍA LIBRE EN LAS REACCIONES QUÍMICAS Matemáticamente: G = H -TS Gº es la variación de Energía Libre en condiciones estándar (Tº= 298ºK,[1M],P = 1atm) Gº’ es la variación de energía libre estándar a un pH próximo al fisiológico (pH = 7) R = 1,987 cal/mol grado PROCESO EXOTÉRMICO: es aquel que transcurre con liberación de calor al medio. PROCESO ENDOTÉRMICO: el que transcurre tomando calor del medio. PROCESO EXERGÓNICO: libera energía. (ESPONTANEO) PROCESO ENDERGÓNICO: absorbe energía. (NO ESPONTANEO) E libre ó E de Gibbs (G) Función más importante en Bioquímica Proceso real o factible = G = G –G cambio de E libre de Gibbs negativo (-G) final inicial G < 0 (FACTIBLE y EXERGÓNICO) G = 0 (ISOERGÓNICO-en equilibrio) G > 0 (NO FACTIBLE y ENDERGÓNICO) REACCIONES CON: -G = son exergónicas y espontáneas a derecha +G = endergónicas e inviables a derecha – pero pueden ser viables por acoplamiento energético con las exergónicas VIDEO 2 http://www.youtube.com/watch?v=KcsNFNjjD5c Compuestos c/Patos ∆G° de hidrólisis, en kJ/mol Fosfoenolpiruvato (-61.9) 1,3-bifosfoglicerato (-49.3) Fosfocreatina (-43.0) ATP (-30.5) ADP (-30.5) Glucosa-1-fosfáto (-20.9) Glucosa-6-fosfáto (-13.8) -61,9 kJ/mol (-14,8 cal/mol) -51,4 kJ/mol (-12,3 cal/mol) -43,1 kJ/mol (-10,3 cal/mol) -30,5 kJ/mol (-7,3 cal/mol) -13,8 kJ/mol (-3,3 cal/mol) -9,2 kJ/mol (-2,2 cal/mol) ATP a pH fisiológico está como ATP4-. Mg++ ENZIMAS PRESENTES EN CASI TODAS LAS CÉLULAS 4 cargas (-) próximas originan tensiones intramoleculares que desaparecen al hidrolizarse en ADP+Pi o AMP+PPi. Mg++ Transferencia de energía en el metabolismo celular P (grupos fosfato) = conservación y transferencia de E 1,3-Bis-P-Glicerato y 2P-PEP ceden E al ADP->ATP Creatín-P y Arginín-P = reservas de E p/cederla al ATP (en tejidos con mayores requerimientos temporales como el músculo) Fosforilación oxidativa: transforma ADP en ATP (c/E liberada por oxidación de coenzimas reducidas) Las Enzimas pueden combinar reacciones exergónicas con endergónicas para resultar en una reacción acoplada que en conjunto es exergónica (reacción espontánea). REACCIONES ENERGÉTICAMENTE ACOPLADAS Una reacción altamente exergónica puede hacer que otra endergónica ocurra si ambas se acoplan. nombre ATP ADP + P ADP AMP AMP + P adenosina + P Gº’(kcal/mol) -7,3 -7,7 -3,4 “Los valores de Gº de reacciones secuenciales son aditivos” Este principio explica por que una reacción termodinámicamente desfavorable puede ocurrir, si se acopla a otra reacción que sea exergónica, a través de un intermediario común GLUCOSA + ATP GLUCOSA-6-P + ADP ∆G°’ = -7,3 + 3,3 = -4,0 Kcal/mol ACTIVACION Es la unión de moléculas biológicas de modo tal que, la ruptura de ese enlace químico formado, tiene un G <0 Ejs: 1) A + COENZIMA A-COENZIMA + B 2) FOSFORILACION A-COENZIMA AB + COENZIMA G<0 Estructura química de la Acetil CoA. El grupo acetilo aparece a la izquierda de la figura, unido al azufre (S) ADENOSINA ÁCIDO PANTOTÉNICO CISTEÍNA La Coenzima A es un transportador de grupos acilo. Al grupo sulfhidrilo terminal, se unen los grupos acilo mediante un enlace tioester. La hidrólisis de un tioester es muy favorable termodinámicamente, lo que hace que esta molécula tenga un alto potencial de transferencia de grupos acilo. La CoA es un “transportador de acilos activado” igual que el ATP es “un transportador de P activado”.