El sistema de control del ciclo celular El sistema de control del
Anuncio

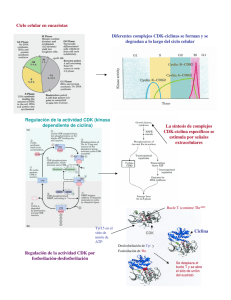
Introducción a la Biología Celular – 2a. Edición Capítulo 18: Control del ciclo celular y muerte celular El sistema de control del ciclo celular En el proceso de división celular participan dos tipos de mecanismos: uno se encarga de elaborar los nuevos componentes de la célula en crecimiento y el otro los sitúa en los lugares correctos y los separa con precisión en el momento de la bipartición de la célula, como se verá en el capítulo 19. Sin embargo, también reviste gran importancia el sistema de control que "enciende" y "apaga" estas maquinarias en los momentos apropiados y coordina las actividades que permiten obtener el producto final. sistema de control del ciclo celular asegura la progresión correcta a través del ciclo mediante la regulación de la maquinaria responsable de los distintos estadios del ciclo. El sistema de control del ciclo celular depende de proteincinasas de activación cíclica El sistema de control del ciclo celular gobierna la maquinaria responsable del ciclo celular mediante la activación y la inactivación cíclicas de proteínas y complejos proteicos que inician o regulan la replicación del DNA la mitosis y la citocinesis. Como se expresó el capítulo 4, la fosforilación seguida de la desfosforilación representa uno de los métodos utilizados con mayor frecuencia por las células para estimular e inhibir la actividad de una proteína, y el sistema de control del ciclo celular utiliza este recurso en forma repetida. Las reacciones de fosforilación que controlan el ciclo celular son llevadas a cabo por un conjunto específico de proteincinasas, enzimas que transfieren un grupo fosfato de una molécula de ATP a una cadena lateral de aminoácidos de la proteína diana. Los efectos de la fosforilación pueden revertirse con rapidez mediante la eliminación del grupo fosfato (desfosforilación), reacción que depende de otro conjunto de enzimas denominadas proteinfosfatasas. Las proteincinasas que constituyen la parte principal del sistema de control del ciclo celular se encuentran presentes durante todo el ciclo celular en las células en proliferación. Sin embargo, estas proteínas sol son activadas en momentos determinados del ciclo y luego pasan con rapidez al estado de desactivación. Por lo tanto, la actividad de estas cinasas fluctúa cíclica. Por ejemplo, algunas de las proteincinasas se activa: al final de la fase G1 y son responsables de promover el pasaje hacia la fase S; mientras que otra ciencia entra en actividad inmediatamente ante de la fase M y es responsable de promover el pasaje de la células hacia la fase de mitosis. La activación y la desactivación de esas cinasas en los momentos apropiados dependen en parte de un segundo grupo de componentes proteico: del sistema de control, las ciclinas, que no ejercen actividad enzimática por sí mismas, pero deben unirse a las cinasas para que éstas adquieran actividad enzimátíca. Por tal motivo, las cinasas del sistema de control del ciclo celular se conocen con el nombre de proteincinasas dependientes de ciclinas, o Cdk (siglas de cyclin-dependent protein kinases) (fig. 18-5). Las ciclinas se denominan de esta manera porque, a diferencia de las Cdk. sus concentraciones varían en forma cíclica durante el ciclo celular. Las alteraciones cíclicas de las concentraciones de ciclinas contribuyen a la formación y la activación cíclicas de los complejos ciclina-Cdk; a su vez, la activación de estos complejos desencadena diversos procesos del ciclo celular, como el ingreso en la fase S o en la M. Más adelante en este capítulo comentaremos la forma en la que se descubrieron estas moléculas (véase Biología experimental, pp. 618-619). El sistema de control del ciclo celular - EDITORIAL MÉDICA PANAMERICANA 1 Introducción a la Biología Celular – 2a. Edición Capítulo 18: Control del ciclo celular y muerte celular Fig. 18-5. La progresión a lo largo del ciclo celular está a cargo de proteincinasas dependiente de ciclinas (Cdk). La actividad enzimática de una Cdk depende de una subunidad reguladora que consiste en una ciclina específica para esa Cdk. El complejo activo fosforila proteínas clave de las células que son necesarias para desencadenar un paso particular del ciclo celular. La cidina también contribuye a dirigir la Cdk hacia sus proteínas diana. Fig. 18-6. El aumento y la declinación de la actividad de Cdk-M durante el ciclo celular. El incremento de la concentración de ciclina M conduce a la formación del complejo ciclina M-Cdk activo, el cual promueve el ingreso de la célula en la fase M. La concentración de ciclina M aumenta en forma constante durante la interfase, alcanza un pico durante la mitosis y declina rápidamente cuando ésta finaliza. Mientras que la actividad de M-Cdk aumenta y disminuye con cada mitosis, la concentración de Cdk no se modifica durante el ciclo celular. Las proteincinasas dependientes de las ciclinas están reguladas por la acumulación y la destrucción de las ciclinas La regulación de las concentraciones de ciclina desempeña un papel importante en la temporización de los acontecimientos del ciclo celular, como el ingreso en la fase M. La ciclina que interviene en el ingreso de las células en la fase M se denomina ciclina M, y el complejo activo que forma con su Cdk se designa con el nombre de M-Cdk. La síntesis de ciclina M comienza inmediatamente después de la división celular y continúa en forma continua durante toda la interfase. La acumulación de ciclina determina que su concentración aumente en forma gradual y contribuye a ajustar el tiempo de iniciación de la mitosis; posteriormente, la rápida eliminación de la ciclina ayuda a salir de la fase de mitosis (fig. 18-6). La disminución brusca de la concentración de ciclina M al final de la mitosis es consecuencia de su rápida destrucción por el sistema proteolítico dependiente de la ubicuitína. En ese momento, numerosas moléculas de esta proteína se unen mediante enlaces covalentes a las moléculas de ciclina M. Este proceso marca a la ciclina para su degradación en proteosomas, los cuales representan estructuras proteolíticas de gran tamaño presentes en todas las células eucariontes. La destrucción de la ciclina inactiva a la Cdk (fig. 18-7). El sistema de control del ciclo celular - EDITORIAL MÉDICA PANAMERICANA 2 Introducción a la Biología Celular – 2a. Edición Capítulo 18: Control del ciclo celular y muerte celular Pero, ¿qué factores determinan la ubicuitinación de las ciclinas a fin de marcarlas para su eliminación posterior? En el caso de la ciclina M, un complejo proteico denominado complejo promotor de la anafase (APC) añade ubicuitina a la ciclina y a otras proteínas que participan en la regulación de la mitosis. Sin embargo, el APC no se encuentra activo en todos los estadios del ciclo celular, sino que su actividad se desencadena en una fase avanzada de la mitosis mediante un proceso que requiere la actividad de M-Cdk. La activación de M-Cdk inicia un proceso que, después de una latencia programada, conduce a la activación del APC, lo cual a su vez determina la ubicuitinación y la degradación de la ciclina M y, en consecuencia, la inactivación de MCdk Mediante estos mecanismos M-Cdk contribuye a su propia inactivación. La función del APC no se limita a desencadenar la degradación de la ciclina M. Como se verá en el capítulo 19, la separación física de los cromosomas replicados en un estadio de la mitosis denominado anafase también depende del APC, y de ahí el nombre de "complejo promotor de la anafase." La actividad de las Cdk también es regulada por procesos de fosforilación y desfosforilación El aumento y la declinación de los niveles de ciclina desempeñan un papel importante en la regulación de la actividad de la Cdk durante el ciclo celular, pero el cuadro es más complejo. En el caso de M-Cdk, la concentración de ciclina M aumenta gradualmente durante toda la interfase, pero la actividad de M-Cdk comienza en forma súbita al final de la interfase (véase fig. 18-6). Por lo tanto, ¿qué desencadena esta activación rápida de M-Cdk? Para que la actividad de M-Cdk sea máxima es necesaria la fosforilación de la cinasa en uno o más sitios por una proteincinasa específica y de desfosforilación en otros sitios por una proteinfosfatasa específica. La eliminación de grupos fosfato inhibidores por la fosfatasa representa el paso final que activa M-Cdk al final de la interfase (fig. 18-11). Una vez activado, cada complejo ciclina M-Cdk puede activar nuevos complejos idénticos, como ilustra la figura 18-12. Esta retroalimentación positiva es responsable del incremento brusco y explosivo de la actividad de M-Cdk que lleva al ingreso repentino de la célula en la fase M. Fig, 18-7. La actividad de las Cdk está regulada por la degradación de la ciclina. La ubicuitinación de una ciclina marca a la proteína para su destrucción ulterior. La degradación de la ciclina inactiva a la Cdk asociada. El sistema de control del ciclo celular - EDITORIAL MÉDICA PANAMERICANA 3 Introducción a la Biología Celular – 2a. Edición Capítulo 18: Control del ciclo celular y muerte celular Distintos complejos ciclina-Cdk desencadenan distintos pasos del ciclo celular Existen varios tipos de ciclina, y en la mayoría de las células eucarion-tes, diversos tipos de Cdk implicados en el control del ciclo celular. Distintos complejos ciclina-Cdk desencadenan pasos diferentes del ciclo celular. Mientras que el complejo M-Cdk actúa en la fase G2 para activar el ingreso en la fase M, distintas ciclinas, denominadas tidinas S y ticunas G1/S, se unen a una proteína Cdk diferente en un estadio avanzado de la fase G: para formar S-Cdk y G1/S-Cdk, respectivamente, lo cual determina el ingreso en la fase S. Otras ciclinas, llamadas tidinas G1, actúan en un estadio más temprano de la fase G1 y se Fig. 18-11. La activación de M-Cdk requiere su fosforilación en algunos sitios y su desfosforilación en otros. El complejo ciclina M-Cdk es enzimáticamente inactivo en el momento de su formación. Posteriormente, la fosforilación de Cdk en ciertos sitios es necesaria para su actividad, y extendida a otros sitios, la inhibe. En este punto, M-Cdk permanece inactivo hasta que finalmente se activa por una fosfatasa que elimina los grupos fosfato inhibidores. Aún no se conocen con certeza los mecanismos que controlan la temporizadón de este complejo proceso de activación. unen a otras proteínas Cdk para formar G1-Cdk, que impulsan el pasaje de la célula a través de la fase G1 hacia la fase S. Más adelante veremos que la formación de estas G1Cdk en las células animales por lo general depende de moléculas de señalización extracelulares que estimulan la división celular. En el cuadro 18-2 se presentan los nombres de las ciclinas y sus Cdk acompañantes. Fig. 18-12. El M-Cdk activado a su vez activa indirectamente más M-Cdk. Una vez activado, M-Cdk fosforila, y en consecuencia activa, una mayor cantidad de fostatasa activadora, la cual a su vez puede activar más de M-Cdk El sistema de control del ciclo celular - EDITORIAL MÉDICA PANAMERICANA 4 Introducción a la Biología Celular – 2a. Edición Capítulo 18: Control del ciclo celular y muerte celular mediante la eliminación de los grupos fosfato inhibidores de la subunidad Cdk. Aunque no se muestra en la figura, el complejo M-Cdk activado también inhibe a la cinasa inhibidora ilustrada en la figura 18-11, lo cual promueve una mayor activación de M-Cdk Mediante estos mecanismos M-Cdk activa en forma indirecta más Cdk-M, de manera que su activación se produce en forma explosiva. Como se comentó en el caso de la ciclina M, la concentración de cada upo de ciclina aumenta en forma gradual y luego declina bruscamente en un momento específico del ciclo celular como consecuencia de su degradación por la vía de la ubicuitina. El incremento de la concentración contribuye a activar su Cdk acompañante, mientras que el descenso rápido determina que la Cdk retorne al estado de inactividad (fig. 18-13). De lal modo, la acumulación gradual de una ciclina hasta alcanzar un nivel crítico es uno de los mecanismos mediante el cual el sistema de control mide los intervalos entre un estadio del ciclo celular y el siguiente. Al igual que en el caso del complejo M-Cdk, cada Cdk también debe fosforilarse y desfosforilarse en forma apropiada para poder actuar. Cada complejo ciclina-Cdk activado ejerce sus efectos sobre un conjunto diferente de proteínas diana en la célula. En consecuencia, cada tipo de complejo desencadena un estadio de transición distinto del ciclo celular. Por ejemplo, M-Cdk fosforita proteínas clave que promueven la condensación de los cromosomas, la ruptura de la envoltura nuclear y la reorganización de los microtúbulos del citoesqueleto para formar un huso mitótico, procesos que, como se verá en el capítulo 19, anuncian el ingreso en la fase de mitosis. Hasta el momento hemos centrado la atención en la activación de Cdk-M, que impulsa las células hacia la mitosis. Sin embargo, el proceso mediante el cual Cdk-S desencadena el ingreso en la fase S reviste tanta importancia como el anterior. La S-Cdk activa la replicación del RNA y contribuye al bloqueo de un nuevo proceso de replicación Para controlar el comienzo y el desarrollo de la replicación del DNA es necesario que la célula resuelva diversos problemas. No solo es esencial que la replicación sea muy precisa para reducir el riesgo de mutaciones en la generación siguiente de células, sino que cada nucleótido del genoma debe ser copiado una sola vez para prevenir los efectos potencialmente deletéreos de la amplificación genética. El sistema de control del ciclo celular es el encargado de garantizar que la replicación del DNA comience en el momento apropiado y no se produzca más de una vez por ciclo. Como se comentó en el capítulo 6, la replicación del DNA comienza en los orígenes de la replicación, secuencias de nucleótidos que están dispersas en distintos sitios a lo El sistema de control del ciclo celular - EDITORIAL MÉDICA PANAMERICANA 5 Introducción a la Biología Celular – 2a. Edición Capítulo 18: Control del ciclo celular y muerte celular largo de cada cromosoma. Estas secuencias recluían proteínas específicas que controlan el proceso de replicación del DNA Un complejo multiproteico, denominado complejo de reconocimiento del origen de replicación (ORC), permanece unido a los orígenes de la replicación durante la totalidad del ciclo celular y actúa como una suerte de "pista de aterrizaje" para otras proteínas reguladoras que se unen antes del comienzo de la fase S. Una de estas proteínas reguladoras se conoce como Cdc6, que está presente en una concentración reducida durante la mayor parte del ciclo celular, pero que aumenta transitoriamente en un estadio temprano de G1. Cuando Cdc6 se une a los ORC en G1 promueve la fijación de otras proteínas para formar un complejo prerreplicativo. Una vez ensamblado este complejo, el origen de replicación se encuentra listo para activarse. La activación ulterior de S-Cdk en un estadio avanzado de G: es el mecanismo que inicia la replicación del DNA (fig. 18-14). Fig, 18-13. Diferentes Cdk se asocian con cidinas distintas para desencadenar los diversos estadios del ciclo celular. Para simplificar, solo se ¡lustran dos tipos de complejos ciclina-Cdk, uno que desencadena la fase S y otro que desencadena la fase M. En ambos casos, la activación de la Cdk requiere la unión de una ciclina (además de la fosforilación y la desfosforilación, como se observa en la fig. 18-11), y su inactivación depende de la degradación de la ciclina. Pregunta 18-4 Se inyecta una cantidad pequeña de citoplasma aislado de una célula en mitosis en un ovocito de rana no fecundado, lo que determina que el ovocito ingrese en la fase M, Luego se obtiene una muestra de citoplasma del ovocito y se la inyecta en un segundo ovocito, que también ingresa en la fase M. Este proceso se repite varias veces hasta que virtualmente no quede nada de la muestra de proteína inicial; a pesar de ello, la última muestra de citoplasma obtenida de la serie de El sistema de control del ciclo celular - EDITORIAL MÉDICA PANAMERICANA 6 Introducción a la Biología Celular – 2a. Edición Capítulo 18: Control del ciclo celular y muerte celular ovocitos inyectados sigue siendo capaz de promover el ingreso en la fase M con la misma eficiencia que las muestras previas. Explique esta sorprendente observación. S-Cdk no solo desencadena la activación del origen de replicación, sino que además evita la rerreplicación del DNA S-Cdk contribuye a la fosforilación de Cdc6, lo cual hace que ésta y otras proteínas del complejo prerreplicativo se disocien del ORC después de que se active el origen. Este desensamblado impide que la replicación se produzca nuevamente en el mismo origen. Además, la fosforilación inducida por S-Cdk (y por MCdk, la cual se activa al comienzo de la fase M) marca a Cdc6 para su posterior ubicuitinación y degradación (véase fig. 18-14); esto asegura que la replicación del DNA no se reanude en una fase más avanzada del mismo ciclo celular. Las Cdk son inactivas durante la mayor parte de la fase G1 Ya comentamos la forma en la que las Cdk activadas desencadenan las transiciones entre un estado del ciclo celular y el siguiente, pero, ¿cómo se revierten estos procesos de manera que las células hijas puedan repetir más adelante el ciclo? Al final de la mitosis, la actividad de todas las Cdk en la célula es nula. Los complejos S-Cdk son inactivados por la destrucción de la ciclina S al final de la fase S, los M-Cdk, por la destrucción de la ciclina M al final de la mitosis (véase fig. 18-3). La inactivación de M-Cdk conduce a todos los otros procesos que determinan la salida de la célula de la fase de mitosis. Las Cdk permanecen inhibidas durante la mayor parte de G1 Existen varios mecanismos que impiden su reactivación durante G1, como la fijación de las proteínas inhibidoras de Cdk (véase más adelante). Estos mecanismos retrasan la progresión a la fase S y dejan tiempo para que la célula crezca. La salida de este estado de inhibición en general es consecuencia de la acumulación de ciclinas G1 proceso que, como se verá más adelante, en las células animales es estimulado por señales extracelulares que promueven la proliferación celular. El sistema de control del ciclo celular puede interrumpir el ciclo en puntos específicos Hemos visto que el sistema de control del ciclo celular desencadena los distintos acontecimientos que jalonan el ciclo celular siguiendo un orden espacífico. Por ejemplo, solo inicia la mitosis después de que se haya replicado la totalidad del DNA, y solo permite la bipartición celular una vez que se haya completado la mitosis. Si uno de los pasos se retrasa, el sistema de control demora la activación del paso siguiente a fin de mantener la secuencia normal. Esta capacidad autorreguladora garantiza que, por ejemplo, si la síntesis de DNA se demora por algún motivo durante la fase S, la célula no progrese a la fase M con una replicación incompleta del DNA. Como se mencionó antes, el sistema de control cumple esta función mediante la acción de frenos moleculares capaces de detener el ciclo celular en puntos de control específicos, lo cual permite que la célula revise su estado interno y las condiciones del medio antes de reanudar el ciclo (véase fig. 18-4). Los mecanismos moleculares responsables de interrumpir la progresión del ciclo celular en los distintos puntos de control no se conocen con precisión. Sin embargo, se sabe que en algunos casos entran en acción proteínas inhibidoras de las Cdk El sistema de control del ciclo celular - EDITORIAL MÉDICA PANAMERICANA 7 Introducción a la Biología Celular – 2a. Edición Capítulo 18: Control del ciclo celular y muerte celular específicas que bloquean el ensamblado o la actividad de uno o más complejos ciclinaCdk. Uno de los mecanismos más conocidos consiste en la interrupción del ciclo celular en G1 en presencia de un daño del DNA, lo cual asegura que la célula no replique el DNA dañado. La lesión del DNA determina un incremento de la concentración y la actividad de Fig. 18-14. S-Cdk desencadena la reputación del DNA y garantiza que ésta ocurra solo una vez por cada ciclo celular. El ORC permanece asociado con el origen de replicación durante la totalidad del ciclo celular. En un estadio temprano de G1 la proteína reguladora Cdc6 se asocia con el ORC. Mediante la ayuda de Cdc6, otras proteínas se unen al DNA adyacente (no ilustrado en la figura) y ello conduce a la formación de un complejo prerreplicativo. El complejo S-Cdk (con la intervención de otra proteincinasa no representada en la figura) desencadena el disparo del origen mediante la inducción del ensamblado de la DNA polimerasa y la iniciación de la síntesis del DNA (véase cap. 6). S-Cdk también contribuye a bloquear la repetición de la replicación participando de la fosforilación de Cdc6, la cual se disocia del origen y se degrada. El complejo proteico que se ensambla en el origen de la replicación para catalizar la replicación del DNA en el momento en que se dispara el origen no se muestra en la figura. la proteína reguladora de genes denominada p53, la cual activa la transcripción de un gen que codifica una proteína inhibidora de Cdk llamada p21. La proteína p21 se une a G1/SCdk y a S-Cdk e impide que promuevan la progresión de la célula a la fase S del ciclo celular (fig. 18-15). La interrupción del ciclo celular en G1 permite ganar tiempo para reparar el DNA dañado antes de su replicación. Si la proteína p53 está ausente o es defectuosa, la replicación irrestricta del DNA dañado conduce a una incidencia elevada de mutaciones y a la generación de células que tienden a malignizarse. En efecto, en la mitad aproximadamente de todos los cánceres humanos es posible identificar mutaciones del gen p53. Otro punto de control importante del ciclo celular tiene lugar durante la mitosis. En este punto, la célula se asegura de que todos sus cromosomas estén unidos en forma apropiada al huso mitótico. Como se verá en el capítulo 19, este huso es una estructura El sistema de control del ciclo celular - EDITORIAL MÉDICA PANAMERICANA 8 Introducción a la Biología Celular – 2a. Edición Capítulo 18: Control del ciclo celular y muerte celular citoesquelética que ejerce una fuerza de tracción sobre los cromosomas duplicados para separarlos y distribuirlos en las dos células hijas. Si la célula comienza a separar sus cromosomas antes de que todos se encuentren debidamente unidos al huso mitótico, una Fig, 18-15. El daño del DNA interrumpe el ciclo celular en G1. La lesión del DNA determina que la proteína p53, que normalmente es degradada con rapidez, se estabilice y se active. Esto se debe en parte a la fosforilación de p53 por proteincinasas específicas que son activadas en respuesta a una lesión del DNA. La proteína p53 activada se acumula y estimula la transcripción del gen que codifica a la proteína inhibidora de Cdk (p21). La proteína p21 se une a G1/S-Cdk y a S-Cdk e inactiva a estos complejos deteniendo el ciclo celular en G1. Pregunta 18-5 ¿Por qué supone que las células pasaron a un estado G0 especial para salir del ciclo celular en lugar de detenerse simplemente en un punto de control de G1? El sistema de control del ciclo celular - EDITORIAL MÉDICA PANAMERICANA 9 Introducción a la Biología Celular – 2a. Edición Capítulo 18: Control del ciclo celular y muerte celular de las células hijas recibirá un conjunto incompleto de cromosomas y la otra recibirá un número excesivo. Ambas situaciones pueden ser letales para las células. Por lo tanto, la célula en división debe asegurarse de que hasta el último de sus cromosomas se encuentre debidamente unido al huso mitótico antes de completar la mitosis. Para ello recurre a una señal negativa: los cromosomas que no están fijados al huso mitótico envían una señal de detención al sistema de control del ciclo celular. Aunque se desconoce su origen, esta señal bloquea el progreso ulterior a través de la fase de mitosis mediante la inhibición de la activación del APC. En ausencia de un APC activo, los cromosomas duplicados permanecen unidos entre sí y ninguno de ellos podrá ser separado por tracción hasta que todos se encuentren correctamente ordenados sobre el huso mitótico. Las células pueden desmantelar su sistema de control y abandonar el ciclo celular La decisión más drástica que puede adoptar el sistema de control es que la célula se retire completamente del ciclo y se interrumpa la división celular. Esta decisión no es lo mismo que hacer una pausa en la mitad de un ciclo para adaptarse a un retraso transitorio, y reviste especial importancia en los organismos pluricelulares. Por ejemplo, en el cuerpo humano, las células nerviosas y las células musculares esqueléticas permanecen sin dividirse durante toda la vida; estas células ingresan en G0, un estado G: modificado en el cual el sistema de control del ciclo celular se encuentra en gran medida desmantelado por la desaparición de muchas de las Cdk y las ciclinas. Algunos tipos celulares, como los hepatocitos, normalmente se dividen solo una vez por año o cada dos años, mientras que ciertas células epiteliales del tracto gastrointestinal se dividen más de dos veces por día para la renovación continua del revestimiento epitelial del intestino. Muchas de las células humanas se encuentran a mitad de camino entre esas dos tendencias: pueden dividirse si surge la necesidad, pero en condiciones normales lo hacen con escasa frecuencia. Como regla general, las células de los mamíferos solo se multiplican (proliferan) si este proceso es estimulado por señales provenientes de otras células. En ausencia de tales señales, el ciclo celular se interrumpe en un punto de control G1 y la célula ingresa en la fase G0, en la cual puede permanecer durante días o semanas, o durante toda la vida del organismo. En consecuencia, las diferencias entre la velocidad de división celular en el cuerpo adulto dependen en gran medida del tiempo que las células permanecen en G0 o G1; una vez superado el punto de control G1 (véase fig. 184), la célula en general progresa a través del ciclo celular con rapidez, típicamente entre 12 y 24 horas en los mamíferos. El punto de control G1 a veces se designa con el nombre de comienzo, ya que si la célula lo supera significa que completará un ciclo de división pleno, aunque en realidad sería más lógico denominarlo de detención (fig. 18-16). En la figura 18-17 se indican algunos de los principales puntos de control del ciclo celular. El sistema de control del ciclo celular - EDITORIAL MÉDICA PANAMERICANA 10 Introducción a la Biología Celular – 2a. Edición Capítulo 18: Control del ciclo celular y muerte celular Fig. 18-16. El punto de control de G, es comparable con una encrucijada. La célula puede "decidir" el cumplimiento de un ciclo celular completo, efectuar una pausa transitoria hasta que las condiciones sean favorables o abandonar definitivamente el ciclo celular e ingresar en G0. Fig, 18-17. El sistema de control del ciclo celular puede interrumpirlo en varios puntos. Las barras rojas en forma de T representan puntos del ciclo celular en los que el sistema de control puede accionar frenos moleculares para detener la progresión en respuesta a un daño del DNA, a procesos celulares que no se han completado o a condiciones adversas del medio extracelular. El punto de control señalado en la fase M garantiza que todos los cromosomas encuentren debidamente unidos al huso mitótico antes de progresar hacia la anafase, momento en el que los cromosomas de las células hijas se separan y se dirigen hacia polos opuestos del huso mitótico (véase cap. 19). El comienzo y la detención de la proliferación celular son fundamentales para el control de la cantidad de células y las proporciones corporales de un organismo pluricelular. Sin embargo, el control de la división celular representa solo una parte del problema. Como veremos a continuación, en el otro platillo de la balanza operan mecanismos de control igualmente importantes que determinan si una célula sobrevive o se suicida. El sistema de control del ciclo celular - EDITORIAL MÉDICA PANAMERICANA 11