Otras reacciones
Anuncio

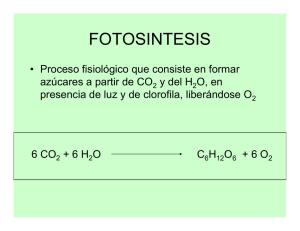
REACCIONES QUÍMICAS 4º E.S.O. 2.6. OTRAS REACCIONES. 2.6.1. OXIDACIÓN Y COMBUSTIÓN El oxígeno, que forma el 21 % de la atmósfera, es una sustancia muy reactiva. Produce reacción química exotérmica con casi todas las sustancias conocidas. La reacción de cualquier sustancia con el oxígeno recibe el nombre de oxidación y es exotérmica, es decir, desprende calor. Las sustancias de origen biológico, como la madera, las grasas o el azúcar, también se combinan con el oxígeno y se oxidan. Pero en estos casos la reacción es tan exotérmica que se produce, además de calor, la emisión de luz: una llama. Por eso, estas reacciones reciben el nombre especial de combustión. En la combustión, los productos que se producen siempre son dióxido de carbono y agua. Compuesto + O2 CO2 + H2O 2.6.2. RESPIRACIÓN Y FOTOSÍNTESIS. Para realizar las funciones vitales todos los seres vivos necesitan energía, energía que obtienen de la oxidación de azúcares, sobre todo glucosa, y grasas. Puesto que 58 PROYECTO ANTONIO DE ULLOA Los animales obtienen su energía de la respiración REACCIONES QUÍMICAS 4º E.S.O. esta combustión libera mucha energía, debe hacerse poco a poco, en procesos controlados por enzimas. Este proceso controlado de combustión se llama respiración y tiene lugar en el interior de las células, adonde llega el oxígeno procedente de los pulmones. C6H12O6 + 6·O2 6·CO2 + 6·H2O Respiración Las plantas, además de la respiración, que emplean para obtener energía, obtienen recursos esenciales a través de otro proceso, la fotosíntesis. La fotosíntesis es un proceso opuesto a la respiración. Mientras que en ésta la glucosa se combina con el oxígeno para producir agua y dióxido de carbono, en la fotosíntesis, gracias a la luz del Las plantas realizan la fotosíntesis pero también la Sol, el agua y el dióxido de carbono se combinan para dar glucosa. 6·CO2 + 6·H2O C6H12O6 + 6·O2 Fotosíntesis 2.6.3. DESCOMPOSICIÓN. En muchas ocasiones una sustancia química, por efecto del calor, sufre una transformación y se transforma en varias sustancias más simples. Este tipo de reacción se conoce como descomposición. Esto PROYECTO ANTONIO DE ULLOA ocurre con el 59 REACCIONES QUÍMICAS 4º E.S.O. trioxocarbonato(IV) de calcio, que se descompone en dióxido de carbono y óxido de calcio: CaCO3 CO2 + CaO La luz o la corriente eléctrica pueden, también, ocasionar descomposiciones. Así, el agua, es descompuesta en sus elementos componentes, hidrógeno y oxígenos, merced a la acción de una corriente eléctrica: 2·H2O 2·H2 + O2 2.6.4. ADICIÓN. De la misma forma que el calor puede descomponer una sustancia compleja en otras más simples, también puede hacer que dos sustancias simples se combinen entre sí para dar origen a otra más compleja. Son las reacciones de síntesis o adición. Así, el nitrógeno y el hidrógeno, por simple calentamiento, reaccionan entre sí para dar amoniaco: 3·H2 + N2 2·NH3 o el carbono en combustión con el oxígeno produce dióxido de carbono: C + O2 60 CO2 PROYECTO ANTONIO DE ULLOA