guíasoluciones[2][1]
Anuncio
![guíasoluciones[2][1]](http://s2.studylib.es/store/data/004409996_1-4c22b608b62968c9dca601aaf9328ec2-768x994.png)
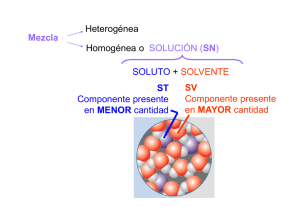
GUÍA DE TRABAJO QUIMICA 4° MEDIO DISOLUCIONES 1. Determinar la masa molar (PM)de: Compuesto a) Al2(SO4)3 Peso Molecular b) Fe(OH)3 c) Al(OH)3 2. La masa de 2,6 moles de un compuesto es de 312 gr. Determine el peso molecular del compuesto. 3. ¿Cuántos moles de CO2 hay en 120 gr de CO2? 4. Determine los moles de soluto en cada una de las siguientes soluciones a) 250 ml de Ca (NO3)2 0.350M ( R = 0,0875 moles) b) 0.6 ml de KBr 0.78 M 5. Determinar la Molaridad de 300 ml de una solución acuosa que contiene 12 gr de ácido sulfúrico disuelto 6. Si en una solución de NaCl se encuentran 28gr de esta sal ¿Cuál es la concentración molar en 1 litro de esta solución? (R= O,48 M) 7. ¿Cuál es la molaridad de una solución en que hay 3 moles de CaCO3 en 750 ml de solución?(R= 4 M) 8. ¿Cuántos litros de Na2CO3 0.2M pueden se preparados140 gramos? (R= 6.6 Lts) 9. ¿Cuántos moles de soluto hay en 0.6 ml de KBr 0.78 M? (R= 4,68 x10-4 moles) 10. ¿Cuántos gramos de Al2 (SO4)3 se requerirán para preparar 300 ml de solución 0.2 M? (R= 20,5 gr) 11. Completa La siguiente tabla Soluto AgNO3 Peso Molecular Moles Masa (gr) Volumen de la Solución ( Lts) 130 0.50 NaNO3 HCl 0.50 20 1.5 Molaridad ( M) 0.01