Clase_termo 3
Anuncio
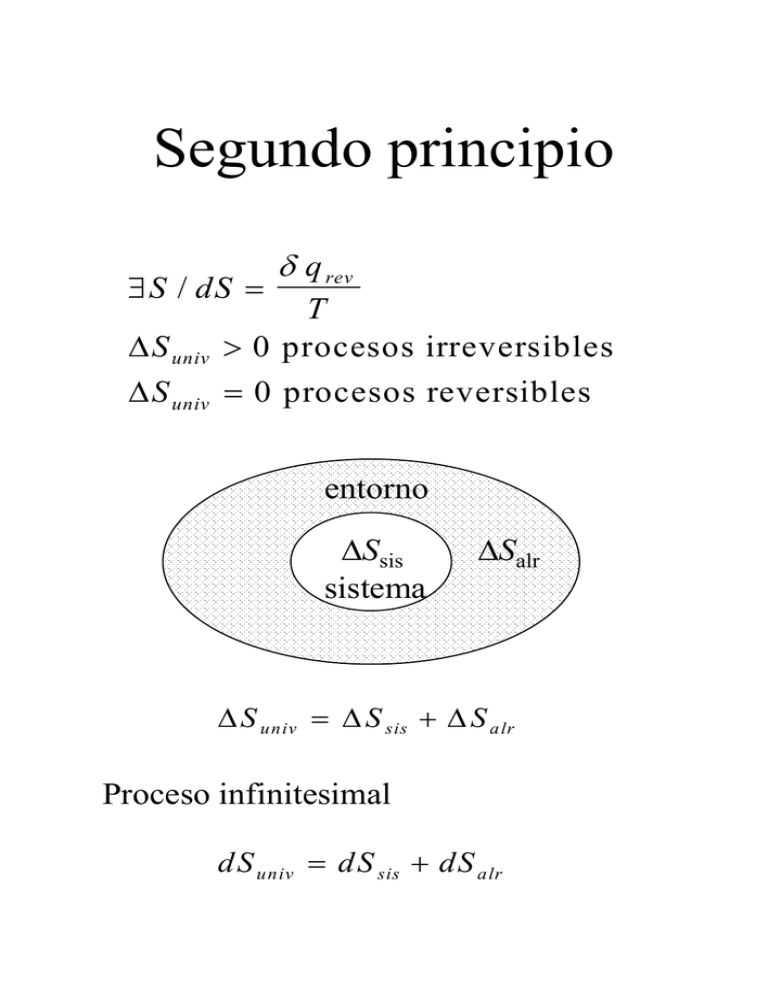
Segundo principio S / dS S univ S univ q rev T 0 procesos irreversibles 0 procesos reversibles entorno Ssis sistema Salr S univ S sis S alr Proceso infinitesimal dS univ dS sis dS alr Calculando S Proceso cíclico S 0 porque S es función de estado Proceso adiabático reversible q rev S , q rev 0 S 0 T Proceso isotérmico reversible S qrev T Qrev 1 q rev T T Cambio de fase reversible H S T Proceso reversible de un gas ideal q rev d E w rev q rev CV dT PdV T2 V T2 V 2 dT P S CV dV T T T1 V1 2 dT dV S CV nR T V T1 V1 T2 V2 S CV ln nR ln T1 V1 Proceso irreversible de un gas ideal T2 V2 S CV ln nR ln T1 V1 Calentamiento a presión constante S q rev T T2 T1 C P dT T Entropía y equilibrio Entropía del universo a lo largo de un proceso Suniverso 25 20 15 10 5 0 1 2 3 4 5 6 7 8 9 10 11 12 Tiem po Suniv máxima en el equilibrio dS univ = 0 en el equilibrio er 1 Combinación del y el do 2 principio Desigualdad de Clausius dS q T (1) Primer principio dE q w (2) Reemplazando (1) en (2) dE TdS w (3) A P=cte., si sólo hay trabajo PV dE TdS PdV (4) Energía libre Consideramos un sistema en equilibrio térmico y mecánico con su entorno: dE TdS PdV dE d (TS ) d ( PV ) porque T y P son ctes. dE d (TS ) d ( PV ) 0 d ( E TS PV ) 0 Definimos G E PV TS dG 0 Eq. térmico y mecánico. Sólo hay trabajo PV. Resumiendo S / dS dS qirrev qrev T Desigualdad de Clausius T dSuniv 0 Proceso irreversible dSuniv 0 Proceso reversible o equilibrio dG 0 Proceso irreversible a T y P constante. Sólo trabajo PV. dG 0 Proceso reversible o equilibrio a T y P constante. Sólo trabajo PV.



