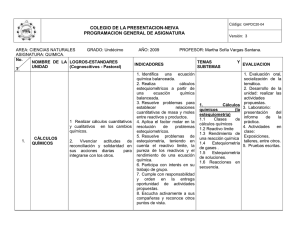
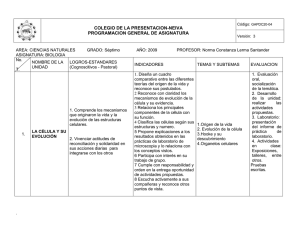
AREA: CIENCIAS NATURALES GRADO: Decimo
Anuncio
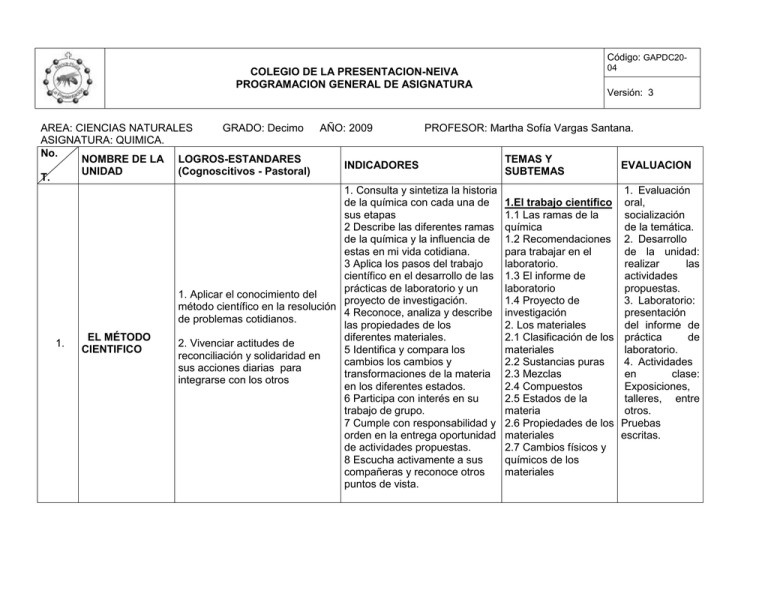
Código: GAPDC20- COLEGIO DE LA PRESENTACION-NEIVA PROGRAMACION GENERAL DE ASIGNATURA 04 Versión: 3 AREA: CIENCIAS NATURALES GRADO: Decimo AÑO: 2009 PROFESOR: Martha Sofía Vargas Santana. ASIGNATURA: QUIMICA. No. NOMBRE DE LA LOGROS-ESTANDARES TEMAS Y INDICADORES EVALUACION UNIDAD (Cognoscitivos - Pastoral) SUBTEMAS T. 1. Consulta y sintetiza la historia 1. Evaluación de la química con cada una de 1.El trabajo científico oral, sus etapas 1.1 Las ramas de la socialización 2 Describe las diferentes ramas química de la temática. de la química y la influencia de 1.2 Recomendaciones 2. Desarrollo estas en mi vida cotidiana. para trabajar en el de la unidad: 3 Aplica los pasos del trabajo laboratorio. realizar las científico en el desarrollo de las 1.3 El informe de actividades prácticas de laboratorio y un laboratorio propuestas. 1. Aplicar el conocimiento del proyecto de investigación. 1.4 Proyecto de 3. Laboratorio: método científico en la resolución 4 Reconoce, analiza y describe investigación presentación de problemas cotidianos. las propiedades de los 2. Los materiales del informe de EL MÉTODO diferentes materiales. 2.1 Clasificación de los práctica de 1. 2. Vivenciar actitudes de CIENTIFICO 5 Identifica y compara los materiales laboratorio. reconciliación y solidaridad en cambios los cambios y 2.2 Sustancias puras 4. Actividades sus acciones diarias para transformaciones de la materia 2.3 Mezclas en clase: integrarse con los otros en los diferentes estados. 2.4 Compuestos Exposiciones, 6 Participa con interés en su 2.5 Estados de la talleres, entre trabajo de grupo. materia otros. 7 Cumple con responsabilidad y 2.6 Propiedades de los Pruebas orden en la entrega oportunidad materiales escritas. de actividades propuestas. 2.7 Cambios físicos y 8 Escucha activamente a sus químicos de los compañeras y reconoce otros materiales puntos de vista. Código: GAPDC20- COLEGIO DE LA PRESENTACION-NEIVA PROGRAMACION GENERAL DE ASIGNATURA No. T. 2 NOMBRE DE LA UNIDAD LOGROS-ESTANDARES (Cognoscitivos - Pastoral) INDICADORES 1. Conceptualiza y explica los diferentes modelos atómicos y valora la importancia de cada uno de ellos en su época. 2. Describe e identifica las características de las diversas partículas subatómicas. 1. Explicar la estructura de los 3. Explica el comportamiento químico átomos a partir de las de los átomos con base a la diferentes teorías, analizar y distribución electrónica. explicar la variación de las 4. Identifica los elementos químicos leyes periódicas, luego de en la tabla periódica teniendo en deducir sus propiedades de ESTRUCTURA cuenta su número atómico y su acuerdo con su ubicación en la DE LOS distribución electrónica. tabla periódica. MATERIALES 5. Realiza correctamente la distribución electrónica de un 2 Asumir actitudes de respeto elemento dado, teniendo en cuanta y apertura en su diario vivir conceptos básicos y la relación entre fortaleciendo sus relaciones la tabla periódica. interpersonales 6. Escucha atentamente las explicaciones dadas, y respeta la opinión de sus compañeras 7. Desarrolla, presenta y sustenta a tiempo y correctamente la unidad. 8. Presenta actitudes de solidaridad frente a las situaciones dadas diariamente 04 Versión: 3 TEMAS Y SUBTEMAS 1. Estructura de los materiales 1.1 El átomo 1.2 Modelos atómicos 1.3 Configuración electrónica 1.4 La tabla periódica 1.5 Propiedades físicas y químicas de los materiales 2. Organización de los elementos químicos 2.1 Tabla periódica moderna 2.2 Elementos metálicos, no metálicos y semimetales. 2.3 Grupos y periodos 2.4 Propiedades periódicas de los elementos EVALUACION 1. Evaluación oral, socialización de la temática. 2. Desarrollo de la unidad: realizar las actividades propuestas. 3. Laboratorio: presentación del informe de práctica de laboratorio. 4. Actividades en clase: Exposiciones, talleres, entre otros. 5. Pruebas escritas. Código: GAPDC2004 COLEGIO DE LA PRESENTACION-NEIVA PROGRAMACION GENERAL DE ASIGNATURA No. T. NOMBRE DE LA UNIDAD LOGROS-ESTANDARES (Cognoscitivos INDICADORES Pastoral) 1. Clasificar, definir y diferenciar los diferentes tipos de enlace químico. 3 ENLACE QUÍMICO 2. Reconocer las virtudes de la virgen María, mujer elegida, asumiéndolas como modelo de su vida y fortaleciendo su autoestima. 1. Clasifica y define el enlace iónico, el covalente y el enlace metálico. 2. Diferencia el enlace iónico del covalente teniendo en cuenta la electronegatividad de los elementos que conforman el compuesto. 3. Determina las propiedades físicas y químicas de las moléculas a partir de las fuerzas intermoleculares que las mantienen unidas 4. Presenta actitudes de respeto consigo misma y trato digno hacia los demás. 5. Desarrolla, presenta y sustenta a tiempo la unidad. 6. Escucha atentamente las explicaciones dadas, y respeta la opinión de sus compañeras. Versión: 3 TEMAS Y SUBTEMAS 1. Los Enlaces Químicos 1.1 Ley Del Octeto 1.2 Estructura De Lewis 1.3 Electrones De Valencia. 1.4 Tipos De Enlace Químico Enlace iónico Enlace covalente Enlace metálico Números de oxidación 2. Las Moléculas 2.1 Fuerzas Intermoleculares Interacciones dipolodipolo Puentes de hidrogeno Fuerzas de London 2.2 La arquitectura de las moléculas EVALUACION 1. Evaluación oral, socialización de la temática. 2. Desarrollo de la unidad: realizar las actividades propuestas. 3. Laboratorio: presentación del informe de práctica de laboratorio. 4. Actividades en clase: Exposiciones, talleres, entre otros. 5. Pruebas escritas. Código: GAPDC2004 COLEGIO DE LA PRESENTACION-NEIVA PROGRAMACION GENERAL DE ASIGNATURA No. NOMBRE DE LA UNIDAD T. LOGROS-ESTANDARES (Cognoscitivos - Pastoral) 1. Clasificar los compuestos inorgánicos según su estructura, demostrando su obtención y las clases de nomenclatura, ejemplificando cada una de las funciones químicas inorgánicas 4. NOMENCLATURA QUÍMICA 2. Vivenciar el Versión: 3 INDICADORES TEMAS Y SUBTEMAS 1. Define las diferentes funciones químicas e identifica el grupo funcional que la representa. 2. Aplica las normas de la nomenclatura stock, tradicional y sistemática para nombrar y formular compuestos inorgánicos. 3. Define e identifica los conceptos de mol, numero de avogadro, átomos, moléculas y masa molar, los relaciona y aplica en la resolución de problemas. 4. Demuestra compromiso de mejoramiento permanente corrigiendo sus faltas principio de singularidad mediante la práctica del valor de la sencillez en su cotidianidad a ejemplo de la virgen María y Marie 5. Desarrolla, presenta Poussepin. sustenta a tiempo la unidad. 6. Se esfuerza por crecimiento en valores fortalecimiento de autoestima y su y su 1. Nomenclatura Química 1.1 Función Oxido 1.2 Función Acido 1.3 Función Hidróxidos 1.4 Función Sales. 2. El Mol 2.1 Masa Atómica 2.2 Masa Molecular 2.3 Formula Empírica 2.4 Formula Molecular. EVALUACION 1. Evaluación oral, socialización de la temática. 2. Desarrollo de la unidad: realizar las actividades propuestas. 3. Laboratorio : presentación del informe de práctica de laboratorio. 4. Actividades en clase: Exposiciones, talleres, entre otros. 5. Pruebas escritas Código: GAPDC20- COLEGIO DE LA PRESENTACION-NEIVA PROGRAMACION GENERAL DE ASIGNATURA No. T. 5. NOMBRE DE LA UNIDAD COMPORTAMIENTO QUÍMICO DE LOS MATERIALES LOGROS-ESTANDARES (Cognoscitivos - Pastoral) 1. Analizar los cambios que puede tener la materia a través de las ecuaciones químicas, comprobando las diferencias entre las reacciones químicas y las formas de balancear ecuaciones mediante la resolución de problemas. 2. Fortalecer su autonomía mediante el control de sus actos al relacionarse consigo mismo, con los otros, con la naturaleza y con Dios. INDICADORES 1. Analiza e identifica la información de una ecuación química balanceada. 2. Clasifica y relaciona los diferentes tipos de reacciones químicas y describe y aplica los diferentes métodos de balanceo de ecuaciones. 3. Clasifica e identifica las propiedades de las diferentes celdas: voltaicas, galvánicas, y electrolíticas y describe su funcionamiento. 4. Consulta responsablemente diferentes fuentes de información, para ampliar sus conocimientos. 5. Desarrolla, presenta y sustenta a tiempo la unidad. 6. Manifiesta en su actividad cotidiana la formación en valores especialmente el de la sencillez. 04 Versión: 3 TEMAS Y SUBTEMAS 1. Comportamiento químico de los materiales 1.1 Las Reacciones Químicas. 1.2 Términos Y Símbolos De Una Reacción Química. 1.3 Clases De Reacciones Químicas 1.4 Leyes Pondérales 1.5 Métodos De Balanceo De Ecuaciones. 2. La Electroquímica 2.1 La Electrolisis 2.2 Aplicación De La Electrolisis EVALUACION 1. Evaluación oral, socialización de la temática. 2. Desarrollo de la unidad: realizar las actividades propuestas. 3. Laboratorio: presentación del informe de práctica de laboratorio. 4. Actividades en clase: Exposiciones, talleres, entre otros. 5. Pruebas escritas Código: GAPDC20- COLEGIO DE LA PRESENTACION-NEIVA PROGRAMACION GENERAL DE ASIGNATURA No. T. 6. NOMBRE DE LA UNIDAD ESTADOS FÍSICOS DE LOS MATERIALES LOGROS-ESTANDARES (Cognoscitivos - Pastoral) 1. Comparar las características de los diferentes estados de la materia, deduciendo sus características, comportamiento y leyes. 2. Demostrar perseverancia en la ejecución responsable de las labores asignadas. INDICADORES 1. Compara las características de gases, con la de los líquidos y los sólidos. 2. Explica el comportamiento del estado gaseoso, teniendo en cuenta las leyes que lo rigen y la aplicación de estas en la solución de problemas. 3. Describe las leyes físicas que rigen los estados sólidos y líquidos. 4. Consulta responsablemente diferentes fuentes de información, para ampliar sus conocimientos. 5. Desarrolla, presenta y sustenta a tiempo la unidad. 6. Manifiesta en su actividad cotidiana la formación en valores especialmente el de la sencillez. 04 Versión: 3 TEMAS Y SUBTEMAS 1 Estados Físicos De Los Materiales 1.1 Estado Gaseoso 1.2 Teoría Cinética De Los Gases 1.3 Leyes De Los Gases 1.4 Características De Los Líquidos 1.5 Estado Sólido 1.6 Cambios De Estado EVALUACION 1. Evaluación oral, socialización de la temática. 2. Desarrollo de la unidad: realizar las actividades propuestas. 3. Laboratorio: presentación del informe de práctica de laboratorio. 4. Actividades en clase: Exposiciones, talleres, entre otros. 5. Pruebas escritas Código: GAPDC20- COLEGIO DE LA PRESENTACION-NEIVA PROGRAMACION GENERAL DE ASIGNATURA No. T. NOMBRE DE LA UNIDAD LOGROS-ESTANDARES (Cognoscitivos - Pastoral) INDICADORES 04 Versión: 3 TEMAS Y SUBTEMAS 1. Clasifica y describe las 1. Sintetizar las propiedades de 7. SISTEMAS HOMOGÉNEOS Y HETEROGÉNEOS las soluciones y de acuerdo a estas diferencia las soluciones de los coloides confrontando los resultados de sus consultas y profundiza sobre las aplicaciones en la ciencia de las características y propiedades de las soluciones. 2. Apropiarse del espíritu de caridad de nuestra madre fundadora siendo coherente con el pensar y obrar. características que diferencian el sistema homogéneo del heterogéneo. 2. Aplica, los diferentes métodos de separación de mezclas, de acuerdo con los componentes que la forman. 3. Enumera y explica los factores que afectan la solubilidad de un soluto en un disolvente determinado. 4. Toma conciencia en la construcción de su aprendizaje como éxito personal. 5. Desarrolla, presenta y sustenta a tiempo la unidad. 6. Presenta autocontrol frente a situaciones de su cotidianidad 1. Sistemas homogéneos y heterogéneos 1.1 El agua como un sistema homogéneo 1.2 Propiedades del agua 1.3 Clases de soluciones 1.4 Propiedades coligativas de las soluciones. 2. Concentración de las soluciones 2.1 Unidades físicas de concentración 2.2 Unidades químicas de concentración EVALUACION 1. Evaluación oral, socialización de la temática. 2. Desarrollo de la unidad: realizar las actividades propuestas. 3. Laboratorio: presentación del informe de práctica de laboratorio. 4. Actividades en clase: Exposiciones, talleres, entre otros. 5. Pruebas escritas Código: GAPDC2004 COLEGIO DE LA PRESENTACION-NEIVA PROGRAMACION GENERAL DE ASIGNATURA No. T. NOMBRE DE LA UNIDAD LOGROS-ESTANDARES (Cognoscitivos - Pastoral) 1. Analizar 8. CÁLCULOS QUÍMICOS A PARTIR DE LAS ECUACIONES BALANCEADAS la información cualitativa y cuantitativa que puede ofrecer una ecuación química, estableciendo relaciones entre reactivos y productos, convirtiendo moles a gramos y número de átomos en una muestra dada, resolviendo problemas con ecuaciones. 2. Aceptar el compromiso de vida cristiana desde nuestra condición de bautizados y en la proyección de la comunidad. Fecha: ______________________ INDICADORES Versión: 3 TEMAS Y SUBTEMAS 1. Realiza cálculos estequiometricos a partir de una ecuación química balanceada. 2. Determina y aplica los cálculos basados en las 1. Cálculos leyes ponderales que se estequiometricos pueden realizar en una 1.1 Clases de cálculos ecuación química químicos balanceada. 1.2 Reactivo limite 3. Resuelve problemas de 1.3 Rendimiento de una estequiometria, teniendo en reacción química cuenta el reactivo limite, la 1.4 Estequiometria de pureza de los reactivos y el gases. rendimiento de una ecuación 1.5 Estequiometria de química. soluciones. 4. Manifiesta actitudes que la 1.6 Reacciones en comprometen con su secuencia mejoramiento permanente. 5. Desarrolla, presenta y sustenta a tiempo la unidad 6. Presenta coherencia con su forma de pensar y obrar EVALUACION 1. Evaluac ión oral, socialización de la temática. 2. Desarro llo de la unidad: realizar las actividades propuestas. 3. Laborat orio: presentación del informe de práctica de laboratorio. 4. Activida des en clase: Exposiciones, talleres, entre otros. 5. Prueba s escritas Firma del Docente: _______________________ VoBo:_________________________________________