iejercicios - Investigadores
Anuncio
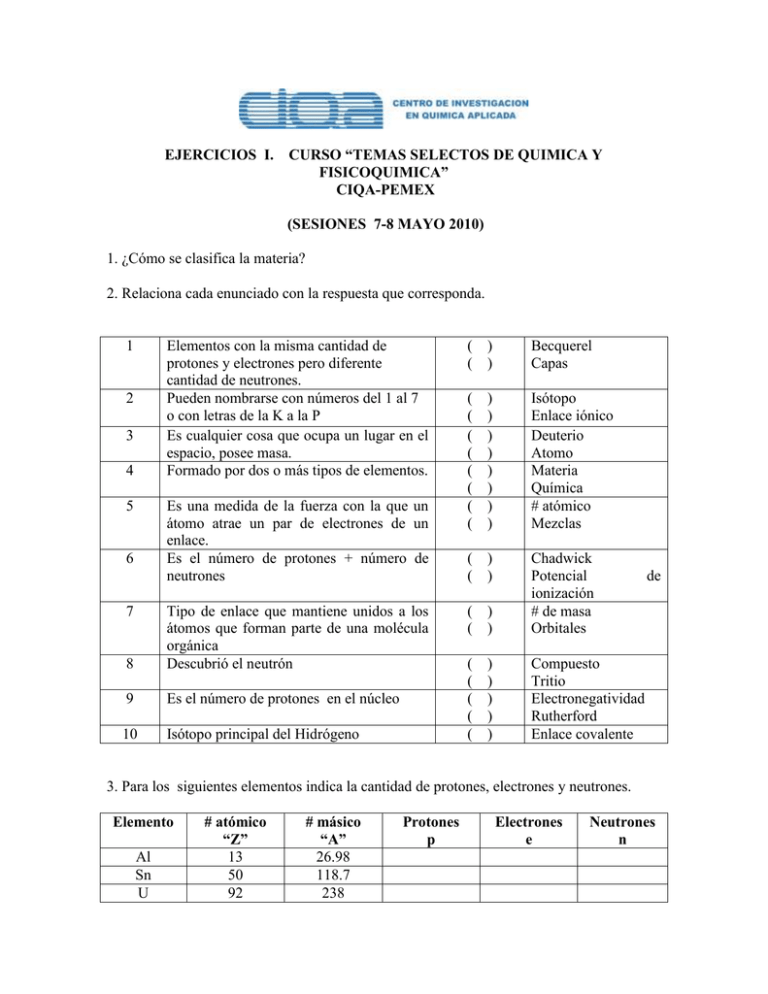
EJERCICIOS I. CURSO “TEMAS SELECTOS DE QUIMICA Y FISICOQUIMICA” CIQA-PEMEX (SESIONES 7-8 MAYO 2010) 1. ¿Cómo se clasifica la materia? 2. Relaciona cada enunciado con la respuesta que corresponda. 1 Elementos con la misma cantidad de protones y electrones pero diferente cantidad de neutrones. Pueden nombrarse con números del 1 al 7 o con letras de la K a la P Es cualquier cosa que ocupa un lugar en el espacio, posee masa. Formado por dos o más tipos de elementos. 2 3 4 5 Es una medida de la fuerza con la que un átomo atrae un par de electrones de un enlace. Es el número de protones + número de neutrones 6 7 8 Tipo de enlace que mantiene unidos a los átomos que forman parte de una molécula orgánica Descubrió el neutrón 9 Es el número de protones en el núcleo 10 Isótopo principal del Hidrógeno ( ( ) ) Becquerel Capas ( ( ( ( ( ( ( ( ) ) ) ) ) ) ) ) Isótopo Enlace iónico Deuterio Atomo Materia Química # atómico Mezclas ( ( ) ) ( ( ) ) Chadwick Potencial ionización # de masa Orbitales ( ( ( ( ( ) ) ) ) ) Compuesto Tritio Electronegatividad Rutherford Enlace covalente de 3. Para los siguientes elementos indica la cantidad de protones, electrones y neutrones. Elemento Al Sn U # atómico “Z” 13 50 92 # másico “A” 26.98 118.7 238 Protones p Electrones e Neutrones n 4. Encuentra la composición porcentual de cada elemento: Calcio, Fósforo y Oxígeno en la molécula del fosfato de calcio de fórmula Ca3(PO4)2. 5. Cuál es la fórmula molecular del compuesto siguiente? fórmula empírica CH, masa molar 78 g/mol. a) CH b) C2H2 c) C4H4 d) C6H6 6. Determine la fórmula empírica de un compuesto que contiene 52.9% de aluminio y 47.1% de oxígeno. a)AlO b) Al2O3 c) Al3O2 d) Al4O6 7. Una muestra de glucosa C6H12O6, contiene 4.0 x 1022 átomos de carbono. ¿Cuántos átomos de hidrógeno y cuántas moléculas de glucosa contiene la muestra? a) 8.0 x 1022 átomos de H, 8.0 x 1022 moléculas de glucosa b) 8.0 x 1022 átomos de H, 4.0 x 1022 moléculas de glucosa c) 4.0 x 1022 átomos de H, 4.0 x 1022 moléculas de glucosa d) 8.0 x 1022 átomos de H, 6.7 x 1021 moléculas de glucosa 8. Con base en la fórmula estructural siguiente, calcule el porcentaje de carbono presente. (CH2CO)2C6H3(COOH) a) 64,70% b)66,67% c) 69,25% d)76,73% 9. ¿Cuál es la masa en gramos de 0.257 mol de sacarosa,C12H22O11? a) 342 g b) 88.0 g c) 8.80 g d) 12.5 g 10. Determine el peso molecular del compuesto siguiente: Ca(C2H3O2)2 a) 99 b) 152 c) 94 d) 158 11. Se prepara una solución que contiene 13 mL de benzaldehído (d=1.044 g/mL) en 80 mL de benceno C6H6 (d= 0.874 g/mL). El análisis de benzaldehído (esencia de almendras) muestra la siguiente composición: %C = 79.22, %H = 5.69 y % O = 15.07. Calcular: a) Fórmula molecular del benzaldehído b) Peso molecular del benzaldehído c) Molaridad 12. Calcula la cantidad en gramos de soluto presente en 175 mL de una solución acuosa 0.32 M de ácido perclórico (HClO4). 13. ¿Qué molalidad tiene una solución que se preparar disolviendo 48 g de estireno (C8H8) en 450 mL de tolueno (C7H8)? Densidad del tolueno = 0.867 g/mL 14. Si en 17 g de NH3 hay 3 g de H ¿ Cuántos g de N habrá en 85 g de NH3? 15. Calcula el peso molecular y el % de cada elemento de los siguientes compuestos: a) HCl d) KMnO4 b) H2S e) Na2SO4 c) Ca(OH)2 f) NH4OH II. Preparación de soluciones. 1)gr = ? de K2Cr2O7 para preparar 250 ml de solución 2.16M. 2) ¿Cuál es la Molaridad de una solución de 85 ml de etanol que contiene 1.77 g de etanol (C2H5OH)? 3) Se tienen 3.81 g de glucosa y se quiere preparar una solución 2.53M. Calcula el volumen en ml que deberá utilizarse. 4) Calcula el volumen que se necesita a partir de 500 ml de una solución de H2SO4 1.75M para preparar una solución de H2SO4 8.61M. 5) Calcula el volumen que se necesita a partir de 200 ml de NaOH 0.866M y se quiere preparar una solución NaOH 5.07M. 6) ¿Cómo prepararías 1 L de solución 0.1 M de H2SO4 partiendo de H2SO4 2 M? 7) ¿Cuántos g de BaS04 se necesitan para preparer 1 litro de BaSO4 5N ? 8) ¿Cuántos g de CaCl2 se necesitan para preparer 1500 mL de CaCl2 3N? 9) Cuál es la Normalidad de una solución preparada a partir de 320g of NaOH en 2500 mL de agua? 10) Calcular la Normalidad y Molaridad de 555g de CaCl2 en 500 mL de agua. 11) Se requiere preparar 3L of NaOH 4N a partir de NaOH 12N. 12) ¿Cuál es la Normalidad de HCl preparado a partir de 3 mL de HCl 10N diluído a 500 mL? III. Nomenclatura compuestos orgánicos 1) Dibuja la fórmula estructural de los siguientes compuestos: a) Metilhexilcetona. b) 3-(bromometil)-4-octanol c) 3,7-Dimetil-1-octanol d) Acetato de ciclohexilo e) 3,5-Dimetil-2-ciclohexen-1-ona f) Acido 3-Iodopropiónico g) 3-tert-butilfenol h) Anhídrido butílico i) Cloruro de octanoílo j) Benzaldehído k) Acetato de butilo m) 3-etil-5-decanona. 2) Escribe el nombre IUPAC para cada una de las siguientes estructuras: S a) b) c) d) CH3 O Cl N Cl e) f) H3C CH3 H3C CH3 H3C CH3 H3C H3C Cl CH g) CH3 H2C h) i) j) Br H3C O O k) H3C CH3 H2C H O
