TRABAJO DE - STANA3ESO15-16
Anuncio

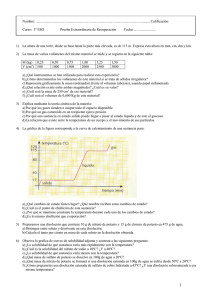
TRABAJO DE RECUPERACIÓN DE FÍSICA Y QUÍMICA 3º E. S. O. TEMA 0.- EL TRABAJO CIENTÍFICO. 1.- ¿Cuáles son las etapas comunes de cualquier investigación científica? 2.- ¿Qué es una teoría científica? 3.-¿Qué cantidad es mayor: 1500g o 1,6 kg; 1,8 m o 2000 mm; 2500 m o 2 km; 150 min o 2 horas; 2 g/cm3 o 2000 kg/m3? 4.- Explica detalladamente cómo calcularías en el laboratorio la densidad de un trozo de mineral. 5.- La masa de varios volúmenes del mismo material se mide y se registra en la siguiente tabla: m (kg) 0,25 0,50 0,75 1,00 1,25 1,50 V (cm3) 500 1000 1500 2000 2500 3000 a) b) c) d) ¿ Qué instrumentos se han utilizado para realizar el experimento? Representa gráficamente la masa frente al volumen ¿Cuál es la masa de 250 cm3 de este material? ¿Cuál será el volumen de 0,600 kg de este material? 6.- ¿Cuántas cifras significativas tienen estas medidas? a) b) c) d) 325 m 0,0023 m 2,25 • 10-5 m 21,005 m 7.- Un prisma mide 5 cm de largo, 3 cm de ancho y 12 cm de alto. ¿Cuál es el volumen del prisma? Expresa el resultado en centímetros cúbicos y en metros cúbicos y en notación científica. TEMA 1.- LOS ESTADOS DE AGREGACIÓN DE LA MATERIA. 1.- Características generales de un sólido, un líquido y un gas. 2.- ¿Por qué se mantiene constante la temperatura durante un cambio de estado? Define el calor latente de cambio de estado. 3.- La gráfica de la figura corresponde a la curva de enfriamiento de una sustancia pura. En ella se representa la variación de la temperatura con el tiempo hasta que el gas se convierte en líquido y luego hasta que el líquido se solidifica. a) b) c) ¿Cuál es el punto de fusión de esta sustancia? ¿Cuál es su punto de ebullición? ¿En qué estado se encuentra la sustancia a 20ºC? 4.- ¿Qué relación hay entre la temperatura de los cuerpos y el movimiento de las partículas? 5.- Dibuja la gráfica de calentamiento de una sustancia que se encuentra inicialmente a 25ºC y cuyos puntos de fusión y de ebullición son 80ºC y 150ºC, respectivamente. ¿En qué estado se encuentra esa sustancia a 130ºC? 6.- Expresa n grados centígrados las siguientes temperaturas que están indicadas en la escala Kelvin: 100 K, 300 K, 250 K, 325 K, 273 K 7.- Describe y justifica: a) b) c) ¿Cómo se modifica la presión de un gas si, manteniendo su temperatura constante, su volumen disminuye? ¿Cómo se modifica el volumen de un gas si se eleva la temperatura, pero la presión permanece constante? ¿Cómo se modifica la presión de un gas si se incrementa la temperatura, pero el volumen permanece constante? TEMA 2.- SUSTANCIAS PURAS Y MEZCLAS. 1.- Explica en qué se diferencian un elemento y un compuesto. ¿Qué es una sustancia pura? 2.- ¿Cómo separarías los componentes de una mezcla de granos de arena muy finos, sal y limaduras de hierro? ¿En qué propiedades de estas sustancias te has basado para elegir el método de separación? ¿Qué nombre recibe cada uno de los métodos de separación que has utilizado? 3.- Preparamos una disolución que contiene 10 g de nitrato de potasio y 15 g de cloruro de potasio en 475 g de agua. a) ¿Cómo clasificarías esta disolución según el número de sus componentes? b) Distingue entre soluto y disolvente en esta disolución. c) Calcula el tanto por ciento en masa de cada soluto en la disolución obtenida. 4.- Una disolución contiene 116 g de acetona, 138 g de etanos y 126 g de agua. Determina el porcentaje en masa de cada componente en la disolución. 5.- ¿Qué significa que una disolución de yodo en alcohol está al 1%? 6.- Si se afirma que una disolución está saturada, se está indicando que tiene mucho soluto disuelto? 7.- La variación de la solubilidad de las sustancias con la temperatura se utiliza para purificarlas. Así, si la sustancia que se quiere purificar es más soluble en caliente, se prepara una disolución y se deja enfriar. La sustancia pura cristalizará y se depositará en el fondo del recipiente, mientras que las impurezas, al formar una disolución diluida, no se separarán. a) b) ¿Cómo se puede purificar una sustancia que es más soluble en frío que en caliente, como el hidróxido de calcio? ¿Cómo se prepararía una disolución sobresaturada de esta sustancia? 8.- ¿De qué forma recuperarías el sulfato de cobre (cristales azules) que se encuentra disuelto en determinado volumen de agua? 9.- Calcula el porcentaje en masa de una disolución que se ha preparado disolviendo en 120 g de agua, 30 g de hidróxido se sodio (NaOH). TEMA 3.- TEORÍA ATÓMICA. 1.- Responde si las siguientes afirmaciones son verdaderas o falsas. a) La carga del protón es igual en valor numérico a la carga del neutrón. b) La carga del electrón es igual en valor numérico a la carga del protón. c) La masa de un protón es mayor que la masa de un electrón. d) La masa de un neutrón es menor que la masa de un protón. e) La masa del átomo está prácticamente concentrada en su núcleo. 2.- Según J. J. Thomson, ¿cómo están distribuidas las partículas positivas y negativas en el átomo 3.- En 1911, Ernest Rutherford y sus colaboradores bombardearon una fina lámina de oro con partículas a gran velocidad. a) ¿Cómo era la carga de estas partículas, positiva o negativa? b) ¿Qué ocurre con la mayor parte de estas partículas cuando llegan a la lámina? c) ¿Por qué algunas partículas rebotan al chocar contra la lámina? d) ¿Cómo justifica Rutherford estos comportamientos de las partículas con su modelo atómico? 4.- Completa la siguiente tabla: ISÓTOPO Z A Nº de electrones Nº de protones Nº de neutrones 40 Ca O 23 Na 238 U 18 5.- Dibuja un átomo de carbono que tiene 6 protones, 6 neutrones y 6 electrones y después, un isótopo de este átomo. 6.- El magnesio natural tiene un isótopo de mas atómica relativa 24 y abundancia 78,70%, un segundo isótopo de masa atómica relativa 25 y abundancia 10,13%, y otro de masa atómica relativa 26 y abundancia 11,17%. Halla la masa atómica media del magnesio. 7.- Escribe la configuración electrónica del 23 Na. 8.- ¿Qué diferencia hay entre la fisión y la fusión nuclear? ¿Qué aplicaciones tiene la fisión nuclear? TEMA 4.- ESTRUCTURA DE LA MATERIA. 1.- ¿Qué es un elemento químico? 2.- ¿Cómo se ordenan los elementos en la tabla periódica actual? ¿Qué inconveniente sigue presentando esta tabla? 3.- ¿Qué es un período? ¿Qué regularidades presentan los períodos? ¿Qué es un grupo? ¿Qué regularidades presentan los grupos? 4.- ¿Cómo varía el carácter metálico a lo largo de un período y a lo largo de un grupo? 5.- Indica cuáles de las siguientes sustancias se presentan en la naturaleza, preferentemente como átomos aislados, moléculas o cristales. a) Diamante b) Helio c) Oxígeno d) Cuarzo e) Dióxido de carbono f) Cloruro de sodio g) Neón h) Cobre 6.- ¿Qué compuesto tiene mayor porcentaje de oxígeno, el agua, H 2O, o el dióxido de carbono, CO2? (Masas atómicas: H= 1; O = 16; C = 12) 7.- ¿Cuál es la masa molar del oxígeno? ¿Cuántas moléculas hay en 0,5 mol de moléculas de oxígeno? ¿Cuántos átomos de oxígeno hay en 0,5 mol de moléculas de oxígeno? ¿Cuál es la masa de 0,5 mol de moléculas de oxígeno? 8.- Cita dos compuestos covalentes que formen moléculas y otros dos que formen cristales. 9.- ¿Cuántos electrones debe poseer la última capa de un átomo para que no tenga tendencia ni a perder ni a ganar otros electrones del exterior? 10.- ¿Qué tipo de enlace mantiene unidos a los átomos en el NaCl? ¿Qué se forma, una molécula o un cristal? TEMA 5.- LAS REACCIONES QUÍMICAS. 1.- Características de un cambio químico. 2.- El cloruro de hidrógeno se obtiene en la industria, haciendo reaccionar juntos hidrógeno y cloro. Escribe la ecuación química equilibrada de esta reacción. 3.- Ajusta las siguientes ecuaciones químicas: a) Na (s) + Cl2 (g) → NaCl (s) b) H2 (g) + I2 (g) → HI (g) c) Al (s) + O2 (g) → Al2O3 (g) d) PdCl2 (aq) + HNO3 (aq) → Pd(NO3)2 (s) + HCl (aq) 4.- El amoniaco se descompone en nitrógeno e hidrógeno, ambos en estado gaseoso. a) Escribe la ecuación de la reacción ajustada. b) Calcula la cantidad de hidrógeno que se desprende en la descomposición de 68 g de amoniaco. c) ¿Cuántas moléculas de hidrógeno se desprenden? 5.- Indica de qué tipo es una sustancia disuelta en agua si: a) Su pH es menor de 7. b) Su pH es mayor de 7. c) Su pH es igual a 7. ¿Qué ocurre si la sustancia del apartado a) reacciona con la sustancia del apartado b)? 7.- El nitrato de plata, AgNO3, reacciona con el cloruro de sodio, NaCl, ambos en disolución acuosa, para dar un precipitado blanco de cloruro de plata AgCl, y nitrato de sodio, NaNO3. a) Escribe y ajusta la ecuación química. b) Calcula la cantidad de cloruro de plata que se obtiene cuando 1 mol de nitrato de plata reacciona con la cantidad suficiente de cloruro de sodio. c) Calcula la masa de cloruro de plata que se obtiene cuando 10g de nitrato de plata reaccionan con una masa suficiente de cloruro de sodio. d) ¿Qué cantidad de cloruro de sodio reacciona exactamente con 1 mol de nitrato de plata. FORMULACIÓN. 1.- Óxido de potasio 2.- Óxido de hierro (III) 3.- Trihidruro de fósforo 4.- Hidruro de calcio 5.- Peróxido de hidrógeno 6.- Sulfuro de magnesio 7.- Hidróxido de sodio 8.- Cloruro de carbono 1.- BH3 2.- KOH 3.- Fe2S3 4.- HI 5.- CaH2 6.- H2O2 7.- CO 8.-CuO