Esquema - enlace químico. - Recursos para la Física y Química
Anuncio

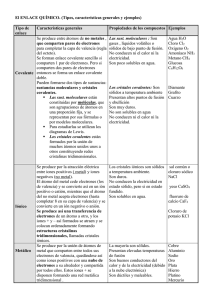
IES Menéndez Tolosa Física y Química – 3º ESO Componentes del equipo: Nombre y apellidos del componente 1 Nombre y apellidos del componente 2 Física y Química – 3º ESO IES Menéndez Tolosa ÍNDICE 1. 2. 3. 4. Enlace químico Enlace iónico Enlace covalente Enlace metálico Física y Química – 3º ESO IES Menéndez Tolosa 1. EL ENLACE QUÍMICO Los elementos se pueden unir consigo mismos o unos con otros, de manera que la naturaleza del enlace depende del tipo de elementos que se unen, pudiéndose distinguir tres tipos de enlaces: covalente, iónico y metálico. 2. ENLACE IÓNICO (metal con no metal) Es la unión que se establece cuando se une un metal con un no metal, ejemplo el sodio con el cloro. Los metales pierden (ceden) con facilidad electrones de la última capa convirtiéndose en iones positivos (catión) y los no metales aceptan con facilidad dichos electrones convirtiéndose en iones negativos (anión). En el enlace iónico hay una transferencia de electrones desde el átomo metálico al no metálico. Los iones positivos y los negativos se unen mediante fuerzas electrostáticas de atracción. Los iones se acoplan de modo que cada ión está rodeado por iones de signo contrario, formándose una estructura ordenada que se denomina red iónica. Se forman cristales y no moléculas aislada, ejemplo el cloruro de sodio (sal común). Los compuestos iónicos se representan mediante una fórmula que indica la proporción de iones en el compuesto. Propiedades de los compuestos iónicos: Son sólidos a temperatura ambiente. Elevados puntos de ebullición y de fusión. Son duros, difíciles de rayar. Son solubles en agua porque la atracción eléctrica entre los iones disminuye en un medio acuoso, quedando estos libres para moverse. En estado sólido no conducen la electricidad porque las cargas eléctricas de los iones están en posiciones fijas en la estructura cristalina y no quedan partículas libres que puedan transportar las cargas. En disolución o fundidos si conducen la corriente eléctrica por la movilidad de los iones. IES Menéndez Tolosa 3. Física y Química – 3º ESO ENLACE COVALENTE (no metal con no metal) Los elementos no metálicos se unen entre si o con el hidrógeno formando moléculas. En este enlace los átomos alcanzan su estabilidad compartiendo pares de electrones para completar con electrones su capa de valencia (última capa con electrones). Hay dos tipos de sustancia covalentes: las sustancias moleculares y los sólidos covalentes. 1. Las sustancias moleculares. Están constituidas por moléculas. Una molécula es la agrupación de un número concreto de átomos unidos entre sí mediante enlaces covalentes. Se representa mediante una fórmula molecular que indica cuántos átomos de cada clase hay en la molécula. El hidrógeno se une con él mismo para formar H2, al igual que el Cl2, N2..., este tipo de moléculas reciben el nombre de diatómicas. El agua (H2O), el amoniaco, el metano, el flúor,… son ejemplos de moléculas de este tipo. Propiedades de las sustancias moleculares: A temperatura ambiente son gases, líquidos volátiles o sólidos. Puntos de fusión y ebullición son bajos. No conducen el calor ni la electricidad. La mayoría son poco solubles en agua. 2. Sólidos covalentes. En los sólidos covalentes no se forman moléculas: los átomos se enlazan unos a otros constituyendo redes cristalinas tridimensionales extensas. Son sólidos covalentes tri-dimensionales el diamante (C) y el cuarzo (SiO2). Propiedades de los sólidos covalentes: Son sólidos a temperatura ambiente. Presentan temperaturas de fusión y ebullición muy elevada. Son muy duros. No conducen el calor ni la electricidad. Son insolubles en agua. Física y Química – 3º ESO IES Menéndez Tolosa 4. ENLACE METÁLICO ( metales) Cuando se trata de elementos metálicos, se unen en forma de estructura cristalina. Son agrupaciones de átomos iguales. Los átomos de los metales tienen tendencia a ceder electrones para completar su octeto y convertirse en iones positivos. En el enlace metálico los iones positivos formados comparten el conjunto de iones cedidos. Se forma una estructura ordenada de iones positivos llamada red metálica entre los que se mueven los electrones libres que forman una nube electrónica. El enlace metálico se produce cuando los iones positivos de un metal comparten una nube electrónica. Propiedades de los metales: Son sólidos a temperatura ambiente (excepto el mercurio que es líquido) porque forman redes cristalinas. Presentan elevadas temperaturas de ebullición y de fusión. Son buenos conductores del calor y de la electricidad, debido a la existencia de electrones libres que pueden moverse por la red. Son dúctiles y maleables porque se puede deformar la red metálica y desplazar los iones positivos unos sobre otros sin romper la red ni alterar su estructura. Son generalmente duros, sin embargo, algunos como el sodio o el litio son tan blandos que se pueden dañar con la uña.