Enlace Metálico y Coordinado
Anuncio

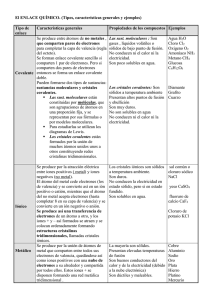
ENLACE METÁLICO. Los electrones negativos se distribuyen por todo el metal formando enlaces no direccionales o deslocalizados con los iones plata positivos. Esta estructura, conocida como enlace metálico, explica las propiedades características de los metales: son buenos conductores de la electricidad al estar los electrones libres para moverse de un sitio a otro, y resultan maleables B(como se muestra en la ilustración) porque sus iones positivos se mantienen unidos por fuerzas no direccionales. Si los átomos enlazados son elementos metálicos, el enlace se llama metálico. Los electrones son compartidos por los átomos, pero se pueden mover a través del sólido proporcionando conductividad térmica y eléctrica, brillo, maleabilidad y ductilidad. Si los átomos enlazados son no metales e idénticos (como en N2 o en O2), los electrones son compartidos por igual por los dos átomos, y el enlace se llama covalente apolar. Si los átomos son no metales pero distintos (como en el óxido nítrico, NO), los electrones son compartidos en forma desigual y el enlace se llama covalente polar polar porque la molécula tiene un polo eléctrico positivo y otro negativo, y covalente porque los átomos comparten los electrones, aunque sea en forma desigual. Estas sustancias no conducen la electricidad, ni tienen brillo, ductilidad o maleabilidad. ENLACE COVALENTE COORDINADO El agua mantiene prácticamente invariable su estructura molecular en el hidrato, al estar unida al compuesto anhidro mediante enlaces covalentes coordinados a través de uno de los pares de electrones solitarios del oxígeno y, a veces, mediante enlaces de hidrógeno. En los compuestos de coordinación, el metal suele ser un metal de transición . Las moléculas neutras o iones negativos se denominan ligandos y forman enlaces con el metal a través de sus pares de electrones libres; estos enlaces son covalentes de tipo dativo (aquéllos en los que los dos electrones del enlace provienen de uno sólo de los átomos implicados en el enlace). Son ligandos habituales el amoníaco (NH3), el agua (H2O), los iones cloruro (Cl−) y los iones hidróxido (OH−). Los complejos pueden estar cargados positiva o negativamente, o también pueden ser neutros, dependiendo de la suma de las cargas del metal y los ligandos. El número de ligandos que rodean al metal recibe el nombre de número o índice de coordinación del complejo. Los números o índices de coordinación más habituales son 4 y 6. Los complejos tetracoordinados suelen ser cuadrados o tetraédricos, mientras que los hexacoordinados son octaédricos. A continuación se muestran algunos ejemplos. El cis−platino es una molécula tetracoordinada planocuadrada, y se utiliza en la quimioterapia anticancerígena. Es eléctricamente neutra: el platino está en forma de ion con carga +2, los dos ligandos amoníaco son neutros y los dos cloruros poseen una carga negativa cada uno. El anión tetraédrico tetraclorocobalto (II) posee carga negativa porque el ion cobalto (Co2+) está rodeado de cuatro ligandos cloruro con una carga negativa cada uno. El catión hexaacuoníquel (II) tiene carga positiva, ya que el ion Ni2+ está rodeado por seis moléculas de agua neutras dispuestas en las esquinas de un octaedro. 1 Los quelatos son compuestos de coordinación en los que el ligando posee dos o más puntos de unión con el metal. El ligando 1,2−diaminoetano (etilendiamina) es un ejemplo de ligando bidentado. Entre los numerosos ejemplos de complejos fuertemente coloreados se encuentra el catión tetraacuocobre (II), Cu(H2O)42+, que es el responsable del color azul del sulfato de cobre. Otro complejo de este tipo es el catión pentaacuotiocianatohierro (III), Fe(H2O)5SCN2+, que confiere a las disoluciones un color rojo sangre. INSTITUTO TECNOLÓGICO Y DE ESTUDIOS SUPERIORES DE MONTERREY CAMPUS ESTADO DE MÉXICO. QUÍMICA INORGÁNICA Enlace Metálico y Enlace Coordinado. 3 2