FUERZAS DE ATRACCIÓN Y ESTADO SÓLIDO FUERZAS INTERMOLECULARES.-
Anuncio
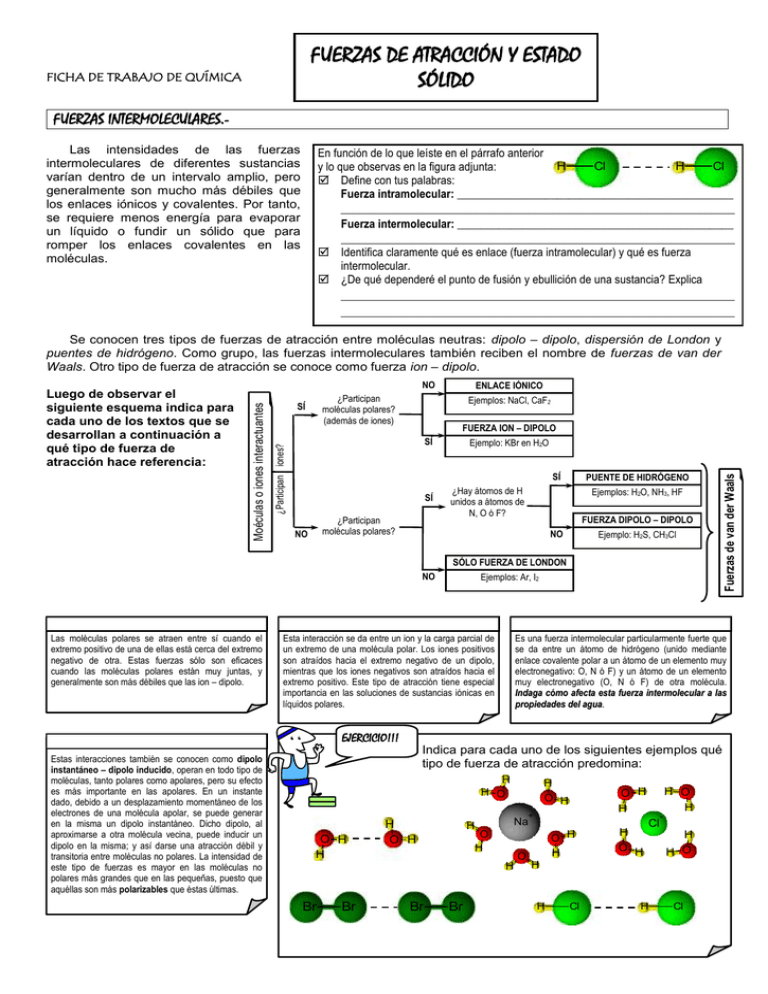
FUERZAS DE ATRACCIÓN Y ESTADO SÓLIDO FICHA DE TRABAJO DE QUÍMICA FUERZAS INTERMOLECULARES.Las intensidades de las fuerzas intermoleculares de diferentes sustancias varían dentro de un intervalo amplio, pero generalmente son mucho más débiles que los enlaces iónicos y covalentes. Por tanto, se requiere menos energía para evaporar un líquido o fundir un sólido que para romper los enlaces covalentes en las moléculas. En función de lo que leíste en el párrafo anterior H Cl H Cl y lo que observas en la figura adjunta: Define con tus palabras: Fuerza intramolecular: _______________________________________________ ___________________________________________________________________ Fuerza intermolecular: _______________________________________________ ___________________________________________________________________ Identifica claramente qué es enlace (fuerza intramolecular) y qué es fuerza intermolecular. ¿De qué dependeré el punto de fusión y ebullición de una sustancia? Explica ___________________________________________________________________ ___________________________________________________________________ Se conocen tres tipos de fuerzas de atracción entre moléculas neutras: dipolo – dipolo, dispersión de London y puentes de hidrógeno. Como grupo, las fuerzas intermoleculares también reciben el nombre de fuerzas de van der Waals. Otro tipo de fuerza de atracción se conoce como fuerza ion – dipolo. NO ¿Participan moléculas polares? (además de iones) FUERZA ION – DIPOLO SÍ Ejemplo: KBr en H2O SÍ SÍ ¿Participan moléculas polares? NO PUENTE DE HIDRÓGENO ¿Hay átomos de H unidos a átomos de N, O ó F? Ejemplos: H2O, NH3, HF FUERZA DIPOLO – DIPOLO NO Ejemplo: H2S, CH3Cl SÓLO FUERZA DE LONDON NO Las moléculas polares se atraen entre sí cuando el extremo positivo de una de ellas está cerca del extremo negativo de otra. Estas fuerzas sólo son eficaces cuando las moléculas polares están muy juntas, y generalmente son más débiles que las ion – dipolo. Ejemplos: Ar, I2 Esta interacción se da entre un ion y la carga parcial de un extremo de una molécula polar. Los iones positivos son atraídos hacia el extremo negativo de un dipolo, mientras que los iones negativos son atraídos hacia el extremo positivo. Este tipo de atracción tiene especial importancia en las soluciones de sustancias iónicas en líquidos polares. Fuerzas de van der Waals SÍ ENLACE IÓNICO Ejemplos: NaCl, CaF2 ¿Participan iones? Moéculas o iones interactuantes Luego de observar el siguiente esquema indica para cada uno de los textos que se desarrollan a continuación a qué tipo de fuerza de atracción hace referencia: Es una fuerza intermolecular particularmente fuerte que se da entre un átomo de hidrógeno (unido mediante enlace covalente polar a un átomo de un elemento muy electronegativo: O, N ó F) y un átomo de un elemento muy electronegativo (O, N ó F) de otra molécula. Indaga cómo afecta esta fuerza intermolecular a las propiedades del agua. EJERCICIO!!! Estas interacciones también se conocen como dipolo instantáneo – dipolo inducido, operan en todo tipo de moléculas, tanto polares como apolares, pero su efecto es más importante en las apolares. En un instante dado, debido a un desplazamiento momentáneo de los electrones de una molécula apolar, se puede generar en la misma un dipolo instantáneo. Dicho dipolo, al aproximarse a otra molécula vecina, puede inducir un dipolo en la misma; y así darse una atracción débil y transitoria entre moléculas no polares. La intensidad de este tipo de fuerzas es mayor en las moléculas no polares más grandes que en las pequeñas, puesto que aquéllas son más polarizables que éstas últimas. Indica para cada uno de los siguientes ejemplos qué tipo de fuerza de atracción predomina: H H O O H H H Na O H O Br Br Br H O H O H H + H O H H Br H O H O H H H O H Cl - H O H H H Cl H Cl ESTADO SÓLIDO.- CLASIFICACIÓN Y ESTRUCTURA DE LOS SÓLIDOS Ahora nos concentraremos en la relación existente entre las propiedades de los sólidos y sus estructuras y enlaces. Los sólidos pueden ser cristalinos o amorfos: Sólidos Amorfos.- Estos sólidos carecen de formas y caras bien definidas, sus partículas no tienen un orden definido ni regular, no existe un patrón de ordenamiento que se repita a través de todo el sólido. Ejemplos de este tipo de sólidos son el vidrio, el caucho, la cera y muchos plásticos. Dado que las partículas de un sólido amorfo carecen de un orden de largo alcance, la intensidad de las fuerzas de atracción varía de un punto a otro de una muestra; por lo tanto no funden a una temperatura específica. Sólidos Cristalinos.- En estos sólidos las partículas están organizadas en un patrón sistemático regular denominado red cristalina. El orden característico de los sólidos cristalinos nos permite tener una imagen de todo un cristal examinando sólo una pequeña parte de él. A la unidad de repetición sistemática de un sólido cristalino se le denomina celda unidad. Existen diferentes tipos de celda unidad que generan distintos empaquetamientos en la estructura de los sólidos, no obstante un análisis de éstos escapa a los fines del presente curso. CLASIFICACIÓN DE LOS SÓLIDOS CRISTALINOS.- EJERCICIO!! Las propiedades físicas de los sólidos cristalinos, como su punto de fusión y su dureza, dependen tanto del acomodo de las partículas unitarias como de las fuerzas de atracción entre ellas. Los dibujos adjuntos representan una parte de la estructura de tres sólidos cristalinos. Identifica para cada caso el tipo de partícula unitaria. En tal sentido, estos sólidos se clasifican sobre la base de los tipos de fuerzas que mantienen unidas las partículas. TABLA.- Tipos de Sólidos Cristalinos. Partículas Tipo de Sólido Unitarias Iónico Iones (aniones y cationes) Propiedades Ejemplo Atracción electrostática entre iones (enlace iónico). Muy intensa. Duros y quebradizos. Baja conductividad térmica y eléctrica. Casi todos se disuelven en solventes polares. Elevado punto de fusión (800 – 3000ºC) Alta conductividad eléctrica en estado líquido o solución acuosa NaCl ZnS MgO CaF2 Frágiles. Baja conductividad térmica y eléctrica. Solubles en líquidos que formen puentes de H Puente de Hidrógeno. Punto de fusión intermedio (mayor que sólidos similares que Intensidad intermedia. no presenten puentes de H), aunque son líquidos o gases a temperatura ambiente. Muy baja conductividad eléctrica en estado líquido. H2O HF NH3 CH3OH Polar Moléculas polares (sin puentes de H) Dipolo – Dipolo. Intensidad más bien débil. Frágiles. Baja conductividad térmica y eléctrica. Solubles en otros solventes polares y en algunos no polares. Bajo punto de fusión. Muy baja conductividad eléctrica en estado líquido. HCl H2S CHCl3 Apolar Átomos (gases nobles) o moléculas no polares Dispersión de London (Dipolo Instantáneo – Dipolo Inducido) Débil. Blandos. Baja conductividad térmica y eléctrica. Solubles en solventes apolares o poco polares. Muy bajo punto de fusión. Muy baja conductividad eléctrica en estado líquido. Ar S8 P4 CH4 CO2 C (diamante) SiO2 Red Covalente Átomos Enlace Covalente. Muy fuerte. Muy duros. Comúnmente baja conductividad térmica y eléctrica. Insolubles. Muy alto punto de fusión (Ej: diamante 3550ºC) Metálico Cationes metálicos y electrones de valencia deslocalizados Enlace Metálico. Intensidad variable (depende del metal) Desde blandos hasta muy duros. Maleables y dúctiles. Muy buena conductividad térmica y eléctrica. Insolubles en agua aunque los alcalinos reaccionan con ella. Casi todos tienen altos puntos de fusión. Muy alta conductividad eléctrica en estado líquido. Atómico Molecular Con Puentes Moléculas con de Hidrógeno H y N, O ó F Fuerza entre las Partículas (cuarzo) SiC WC Cu Fe Al Pt 1.- Los dibujos adjuntos representan a nivel submicroscópico dos formas alotrópicas del carbono sólido: el grafito y el diamante. Observa las imágenes, identifícalas y explica por qué mientras una es el sólido más duro que se conoce, con la otra se puede escribir. Observa las siguientes representaciones a nivel submicroscópico y responde: a) ¿A qué tipo de sólido corresponde cada representación? b) ¿Qué ocurrirá al golpear cada uno de los sólidos? Justifica Ordena las siguientes sustancias según la intensidad de las fuerzas de atracción que experimentan sus partículas: N2, H2O, NaCl y HCl. ¿Qué tipo de fuerza de atracción se debe vencer para realizar cada uno de los siguientes procesos? a) Hervir H2O b) Fundir CCl4 c) Disociar iónicamente NaCl d) Sublimar I2 En un experimento se obtuvieron los siguientes datos: Indicar: EJERCICIOS!!! 2.- 3.4.- 5.- Sólido A B C Punto de fusión Alto Alto Bajo Conductividad eléctrica Si, fundido Si, sólido No conduce Solubilidad en agua Muy soluble Insoluble Insoluble a) A qué tipo de sólido corresponde cada muestra. b) Las partículas que los forman y las fuerzas que los mantienes unidas. 6.- Entre las siguientes sustancias: Ne, Ag, CH4, KCl y H2O, elije aquella/s que sea/n más representativa/s de cada una de las siguientes afirmaciones: a) Conduce la corriente eléctrica en estado sólido. b) Sus partículas se mantienen unidas en estado sólido por fuerzas de London y funde a temperatura muy inferior a la del ambiente. c) No conduce la corriente eléctrica en estado sólido pero sí fundido y es muy soluble en agua. d) Presenta punto de ebullición muy superior al de sustancias similares, puesto que presenta puentes de hidrógeno. ESTADO LÍQUIDO FICHA TEÓRICA : Existen numerosas sustancias que, a presión y temperatura ambiente, son líquidos: alcohol, benceno, agua, acetona, etc. ¿Qué características tiene el estado líquido? En la mayoría de los casos una sustancia en estado líquido tiene menor densidad que en estado sólido, salvo en el caso del agua, en la cual la densidad es mayor. En el interior de un líquido, las moléculas son atraídas hacia todas direcciones; pero en la superficie, llamada también interfase, sólo son atraídas por las moléculas que se encuentran inmediatamente por debajo de ellas. Como resultado de este desequilibrio de fuerzas, resulta que las moléculas de la superficie se comportan como una película invisible y tensa; la tensión de las moléculas superficiales hace que pequeñas cantidades de líquido formen una esfera, donde la superficie es la mínima para un volumen determinado. Este efecto, llamado tensión superficial, es equivalente a la cantidad de energía requerida para extender la superficie del líquido. Los líquidos no poseen una forma geométrica determinada y son prácticamente incomprensibles, debido a que la distancia entre sus moléculas es comparable con aquella que existe entre las moléculas que formanun sólido. Una consecuencia de la incompresibilidad de los líquidos y de su incapacidad para soportar fuerzas es que transmiten la presión en todas direcciones. Un líquido toma la forma del recipiente que ocupa, debido a que sus moléculas tienen la energía cinética suficiente como para moverse con libertad pero no para separarse de las demás, por lo que conserva su volumen. En general, cuando un sólido recibe suficiente cantidad de energía, pasa al estado líquido (fusión); si el líquido se sigue calentando pasará al estado gaseoso (ebullición) Las moléculas en el líquido están en constante movimiento, esto hace que las que se encuentran en la superficie adquieran la suficiente energía cinética como para escapar de la superficie, transformándose en vapor, mediante un proceso llamado evaporación. Si el líquido se encuentra en un recipiente cerrado y libre de aire, llega un punto en el cual el número de moléculas que pasan al estado de vapor coincide con el número de moléculas que se condensan, es decir que alcanzan un equilibrio, llamado equilibrio de la presión de vapor La presión de vapor de un líquido es la presión ejercida por su vapor cuando los estados líquido y gaseoso están en equilibrio dinámico. Volatilidad, presión de vapor y temperatura: Las sustancias con presión de vapor elevadas se escapan con mayor facilidad que las que tienen presión de vapor baja. Cuando un líquido se evapora fácilmente decimos que es volátil. Si se calienta la sustancia, evapora con mayor facilidad ya que la presión de vapor aumenta al aumentar la temperatura. Se incrementa en forma no lineal. Presión de Vapor y punto de ebullición: Un líquido hierve cuando la presión de vapor se iguala a la presión externa que actúa sobre el líquido .En este punto se hace posible la formación de burbujas de vapor en el interior del líquido. El punto de ebullición de un líquido a una presión de 1 atm se le llama punto de ebullición normal. Fuerzas de Atracción Intermolecular: Cuanto mayor sean las fuerzas de atracción intermolecular menor es la P de V y viceversa. Al aumentar la temperatura, aumenta el movimiento de las partículas, esto hace que se rompan algunas de las F.A.I que hay entre las moléculas. Por consiguiente pasan fácilmente a fase de vapor. CAMBIOS DE ESTADO FICHA DE EJERCICIOS Nº 3 ESTADO SÓLIDO 1. Una sustancia blanca funde con alguna descomposición a 730ºC. Es un sólido no conductor de la electricidad, pero si se disuelve en agua para formar una solución es buena conductora. ¿Qué tipo de sólido puede ser la sustancia? 2. Dado el punto de fusión de N2 –210ºC y del NaCl 800 ºC: a. Clasifique el tipo de sólido que forman, e indique las fuerzas de atracción que participan b. Indique las diferencias observadas en sus puntos de fusión y en la solubilidad en agua. 3. Se tiene un sólido duro, no volátil, con alto punto de fusión y de ebullición, insoluble en agua y no conductor de la electricidad, ¿qué tipo de sólido es y que enlace presenta? 4. Considerando el cobre ¿Qué tipo de sólido es?, explique en fusión del enlace la conductividad eléctrica. 5. Entre los siguientes materiales en estado sólido: Sodio, Germanio, Metano, Neón, cloruro de potasio, agua, escoger los más representativos de : a. un sólido ligado por fuerzas de Van der Waals, que funde muy por debajo de la temperatura ambiente. b. un sólido de alta conductividad eléctrica, que funde aproximadamente a 200 ºC c. una red sólida de alto punto de fusión con átomos unidos en forma covalente. d. un sólido no conductor que se transforma en buen conductor al fundirse. e. una sustancia con marcados enlaces de H 6. Un joven estudiante comienza a trabajar en el laboratorio y encuentra una lista de los siguientes sólidos, que tiene en el laboratorio: Carbono, Cloruro de Sodio, N2, Ag se da cuenta que los sólidos que no están etiquetados. ¿Qué pasos tendría que dar el joven para poder distinguir cada sólido? 7. Para dos sólidos se encuentran las siguientes características: a. Para el sólido 1, es mal conductor, muy duro e insoluble en agua b. Para el sólido 2, tiene brillo, es dúctil y maleable, no es soluble en agua ¿De qué tipos de sólidos se trata? 8. Dos sólidos A y B tienen las siguientes propiedades: a. ¿Qué tipo de sólido es cada uno, qué partículas lo forman y qué fuerzas actúan entre las partículas? b. Explique la solubilidad de A en agua A B Punto de fusión alto no conduce en estado sólido. soluble en agua Punto de fusión bajo insoluble en agua. conductor en estado sólido. ESTADO LÍQUIDO 1. Cómo se relaciona la presión de vapor de un líquido con a. Fuerzas de atracción intermolecular. b. Volatilidad 2. Explique por qué: a. Se requiere más tiempo para cocer un huevo en la cima del Aconcagua que en Montevideo. b. En una olla a presión los alimentos se cuecen en menos tiempo. 3. A 20 ºC la presión de vapor de dos líquidos A y B son respectivamente 78, 0 torr y 280 torr. Justifique las respuestas a. ¿Cuál de los dos líquidos tiene mayor fuerza de atracción intermolecular? b. ¿Cuál es más volátil? c. ¿Cuál de los dos líquidos hierve a mayor temperatura? 4. Se dispone de dos líquidos A y B en recipientes iguales a la misma temperatura 25 ºC. Cada uno de los recipientes se conecta a un manómetro y se registran los siguientes datos: Líquido A Pv = 92 torr; Liquido B Pv 23.8 torr. a. ¿Cuál de los líquidos es más volátil? ¿por qué? b. Explique que líquido tendrá mayor punto de Ebullición. 5. Sabiendo que el punto de ebullición normal del alcohol etílico es 78,3 ºC y que el punto de ebullición normal del éter dietílico es 34,6 ºC. ¿cuál de los dos tiene mayor presión de vapor? Explique porque. 6. Dado dos líquidos A y B, siendo A más volátil que B. a. Como será la presión de vapor de A con respecto a B. Justifica b. Cómo será las fuerzas intermoleculares de A con respecto a B. Justifica c.


