CAMBIOS DE ESTADO. a) la evaporación
Anuncio

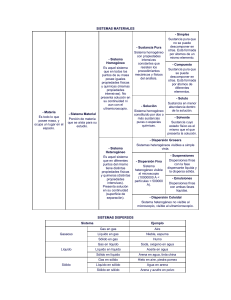
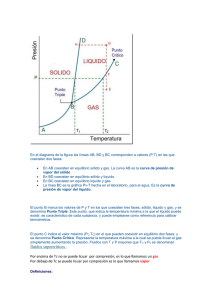
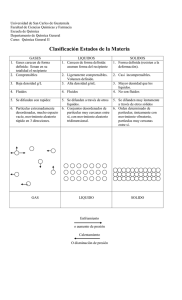
CAMBIOS DE ESTADO. Paso de una sustancia de un estado a otro. Los más importantes son: a) la evaporación b) la condensación c) la solidificación d) la fusión e) la vaporización f) la sublimación En un cambio de estado el cuerpo absorbe o desprende una determinada cantidad de calor por unidad de masa, denominado calor latente (de fusión, de ebullición, etc.), y durante el mismo la temperatura permanece invariable y constante para una presión externa dada. Evaporación. Paso de una sustancia del estado líquido al de vapor, a una temperatura inferior a la de ebullición. Tiene lugar sólo en la superficie del líquido y se produce de forma gradual. Condensación. Paso de una sustancia de la fase de vapor a la líquida (o la sólida); el proceso inverso es la vaporización (o la sublimación). Solidificación. Paso de un cuerpo del estado líquido al sólido; es el fenómeno inverso de la fusión. Para cada cuerpo tiene lugar a una temperatura determinada −punto de solidificación o de fusión− con desprendimiento de calor y, generalmente, acompañada de una disminución del volumen. Fusión. Paso de un cuerpo del estado sólido al líquido. Se verifica con absorción de calor, generalmente con aumento de volumen, y a una temperatura constante que depende de la naturaleza de los cuerpos y de la presión externa. Vaporización. Paso de una sustancia del estado líquido al gaseoso. Puede ser evaporación o ebullición según afecte sólo a la superficie o a todo el volumen. El calor de vapor es la cantidad de vapor que absorbe la unidad de masa de una sustancia al vaporizarse a una temperatura dada. Sublimación. 1 Paso de un cuerpo directamente del estado sólido al de vapor o del de vapor al sólido; este último se llama también condensación. La transición sólido−vapor se produce cuando el sólido está sometido a una presión inferior a su presión de vapor, por lo que en muchos casos la cantidad de vapor en equilibrio con la fase sólida es mínima. Se llama calor de sublimación al absorbido (o desprendido) por la unidad de masa de una sustancia al sublimar. Estado metastable. El de un sólido, líquido o gas que permanece en un determinado estado de agregación en unas condiciones en que debería haberse producido un cambio de agregación. La experiencia empírica indica que los cuerpos materiales adoptan diversas formas según el valor que toman las variables termodinámicas que los caracterizan. El estado sólido se reconoce por la invariabilidad de forma y volumen; el estado líquido presenta sólo invariancia de volumen y el estado gaseoso carece de ambas. Para una misma sustancia y a presión constante, los estados sólido, líquido y gaseoso corresponden a valores crecientes de la temperatura. A temperaturas bajas, la energía cinética de las moléculas es insuficiente para superar las fuerzas de cohesión que tienden a mantenerlas unidas. Se tienen entonces los sólidos cristalinos. En éstos los movimientos de las moléculas se limitan a vibraciones en torno a determinados puntos que corresponden a los nudos de la red cristalina. En el otro extremo del espectro, para valores muy superiores de la temperatura, la energía potencial intermolecular es prácticamente despreciable frente a la agitación molecular. El correspondiente estado de agregación es el gaseoso. El estado intermedio corresponde a los líquidos y al estado amorfo: aunque pequeña, la velocidad de las moléculas es lo suficiente para que éstas no puedan formar un retículo cristalino. Aumentando todavía la temperatura a partir del estado gaseoso, se llega a un punto en el que las moléculas se han disociado en sus átomos constituyentes y éstos a su vez han desaparecido para dar lugar a núcleos y electrones separados: este nuevo estado, característico de la materia estelar, se conoce con el nombre de plasma 2 Bibliografía: © Salvat Editores, S.A. 1999 Ecuación de estado de la materia 3