Laboratorio6REV1MyMGuia03
Anuncio
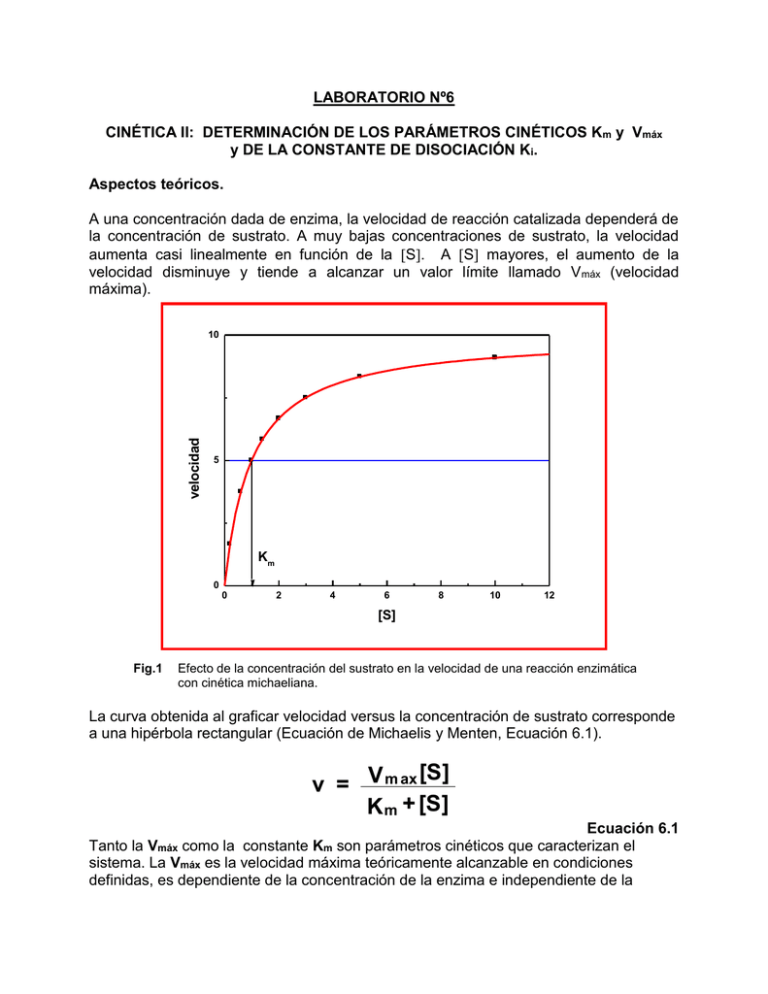
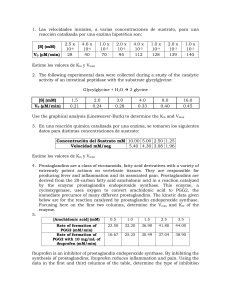
LABORATORIO Nº6 CINÉTICA II: DETERMINACIÓN DE LOS PARÁMETROS CINÉTICOS Km y Vmáx y DE LA CONSTANTE DE DISOCIACIÓN Ki. Aspectos teóricos. A una concentración dada de enzima, la velocidad de reacción catalizada dependerá de la concentración de sustrato. A muy bajas concentraciones de sustrato, la velocidad aumenta casi linealmente en función de la S. A S mayores, el aumento de la velocidad disminuye y tiende a alcanzar un valor límite llamado V máx (velocidad máxima). velocidad 10 5 Km 0 0 2 4 6 8 10 12 [S] Fig.1 Efecto de la concentración del sustrato en la velocidad de una reacción enzimática con cinética michaeliana. La curva obtenida al graficar velocidad versus la concentración de sustrato corresponde a una hipérbola rectangular (Ecuación de Michaelis y Menten, Ecuación 6.1). [S] v = V m ax K m + [S] Ecuación 6.1 Tanto la Vmáx como la constante Km son parámetros cinéticos que caracterizan el sistema. La Vmáx es la velocidad máxima teóricamente alcanzable en condiciones definidas, es dependiente de la concentración de la enzima e independiente de la concentración del sustrato, sus unidades son las de velocidad. La Km se conoce como constante de Michaelis y Menten, es numéricamente igual a la concentración de sustrato que da una velocidad igual a la mitad de la Vmax, es independiente de la concentración de enzima, sus unidades son de concentración. Condiciones que deben cumplirse para que en una reacción con cinética michaeliana los datos experimentales se ajusten a esta ecuación: Velocidad inicial (vo) tiempo 0 tiempo 0 [E] <<< [S] Curva progreso de la reacción enzimática. 10 8 [P] 6 [S]O = 1 KM vo 4 2 0 0 100 200 300 400 500 600 tiempo Fig.2 Típica curva progreso de una reacción enzimática. En este caso la disminución de la concentración de sustrato en el tiempo explica la disminución de la pendiente de la curva (velocidad). En la zona donde la pendiente tiende a cero se ha alcanzado el equilibrio. La velocidad de una reacción enzimática disminuye en el tiempo. Esta disminución se debe a varios factores dependientes del tiempo de la reacción; como la disminución de la concentración del sustrato a medida que éste se transforma, el aumento de la concentración del producto que puede traducirse en una mayor inhibición de la reacción directa, como también en una mayor velocidad de la reacción inversa. Además la posible inactivación de la enzima aumenta con el tiempo de ensayo. Se han obtenido ecuaciones integradas que dan cuenta de la disminución de la concentración del sustrato y del aumento de la inhibición por producto en el tiempo, sin embargo, no hay ecuaciones que consideren todos los factores que pueden estar involucrados. 30 Por ello, normalmente se mide la velocidad inicial de la reacción a partir de la tangente obtenida a tiempos cortos en la curva progreso de la reacción enzimática (concentración de producto (o de sustrato) versus tiempo de reacción). Experimentalmente, se mide la velocidad inicial a diferentes concentraciones de sustrato. El rango adecuado de concentración de sustrato a utilizar es de 0,2 Km 3,0 Km. La ecuación de Michaelis y Menten puede ser linealizada, con la ventaja que Vmáx y Km pueden determinarse fácilmente por regresión lineal utilizando una calculadora. Si un sistema enzimático sigue una cinética tipo Michaeliana, las transformaciones lineales dan origen a rectas del tipo y = mx + b. Ecuación de Lineweaver y Burk. 1 v Km Vmax 1 1 S Vmax Ecuación 6.2 0,6 0,4 1/v 1. 0,2 0,0 -1 0 1 2 3 4 5 1/[S] Fig. 3 Gráfica de Lineweaver y Burk para una reacción que sigue la cinética michaeliana. La pendiente es igual a Km/Vmax y el intercepto en el eje x es –1/Km. 31 Ecuación de Hanes – Woolf. S v Km Vmax S Vmax Ecuación 6.3 1,2 1,0 Vmax= 1/pendiente 0,8 [S]/v 2. 0,6 0,4 0,2 0,0 -2 0 -Km 2 4 6 8 10 [S] Fig. 4 Gráfica de Hanes y Woolf para una reacción que sigue la cinética michaeliana. La pendiente es igual a 1/Vmax y el intercepto en el eje x es – Km. 32