LEYES DE LA VELOCIDAD
Anuncio
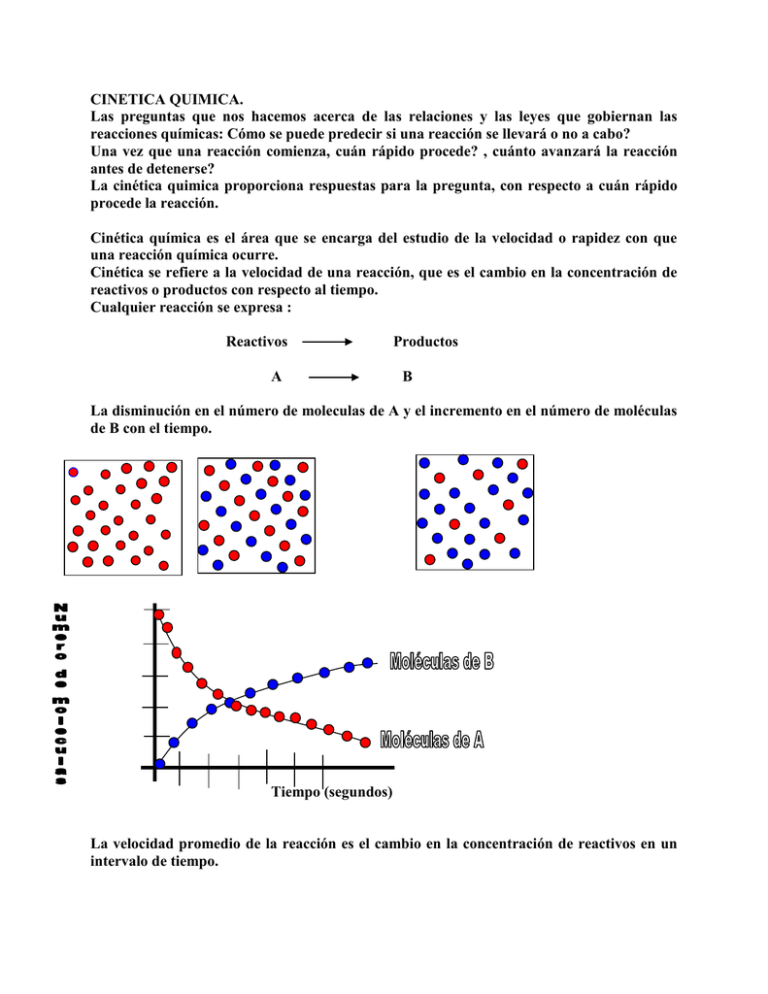
CINETICA QUIMICA. Las preguntas que nos hacemos acerca de las relaciones y las leyes que gobiernan las reacciones químicas: Cómo se puede predecir si una reacción se llevará o no a cabo? Una vez que una reacción comienza, cuán rápido procede? , cuánto avanzará la reacción antes de detenerse? La cinética quimica proporciona respuestas para la pregunta, con respecto a cuán rápido procede la reacción. Cinética química es el área que se encarga del estudio de la velocidad o rapidez con que una reacción química ocurre. Cinética se refiere a la velocidad de una reacción, que es el cambio en la concentración de reactivos o productos con respecto al tiempo. Cualquier reacción se expresa : Reactivos A Productos B La disminución en el número de moleculas de A y el incremento en el número de moléculas de B con el tiempo. Tiempo (segundos) La velocidad promedio de la reacción es el cambio en la concentración de reactivos en un intervalo de tiempo. velocidad prom edio Br2 final Br2 inicial t final t inicial Br2 t VELOCIDADES DE REACCIÓN Y ESTEQUIOMETRÍA Para reacciones estequiométricas simples, tales como A B, se puede expresar la velocidad en términos del cambio en la concentración del reactivo o del producto: velocidad A t O velocidad B t la velocidad de formación del producto no requiere el signo negativo porque es una cantidad positiva. Para: velocidad 2A B 1 A 2 t O velocidad B t En general, para la reacción: aA + bB cC + dD La velocidad esta dada: velocidad 1 A 1 B 1 C 1 D a t b t c t d t Ejemplos: Escribir las expresiones de velocidad para las siguientes reacciones en términos de la desaparición de los reactivos y de la aparición de los productos: a) I-1(ac) +OCl-1(ac) velocidad Cl-1(ac) + OI-1(ac) I 1 OCl 1 Cl 1 OI 1 t t t t b) 3O2(g) velocidad 2O3(g) 1 O2 1 O3 3 t 2 t c) 4NH3 (g) + velocidad 5O2(g) 4NO (g) + 6H2O(g) 1 NH 3 1 O2 1 NO 1 H 2 O 4 t 5 t 4 t 6 t LEYES DE LA VELOCIDAD Para muchas reacciones es posible expresar la velocidad de una reacción mediante una ecuación matemática conocida como la ley de la velocidad o Ecuación de la velocidad. aA +bB + …. -------- gG + hH + ….. donde a, b,…. Son los coeficientes en la ecuación balanceada. La velocidad de la reacción puede ser expreseada así: Velocidad = K[A]m[B]n…… En esta expresión los símbolos: [A], [B],…..representan las concentración molar. Los exponentes m,n,…. Son generalmente numeros enteros y en algunos casos pueden ser números fraccionarios o negativos. Es bueno informar que no hay ninguna relación entre los exponentes m,n,…. Y los coeficientes correspondientes a, b,…. en la ecuación balanceada. Los exponentes en la ecuación de rapidez se llaman orden de reacción Ej. Si m = 1 se dice que la reacción es de primer orden en A. Si n = 2 la reacción es de segundo orden en B. El total de los exponentes m + n +….. es el orden total de la reacción o orden global. K es la constante de rapidez. Y es una constante de proporcionalidad que es caracteristica de una reacción en particular y que significativamente depende de la temperatura. Ejemplo: Para la reacción: F2 (g) + 2ClO2 (g) 2FClO2 (g) velocidad k F2 ClO2 La ley de la velocidad es: El orden de reacción es: velocidad kF2 ClO2 La suma de los exponentes a los que se elevan todas las concentraciones de reactivos que x y aparecen en la ley de velocidad es lo que se llama orden de reacción. X = 1 y Y = 1 el orden global es 1 + 1 = 2 El orden de reacción siempre se define en términos de concentraciones de reactivos (no de productos). La velocidad de una reacción es usualmente expresada en la unidades de mol es por litros por unidad de tiempo. Ej: Mol L-1 s-1 Mol L-1 min-1 La unidad de K depende del orden de la reacción. DEPENDENCIA DE LA VELOCIDAD RESPECTO A LAS CONCENTRACIONES DE LOS REACTIVOS. 1.) Suponiendo que para cierta reacción X = 1 y Y = 2 La ley de la velocidad para la reacción es: Velocidad = K[A][B]2 Suponiendo que inicialmente [A] = 1.0 M y [B] = 1.0 M Si se duplica la concentración de [A] desde inicialmente [A] = 1.0 M hasta inicialmente [A] = 2.0 M manteniendo [B] constante, tambien se duplica la velocidad Para [A] = 1.0 M Para [A] = 2.0 M velocidad1= k(1.0M)(1.0M)2=k(1.0M3) velocidad2=k(2.0M)(1.0M)2=k(2.0M3) VELOCIDAD2 = 2(VELOCIDAD1) 2.) Si se duplica la concencentración de B desde 1.0 M hasta 2.0 M manteniendo [A] constante, la velocidad en cuanto se incrementará? Para [B] = 1.0 M Para [B] = 2.0 M velocidad1= k(1.0M)(1.0M)2=k(1.0M3) velocidad2=k(1.0M)(2.0M)2=k(4.0M3) VELOCIDAD2 = 4(VELOCIDAD1) NOTA: Para cierta reacción, X = 0 y Y = 1 a) Escribir la ley de la velocidad b) El orden de la reacción con respecto a A c) El orden con respecto a B c) Orden global. La velocidad de la reacción es independiente de la concentración de A. DETERMINACION EXPERIMENTAL DE LA LEY DE VELOCIDAD Puntos para determinar la ley de la velocidad: 1. Para reacciones en disolución, la concentración de ciertas especies puede ser seguida por metodos espectrofotometricos. 2. Si existen iones involucrados, el cambio en la concentracion tambien puede ser monitoreado por medidas de conductancia electrica. 3. Las reacciones que involucran gases se siguen de forma conveniente por mediciones de presión. 4. Si una reacción sólo implica un reactivo, la ley de velocidad puede ser determinada con facilidad midiendo la velocidad de la reacción como función de la concentración del reactivo. 5. Si la reacción que requiere más de un reactivo, se puede encontrar la ley de velocidad midiendo la dependencia de la velocidad de reacción respecto a la concentración de cada reactivo, independientemente. Se fijan las concentraciones de todos los reactivos exceptuando uno y se registra la velocidad de la reaccion como una función de la concentración de ese reactivo. Cualquier cambio en la velocidad debe ser debido a cambios en esa sustancia. Ejemplo # 1. Se ha observado la velocidad de la reacción: A + 2B C a 25 grados Celsius. Determine la ley de la velocidad para la reacción y su constante de velocidad, a partir de los siguientes datos: Experimento Inicial Inicial [A] (M) [B] (M) 1 0.100 0.100 2 0.200 0.100 3 0.400 0.100 4 0.100 0.300 5 0.100 0.600 x y Ley de la velocidad: Velocidad = K[A] [B] Velocidad inicial (M/s) 0.550 x 10-5 2.20 x 10-5 8.80 x 10-5 1.65 x 10-5 3.30 x 10-5 En los experimentos 1 y 2 se ve que cuando se duplica la concentración de A, a [B] es constante, y la velocidad se incrementa cuatro veces. Entonces la reacción es de segundo orden con respecto a B. En los experimentos 4 y 5 indican que al duplicar a [B] la concentración de [A] es constante, la velocidad se duplica; la reacción es de primer orden respecto a B. velocidad1 5.50 x 106 M / s 1 velocidad2 2.20 x 105 M / s 4 expresamos la razon de las velocidades en términos de la ley de velocidad: x velocidad1 1 k (0.100 M ) x (0.100 M ) y 0.100M 1 velocidad2 4 k (0.200 M ) x (0.100 M ) y 0.200M 2 x entonces x = 2 y la reaccion es de segundo orden respecto a A haciendo lo mismo con los datos del 4 y 5 velocidad4 1.65 x 105 M / s 1 velocidad5 3.30 x 105 M / s 2 y la ley de la velocidad: y velocidad4 1 k (0.100 M ) x (0.300 M ) y 0.300M 1 x y velocidad5 2 k (0.100 M ) (0.600 M ) 0.600M 2 y y = 1 la reacción es de primer orden respecto a B. y el orden global es 2 + 1 = 3 y la ley de la velocidad es: velocidad = k[A]2[B] La constante de velocidad puede calcularse: K= k velocidad4 [ A] 2 [ B] 5.50 x 106 M / s 5.50 x 103 / M 2 s 2 (0.100M ) (0.100M ) METODO DE LA VELOCIDAD INICIAL Este simple método de establecer los exponentes en una ecuación de velocidad envuelve medidas de la velocidad inicial de una reacción para diferentes set de concentraciones iniciales. Este método es aplicado para la siguiente reacción: S2O82- (aq) + 3I- (aq) ------ 2SO42- (aq) + I3-(aq) Ej. Los datos de la tabla siguiente fueron obtenidos de tres reacciones que incluyeron S2O82- y I-. Use los datos para establecer el orden de la reacción con respecto a I-, y el orden total de la reacción. Data experimental para la reacción : S2O82- + 3I- ------ 2SO42- + I3Experim Concentración inicial, M Veloc de reacción inicial, ento mol S2O82- Mol L-1 s-1 Exper. 1 2 3 [S2O82-] 0.038 0.076 0.076 [I-] 0.060 0.060 0.030 R1 = 1.4 X 10-5 R2 = 2.8 X 10-5 R3 = 1.4 X 10-5 La velocidad de la reacción es: Velocidad = K[S2O82-]m[I-]n Mirando la gráfica, vamos a determinar los valores de m y n. En los experimentos 1 y 2 , la concentración de iones I [I-] se mantiene constante y la concentración de iones [S2O82-] aumenta por un factor de 2 desde el valor 0.038 hasta el valor 0.076 M. Note que representamos 0.076 como 2 X 0.038. La velocidad de la reacción aumenta tambien por un factor de 2. En esta observación se requiere que m = 1. R2 = K (0.076)m (0.060)n = k(2 X 0.038)m (0.060) n = k(2)m( 0.038)m (0.060) n R2 = k(2)m( 0.038)m (0.060) n = 2.8 X 10-5 Mol L-1 s-1 R1 = k(0.038)m (0.060) n = 1.4 X 10-5 Mol L-1 s-1 2.8 X 105 R2 k (2) m (0.038) m (0.060) n m 2 2 R1 k (0.038) m (0.060) n 1.4 X 105 si 2m = 2, entonces m = 1 y la reacción es de primer orden para S2O82la data de los experimentos 2 y 3 se usan para establecer que n = 1 tembién. R2 = K (0.076)m (0.060)n = K (0.076)m (2 X 0.030)n = K (0.076)m (2)n (0.030)n = 2.8 X 10-5 Mol L-1 s-1 R3 = K (0.076)m (0.030)n = 1.4 X 10-5 Mol L-1 s-1 2.8 X 105 R2 k (0.038) m (0.030) n m 2 2 R3 k (0.076) m (0.030) n 1.4 X 105 Si si 2n = 2, entonces n = 1 y la reacción es de primer orden para IEl orden total de la reacción es m + n = 1 + 1 = 2 es de segundo orden Segunda parte: determinar: Como ya sabemos el exponente de las sustancias iónicas podemos a) la constante K usando los resultados del problema anterior. [S2O82-] = 0.050 M y [I-] = 0.025 M solución: m=n=1 Velocidad = K[S2O82-]m[I-]n R1 = K[S2O82-]m[I-]n ; R1 = k(0.038)m (0.060) n = 1.4 X 10-5 Mol L-1 s-1 1.4 x 105 mol L1 s 1 K 6.1 X 103 L mol1 s 1 2 [S 2 O8 ][I ] 0.038 mol/ L x 0.060 mol/ L R1 b) La velocidad inicial de desaparición de los iónes S2O82- en la reacción en donde las concentraciones iniciales son: Velocidad = K[S2O82-]m[I-]n m=n=1 velocidad = k[S2O82-] [I-] = 6.1 X 10-3 L mol-1 s-1 (0.050 mol/L)(0.025 mol/L) = velocidad = 7.6 X 10-6 Mol L-1 s-1 Ejercicio de practica 1. Cuál es la velocidad inicial de reacción expresada en la reacción: S2O82- + 3I- ------ 2SO42- + I3Si las concentraciones iniciales son : [S2O82-] = 0.15 M y [I-] = 0.010 M 2. La velocidad de la reacción: 2 HgCl2 + C2O42- ----- 2 Cl- + 2CO2 (g) + Hg2Cl2 (s) es la siguiente calculando el numero de moles del Hg2Cl2 que se precipita por litros de solución por minutos. Data experimental para la reacc. : 2 HgCl2 + C2O42- ----- 2 Cl- + 2CO2 (g) + Hg2Cl2 (s) Experim Concentración inicial, M Veloc de reacción inicial, ento mol Mol L-1 s-1 Exper. 1 2 3 4 a) b) c) [HgCl2], M 0.105 0.105 0.052 0.052 [C2O42-],M 0.15 0.30 0.30 0.15 R1 = 1.8 X 10-5 R2 = 7.1 X 10-5 R3 = 3.5 X 10-5 R4 = 8.9 X 10-6 Por la data , determine el orden de la reacción con respecto a HgCl 2, con respecto a C2O42- y el orden total de la reacción Cuál es el valor de la constante K? Cuál sería la velocidad inicial de la reacción si [HgCl2] = 0.020 M y [C2O42- ] = 0.22 M VELOCIDAD DE LA REACCION BASADO EN LA FORMACION DE PRODUCTOS. Ejemplo: 1. Cuál es la velocidad de formación del SO42En el experimento 1 de la tabla anterior. Solución : de la ecuación notamos que 2 mol de SO42- es producido por cada moles de S2O82consumido. Entonces: No. moles de SO42- L-1 s-1 = 1.4 X 10-5 Mol S2O82- L-1 s-1 X 2 mol SO42-/ 1 mol S2O82- = No. moles de SO42- L-1 s-1 = 2.8 X 10-5 Mol SO42- L-1 s-1 Ejercicio: Para la reacción 2A ---- B + C, la siguiente data fue obtenida para [A] en función del tiempo. Tiempo, min 0 8 24 40 [A], M 0.80 0.60 0.35 0.20 a) Establezca el orden de la reacción b) Cuál es el valor de la constante de velocidad K c) Calcular la velocidad de formación de B a t = 30 min. CATALISIS Un catalizador es una sustancia que aumenta la velocidad de una reacción química sin ser consumida ella misma. a) el catalizador puede reaccionar para formar un intermediario, pero se regenera en un paso subsecuente de la reacción. La siguiente reacción tiene una constante de velocidad K y una energía de activivación Ea A + B ---k------- C + D En la presencia de un catalizador, sin embargo, la constante de velocidad es Kc llamada la constante de velocidad catalítica. A + B ---Kc ------- C+D Ver gráfica en el libro de texto. Catálisis Heterogénea. Los reactivos y el catalizador están en fases distintas. Por lo general el catalizador es un sólido y los reactivos están en fase gaseosa o líquida. Es la más importante de catálisis en procesos industriales por ej. En las síntesis de muchos compuestos químicos claves. Convertidores catalíticos. A altas temperaturas dentro de un motor de automóvil en marcha , los gases de nitrógeno y oxígeno reaccionan para formar óxido nítrico: N2(g) + O2(g) ---------- 2NO (g) Cuando se libera a la atmósfera, el NO se combina rápidamente con el O2 para formar NO2, que es un gas color café oscuro muy venenoso de olor sofocante: 2N0(g) + O2(g) ---------- 2NO2 (g) Este dióxido de nitrógeno y otros gases indeseables emitidos por un automóvil , como el monóxido de carbono (CO) y varios hidrocarburos crudos, hacen de las emisiones de un automóvil una fuente importante de contaminación del aire. La mayoría de los autos se fabrican en la actualidad con convertidores catalíticos. Un convertidor catalítico eficiente tiene dos propósitos: oxida el CO y los hidrocarburos no quemados a CO2 y H2O y reduce al NO y NO2 a N2 y O2. Los gases calientes, producto de la combustión, en los que se ha inyectado aire pasan a través de la primera cámara de un convertidor para acelerar la combustión completa de los hidrocarburos y para disminuir la emisión de CO Catálisis homogénea. Los reactivos, productos y catalizadores están todos dispersos en una sola fase, generalmente líquida. Los catalizadores ácidos y básicos son los tipos más importantes de catalizadores homogéneos en disolución acuosa. Catálisis enzimática De todos los procesos intrincados que se han desarrollado en los organismos vivos, ninguno es tan importante o tan esencial como la catálisis enzimática. Las enzimas son catalizadores biológicos.