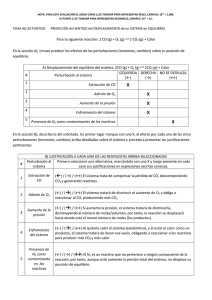
FORMULARIO LIQUIDOS CURVAS DE CALENTAMIENTO: 𝐸𝑛 𝑐𝑎𝑚𝑏𝑖𝑜 𝑑𝑒 𝑇𝑒𝑚𝑝𝑒𝑟𝑎𝑡𝑢𝑟𝑎: 𝑄 = 𝑚𝑐∆𝑇 𝐸𝑛 𝑐𝑎𝑚𝑏𝑖𝑜 𝑑𝑒 𝑓𝑎𝑠𝑒: 𝑄 = 𝑚∆𝐻 Donde: Q= Calor agregado; m= masa; c= calor especifico; ΔT=cambio de temperatura; ΔH=entalpia o calor latente Gráfico: T (°C) vs Q agregado Escala del calor = Q total # de cuadros de la cuadricula DIAGRAMAS DE FASES: Cuatro puntos clave: 1. Punto triple: Temperatura y Presión en la que existen los 3 estados de agregación de una sustancia. 2. Punto de fusión y punto de ebullición: A la misma temperatura 1 atm 3. Punto crítico: Temperatura y Presión en la que el gas no se puede condensar, denominándose fluido supercrítico o vapor sobrecalentando. PRESION DE VAPOR Y TEMPERATURA: ECUACION DE CLAUSIUS CLAPEYRON, POR GRAFICAS Y ADAPTADA Ecuacion de Clausius Clapeyron ∆𝑯𝒗𝒂𝒑 𝟏 ( )+𝑪 𝑹 𝑻 Donde: P vapor= Presión de vapor; R= 8,31 J/mol-K; T= Temperatura en Kelvin; ΔH vap= Calor latente de vaporización Para graficar: Transformar datos: P vapor (no importa las unidades de presión) → ln P vapor (no tiene unidades) T (C) → T (K) → 1/T (1/K) 𝒍𝒏 𝑷𝒗𝒂𝒑𝒐𝒓 = − Luis Vaca - Selvis Rivera 𝒑𝒆𝒏𝒅𝒊𝒆𝒏𝒕𝒆 → 𝒎 = − ∆𝑯𝒗𝒂𝒑 𝑹 Despejamos el ΔH vap Ecuación adaptada: 𝑃2 ∆𝐻𝑣𝑎𝑝 1 1 𝑙𝑛 ( ) = ( − ) 𝑃1 𝑅 𝑇1 𝑇2 SOLIDOS CELDA CUBICA SIMPLE 1/8 de átomo por arista en el cubo → 1 átomo por todas las aristas. Relación radio arista: 𝑎 = 2𝑟 CELDA CUBICA CENTRADA EN EL CUERPO 1/8 de átomo por arista en el cubo → 1 átomo por todas las aristas; 1 átomo central Átomos totales: 2 átomos Relación radio arista: 𝑎 = 4 𝑟 √3 CELDA CUBICA CENTRADA EN LAS CARAS 1/8 de átomo por arista en el cubo → 1 átomo por todas las aristas; ½ átomo por cara en el cubo → 3 átomos por todas las caras. Átomos totales: 4 átomos Relación radio arista: 𝑎 = √8 𝑟 ECUACIONES GENERALES PARA SOLIDOS CRISTALINOS Cuando hay átomos en las aristas ¼ de átomo por arista Volumen de la celda Vcelda= a3 Volumen de los átomos en la celda V átomos= (4/3) π r3 x # átomos totales Factor de empaquetamiento %V= (V átomos/ V celda) x 100 Densidad 𝜌=m celda/ V celda Masa de la celda Calcular por estequiometria a partir del número de átomos totales. DISFRACCION DE RAYOS X: LEY DE BRAGG 𝑛𝜆 = 2𝑑𝑠𝑒𝑛𝜃 Donde: n= orden de la difracción del rayo (es un numero natural) λ= longitud de onda d= distancia entre planos del cristal θ= ángulo de difracción SOLUCIONES Luis Vaca - Selvis Rivera UNIDADES DE CONCENTRACION UNIDAD DE CONCENTRACION MOLARIDAD (M) NUMERADOR DENOMINADOR EXPRESION MATEMATICA Moles de soluto Volumen de solución M n sto. Vsol. Mol L MOLALIDAD (m) Moles de soluto Kilogramo de solvente m Mol Kg NORMALIDAD (N) Equivalentegramo de soluto Litro de solución nsto. Kg svte Eq g ( sto) N Vsol UNIDADES Eq g L N= M×#C masa del soluto Peso molecular soluto Valencia Valencia= #C = # de H en ácidos, # de OH en bases y Producto de cargas en Sales FRACCION MOLAR Moles de un Moles totales de nsto n svte X sto X svte (X) componente todos los nsto svte n( sto svte) (sto. ó svte.) componentes Xsoluto + X solvente = 1 TANTO POR Masa de un Masa total de masasto % sto x100 CIENTO EN MASA componente todos los masasto svte (%) (sto. ó svte.) componentes PARTES POR Masa de un Masa total de masasto ppm x10 6 MILLON componente todos los masasvte (ppm) (sto. ó svte.) componentes Masa de un Volumen de la masasto ppm x10 6 componente solución Volumen stve (sto. ó svte.) Eq − g = Valor matemático menor a 1 Valor matemático menor a 1 UNIDADES DE DILUCION (CUANDO SE PREPARAN MEZCLAS MUY SEMEJANTES A UNA INICIAL) 𝑉1𝐶1 = 𝑉2𝐶2 CONCENTRACION DE UN GAS (LEY DE HENRY) Cg = kPg Dónde: Cg es la solubilidad del gas en la solución (Molaridad) Pg es la presión parcial del gas en la solución k es la constante de la ley de Henry (diferente para cada par soluto-solvente) PROPIEDADES COLIGATIVAS Disminución de la Presión de Vapor o Ley de Raoult PA X A Pº A PA es la presión de vapor de la solución XA es la fracción molar del solvente PºA es la presión de vapor del solvente puro Para medir la variación de presión tenemos Luis Vaca - Selvis Rivera mg. Kg mg. L. Δ𝑃 = 𝑃°𝐴 − 𝑃𝐴 Elevación del Punto de Ebullición Tb k b m Tb es el cambio en la temperatura de ebullición Kb es la constante molal de elevación del punto de ebullición m es la molalidad Para medir el punto de ebullición de la solución tenemos: Δ𝑇𝑏 = 𝑇𝑏 − 𝑇𝑏° Donde: Tb es la temperatura de ebullición de la solución y Tb° es la temperatura de ebullición del solvente puro. Disminución del Punto de Congelación T f k f m Tf es el cambio de la temperatura de congelación kf es la constante molal de la disminución del punto de congelación m es la molalidad Para medir el punto de ebullición de la solución tenemos: Δ𝑇𝑓 = 𝑇𝑓° − 𝑇𝑓 Dónde: Tf es la temperatura de fusión de la solución y Tf° es la temperatura de fusión del solvente puro. Presión osmótica 𝜋 = 𝑀𝑅𝑇 Π es la presión osmótica de la solución M es la Molaridad de la solución R es la constante de gases ideales T es la temperatura en K 1. CINETICA QUIMICA ECUACIÓN GENERAL DE VELOCIDAD: Si tenemos la reacción: 𝑎𝐴 + 𝑏𝐵 → 𝑐𝐶 + 𝑑𝐷 A medida que avanza el tiempo de reacción, los reactivos comienzan a consumirse y los productos aparecen. En cinética química se analiza el concepto de velocidad de reactivos y productos que se definen por: 𝑉=− ∆[𝐴] ∆𝑡 REACTIVOS Luis Vaca - Selvis Rivera 𝑉= ∆[𝐶] ∆𝑡 PRODUCTOS A estas velocidades se denominan velocidades medias porque solo dependen de concentraciones y de instantes para amplios intervalos de tiempo. Al graficar las concentraciones vs el tiempo de la reacción, en los reactivos se tienen curvas con tendencia negativa por que la cantidad de reactivo disminuye con respecto al tiempo, esta curva corresponde a la velocidad de desaparición del reactivo y en instantes determinados podemos hallar velocidades instantáneas tal como muestra la figura. Se toma el punto del tiempo donde queremos hallar esa velocidad y se traza una recta tangente, a partir de ella se saca la pendiente que equivale a la velocidad instantánea. Para hallar las velocidades de la reacción se relaciona la variación de la concentración con respecto al tiempo multiplicado por el inverso del coeficiente estequiométrico. La ecuación general de velocidad de la reacción (en Molar/segundo) viene dada por: 𝑉=− 1 ∆[𝐴] 1 ∆[𝐵] 1 ∆[𝐶] 1 ∆[𝐷] =− = = 𝑎 ∆𝑡 𝑏 ∆𝑡 𝑐 ∆𝑡 𝑑 ∆𝑡 ECUACION DE VELOCIDAD QUE DEPENDE DE LOS REACTIVOS: Si la velocidad de la reacción solo depende de los reactivos, se tiene la siguiente expresión: 𝑉 = 𝑘[𝐴]𝑥 [𝐵] 𝑦 Dónde: k es la constante de velocidad, [A] es la concentración del primer reactivo, [B] es la concentración del segundo reactivo, X y Y son los coeficientes que indica como varia la concentración y la velocidad de la reacción. Para hallar el orden individual se deben tomar dos experimentos donde la concentración de uno de ellos es constante para analizar la variación de velocidad y concentración del otro reactivo. El orden de la reacción se obtiene sumando los coeficientes X y Y. REACCION DE ORDEN 0, 1 Y 2 Al relacionar las concentraciones de los reactivos y el tiempo de avance de la reacción se pueden obtener varias ecuaciones útiles para el cálculo de la constante de velocidad de reacciones con orden definido. El tiempo de vida media se define como el tiempo que debe transcurrir para que se acabe la mitad del reactivo. Aquí se tiene una tabla resumen de las reacciones ORDEN DE LA REACCION UNIDADES DE K ECUACION DE LA CONSTATE K TIEMPO DE VIDA MEDIA 0 M/s [A]=-kt+[Ao] t1/2=[Ao]/2k 1 1/s ln[A]=-kt+ln[Ao] t1/2=ln 2/k 2 1/M.s 1/[A]=kt+1/[Ao] t1/2=1/k[Ao] Luis Vaca - Selvis Rivera GRAFICAMENTE: ORDEN 1 ORDEN 2 Pendiente: -k Pendiente: k ENERGIA DE ACTIVACION (Ea): Es la energía que se necesitan los reactivos para convertirse en productos. Se mide desde donde inicia la reacción hasta la cumbre de la loma que se llama complejo activado. Si tenemos una reacción endotérmica la energía de activación es más grande porque necesitamos agregar mucho calor (energía) para iniciar la reacción, por eso es más lenta. Si tenemos una reacción exotérmica la energía de activación es mucho menor porque los reactivos no necesitan tanta energía para iniciar la reacción, es más rápida. Reacción endotérmica Reacción exotérmica Catalizador: Es una sustancia que acelera la reacción disminuyendo la energía de activación sin formar productos al final de la reacción. Luis Vaca - Selvis Rivera ECUACION DE ARRHENIUS: Al relacionar las constantes de velocidad con sus respectivas temperaturas se define la ecuación de Arrhenius. k Ae Ea ln k Ea RT RT ln A Al graficar ln K (de las constantes) vs 1/T (1/K), se obtiene una relación lineal con pendiente negativa a partir de la cual se obtiene la energía de activación. Para dos constantes y dos temperaturas: 𝒍𝒏 ( 𝒌𝟏 𝑬𝒂 𝟏 𝟏 )= ( − ) 𝒌𝟐 𝑹 𝑻𝟐 𝑻𝟏 Dónde: k1 y k2 son las constantes de velocidad para la reacción, Ea es la energía de activación en J/mol, R es la constante de gases 8,31 J/mol-K y T1 – T2 son las temperaturas en kelvin. 2. EQUILIBRIO QUIMICO CONSTANTES DE EQULIBRIO Se tiene la reacción en equilibrio: 𝒂𝑨 + 𝒃𝑩 ↔ 𝒄𝑪 + 𝒅𝑫 Las velocidades de reacción entre reactivos y productos se mantienen constantes mediante una relación matemática llamada constante de equilibrio, la cual relaciona las concentraciones de productos sobre reactivos elevados cada uno a su coeficiente estequiométrico. [𝑪]𝒄 [𝑫]𝒅 𝑲𝒄 = [𝑨]𝒂 [𝑩]𝒃 Luis Vaca - Selvis Rivera También podemos expresar las concentraciones de reactivos y productos como presiones parciales. [𝑷𝑪]𝒄 [𝑷𝑫]𝒅 𝑲𝒑 = [𝑷𝑨]𝒂 [𝑷𝑩]𝒃 Constante de equilibrio (Kp) en término de presiones parciales En las reacciones en que intervengan gases es más sencillo medir presiones parciales que concentraciones. Así en una reacción tipo: a A + b B c C + d D, se observa la constancia de Kp viene definida por: KP pCc pDd pAa pDd En la reacción: 2 SO2(g) + O2(g) 2 SO3(g) KP p(SO3 )2 p(SO2 )2 p(O2 ) De la ecuación general de los gases: p V n R T se obtiene: [SO3 ]2 (RT )2 n KC (RT )1 p R T Molaridad R T KP 2 2 [SO2 ] (RT ) [O2 ] (RT ) V Vemos, pues, que KP puede depender de la temperatura siempre que haya un cambio en el nº de moles de gases pCc pDd [C ]c (RT )c [D]d (RT )d KP a KC (RT )n d a a b b pA pD [ A] (RT ) [B] (RT ) Donde Δn = incremento en nº de moles de gases (nproductos – nreactivos) Tener en cuenta que solo se consideran los compuestos acuosos o gaseosos que tienen concentración, a los sólidos y líquidos no los escribe en la fórmula de Kc Para relacionar las constantes Kp y Kc se utiliza la ecuación. 𝐾𝑝 = 𝐾𝑐(𝑅𝑇 )∆𝑛 Donde: Kp es la constante de equilibrio para gases Kc es la constante de equilibrio para soluciones R es la constante de gases 0,082 L-atm/mol-k T es la temperatura en kelvin Δn= diferencia del número de moles totales entre productos y reactivos **Conceptos de ácidos y bases de Arrhenius** --Un ácido es una sustancia que, cuando se disuelve en agua, aumenta la concentración de iones H+. ---Una base es una sustancia que, cuando se disuelve en agua, aumenta la concentración de iones OH-. Luis Vaca - Selvis Rivera **Conceptos de Brönsted- Lowry de ácidos y bases. ** --Un ácido; es una sustancia que puede donar un proton y, --Una base; es una sustancia que puede aceptar un protón. En estos términos, la reacción de un ácido con una base, es la transferencia de un proton del ácido a la base; este es e l único tipo de reacción tratada formalmente por esta teoría. Los ácidos y bases pueden ser moléculas o iones **Conceptos de Lewis de ácidos y bases. ** Lewis definió una base; como una sustancia que posee un par de electrones sin compartir, con el cual puede formar un enlace covalente con un átomo, una molécula o un ion, es decir puede ceder electrones. Un ácido es una sustancia que puede formar un enlace covalente aceptando un par de electrones de la bases., es decir incorpora a su estructura electrones. **Auto ionización del agua:** Kw = [H3O+][OH-] = [H+][OH-] = 1.0 x 10-14 (a 25 °C) En una disolución ácida [H+] es mayor que 1.0 x10*-7 M; en una disolución básica [OH-] es menor que 1.0x10*-7 M. **pH: La concentración molar de H+(ac) en una disolución acuosa es por lo general muy pequeña. Por lo tanto, por conveniencia expresaremos [H+] en términos del pH, el cual es el logaritmo negativo de base 10 de [H+].*: pH = -log[H+] **pOH: El logaritmo negativo también es una forma conveniente de expresar las magnitudes de cantidades pequeñas. Utilizamos la convención de que el logaritmo negativo de una cantidad se indica como “p” (cantidad). Entonces, podemos expresar la concentración de OH- como pOH: pOH = -log[OH-] Asimismo, p Kw es igual a –log Kw. Tomando el logaritmo negativo de ambos lados de la ecuación -log[H+] + (-log[OH-]) = -log Kw obtenemos la siguiente expresión útil: pH + pOH = 14.00 **Relación entre Kw, Ka y Kb** Luis Vaca - Selvis Rivera El resultado de multiplicar Ka por Kb es exactamente la constante del producto iónico del agua, Kw. Obtuvimos el equilibrio de autoionización del agua, para el cual la constante de equilibrio es Kw. Esta relación es tan importante que merece atención especial: el producto de la constante de disociación ácida de un ácido por la constante de disociación básica de su base conjugada es igual a la constante del producto iónico del agua. Ka × Kb = Kw Conforme aumenta la fuerza de un ácido (Ka más grande), la fuerza de su base conjugada debe disminuir (Kb más pequeña) de tal forma que el producto Ka ×,Kb sea igual a 1.0×10 -14a 25 °C. COCIENTE DE LA REACCION: Cuando tomamos las concentraciones al inicio de la reacción estamos hablando del cociente de la reacción. 𝑄𝑐 = [𝐶𝑜]𝑐 [𝐷𝑜]𝑑 [𝐴𝑜]𝑎 [𝐵𝑜]𝑏 Si Qc<Kc entonces el equilibrio se desplaza hacia la derecha (Hay mas reactivos que productos) Si Qc=Kc entonces el sistema esta equilibrado Si Qc>Kc entonces el equilibrio se desplaza hacia la izquierda (Hay mas producto que reactivos) CALCULO DE K A PARTIR DE CONCENTRACIONES INICIALES Y EN EL EQUILIBRIO: Sea la reacción en el equilibrio 𝑎𝐴 + 𝑏𝐵 ↔ 𝑐𝐶 + 𝑑𝐷 Suponga que al inicio de la reacción le dan las concentraciones iníciales solo de los reactivos porque aun no se han formado productos: 𝐴𝑜 𝑦 𝐵𝑜 Para llegar al equilibrio se necesita que los reactivos comiencen a transformarse en los productos hasta que en un determinado instante ya no hay más cambios o variaciones en la concentración. Aquí se tienen tres momentos de la reacción y al final para llegar al equilibrio se necesitan sumar las concentraciones del inicio y del cambio. A INICIO Ao CAMBIO -ax EQUILIBRIO Ao - ax B Bo -bx Bo - bx C 0 +cx cx D 0 +dx dx Recuerde que si nos piden hallar la K de equilibrio se lo hace con las concentraciones en el equilibrio donde generalmente nos dan datos iníciales y un dato en el equilibrio para despejar el valor de x. Cuando nos dan valores de K y concentraciones iníciales, con la expresión de K podemos hallar el valor de x y determinar concentraciones en el equilibrio. Luis Vaca - Selvis Rivera ANALISIS GRAFICO DE CONCENTRACIONES EN EL EQUILIBRIO: Siempre los reactivos tienden a disminuir su concentración con respecto al tiempo y los productos a aumentarla, aunque en el equilibrio se altere la concentración de algún componente, estos tendrán las mismas tendencias para restablecer su equilibrio dependiendo de la estequiometria de la reacción. Ejemplo: N2 + 3H2 ↔ 2NH3 Cuando se adiciona más H2 el equilibrio desaparece alterando la reacción, para regresar al estado normal los reactivos disminuyen un poco su concentración y los productos aumentan ciertamente la cantidad que poseen. PRINCIPIO DE LE-CHATELIER Cuando un sistema en equilibrio es perturbado o alterado siempre trata de restablecer el equilibrio, para contrarrestar esa perturbación. Cambios de concentración: + reactivos: → equilibrio hacia la derecha - reactivos: ← equilibrio hacia la izquierda - producto: → equilibrio hacia la derecha + producto: ← equilibrio hacia la izquierda Cambios de temperatura: REACCIONES ENDOTERMICAS ΔH >0 R + CALOR → P + Calor = + reactivos: → equilibrio hacia la derecha - Calor = - reactivos: ← equilibrio hacia la izquierda REACCIONES EXOTERMICAS ΔH <0 R → CALOR + P + Calor = + producto: ← equilibrio hacia la izquierda - Calor = - producto: → equilibrio hacia la derecha Cambios de presión y volumen: PV = nRT + Presión, - Volumen: El equilibrio se desplaza hacia donde hay menos cantidad de moles totales, es decir donde las moles son menores (entre reactivos y productos totales) Luis Vaca - Selvis Rivera - Presión, +Volumen: El equilibrio se desplaza hacia donde hay mas cantidad de moles totales, es decir donde las moles son menores (entre reactivos y productos totales) Tips: --Si en un ejercicio nos dicen tiene el 20% en peso quiere decir: 20% en un 100% equivale a 20 g en la solución. Y lo demás será del solvente (disolvente) ---En la mayoría de los casos si no nos dan el disolvente de una solución se asume que este es el agua. --- La densidad de la solución= 𝑚𝑎𝑠𝑎 𝑑𝑒𝑙𝑎 𝑠𝑜𝑙𝑢𝑐𝑖𝑜𝑛 𝑚𝑎𝑠𝑎 𝑑𝑒𝑙 𝑠𝑜𝑙𝑢𝑡𝑜+𝑚𝑎𝑠𝑎 𝑑𝑒𝑙 𝑠𝑜𝑙𝑣𝑒𝑛𝑡𝑒 = 𝑣𝑜𝑙𝑢𝑚𝑒𝑛 𝑑𝑒𝑙 𝑠𝑜𝑙𝑢𝑡𝑜+𝑣𝑜𝑙𝑢𝑚𝑒𝑛 𝑑𝑒 𝑠𝑜𝑙𝑣𝑒𝑛𝑡𝑒 𝑣𝑜𝑙𝑢𝑚𝑒𝑛 𝑑𝑒 𝑙𝑎 𝑠𝑜𝑙𝑢𝑐𝑖𝑜𝑛 ---En la elevación del punto ebulloscopio: Tb > T°b. ---En la disminución del punto de congelación: Tf<T°f ---En la ley de Henrry Cg=kPg la solubilidad de una gas es proporcional a la presión. ---Los factores que influyen en la velocidad de reacción son: --concentración, --uso de catalizadores, --temperatura, --tamaño de la partícula --presion, --- La velocidad de reacción directa es igual a la velocidad de reacción inversa. --Si Q= Kc Q>Kc Q<Kc Equilibrio Reacción inversa Reacción directa ---Si una sustancia se presenta en un estado líquido o solido en un reacción no se la tomara en cuenta al momento de realizar la ecuación de equilibrio, solo se tomaran en cuenta las sustancias en estado gaseoso o acuoso. ---Si hay perturbación al aumentar la presión. El sistema se dirigirá su equilibrio donde tengamos menor cantidad de moles gaseosas. ---- acido + base sal neutra + agua ---acido + algo base conjugada + otra cosa --- base + algo acido conjugado + otra cosa ---Si los ácidos o bases son fuertes la reacción será irreversible. ---Porcentaje de ionización o disociación = i= 𝑐𝑜𝑛𝑐𝑒𝑛𝑡𝑟𝑎𝑐𝑖𝑜𝑛 𝑒𝑛 𝑒𝑞𝑢𝑖𝑙𝑖𝑏𝑟𝑖𝑜 (𝑋) x100 𝑐𝑜𝑛𝑐𝑒𝑛𝑡𝑟𝑎𝑐𝑖𝑜𝑛 𝑖𝑛𝑖𝑐𝑖𝑎𝑙 (𝐶𝑜) ---Si hay constante de equilibrio de ley el ácido o base es débil. Luis Vaca - Selvis Rivera --- La acides de una solución se caracteriza por la presencia de iones hidrogeno [H+] asi mismo para las bases con la presencia de oxidrilos [OH-]. --- En los ácidos débiles hay más H y las bases fuertes hay elementos alcalinos. ---Entre más fuerte es el ácido más débil será la base conjugada, entre más fuerte es la base, más débil será el ácido conjugado. ---En una ecuación el medio será acido, básico o neutro si, en los reactivos hay un ácido o base fuerte, será 1 de los 2, por otro lado si tenemos en los reactivos una sal neutra, el tipo de medio se determinara observando los productos, cuando estos sean débiles, es decir si la base es débil el medio será básico, si el ácido es débil el medio será acido. Lo contrario a lo enunciado con respecto a los reactivos. Luis Vaca - Selvis Rivera