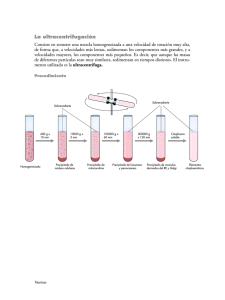
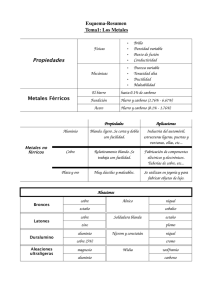
DISCUSION DE RESULTADOS ENSAYO N° 1: Propiedades reductoras del cobre. a) Empleando HNO3 diluido y concentrado Primer tubo (HNO3 diluido): El ácido nítrico diluido no reacciona con el cobre. Resultado esperado: no se observa efervescencia ni una posible liberación de gas marrón (NO₂). Segundo tubo (HNO3 concentrado): El ácido nítrico concentrado es un oxidante aún más fuerte, reacciona de manera violenta, y con mayor rapidez y vigor. Se liberará dióxido de nitrógeno (NO₂) en mayores cantidades, que es un gas de color marrón rojizo y bastante tóxico. Reacción química esperada: Cu(s) + 4HNO3(concentrado) → Cu(NO3)2(aq) + 2NO2(g) + 2H2O(l) Resultado esperado: Se observará efervescencia vigorosa, emisión de gas marrón rojizo (NO₂) y cambio en el color de la solución. b) Empleando H2SO4 diluido y concentrado Primer tubo (H2SO4 diluido): El ácido sulfúrico diluido no es lo suficientemente fuerte para oxidar el cobre, por lo que no se espera una reacción observable. Resultado esperado: No habrá cambios visibles, ni efervescencia ni producción de gas. Segundo tubo (H2SO4 concentrado): En este caso, el ácido sulfúrico concentrado puede reaccionar con el cobre cuando está caliente, ya que actúa como un agente oxidante fuerte. La reacción puede producir dióxido de azufre (SO₂), que es un gas tóxico con olor a azufre. Reacción química esperada: Cu(s) + 2H2SO4(l) → CuSO4(aq) + SO2(g) + 2H2O(l) Resultado esperado: Se observará efervescencia y la emisión de un gas (SO₂), lo que indicará una reacción. c) Adición de hcl diluido y concentrado Primer tubo (HCl diluido) El cobre es un metal bastante resistente al ataque del ácido clorhídrico diluido (HCl), por lo que no se observará una reacción visible. El HCl diluido no es lo suficientemente fuerte para oxidar al cobre y convertirlo en iones, por lo que el cobre permanece sin reaccionar. Resultado esperado: No habrá cambios visibles, ni efervescencia ni cambio de color. Segundo tubo (HCl concentrado): El HCl concentrado tampoco puede oxidar al cobre en condiciones normales. Esto es porque el cobre no reacciona directamente con el HCl a menos que haya un agente oxidante presente. En este caso, tampoco debería ocurrir una reacción visible entre el cobre y el HCl concentrado. Resultado esperado: No habrá una reacción visible. ENSAYO N° 2: Reacciones de las sales de cobre y plata a) CuSO₄ con NaOH: Cuando agregas NaOH (hidróxido de sodio) a una solución de CuSO₄ (sulfato de cobre), se forma un precipitado de hidróxido de cobre (Cu(OH)₂), que es de color azul claro. El procedimiento se continúa con el tratamiento de este precipitado bajo diferentes condiciones en tres tubos de ensayo. Reacción general inicial: CuSO4(aq) + 2NaOH(aq) → Cu(OH)2(s) + Na2SO4(aq) El Cu(OH)₂ es un precipitado azul insoluble. Primer tubo: Agregar HCl diluido: Cuando se añade HCl diluido al precipitado de Cu(OH)₂, este se disuelve debido a la formación de Cu²⁺ y agua, al reaccionar el H⁺ del HCl con los grupos hidroxilo (OH⁻) del Cu(OH)₂. El HCl protona los iones OH⁻, transformando el precipitado insoluble en una solución transparente. Reacción esperada: Cu(OH)2(s) + 2HCl(aq) → CuCl2(aq) + 2H2O(l) Se observará la disolución del precipitado azul, y la solución se volverá clara o ligeramente verdosa debido a la formación de CuCl₂. Segundo tubo: Exceso de NaOH: Si se agrega un exceso de NaOH, el Cu(OH)₂ inicialmente no se disolverá, ya que el hidróxido de cobre no es anfótero, lo que significa que no se disuelve en una base fuerte. Por lo tanto, el exceso de NaOH no afectará significativamente al precipitado. Resultado esperado: El precipitado azul de Cu(OH)₂ se mantendrá sin cambios, ya que no reacciona con el exceso de NaOH. Tercer tubo: Calentamiento: Al someter el precipitado de Cu(OH)₂ a calentamiento, este se descompone térmicamente para formar óxido de cobre(II) (CuO), que es de color negro. El calor elimina el agua del Cu(OH)₂, formando el óxido. Reacción esperada: Cu(OH)2(s) → CuO(s) + H2O(g) El precipitado azul claro de Cu(OH)₂ se transformará en un precipitado negro de CuO (óxido de cobre). a) AgNO₃ con NaOH Cuando se emplea AgNO₃ (nitrato de plata), la adición de NaOH provoca la formación de un precipitado de Ag₂O (óxido de plata), ya que el hidróxido de plata (AgOH) es inestable y se descompone rápidamente en óxido de plata y agua. Reacción general inicial: 2AgNO3(aq) + 2NaOH(aq) → Ag2O(s) + 2NaNO3(aq) + H2O(l) El Ag₂O es un precipitado de color marrón oscuro o negro. Primer tubo: Agregar HCl diluido: Cuando se añade HCl diluido al precipitado de Ag₂O, ocurre una reacción que forma un precipitado blanco de AgCl (cloruro de plata), insoluble en agua, pero que se disolvería en amoníaco. Reacción esperada: Ag2O(s) + 2HCl(aq) → 2AgCl(s) + H2O(l) Se observa la transformación del precipitado marrón oscuro o negro de Ag₂O en un precipitado blanco de AgCl. Segundo tubo: Exceso de NaOH: El óxido de plata (Ag₂O) no reacciona con el exceso de NaOH, ya que no es anfótero. Por lo tanto, el precipitado marrón oscuro o negro se mantendrá. Resultado esperado: No habrá ningún cambio, el precipitado de Ag₂O permanecerá. Tercer tubo: Calentamiento: Al calentar el Ag₂O, no se produce un cambio, ya que es estable a temperaturas moderadas. Sin embargo, a temperaturas muy altas, el Ag₂O puede descomponerse para formar plata metálica (Ag) y oxígeno (O Resultado esperado: No habrá un cambio visible bajo calentamiento moderado. El precipitado negro de Ag₂O se mantendrá. ENSAYO N° 3: Hidrolisis de las sales de cobre y plata a) Solución de CuSO₄: La solución de CuSO₄ se muestra de color amarillo al agregar el azul de bromotimol, indicando que la solución es ácida. Esto ocurre porque el ion Cu²⁺ tiende a hidrolizarse, liberando protones (H⁺) en solución, lo que disminuye el pH. Reacción de la hidrólisis de Cu²⁺: Cu2 + 2H2O ⇌ Cu(OH)2(s ) + 2H (aq) Como resultado, la presencia de H⁺ genera un medio ácido. b) Solución de AgNO₃: La solución de AgNO₃ se muestra de un color verde, indicando que el pH es ligeramente básico. En este caso, el ion Ag⁺ no hidroliza de manera significativa en agua, ya que el ion NO₃⁻ es la base conjugada de un ácido fuerte (HNO₃), lo que evita la formación de protones o hidroxilos en solución. ENSAYO N° 4: Acción de un álcali sobre los metales del grupo 12 Adición de NaOH a cada sustancia: El NaOH es una base fuerte que reacciona con los iones metálicos en solución, formando hidróxidos insolubles. Dependiendo del metal, el comportamiento del precipitado puede variar. 1. Zn (zinc): Al añadir NaOH, se forma un precipitado blanco de hidróxido de zinc (Zn(OH)₂). Reacción: Zn(aq) + 2OH(aq) → Zn(OH)2(s) Este es un precipitado blanco, y es ligeramente insoluble en agua. Exceso de NaHO: El hidróxido de zinc (Zn(OH)₂) es anfótero, por lo que se disuelve en exceso de NaOH, formando un complejo soluble. Este comportamiento es característico de metales de transición que pueden actuar como ácidos y bases al reaccionar con hidróxidos. 2. Cd (cadmio): Al añadir NaOH, se forma un precipitado blanco de hidróxido de cadmio (Cd(OH)₂). Reacción: Cd(aq) + 2OH(aq) → Cd(OH)2(s) El Cd(OH)₂ es un precipitado blanco, insoluble en agua. Exceso de NaHO: El hidróxido de cadmio (Cd(OH)₂) no se disuelve en exceso de NaOH, ya que no es anfótero. Esto indica que el Cd²⁺ no tiene una gran capacidad para formar complejos solubles en soluciones fuertemente básicas. Hg (mercurio): Al añadir NaOH, se forma un precipitado amarillo de óxido de mercurio (HgO) en lugar del hidróxido, ya que el Hg(OH)₂ se descompone rápidamente en HgO. Reacción: Hg(aq) + 2OH(aq) → HgO(s) + H2O(l) El HgO es un precipitado amarillo. Exceso de NaOH: El óxido de mercurio (HgO) tampoco es anfótero y, por lo tanto, no se disuelve en exceso de NaOH. El Hg²⁺ tiene una química diferente y tiende a formar óxidos estables en lugar de hidróxidos solubles. CUESTIONARIO 1. ¿Por qué a los elementos del grupo 12 ya no se les considera como metales de transición? Los elementos del grupo 12 tienen una configuración electrónica de d10s2 d10s2. Esto significa que, en su estado elemental y en la mayoría de sus compuestos, la subcapa d está completamente llena, lo que contrasta con los metales de transición, que se caracterizan por tener orbitales d parcialmente llenos. Según la definición de la IUPAC, un metal de transición es aquel cuyo átomo tiene una subcapa d incompleta o que puede formar cationes con una subcapa d incompleta. Dado que los elementos del grupo 12 no cumplen con esta condición, no se les clasifica como metales de transición. 2. ¿En que consiste la copelación? La copelación es un proceso metalúrgico utilizado para refinar metales preciosos como el oro y la plata, separándolos de metales de base como el plomo, cobre, zinc y otros. Este proceso se lleva a cabo a altas temperaturas, típicamente entre 1,000 y 1,200 °C, en un horno especializado, donde las menas o aleaciones se tratan en un recipiente poroso conocido como copela, que permite la absorción de los óxidos formados durante la reacción 3. ¿Cuáles son los metales y no metales? ¿cómo los diferenciaste? Metales: Los metales son elementos que generalmente se encuentran en el lado izquierdo y centro de la tabla periódica. Presentan las siguientes propiedades: Ejemplos de metales: Hierro (Fe), Cobre (Cu), Zinc (Zn), Plata (Ag), Oro (Au), Aluminio (Al), Mercurio (Hg), entre otros. No metales: Los no metales son elementos que se encuentran en el lado derecho de la tabla periódica (excepto el hidrógeno). Tienen características opuestas a los metales: Ejemplos de no metales: Oxígeno (O₂), Nitrógeno (N₂), Carbono (C), Azufre (S), Cloro (Cl₂), Fósforo (P), Hidrógeno (H₂), entre otros. Metales: Los metales son elementos que generalmente se encuentran en el lado izquierdo y centro de la tabla periódica. Presentan las siguientes propiedades: Ejemplos de metales: Hierro (Fe), Cobre (Cu), Zinc (Zn), Plata (Ag), Oro (Au), Aluminio (Al), Mercurio (Hg), entre otros. No metales: Los no metales son elementos que se encuentran en el lado derecho de la tabla periódica (excepto el hidrógeno). Tienen características opuestas a los metales: Ejemplos de no metales: Oxígeno (O₂), Nitrógeno (N₂), Carbono (C), Azufre (S), Cloro (Cl₂), Fósforo (P), Hidrógeno (H₂), entre otros. Diferencia: Las propiedades físicas y químicas de cada elemento determinan si es un metal o un no metal. Característica metales No metales Brillo Tiene brillo No tiene brillo Conductividad Buenos conductores de calor Malos conductores y electricidad Maleabilidad y ductilidad Maleables y dúctiles Quebradizos en estado de solido Estado físico Puntos de fusión y Mayormente solidos Pueden ser solidos líquidos (excepto Hg) o gases Generalmente altos Generalmente bajos Lado izquierdo y centro Lado derecho ebullición Posición en la tabla periódica 4. La tabla moderna actual fue idea por Henry Moseley a partir de la tabla periódica del ruso Dmitri Mendeléyev, en lo cual Moseley modifico la tabla tendría 7 filas y 18 grupos y Werner aporto con la distribución electrónica de los elementos. 5. Describa las propiedades de los metales, no metales y metaloides. Metales: Brillo metálico. Buenos conductores de calor y electricidad. Maleables (se pueden moldear) y dúctiles (se pueden estirar en hilos). Sólidos a temperatura ambiente (excepto el mercurio, que es líquido). Altos puntos de fusión y ebullición. Densidad alta. Tienden a perder electrones en reacciones químicas, formando cationes (iones positivos). No Metales: Opacos o sin brillo metálico. Malos conductores de calor y electricidad. No maleables ni dúctiles; son frágiles en estado sólido. Pueden ser sólidos, líquidos o gases a temperatura ambiente (ej. carbono es sólido, bromo es líquido, oxígeno es gas). Bajos puntos de fusión y ebullición en comparación con los metales. Tienden a ganar electrones, formando aniones (iones negativos). Metaloides: Tienen propiedades intermedias entre metales y no metales. Brillo variable (algunos son brillantes, otros opacos). Semiconductores de electricidad (útiles en la industria electrónica, como el silicio). Moderadamente maleables y frágiles. Pueden actuar como metales o no metales en reacciones químicas. 6. Defina los siguientes compuestos y señale un ejemplo para cada caso: Función química: Es el conjunto de propiedades químicas que caracterizan a un grupo de compuestos con comportamientos similares. Depende de los grupos de átomos (radicales) presentes en la molécula que le confieren esas propiedades específicas. Ejemplo: La función química de los ácidos es liberar iones H⁺ en solución acuosa. Un ejemplo es el ácido clorhídrico (HCl). Estado de oxidación: Es el número que indica la capacidad de un átomo para ganar o perder electrones en una reacción química. Se utiliza para describir cómo se distribuyen los electrones en los compuestos. Ejemplo: El estado de oxidación del hierro (Fe) en Fe₂O₃ es +3. Oxiácido: Es un ácido que contiene oxígeno, hidrógeno y otro elemento (generalmente un no metal). Se forma cuando un óxido ácido se disuelve en agua. Ejemplo: El ácido sulfúrico (H₂SO₄) es un oxiácido, que se obtiene de la reacción del trióxido de azufre (SO₃) con agua. Hidrato: Es un compuesto que contiene moléculas de agua integradas en su estructura cristalina. La cantidad de agua en el hidrato es específica y se denomina "agua de hidratación." Ejemplo: El sulfato de cobre pentahidratado (CuSO₄·5H₂O) es un hidrato que contiene cinco moléculas de agua por cada fórmula de sulfato de cobre. 7. Cuáles son las principales propiedades de los ácidos y de las bases. Acidos Tener un sabor agrio: Ejemplos comunes incluyen el jugo de limón, el vinagre y los refrescos de cola. Cambiar el color del papel tornasol de azul a rojo: Esto se usa como prueba para identificar ácidos. Ser corrosivos y dañinos para la piel y los tejidos biológicos en general. Reaccionar con metales activos para producir hidrógeno gaseoso. Reaccionar con bases para formar sales y agua en un proceso llamado neutralización. Tener la capacidad de conducir electricidad cuando se disuelven en agua: especialmente los ácidos fuertes. Bases Tener un sabor amargo y un tacto resbaloso o jabonoso. Cambiar el color del papel tornasol de rojo a azul. Disolver grasas y dañar la piel y los tejidos biológicos. Reaccionar con ácidos para formar sales y agua en un proceso de neutralización REFERENCIAS Barron, A. (2022). Los Elementos del Grupo 12, Rice University. Revista libretex https://espanol.libretexts.org/Quimica/Qu%C3%ADmica_Inorg%C3%A1nica/Qu%C 3%ADmica_de_los_Elementos_del_Grupo_Principal_%28Barron%29/05:_Grupo_12 /5.01:_Los_Elementos_del_Grupo_12 Daza, J. (2019). Copelacion-02-fundamento-teorico, Universidad Nacional De San Antonio Abad Del Cusco. Revista de studocu.https://www.studocu.com/pe/document/universidad-nacional-de-san-antonioabad-del-cusco/fisica-i/copelacion-02-fundamento-teorico-compress/29925200 Ondarse Álvarez, Dianelys (30 de septiembre de 2021). Metales y No Metales. Enciclopedia Humanidades. Recuperado el 12 de septiembre de 2024 de https://humanidades.com/metales-y-no-metales/. Equipo de Windows to the Universe. Biomasas y Ecosistemas. Boulder, CO: © Asociación Nacional de Maestros de Ciencias de la Tierra, octubre 3, 2010. En línea. Disponible: http://www.windows2universe.org. Ondarse Álvarez, Dianelys (15 de julio de 2021). Ácidos y bases. Enciclopedia Concepto. Recuperado el 1 de septiembre de 2024 de https://concepto.de/acidos-y-bases/.

![Entrega de EPP[40]](http://s2.studylib.es/store/data/008959265_1-486d607bfb54096ba41d995ba0ec8805-300x300.png)