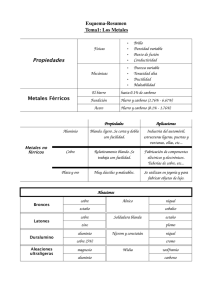
MATERIALES Y PROCESOS MATERIALES Y PROCESOS ALEACIONES NO FERROSAS 1 MATERIALES Y PROCESOS Contenido Introducción a los metales no ferrosos Obtención de metales no ferrosos ¿Por que se utilizan las aleaciones no ferrosas? Conductividad eléctrica y térmica Resistencia especifica Resistencia a alta temperatura Resistencia a la corrosión Bibliografía: Ciencia e Ingeniería de los Materiales, Cuarta edición, International Thomson. Donald R. Askeland, Pradeep P. Phulé. Ciencia e Ingeniería de los Materiales. Tercera edición, Mc Graw Hill. William Smith. 2 MATERIALES Y PROCESOS 3 Tabla periódica de los elementos Metal Metales alcalinos y alcalinotérreos Numero atómico Símbolo Peso atómico Gases nobles No metales Metaloides Metales de transición Lantánidos Actínidos Halógenos MATERIALES Y PROCESOS Abundancia en la corteza terrestre superior, átomos del elemento por cada 106 átomos de Silicio Elementos Elementos formadores de rocas Metales industriales en rojo Metales preciosos en violeta Tierras raras en azul Metales más escasos Número atómico, Z 4 MATERIALES Y PROCESOS 5 Producción mundial de metales World Mineral Production British Geological Survey https://www.lme.com/ ¿Qué es un metal estratégico? Precios actualizados 18/08/2023 2.137← 8.240← 2.300← El acero es la aleación más utilizada: • Bajo costo relativo • Sus propiedades mecánicas (Tensión de fluencia, dureza, elongación, etc.) son muy variables con composición química, la deformación plástica y tratamientos térmicos • Resistencia mecánica 200-2100 MPa • Modulo elástico alto: 200 Gpa • Densidad alta: 7800 kg/m3 • Buenas propiedades tecnológicas: Capacidad para usar métodos de fabricación como la deformación plástica (laminado, forja, etc.), colada de fundición, mecanizado, soldadura y otros. 20.131← 2.150← 25.260← MATERIALES Y PROCESOS Aleaciones no ferrosas Los metales y aleaciones no ferrosas se pueden clasificar por los elementos principales de su composición o por alguna característica común importante. Aleaciones diseñadas para un método de fabricación en particular -Para fabricar piezas por fundición se usa Al aleado con Si y Cu aleado con Sn (Bronce). -El Al aleado con Cu se usa para fabricar piezas que puedan endurecerse por tratamiento térmico. Metales refractarios, temperatura de fusión >2000° C: Mo, W, Nb y Ta. Metales preciosos: Au, Ag, Pt Metales raros (lantanidos), importantes para la industria Aleaciones base Cu, como el Cu puro, Latón (Cu+Zn), Bronce (Cu+Sn), mucha otras más. Aleaciones base Al, con aleantes como Si, Cu, Mg, Mn Zn y otros. Aleaciones livianas, buena resistencia especifica y baja densidad. Aleaciones base Al, Ti y Mg. Metales blancos, aleaciones base Zn, Sn y Pb. Bajo punto de fusión. Superaleaciones, mantienen resistencia a alta temperatura. Basadas principalmente en Ni. 6 MATERIALES Y PROCESOS Obtención de metales Los metales forman parte gran parte de los minerales de la corteza terrestre. Solo el Au, Ag, Pt y Pd se encuentran en estado nativo. El resto forma parte de compuestos como óxidos, sulfuros, hidróxidos, etc. que a su vez forman parte de diferentes minerales en diferentes grados de concentración Se denomina metalurgia extractiva a los procesos que se llevan a cabo para separar selectivamente las especies metálicas de interés de los minerales. Dependiendo de la naturaleza de los metales se utilizan técnicas de pirometalurgia, electrometalurgia e hidrometalurgia. Pirometalurgia: Utiliza calor para extraer y reducir el metal del mineral. Por ejemplo Fe en alto horno, Pb, Cu. Electrometalurgia: Utiliza el paso de una corriente eléctrica (electrolisis) para reducir el metal del mineral. Ejemplo Al, Mg, Na. Hidrometalurgia: Utiliza una solución acuosa para extraer el metal del mineral, para luego filtrarlo y volverlo a recuperar reduciéndolo de la solución Por ejemplo Au. Cu. A previo se utilizan además técnicas de separación y purificación de los minerales. Y finalmente se utilizan técnicas para purificar mas los metales obtenidos. 7 MATERIALES Y PROCESOS 8 Obtención del Cobre Minerales más utilizados para la obtención del cobre son los sulfurados: calcopirita (CuFeS2) y la calcosina (Cu2S). Contienen Fe y otras impurezas, algunas valiosas que también se recuperan como Bi, Au, Ag y Ni. El método más utilizado es la pirometalurgia donde a partir de la fusión de los sulfuros y óxidos se obtiene cobre líquido. • • • Trituración del mineral. Pulverización del mineral en molino de bolas de acero Eliminación de la ganga. El material pulverizado se introduce en un recipiente con agua y se agita para eliminar la ganga (rocas y tierra pulverizada). CuFeS2 concentración, filtrado y secado trituración eliminación de la ganga Cu2S refinado electrolítico tostado, formación de la mata y conversión MATERIALES Y PROCESOS 9 MATERIALES Y PROCESOS 10 MATERIALES Y PROCESOS 11 Obtención del Cobre • • • Tostación parcial. El Fe tiene mayor afinidad por el oxígeno que el Cu. Con la tostación de los minerales con aire a 500° C se oxida el hierro y no el cobre. Se obtiene producto constituido por óxido de hierro, sulfuros de cobre, hierro y ganga. El concentrado se funde en horno calentándolo por encima de los 1100° C junto con el agregado de fundente. Se oxida el resto de Fe y se forman dos capas líquidas inmiscibles. La superior está formada por la escoria (fundente con impurezas) y la inferior, constituida principalmente por sulfuro de cobre (I) que recibe el nombre de mata (30-70% Cu) En convertidor es un horno rotatorio donde se vuelca la mata fundida y se insufla una corriente de aire que oxida al azufre y al hierro. Llega a 1250° C. Se separan los óxidos volátiles y el resto pasa a la escoria que se retira por volcado. Al finalizar se deja solidificar el metal en forma de platos (cobre blíster 90% Cu). 2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2 2 Cu2O + Cu2S → SO2 + 6 Cu • • El refino del cobre bruto. Permite elevar la pureza del cobre hasta un 99.99%. Puede hacerse en horno de reverbero (1150° C en atmosfera oxidante) o electrolíticamente. Los lingotes de cobre se usan como ánodos de una cuba electrolítica que contiene una solución de sulfato de cobre (II) y ácido sulfúrico. Los cátodos son láminas delgadas de cobre puro intercaladas entre los ánodos. Aplicando una tensión adecuada entre electrodos el Cu de los ánodos se disuelve y se deposita en forma pura sobre los cátodos. Los metales menos nobles (Zn, Fe, etc.) se disuelven en la solución. Los metales más nobles (Ag, Au, Pt) no se disuelven, formando barros anódicos en el fondo de la cuba y posteriormente se recuperan. MATERIALES Y PROCESOS 12 Obtención del Cobre Conversión Concentrado de cobre SO2 Concentrado de cobre oxigeno oxigeno escoria mata Refino electrolítico cátodo ánodo barro anódico MATERIALES Y PROCESOS 13 Obtención del Aluminio • • La obtención industrial del aluminio consta de dos fases. La separación de la alúmina (Al2O3) a partir de la bauxita y luego la reducción de la alúmina electrolíticamente El reciclado de Al directamente por fusión de chatarra ahorra el 95% de la energía utilizada en el proceso de obtención a partir del mineral. La alúmina se extrae del mineral bauxita, tratándola a alta temperatura y presión con una disolución de hidróxido de sodio. Se forma así aluminato de sodio soluble, Al(OH)3 + NaOH → NaAlO2 + 2 H2O • Las impurezas existentes en la bauxita, que son insolubles, se pueden separar del aluminato de sodio por filtración. Luego se precipita el hidrato de alúmina y mediante calcinación se convierte en alúmina anhidra digestión separación precipitación calcinación MATERIALES Y PROCESOS 14 Obtención del Aluminio • • • El aluminio se obtiene por electrólisis de la alúmina fundida (Proceso Hall-Héroult 1866). La alúmina se disuelve en criolita fundida (Na3AlF6) y fluoruro de aluminio. La alúmina tiene un punto de fusión de 2070° C, con el agregado de la criolita como fundente se baja a 950° C haciendo practica la electrolisis. La celda electrolítica en la que se lleva a cabo el proceso es de acero y en su interior se encuentran dispuestos unos bloques de carbón que actúan como ánodos. Las celdas se colocan en serie y al circular una corriente ocurre la reacción de reducción del aluminio por electrólisis. 2 Al2O3 + 3 C → 4 Al + 3 CO2 Se deposita el aluminio liquido obtenido de un 99.5 % de pureza, en la parte inferior de la cuba electrolítica ya que tiene mayor densidad que las sales fundidas. salida de gases y particulados conexión a la próxima celda ánodo de grafito 220 kA celda de acero conexión a la celda previa alumina y criolita fundidas aluminio fundido cátodo de grafito sifón de aluminio liquido MATERIALES Y PROCESOS 15 Obtención del Aluminio Aluar Puerto Madryn MATERIALES Y PROCESOS 16 Obtención del Oro Una de las fuentes mas comunes de Oro es como pequeñas partículas de metal en depósitos de Cuarzo o Pirita. Para su extracción se usa el Cianuro, que forma el complejo en solución acuosa Au(CN)2-. El mineral se tritura en pequeñas partículas que se mezclan con la solución acuosa con CN. Esta se filtra y se decanta para luego recuperar el Au del liquido precipitandolo con ayuda Zn en polvo. Trituración y molienda del mineral Pila (3° Inclinación) Regado con solución con CN Solución con Au Membrana plástica para evitar filtraciones Planta de recuperación Estanque MATERIALES Y PROCESOS Obtención del Oro Mina de Oro en Cerro Vanguardia, Santa Cruz 17 MATERIALES Y PROCESOS 18 Obtención del Zinc • Para su obtención, los minerales ricos en Zn que contienen los sulfuros (Blenda) se trituran, se concentran y luego se tuestan para obtener oxido de Zn. 2 ZnS + 3O2 → 2 ZnO + 2 SO2 • Los óxidos se disuelven con ácido sulfúrico diluido, de esa manera el óxido sólido pasa a una solución liquida de sulfato de Zn. 2 ZnO + H2SO4 → ZnSO4 (ac)+ 2 H2O • Las lejías obtenidas se purifican separando las distintas fases presentes. El ZnSO4 se somete posteriormente a electrólisis con ánodo de Pb y cátodo de Al. Sobre el aluminio se deposita el Zn formando capas de algunos milímetros de espesor. Los cátodos obtenidos se funden y se solidifica el metal para su comercialización. MATERIALES Y PROCESOS Obtención del Estaño y del Plomo • El estaño se obtiene reducción pirometalúrgica del mineral casiterita. En horno de reverbero donde a 1.200-1.300° C se reduce mediante carbón de coque a estaño bruto SnO2 + 2 C → 2 CO + Sn • Posteriormente se refina para separarlo de sus impurezas (principalmente, hierro y cobre), obteniéndose finalmente el metal de alta pureza. Debido a su gran consumo por parte de la industria de conservas también se obtiene Sn por recuperación electrolítica de la hojalata. • El plomo se extrae del mineral galena (PbS). Comienza con la trituración, molienda y enriquecimiento. Al polvo se agregan fundentes silícicos y básicos y aplica tostación a una temperatura a 850 °C para convertir el PbS a monóxido de plomo 2 PbS + 3 O2 → 2 PbO + 2 SO2 • La reducción posterior del PbO a plomo metálico se realiza en un alto horno en el que se introduce carbón de coque que actúa como combustible y reductor. El aire insuflado por las toberas convierte el coque en monóxido de carbono, que reduce el óxido de plomo (II) a metal 2 PbO + C → CO2 + 2 Pb • El metal fundido y la escoria caen en el crisol, donde se separan por de densidad. El plomo disuelve muchos metales por lo que el metal obtenido se debe refinar electrolíticamente. 19 MATERIALES Y PROCESOS 20 Resistencia específica cerámicos cerámicos compuestos aceros polímeros aluminio cobre fundición de hierro oro plomo Cerámicos porosos cauchos metales y aleaciones resistencia mecánica (MPa) resistencia mecánica (MPa) aceros aleados magnesio maderas maderas densidad polímeros zinc Cerámicos porosos cauchos espumas livianos acero inoxidable titanio níquel compuestos latón metales y aleaciones espumas pesados livianos densidad pesados Resistencia específica es la relación entre la resistencia a tracción y la densidad. Aunque una aleación tenga una resistencia inferior a la un material más denso, para una determinada masa puede resistir una carga mucho mayor. Es una de las principales ventajas del uso de las aleaciones livianas de base Al, Mg y Ti. densidades en kg/m3 MATERIALES Y PROCESOS 21 acero metales y cerámicos aceros inoxidable aleaciones aleados compuestos zinc temperatura de oxidación temperatura de fusión de Ni, Co y Fe aluminio acero de bajo carbono temperatura máxima de servicio (° C) níquel latón resistencia mecánica (MPa) resistencia mecánica (MPa) Resistencia a alta temperatura cobre magnesio fundición de hierro oro aluminio polímeros plomo cerámicos porosos cauchos maderas espumas temperatura máxima de servicio (° C) Los aceros al carbono están limitados a temperaturas operativas por debajo de 430° C ya que su resistencia mecánica baja significativamente. La exposición de estos durante mucho tiempo a alta temperatura los fragiliza por la transformación del Carbono en Grafito dentro de su microestructura. Además la velocidad de corrosión aumenta significativamente a alta temperatura. El desarrollo de aleaciones con alta resistencia mecánica a temperatura elevadas esta ligada al desarrollo de aviones con motores a reacción y esta actualmente enfocado a aleaciones de base Níquel con una metalurgia compleja que permite mantener una alta resistencia mecánica a temperaturas de servicio elevada. Este grupo de aleaciones se denomina superaleaciones como el Inconel. MATERIALES Y PROCESOS 22 Resistencia a la corrosión Corrosión de aceros al carbono: Sobre la superficie de los aceros al carbono expuestos a la humedad se forma herrumbre de color marrón rojizo, que lo corroe desde su superficie hacia el interior. La herrumbre es una mezcla variable de hidróxidos y óxidos de hierro. la herrumbre tiende a desprenderse exponiendo más al material, dando lugar a una pérdida de sección resistente que puede destruir las estructuras de acero. El acero al carbono debe protegerse de la corrosión. Corrosión en pilares de puente sobre rio Nandu (China). Construido en 1942. Colapso en el año 2000. MATERIALES Y PROCESOS 23 Resistencia a la corrosión Pasivación: Bajo ciertas condiciones, algunos metales exhiben la particularidad de pasivarse debido a que en su superficie crece una película de oxido muy delgada (de unos cuantos nm), que es muy adherente que además tiene la facilidad de autogenerarse (si las condiciones del medio favorecen su formación). Estas características de la capa de oxido termina protegiendo de la corrosión al material. Ejemplos de metales con óxidos pasivantes: Aceros inoxidables, Aluminio, Titanio y Níquel. Acero al carbono Formación de capa de corrosión con desprendimiento El Acero se sigue exponiendo al medio y continua la corrosión Aluminio Formación de capa de oxido (Al2O3) compacto y adhesivo El Aluminio se mantiene protegido del medio por la capa de oxido pasivante MATERIALES Y PROCESOS 24 Resistencia a la corrosión Corrosión en medios agresivos: Algunas aleaciones no ferrosas son particularmente resistentes a la corrosión en medios agresivos como ambientes salinos y marinos, vapores, fluidos ácidos, fluidos en movimiento, temperaturas altas, etc. La resistencia a la corrosión en estas condiciones puede medirse como la perdida de masa anual del material por corrosión. Muchas aleaciones base Cobre aleadas con otros metales como Zinc, Níquel y Aluminio, permiten obtener piezas con elevada resistencia a la corrosión en estas condiciones. Canilla de latón (Cu-Zn) con algo de corrosión Planta desalinizadora de agua en Bahrain. Uso extensivo de tuberías, válvulas y conexiones de aleaciones Cu-Ni MATERIALES Y PROCESOS 25 Conductividad eléctrica Ley de Ohm Resistividad Conductividad Ley de calentamiento de Joule La ley de Ohm establece que la diferencia de potencial que aplicamos entre los extremos de un conductor es directamente proporcional a la intensidad de la corriente que circula por el mismo. Esa proporcionalidad se denomina Resistencia eléctrica La resistencia depende de la resistividad del material y de la geometría. La resistividad es una propiedad intrínseca del material (independiente de la geometría de la pieza). La conductividad es el inverso. El calentamiento resistivo (Calentamiento de Joule) es el fenómeno por el cual cuando por un conductor circula corriente eléctrica, parte de la energía de los electrones se transforma en calor, elevando la temperatura del mismo. Es proporcional a la corriente al cuadrado y a la resistencia del conductor. MATERIALES Y PROCESOS 26 Conductividad eléctrica Ley de Ohm Resistividad Conductividad Ley de calentamiento de Joule La conductividad eléctrica es la capacidad de un material para dejar pasar la corriente eléctrica a través del mismo y transmitir energía. 2 D 2D Si son del mismo material, ¿Cuál conductor tiene mayor resistencia? MATERIALES Y PROCESOS Conductividad eléctrica Cerámicos Vidrios Cerámicos porosos Metales y aleaciones Compuestos Maderas Polímeros Cauchos Espumas poliméricas Buen conductor RESISTIVIDAD (Ω.m) Buen aislante 27 MATERIALES Y PROCESOS Conductividad eléctrica En los metales la conductividad eléctrica varia con las impurezas, la temperatura y la deformación plástica. (10 -8 Ohm-m) Resistividad,r 6 5 4 3 2 1 0 -200 -100 0 T (ºC) Cables de conducción eléctrica aérea de alta tensión de Aluminio Elemento calefactor de 80%Ni, 20%Cr 28 MATERIALES Y PROCESOS 29 IACS % Aleaciones con alto contenido de cobre IACS % Aleaciones de aluminio Electrolítico (ETP) 110 101 1100 (99% Al) 59 Cobre bajo fosforo (DLP) 120 98 1350 (Recocido -0) 62 Cobre alto fosforo (DHP) 122 85 2024 45.5-49 6101 57 6061-T6 43 Aleaciones de Cobre Latón para maquinado 360 26 Latones 25-50 Bronce naval 25-50 Aceros de bajo C, Hierro 10-18 Almirante 25-50 Aceros inoxidables y aleados 2.5-2.9 Bronce al Fósforo 10-20 Aleaciones no ferrosas Bronce al aluminio, 5% 10-20 Níquel 22 Bronce al berilio 10-20 Estaño 15 Cuproníquel, 30% 5-15 Plomo 7 Cobre Plata Níquel 5-15 Zinc 27 Bronce aluminio (más de 5%Al) 5-15 Plata 108 Bronce al Silicio 5-15 Oro 73 Platino 17 Aleaciones soldadura electrónica Aleaciones ferrosas 60% Sn 40% Pb 11.8 80%Ni 20%Cr 1.5 Sin plomo (95.5%Sn 3.8Ag 0.7Cu) 13.2 Grafito 0.1 100% IACS (International Annealed Copper Standard) es equivalente a una conductividad de 58 MS/m a 20° C o una resistividad de 1/58.108 ohm/m para un conductor de 1 mm2 de sección MATERIALES Y PROCESOS 30 Propiedades térmicas Propiedades térmicas importantes de los metales: Coeficiente de expansión térmica lineal (αL) • Representa el cambio en la longitud de una pieza fabricada con el metal cuando cambiamos la temperatura en 1 Kelvin. • Si se restringe esta deformación genera tensiones internas en el material. • Importante para el cálculo de deformaciones térmicas de estructuras y cuando se unen distintos materiales. Aplicaciones en instrumentos de precisión y en bi-metales para termómetros y termostatos. Conductividad térmica • Es la habilidad del metal para transferir calor. • Ecuaciones similares a las de la conductividad eléctrica. • Los metales tienen los valores más altos, entre ellos los mejores son Cobre y sus aleaciones y Aluminio. • Aplicaciones en radiadores e intercambiadores de calor. Cond. térmica Material αL (10-6 K-1) (W/m.K) Allvar -25 Espuma poliuretano 0.03 Invar (Fe-36%Ni) 1.2 Fibra de vidrio 0.04 Titanio 8.6 0.6 Ladrillo Vidrio 8.4 Vidrio 1-2 Acero 11 Acero 52 Cobre 17 Aluminio 210 Aluminio 23 Laton 125 Cobre 401 Material MATERIALES Y PROCESOS 31 Trabajo en clase: Usos de aleaciones no ferrosas ¿Para que se utilizan estas aleaciones? ¿Que propiedades de estas aleaciones son decisivas para la aplicación? 1. Plomo 2. Plomo-Estaño 3. Bismuto 4. Aluminio aleado 6063 5. Aluminio aleado 1100 (99.0 % Al) 6. Cobre puro 7. Zamak 8. Bronce 9. Bronce al Berilio 10. Latón 11. Silicio 12. Recubrimiento de Estaño 13. Recubrimiento de Zinc Uso de muestras en clase