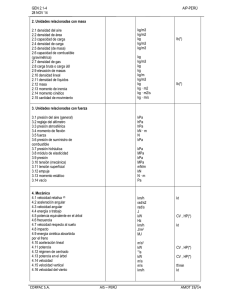
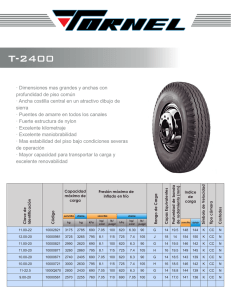
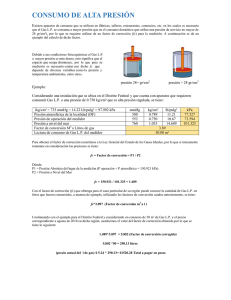
UNIVERSIDAD TECNOLÓGICA DEL VALLE DEL MEZQUITAL Informe II Termodinámica Unidad II PROGRAMA EDUCATIVO MECATRÓNICA TÉCNICO SUPERIOR UNIVERSITARIO EN MECATRÓNICA ÁREA INSTALACIONES ELÉCTRICAS EFICIENTES FACILITADOR: ING. Israel López Mendoza GRADO Y GRUPO: 3 E P R E S E N T A Gary Dair Acosta Martínez Delmy isai Zacarias García Jimmy Donghu Acosta Aldo Uriel Gomez Martinez Vicente Rojo Godinez Periodo escolar: Mayo - agosto 2024 Ixmiquilpan, Hidalgo, a 12 de julio de 2024 Caso práctico taza de agua La presión manométrica de una taza de agua indica 0.545 kpa antes de hervirla, y después de hervirla durante 10 minutos y dejando que vuelva a su densidad normal el agua, se tiene una perdida por lo que nos indica que después de ese transcurso indica 0.392 kpa, en una ubicación donde la presión atmosférica es de 101.3. Suponiendo que el volumen de la taza de agua permanece constante y la temperatura es de 25°c. Determine la temperatura del agua después de hervirla. Esquema del Sistema Termodinámico 1. Estado Inicial: o Presión manométrica antes de hervir: 0.545 kPa o Presión atmosférica local: 101.3 kPa o Temperatura inicial: 25°C 2. Proceso de Ebullición: o Agua hervida durante 10 minutos. o Se deja que el agua vuelva a su densidad normal después de hervirla. 3. Estado Final: o Presión manométrica después de hervir y volver a la densidad normal: 0.392 kPa 4. Determinación de la Temperatura Final: o Utilizando la Ley de Boyle para gases ideales (aproximación debido al cambio de densidad del agua): P1V1=P2V2 o Dado que el volumen de la taza de agua permanece constante, podemos utilizar la relación entre la presión y la temperatura a volumen constante. o La temperatura final del agua se puede determinar considerando la relación de la presión con la temperatura a volumen constante y el cambio de densidad del agua después de hervirla. Resolución del caso practico Para determinar la temperatura del agua después de hervirla, podemos utilizar la ley de los gases ideales. La fórmula de la ley de los gases ideales es: PV=nRT Donde: - P es la presión - V es el volumen - n es el número de moles - R es la constante de los gases ideales - T es la temperatura en Kelvin Dado que el volumen de la taza de agua permanece constante y que la cantidad de gas (vapor de agua) puede cambiar debido al calentamiento y la posterior condensación, nos enfocaremos en las presiones inicial y final para determinar la temperatura del agua después de hervirla. La presión manométrica se relaciona con la presión absoluta de la siguiente manera: Pabs = Pman +Patm - Presión absoluta antes de hervir: Pabs,1 = 0.545 kPa + 101.3 kPa = 101.845 kPa -Presión absoluta después de hervir: Pabs,2 = 0.392 kPa + 101.3 kPa = 101.692 kPa -Temperatura inicial (25 °C): T1 = 25 °C = 25 + 273.15 = 298.15 K -Relación de la ley de los gases ideales: Como el volumen V y el número de moles n permanecen constantes, podemos usar la relación: P1 T1 = P2 T2 -Resolviendo para T2: T2 = T1 ∙ P2 P1 -Sustituyendo los valores: 101.692 kPa T2 = 298.15 K ∙ 101.845 kPa -Calculamos el valor de T2: 101.692 T2 = 298.15 K ∙ 101.845 ≈ 297.74 K -Convertimos T2 a grados Celsius: T2 = 297.74 K – 273.15 = 24.59 °C Por lo tanto, la temperatura del agua después de hervirla y dejarla volver a su densidad normal es aproximadamente 24.59 °C. Evidencias