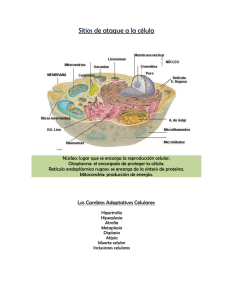
Unidad 1: Fundamentos de Fisiopatología LESIÓN Y MUERTE CELULAR. ADAPTACIÓN A LA LESIÓN 1- ADAPTACIONES CELULARES La célula normal queda limitada a un espectro de función y estructura más bien restringido por su estado de metabolismo, diferenciación y especialización, los condicionantes impuestos por sus células vecinas, y la mayor o menor disponibilidad de sustratos metabólicos. No obstante, es capaz de satisfacer las demandas fisiológicas manteniendo un estado de equilibrio, llamado homeostasia. Las adaptaciones son respuestas funcionales y estructurales reversibles a los cambios en los estados fisiológicos (por ej. embarazo) y a ciertos estímulos patológicos, frente a los cuales se desarrollan estados nuevos, aunque de equilibrio alterado, en los que la célula consigue sobrevivir y mantener su función. La respuesta adaptativa puede consistir en aumento del tamaño de las células (hipertrofia) y de la actividad funcional, incremento de su número (hiperplasia), disminución de su tamaño y su actividad metabólica (atrofia), o cambio en el fenotipo de dichas células (metaplasia). Es posible que, cuando la agresión sea eliminada, la célula recupere su estado original sin sufrir consecuencias perjudiciales. Las células son unidades adaptables y están constantemente expuestas a cambios de su entorno. Las células están sujetas a cambios constantes como resultado de procesos fisiológicos normales y de cambios ambientales externos, incluidos los efectos del tratamiento médico. Por ejemplo, los niveles de hormonas circulantes en un individuo pueden aumentar o disminuir, el patrón de ingesta alimenticia puede cambiar, o puede verse sometido a un tratamiento farmacológico, a temperaturas extremas o a radiaciones. Existen mecanismos homeostáticos que permiten a las células afrontar con éxito esos problemas. Las células se adaptan a cambios tolerables de su entorno modificando su metabolismo o su patrón de crecimiento. Las adaptaciones son cambios reversibles en tamaño, número, fenotipo, actividad metabólica o funciones de las células, en respuesta a cambios registrados en su entorno. Muchas de estas modificaciones son adaptaciones metabólicas fisiológicas y representan una regulación fina de la función metabólica a nivel bioquímico, no reflejándose en cambios morfológicos. Por ejemplo: • Durante períodos de ayuno, se movilizan ácidos grasos desde el tejido adiposo para que tejidos (p. ej., el muscular) puedan obtener energía de ellos. • Durante períodos de falta de calcio de la dieta, para mantener su concentración en los fluidos corporales se moviliza calcio desde sales presentes en la matriz ósea bajo influencia de la parathormona, cuya acción termina activando a los osteoclastos. Tras la administración de ciertos fármacos se induce la formación de enzimas microsomales en las células hepáticas que facilitan el metabolismo de la sustancia en cuestión. Otras modificaciones a cambios ambientales son adaptaciones estructurales fisiológicas. Son debidas a un cambio en el patrón normal de crecimiento y van acompañados de un cambio estructural. Por ejemplo: • Aumento de la actividad celular (aumento del tamaño o del número de células) a causa de un aumento de las demandas funcionales sobre el tejido, o por estímulo hormonal. • Disminución de la actividad celular (reducción del tamaño o del número de células) por reducción del estímulo hormonal de un tejido o por disminución de las demandas funcionales. • Alteración de la morfología celular (cambio en la diferenciación celular) que se produce cuando los cambios en el ambiente que rodea a la célula provocan en ésta una alteración de su estructura. Adaptaciones celulares Atrofia Hipertrofia Involución Hiperplasia Metaplasia Cambio en el tamaño de las células Reducción del tamaño de las células Aumento del tamaño de las células Cambio en el número de células Disminución del número de células Aumento del número de células Cambio de la diferenciación celular Cambio estable a otro tipo celular 1 Unidad 1: Fundamentos de Fisiopatología HIPERPLASIA E HIPERTROFIA El aumento de la demanda funcional sobre un tejido puede compensarse mediante el aumento del número de células (hiperplasia) o del tamaño celular (hipertrofia) Ciertos órganos o tejidos pueden adaptarse aumentando la masa de células funcionales: • La hiperplasia es el aumento del número de células de un tejido a través del incremento de la división celular. Para ello se requiere de influencias hormonales. Este tipo de cambios sólo puede darse en tejidos cuyas células tienen capacidad de división celular, por lo que la hiperplasia no se da en músculo (esquelético o cardíaco) ni en células nerviosas. La hiperplasia es el resultado de una proliferación de células maduras inducida por factores de crecimiento y, en ciertos casos, debida al aumento del desarrollo de nuevas células a partir de células madre tisulares. • La hipertrofia es un aumento del tamaño de las células existentes en un tejido, acompañado de un aumento de su capacidad funcional. El crecimiento celular se logra mediante una mayor síntesis de componentes estructurales, asociado a un aumento del metabolismo celular y a la elevación de los niveles de ARN y proteínas, y de la actividad aumentada de orgánulos necesarios para la síntesis proteica. La hipertrofia como respuesta a una mayor demanda se observa especialmente en tejidos formados por células incapaces de dividirse (músculo cardíaco y esquelético). La hipertrofia y la hiperplasia pueden ocurrir de forma independiente o simultánea para compensar una mayor demanda. Habitualmente se asocian a aumento de tamaño y del peso del órgano o tejido implicado. La hipertrofia puede ser fisiológica o patológica. La primera es causada por el aumento de la demanda funcional o estimulación por parte de hormonas y factores de crecimiento. El músculo esquelético de los fisicoculturistas aumenta de volumen por aumento del tamaño de las fibras musculares individuales en respuesta al aumento de la demanda. En el corazón, el estímulo de la hipertrofia suele ser la sobrecarga hemodinámica crónica, debida a hipertensión o a válvulas defectuosas. En ambos tejidos las células musculares sintetizan más proteínas y aumentan el número de microfilamentos. Ello incrementa la fuerza que cada miocito genera, por lo que son mayores la fuerza y la capacidad de trabajo del músculo en su conjunto. El estímulo más habitual para la hipertrofia muscular es el aumento de la carga de trabajo. El gran crecimiento uterino durante el embarazo es un buen ejemplo fisiológico del aumento de tamaño de un órgano inducido por hormonas, consecuencia, principalmente, de la hipertrofia de las fibras musculares. Bajo estímulo hormonal, también las células del epitelio mamario aumentan en tamaño (hipertrofia) y número (hiperplasia). Algunos ejemplos de estímulos patológicos que inducen aumento de la masa celular de un tejido son: • Si el calcio sérico está anormalmente bajo, las glándulas paratiroides aumentan el número de células productoras de parathormona (hiperplasia). • Si el flujo sanguíneo a través de la válvula aórtica está muy reducido (por un estrechamiento denominado estenosis), la musculatura del ventrículo izquierdo responde con un aumento del tamaño de las células del miocardio (hipertrofia) para vencer esa resistencia al flujo y asegurar una presión arterial adecuada. • La obstrucción permanente del colon (ej. por un tumor) provoca un aumento del tamaño (hipertrofia) de las células musculares lisas de la pared intestinal por encima de la obstrucción. • Si un riñón es extirpado o deja de funcionar, aumenta el tamaño y el peso del riñón sano para compensar la pérdida. El proceso origina un crecimiento de estructuras renales como los glomérulos (hiperplasia compensadora). • Ciertos tumores ováricos producen estrógenos que estimulan una proliferación anormal del endometrio (hiperplasia) que aumenta de tamaño. Un rasgo típico de la hiperplasia es que el patrón de crecimiento alterado termina cuando el estímulo ambiental causante cesa y el tejido vuelve a la normalidad. Por ejemplo, en casos de hiperplasia endometrial, la eliminación de la causa de los niveles elevados de estrógeno hace que el endometrio regrese a lo normal. Esta característica distingue a la hiperplasia de la neoplasia, en la cual existe un crecimiento celular excesivo que no regresa al eliminar el estímulo ambiental causal. 2 Unidad 1: Fundamentos de Fisiopatología Hipertrofia cardíaca: la mayor parte del conocimiento sobre los mecanismos de la hipertrofia se ha adquirido en estudios del corazón. El gran interés en conocer la base molecular de la hipertrofia radica en que, a partir de cierto punto, la hipertrofia cardíaca se convierte en un proceso inadaptado que puede culminar en insuficiencia cardíaca, arritmias y muerte súbita. Existen acciones integradas de sensores mecánicos (que detectan aumento de la carga de trabajo) que estimulan la producción de factores de crecimiento y agonistas. Estas señales originadas en la membrana celular activan cascadas de señalización que culminan en la activación de factores de transcripción que actúan en forma coordinada para aumentar la síntesis de las proteínas musculares responsables de la hipertrofia. La hipertrofia cardiaca se asocia a aumento de la expresión del gen del factor natriurético auricular, que causa secreción renal de sodio, disminución de la volemia y de la presión arterial y, en consecuencia, reduce la carga hemodinámica. Cualquiera que sea la causa y el mecanismo exacto de hipertrofia cardíaca, en última instancia esta alcanza un límite más allá del cual el aumento de tamaño de la masa muscular ya no se consigue adaptar al aumento de la carga. En esta fase se registran diversos cambios regresivos en las fibras miocárdicas, produciéndose en casos extremos la muerte de miocitos. El resultado final de los cambios es el desarrollo de insuficiencia cardiaca, en una secuencia de episodios que ilustra el modo en que una adaptación a la agresión evoluciona y se convierte en lesión celular funcionalmente significativa, si el nivel de agresión no se reduce. La hiperplasia fisiológica debida a la acción de hormonas o factores de crecimiento se registra en diversas circunstancias: cuando existe necesidad de aumentar la capacidad funcional de órganos sensibles a hormonas, o bien cuando hay necesidad de un aumento compensatorio tras una lesión o una resección. Un buen ejemplo de hiperplasia hormonal es la proliferación de epitelio glandular de la mama femenina en la pubertad y durante el embarazo, habitualmente acompañada de hipertrofia de las células de ese epitelio. El ejemplo clásico de hiperplasia compensadora se asocia al estudio de la regeneración hepática. En personas que donan un lóbulo del hígado para trasplante, las células restantes proliferan, de manera que el órgano pronto crece hasta recuperar su tamaño original. La medula ósea experimenta una rápida hiperplasia en respuesta a la carencia de células sanguíneas diferenciadas terminales. La hiperplasia patológica es causada por acciones excesivas o inapropiadas de hormonas o factores de crecimiento que actúan sobre células diana. La hiperplasia endometrial es un ejemplo de hiperplasia anómala inducida por un desequilibrio hormonal con la consiguiente hiperplasia de las glándulas endometriales. La hiperplasia prostática benigna es otro ejemplo habitual de hiperplasia patológica inducida en respuesta a andrógenos. Aunque estas formas de hiperplasia patológica son anómalas, el proceso se mantiene bajo control y la hiperplasia remite cuando la estimulación hormonal cesa. ATROFIA E INVOLUCIÓN La disminución de la demanda funcional provoca una reducción del tamaño o del número de las células En situaciones en las que existe una disminución de las demandas de trabajo o condiciones ambientales adversas, la mayoría de las células tiene la capacidad de disminuir de tamaño y pasar a un nivel de función más reducida y eficiente compatible con la supervivencia. Cuando la masa de células funcionales de un tejido disminuye, se dice que el tejido ha sufrido una atrofia. Existen dos mecanismos de reducción de las células en un tejido: - La disminución del tamaño y del volumen de las células individuales. Esto puede estar asociado a una reducción del metabolismo y a una síntesis disminuida de proteínas estructurales. En ciertas células la reducción física del tamaño se logra mediante un estimulado catabolismo de las proteínas estructurales por autofagia en el sistema lisosómico. -La muerte de las células propias de un tejido u órgano, con reducción del número de células funcionales. En este caso se activan genes específicos que desencadenan la disolución celular. Este tipo de muerte celular se denomina apoptosis. Un órgano que sufre una atrofia debido a que sus células han disminuido su número por haber muerto por apoptosis sufre involución. En muchos tejidos que han sufrido atrofia celular se acumula un pigmento pardo llamado lipofuscina dentro de las células encogidas. Este pigmento, compuesto por material lipídico degenerado en lisosomas, se produce 3 Unidad 1: Fundamentos de Fisiopatología tras la destrucción de membranas y orgánulos celulares por autofagia. La lipofuscina se acumula por ejemplo en las fibras miocárdicas atrofiadas en los ancianos. En general la atrofia se asocia con disminución del tamaño y el peso del órgano o tejido afectado. En algunos casos sin embargo la masa celular perdida es reemplazada por tejido adiposo o fibroso, con lo cual puede mantenerse el tamaño del órgano. La disminución de la masa celular puede ser fisiológica Muchos procesos fisiológicos requieren que se desactive la respuesta tisular. Esto se observa especialmente cuando disminuye el estímulo endocrino que mantiene la masa de células en un tejido blanco. Por ejemplo, la glándula tiroides vuelve a su tamaño normal tras la hiperplasia inducida por la pubertad o el embarazo. En los ancianos, una combinación de factores, como menor actividad física y disminución de secreciones endocrinas, conduce a una disminución del tamaño (atrofia) de muchos órganos y tejidos. Ejemplos de atrofia e involución fisiológica: • El timo involuciona durante la adolescencia. • El miometrio involuciona post partum. • Al disminuir la actividad física con la edad, las fibras musculares disminuyen de tamaño. • En los ancianos, las células secretoras de parathormona disminuyen en la paratiroides, y son reemplazadas por adipocitos. • El testículo se atrofia con la edad por disminución del estímulo gonadotrófico. La masa celular disminuye en algunos estados patológicos • Muchos procesos patológicos provocan una disminución de la demanda funcional, de la estimulación hormonal o nerviosa, de la nutrición, etc., de los tejidos. Como respuesta adaptativa se produce una atrofia o involución. • Las fibras musculares esqueléticas de la pierna sufren atrofia si ésta se inmoviliza, por ejemplo, cuando se coloca un yeso para el tratamiento de una fractura (atrofia por desuso). • La disminución gradual del riego sanguíneo a un tejido provoca la pérdida de células funcionales por involución, así como por atrofia celular (atrofia isquémica). • Una lesión de los axones que inervan a un músculo produce atrofia de las fibras musculares dependientes de esa inervación (atrofia por denervación). • Tras la ablación quirúrgica de la hipófisis, disminuye el número y tamaño de las células de la corteza suprarrenal, por la deficiencia de ACTH. • Tras un traumatismo de la medula espinal, se atrofian las fibras musculares inervadas por las raíces nerviosas afectadas. Mecanismos de la atrofia: la atrofia es consecuencia de la disminución de la síntesis de proteínas y del aumento de su degradación en las células. La síntesis proteínica se reduce al hacerlo la actividad metabólica. La degradación de las proteínas celulares se produce, sobre todo, mediante la vía de ubicuitina-proteosoma. Nota: ciertos trastornos del desarrollo embrionario ocasionan la formación de órganos anormalmente pequeños o la falta completa de desarrollo de algunos órganos o tejidos. El crecimiento incompleto o parcial de un órgano se denomina hipoplasia. La falta total de crecimiento de un órgano durante el desarrollo se denomina agenesia. (No confundir con la atrofia y la involución, en que el tejido o el órgano afectado estaban desarrollado previamente en forma normal). Atrofia celular y autofagia En la atrofia celular se destruyen (y consumen) proteínas y orgánulos estructurales propios de la célula, lo que resulta en disminución de su tamaño, así como de su capacidad funcional. La atrofia es una respuesta adaptativa porque permite a la célula sobrevivir en condiciones adversas al reducir sus necesidades metabólicas al mínimo. Mediante la autofagia la célula puede echar mano de sus propios recursos, consumiendo componentes que en un momento de crisis no son esenciales para la supervivencia, como lípidos 4 Unidad 1: Fundamentos de Fisiopatología provenientes de membranas de orgánulos, proteínas y ARNs. Los orgánulos innecesarios son envueltos en una membrana derivada del RE y se forma un cuerpo autofágico, que se funde con las vesículas que contienen las hidrolasas ácidas lisosomales, que van a hidrolizar los componentes de los orgánulos. Las células que están sufriendo atrofia activa contienen numerosos cuerpos autofágicos. Estos cuerpos, al final del proceso, pueden formar cuerpos residuales, que contienen el material que no pudo ser digerido, como p. ej. el material rico en lípidos denominado lipofuscina. METAPLASIA Los tejidos pueden adaptarse a estímulos ambientales mediante un cambio de la diferenciación celular que se conoce como metaplasia Ciertos estímulos ambientales de larga duración hacen el ambiente inadecuado para algunos tipos celulares especializados. Como respuesta adaptativa, las células modifican su patrón de crecimiento y diferenciación. Se diferencian hacia un nuevo tipo de célula, madura y estable, que está mejor adaptada para resistir el estrés ambiental. Este proceso se denomina metaplasia. Ejemplos: • En los bronquios, bajo la influencia de la irritación crónica por el humo del tabaco, el epitelio respiratorio normal del árbol bronquial (cilíndrico, ciliado y secretor de moco) es sustituido por un epitelio escamoso (metaplasia escamosa). • En la vejiga urinaria, el epitelio normal puede transformarse en un epitelio escamoso como respuesta a una irritación crónica por cálculos o infecciones. • En el cuello uterino, el epitelio cilíndrico normal de la porción inferior puede transformarse en escamoso por su exposición crónica a un ambiente vaginal ácido. • El epitelio escamoso del esófago puede transformarse en epitelio cilíndrico (de tipo estomacal) como respuesta a su exposición al ácido clorhídrico en casos de reflujo gástrico crónico (Esófago de Barrett). • Los epitelios de las glándulas, normalmente cilíndricos, pueden transformarse en escamosos como consecuencia del déficit de vitamina A. La metaplasia es más frecuente en los tejidos epiteliales, pero también puede darse en otros. Por ejemplo, las zonas de tejido fibroso expuestas a traumatismos crónicos pueden formar hueso (metaplasia ósea). Mecanismo de la metaplasia: la metaplasia no se debe a un cambio en el fenotipo de un tipo celular ya diferenciado, sino que es consecuencia de una reprogramación de células madre que se sabe que existen en los tejidos normales, o de células mesenquimatosas no diferenciadas presentes en el tejido conjuntivo. DISPLASIA La displasia se caracteriza por el crecimiento desorganizado de un tejido específico que determina la formación de células de tamaño, forma y organización variables Los grados menores de displasia se asocian con irritación y/o inflamación crónica. Aunque la displasia es anormal, constituye un mecanismo adaptativo en la medida que potencialmente puede revertirse después de la desaparición del estímulo irritante. La displasia se considera una transformación precursora de cáncer. En muchas oportunidades las células displásicas recuperan la estructura y la función previas. IMPORTANTE: Las respuestas adaptativas ante los estímulos patológicos se dan sólo con cambios ambientales tolerables. Las respuestas adaptativas de hiperplasia, hipertrofia, atrofia, involución y metaplasia sólo se dan si el estímulo lesivo es tolerable para las células afectas. El fracaso de la adaptación conduce a la lesión celular, y, si el estímulo es intenso o prolongado, puede llevar a la muerte celular. La adaptación, la lesión reversible y la muerte celular pueden ser etapas de un deterioro progresivo que sucede a diversos tipos de agresiones. La incapacidad para adaptarse con éxito a un cambio ambiental hace fracasar la función celular y provoca una lesión subletal o letal (muerte celular). Ello puede pasar si la célula es especialmente susceptible a ese estímulo lesivo o si éste es tan intenso que supera las respuestas celulares tanto de estrés como adaptativas. Algunas células, como las neuronas cerebrales, son muy sensibles a los cambios de su entorno y mueren rápidamente 5 Unidad 1: Fundamentos de Fisiopatología ante situaciones distintas de la fisiológica. Otras, como los fibroblastos, son extremadamente resistentes a las lesiones y pueden sobrevivir a cambios metabólicos intensos (como por ejemplo la privación completa de oxígeno) durante períodos prolongados sin sufrir daño. LA RESPUESTA DE ESTRÉS CELULAR A LA LESION Algunos cambios ambientales quedan fuera del ámbito tolerable de la normalidad. A menudo esos cambios son debidos a una enfermedad, y por ello se denominan estímulos patológicos. Cabe aclarar que el límite entre lo fisiológico y lo patológico no es rígido, sino que es todo un continuo. Por ejemplo, la exposición a radiaciones UV al tomar sol producen respuestas en la piel que van desde la producción aumentada de melanina (fisiológica) hasta graves quemaduras seguidas de formación de ampollas y el desprendimiento de la piel (patológica). Las principales causas que pueden modificar el ambiente celular y producir enfermedad son: Tipo Genética Nutricionales Inmunitarias Endocrinas Agentes físicos Agentes químicos Infecciosas Anoxia Ejemplos Defectos en los genes, defectos en los cromosomas Deficiencia o exceso de sustancias de la dieta (por ej., hierro, vitaminas) Lesiones producidas por el propio sistema inmunitario (p. ej., autoinmunidad) Defecto o exceso de una actividad hormonal Traumatismos mecánicos, lesiones térmicas (frío/calor), irradiación Intoxicación con muchos agentes (p. ej., metales pesados, solventes, fármacos) Infección por virus, bacterias, parásitos, hongos y otros organismos Habitualmente debida a alteraciones de la circulación o de la respiración Las células lesionadas producen proteínas que las protegen del daño recibido En respuesta a algunos estímulos patológicos, las células presentan una serie de cambios metabólicos conocidos como respuesta al estrés celular, que es un mecanismo importante que permite a las células sobrevivir a pesar de las agresiones ambientales. Las células agredidas desactivan los genes que codifican proteínas habituales y activan otros que codifican proteínas con funciones de organización y protección celular (genes del estrés celular). Muchas de las proteínas de estrés celular fueron inicialmente descubiertas al estudiar la respuesta al shock térmico experimental, y por ello uno de los grupos principales es el de las proteínas del shock térmico (PST). Es por ello que “proteína del shock térmico” y “proteína del estrés celular” son prácticamente sinónimos. Las proteínas del estrés celular son imprescindibles para la viabilidad celular En las células normales, estas proteínas tienen importantes funciones, pero se expresan a bajos niveles. Tras estímulos lesivos (anoxia, calor, metales pesados, radiación, infección), sus niveles aumentan. El alto grado de preservación de estas proteínas a lo largo de la evolución sugiere que son indispensables para la supervivencia celular, además de que su producción aumenta con el estrés celular. Las proteínas de estrés celular son citoprotectoras Los miembros de la familia de proteínas del estrés celular se clasifican según su tamaño. Las PST pequeñas se asocian transitoriamente a proteínas normales para protegerlas de la lesión. La ubicuitina es una proteína abundante en las células normales y ayuda a eliminar proteínas viejas o dañadas, actuando como cofactor de la proteólisis. Una vez marcadas por la ubicuitina (unión covalente), las proteínas son reconocidas y degradadas por proteasas específicas, tras lo cual la ubicuitina vuelve al pool de ubicuitina libre celular. En algunas células sometidas a estrés crónico, grupos permanentes de elementos celulares anormales y ubicuitina forman masas visibles dentro del citoplasma conocidas como cuerpos de inclusión. Un ejemplo de ello se presenta cuando las células hepáticas se ven expuestas crónicamente al alcohol, y forman masas debidas a cuerpos de inclusión llamados cuerpos de Mallory. Otro ejemplo son los cuerpos de Loewy en las células nerviosas de los pacientes con enfermedad de Parkinson. La producción de proteínas del estrés celular tras la exposición a un agente lesivo es una respuesta rápida que reduce la lesión de la célula y asegura su supervivencia, pero estas proteínas sólo pueden proteger hasta cierto 6 Unidad 1: Fundamentos de Fisiopatología límite. Si el estímulo es más intenso o se perpetúa en el tiempo, conduce a la degeneración o a la muerte de la célula. 2-LESIÓN Y MUERTE CELULAR La lesión celular se produce cuando las células son sometidas a algún tipo de agresión o estrés de tal magnitud que no son capaces de adaptarse, o cuando son expuestas a agentes específicamente lesivos o padecen anomalías intrínsecas. La lesión puede evolucionar a lo largo de una fase reversible para culminar en la muerte celular. Lesión subletal (reversible) Si la lesión es tolerable y el estímulo desaparece, la célula puede recuperarse tras un estímulo lesivo. Las proteínas y los orgánulos dañados son eliminados por una respuesta de estrés celular y por autofagia y se sintetizan nuevos componentes celulares. A esto se denomina lesión subletal, y se acompaña de cambios estructurales típicos reconocibles. En las fases iniciales o en las formas leves de lesión, los cambios funcionales y morfológicos son reversibles cuando el estímulo perjudicial cesa. Los rasgos fundamentales de la lesión reversible son la fosforilación oxidativa reducida, con la consiguiente disminución de las reservas de energía en forma de ATP, y el edema celular causado por cambios en las concentraciones de iones y por el aflujo de agua. El edema celular se produce siempre que las células no son capaces de mantener la homeostasia de iones y líquidos y es consecuencia de la disfunción de las bombas iónicas dependientes de la energía en la membrana plasmática. El cambio graso sobreviene en lesiones hipόxicas y en diversas formas de lesión tóxica o metabólica. Se manifiesta por aparición de vacuolas lipídicas en el citoplasma. Se observa, principalmente, en células implicadas en el metabolismo de las grasas o dependientes de él, como los hepatocitos y las células del miocardio. Es esencialmente reversible si se elimina la causa. El edema, hinchazón o tumefacción celular, es la primera manifestación de casi todas las formas de lesión de las células. En el examen microscópico es posible observar en el citoplasma pequeñas vacuolas transparentes, que son segmentos distendidos y desprendidos del RE. Este patrón de lesión no mortal se designa a veces como cambio hidrópico o degeneración vacuolar. El edema celular es reversible. Entre los cambios ultraestructurales de la lesión celular reversible se cuentan los siguientes: 1Alteración de la membrana plasmática, con formación de vesículas y atrofia y pérdida de microvellosidades. 2Cambios mitocondriales, con edema y aparición de pequeñas densidades amorfas. 3Dilatación del RE, con desprendimiento de polisomas. 4Alteraciones nucleares, con desagregación de elementos granulares y fibrilares. Lesión letal: muerte celular irreversible Si el estímulo lesivo, aunque inicialmente haya sido subletal es muy intenso y/o persistente en el tiempo, la lesión se convierte en irreversible y la célula no puede recuperarse y muere. Históricamente, se han reconocido dos tipos principales de muerte celular, la necrosis y la apoptosis, diferenciadas por su morfología, sus mecanismos y sus funciones en la fisiología y en la enfermedad. Si el estímulo letal es arrollador, la célula muere inmediatamente, sin pasar por las fases de la necrosis. Esta muerte instantánea es lo más habitual ante agentes físicos como el calor intenso o los ácidos potentes, que coagulan las proteínas celulares. Las células que mueren “involuntariamente”, sufren una serie de cambios denominada necrosis La necrosis se considera un proceso patológico y una forma “accidental” y no regulada de muerte celular, causada por afectación de las membranas celulares y por pérdida de la homeostasia iónica. Cuando el daño de las membranas es importante, las enzimas lisosόmicas penetran en el citoplasma y digieren la célula, dando lugar a un conjunto de cambios morfológicos definidos como necrosis. Los contenidos celulares escapan a través de la membrana plasmática dañada, pasando al espacio extracelular, en el que inducen una reacción inflamatoria. La necrosis es la forma de muerte celular propia de numerosas lesiones frecuentes, como las causadas por isquemia, exposición a toxinas, diversas infecciones y traumatismos. 7 Unidad 1: Fundamentos de Fisiopatología La lesión letal va seguida de cambios estructurales en las células que reflejan la desintegración de la estructura celular debida a la activación de las enzimas lisosómicas intracelulares. La disolución de elementos celulares mediante la actividad de enzimas propias se denomina autόlisis. Muchos de los cambios observados en la necrosis se deben a la acción de hidrolasas lisosómicas que se liberan cuando se pierde la integridad celular. Al teñir con hematoxilina-eosina, el citoplasma, al principio, es rosa claro con un tinte violáceo (basofilia) a causa del ARN celular. Al perderse el ARN falta el tinte violeta y aumenta el rosa (eosinofilia) en el citoplasma. Al principio, el núcleo celular se hace pequeño, se condensa, y se tiñe intensamente (picnosis). Luego, los núcleos picnóticos se fragmentan en varias partículas, alteración denominada cariorrexis. Esto es seguido de la destrucción completa, o cariólisis, del núcleo. El contorno celular comienza a mostrar irregularidades que reflejan la rotura de la membrana. Luego de la desaparición del núcleo la célula necrótica queda como una masa de proteína parcialmente desnaturalizada que mantiene la silueta aproximada de la célula normal en el tejido. Una vez muertas de este modo (necrosis) las células de un tejido pueden liberar a la sangre proteínas cuya detección tiene valor diagnóstico (proteínas estructurales o enzimas que antes eran intracelulares). Ejemplos: Célula lesionada Enzima elevada en sangre Hepatocito Alanino transaminasa (ALT) Músculo estriado Creatina quinasa (isoforma MM) Páncreas exocrino Amilasa Músculo cardíaco Creatina quinasa (isoforma MB); Aspartato transaminasa (AST); Lactato deshidrogenasa (LDH) Patrones de necrosis tisular La necrosis de los tejidos presenta distintos patrones morfológicos, cuyo reconocimiento es importante, ya que ofrecen indicios sobre la posible causa subyacente. Aunque los términos que describen tales patrones están en cierta medida anticuados, se utilizan con frecuencia y sus implicancias son empleadas a menudo por patólogos y profesionales clínicos. Coagulativa: describe el tejido muerto de aspecto firme y pálido, como si estuviera cocido. Aunque las células están muertas, muchas siluetas celulares y la estructura celular aún pueden reconocerse. Este tipo de necrosis se produce en células con pocos lisosomas, con lo que la destrucción no alcanza a ser completa. Su causa más frecuente es la oclusión del riego arterial a un tejido (ej. riñón). Proteínas liberadas desde las células muertas pueden pasar a la sangre. Licuefactiva: describe el tejido muerto que parece semilíquido a consecuencia de su disolución por la acción de enzimas hidrolíticas. Este tipo de necrosis se observa típicamente en el tejido cerebral en un área que ha sufrido isquemia por oclusión arterial. La gran cantidad de lisosomas en las neuronas y la relativa escasez de proteínas estructurales extracelulares (reticulina, colágeno) conducen a una rápida pérdida de la estructura tisular en el área lesionada y a la licuefacción cuando se liberan las enzimas en cuestión. Otro ejemplo de necrosis licuefactiva es la que ocurre en tejidos con necrosis producida por infecciones bacterianas. Los microorganismos atraen fagocitos a la zona, que luchan contra las bacterias, para lo que a veces liberan las enzimas lisosomales que producen la licuefacción. Caseosa: describe el tejido muerto blando y blanco que recuerda al queso fresco. Las células forman una masa proteinácea amorfa blanquecina donde no se puede apreciar la arquitectura original del tejido. Este patrón de necrosis se asocia invariablemente a la tuberculosis. Gomosa: describe el tejido muerto firme y gomoso. No se reconoce histológicamente el tejido original. El patrón gomoso es típico de la necrosis producida por la infección por la espiroqueta de la sífilis. Hemorrágica: describe tejidos muertos llenos de eritrocitos extravasados. Este patrón se observa cuando la necrosis se debe a la obstrucción del drenaje venoso de un tejido, o a la lesión de los vasos con la consiguiente extravasación de sangre al tejido. Grasa: describe los focos de material amarillento que se observan en el tejido adiposo cuando mueren sus células. Esta reacción suele producirse como consecuencia de la liberación de poderosas enzimas líticas 8 Unidad 1: Fundamentos de Fisiopatología (lipasas) que atacan a los triglicéridos del tejido, como ocurre en el tejido adiposo peri-pancreático en la pancreatitis aguda. También puede observarse tras traumatismos del tejido adiposo, por ejemplo, en la mama. Fibrinoide: describe el aspecto de las paredes de los vasos sanguíneos cuando sus células endoteliales se lesionan, como pasa en la hipertensión o en la vasculitis. Se denomina así porque se deposita fibrina al dañarse la pared del vaso necrótico. Gangrena: Necrosis masiva en un área, con el agregado de crecimiento de microorganismos saprófitos. Típica en el pie diabético o en lesiones intestinales. A diferencia de lo que sucede en la necrosis, cuando el ADN o las proteínas de la célula resultan dañadas más allá del nivel de posible reparación, la propia célula se da muerte a sí misma mediante apoptosis, una forma de muerte celular que se caracteriza por disolución nuclear, fragmentación de la célula sin perdida completa de la integridad de la membrana y eliminación rápida de los residuos celulares. Dado que el contenido de la célula no sale de ella, NO HAY REACCION INFLAMATORIA. La apoptosis es un proceso regulado, desarrollado a través de una serie de vías genéticas. Por ello, se designa en ocasiones como “muerte celular programada”. Este proceso programado consume energía en forma de ATP y está diseñado específicamente para desactivar y eliminar células. Esta forma controlada de muerte celular es muy diferente a la forma caótica producida como resultado directo de un grave e inesperado estímulo lesivo. Durante el desarrollo, muchas células están ya programadas de antemano para la apoptosis, sobreviviendo sólo aquéllas que son “rescatadas” por algún factor trófico específico. La apoptosis es activada por dos vías ampliamente descriptas, la vía intrínseca (o mitocondrial) y la vía extrínseca (a través de receptores de muerte (eg. FAS, TNFr). Las características fundamentales de este proceso celular de muerte son: • Al comenzar el proceso se sintetizan las enzimas necesarias para la disolución celular, sin cambio aparente en la estructura. • Las células apoptóticas pierden especialización y sus contactos con las células vecinas. Sufren disminución de tamaño. La cromatina nuclear se condensa. Las endonucleasas fragmentan los cromosomas en fragmentos de nucleosomas individuales. A diferencia de la necrosis, los orgánulos celulares como las mitocondrias permanecen durante el proceso. • Luego la célula se divide en varios fragmentos rodeados de membrana, conocidos como cuerpos apoptóticos. También se fragmenta el núcleo. Cada cuerpo apoptótico contiene mitocondrias viables y otros orgánulos. Los fragmentos apoptóticos exponen en su superficie lípidos y otras moléculas que facilitan su reconocimiento por las células adyacentes, o por las células fagocíticas locales, que los ingieren mediante fagocitosis para su destrucción. Los fragmentos que no son degradados degeneran extracelularmente. • Aunque es un proceso fisiológico asociado a múltiples funciones normales y no se asocia necesariamente a lesión celular, la muerte celular por apoptosis también puede ocurrir en ciertas situaciones patológicas. Por ejemplo, la deficiencia de TSH o de ACTH por una lesión hipofisiaria resulta en desaparición (por falta del estímulo hormonal) de las células tiroideas o suprarrenales. • El estudio de los tipos de muerte celular que están regulados por genes y vías de transmisión de señales identificables (ver necroptosis y piroptosis) demuestra que la muerte celular puede ser proceso controlado. Esto plantea la posibilidad de antagonizar de forma terapéutica algunas vías moleculares específicas para prevenir la pérdida de células en situaciones patológicas. Otras vías de Muerte celular menos frecuentes Necroptosis: En algunos casos, la muerte celular programada muestra rasgos de necrosis y apoptosis de forma simultánea y se le da el nombre de necroptosis. Esta forma de muerte celular se inicia por la activación de los receptores de TNF y otros estímulos que aún no se conocen. A diferencia de la vía extrínseca de la apoptosis, que también es promovida por receptores de TNF, en la necroptosis se activan unas quinasas llamadas proteínas de interacción con el receptor (RIP), que inician una serie de acontecimientos que causan la disolución de la célula, igual que sucede en la necrosis. El término necroptosis alude a la existencia de rasgos comunes a la apoptosis y la necrosis. Se ha comprobado que algunos agentes infecciosos destruyen las células 9 Unidad 1: Fundamentos de Fisiopatología por este mecanismo y se ha planteado que esta vía participa en las lesiones isquémicas y otras situaciones patológicas, sobre todo en aquellas asociadas a reacciones inflamatorias con producción de la citocina TNF. Sin embargo, todavía no se comprende bien cuándo y por qué sucede y su importancia en las enfermedades humanas. Existen varios tipos de necrosis programada además de la necroptosis, entre ellas podemos nombrar a la piroptosis, parthanatos, ferroptosis y NETosis. La muerte celular conocida como parthanatos implica la hiperactivación de la poli (ADPribosa) (PAR) polimerasa 1 (PARP1), una enzima que se conoce por su papel en los mecanismos de reparación del ADN. La PARilación masiva de las proteínas celulares conduce al agotamiento de NAD + (y consecuentemente de ATP), resultando en una crisis bioenergética y en una forma de necrosis regulada. El término ferroptosis describe un tipo de necrosis regulada que se caracteriza por la producción dependiente del hierro de especies reactivas de oxígeno (ROS). La NETosis (NET es una trampa extracelular de neutrófilos) implicada en la protección contra microbios e infecciones virales. Esta ocurre en neutrófilos, eosinófilos, mastocitos y macrófagos. En ella se produce la descondensación de la cromatina y liberación de una red que se compone de ADN, cromatina e histonas, que inmoviliza y ayuda a la eliminación de las infecciones por parte de las células del sistema inmune. Debido a su importancia creciente en el mecanismo fisiopatológico de las infecciones, a continuación, describimos más en detalle a la piroptosis. Piroptosis: Es una forma de muerte celular que se asocia a la activación de un complejo de proteínas citosólicas que perciben daño o peligro llamadas inflamasoma. El inflamasoma es un complejo multiproteico que reconoce productos de células muertas y algunos microbios e induce la secreción de la forma activa de la interleucina I (IL1) . El resultado neto de la activación del inflamasoma es la activación de las caspasas, algunas de las cuales inducen la producción de citocinas que provocan inflamación, que con frecuencia se manifiesta como fiebre, mientras que otras activan la apoptosis. Por tanto, coexisten la inflamación y la apoptosis. El nombre piroptosis deriva de la asociación de fiebre con apoptosis (del griego, pyro = fuego). Se cree que este es uno de los mecanismos mediante los cuales algunos microbios matan a las células infectadas. Se desconoce su papel en otras situaciones patológicas. Más sobre Inflamasoma: Es un complejo de múltiples copias de una proteína sensora (rica en leucina llamada NLRP-3) una proteína adaptadora (CARD) y la enzima caspasa 1, que pasa de una forma inactiva a otra activa. La composición del inflamasoma depende del estímulo que activa su formación. Los receptores de tipo NOD (NLR) son receptores citosólicos. Estos reconocen una amplia variedad de sustancias, incluidos los productos de células necrosadas (p. ej., ácido úrico y ATP liberado), trastornos iónicos (p. ej., pérdida de K) y algunos productos microbianos. Varios NLR envían señales y activan al inflamasoma, y la caspasa 1 escinde una forma precursora de la citocina interleucina 1 (IL-1) para generar la forma activa. La IL-1 es un mediador de la inflamación que recluta leucocitos e induce fiebre. Las mutaciones con ganancia de función en uno de los NLR dan lugar a los síndromes con fiebre periódica, llamados síndromes autoinflamatorios, que responden muy bien al tratamiento con antagonistas de la IL-1. La vía NLR-inflamasoma interviene en varios trastornos crónicos caracterizados por inflamación. Por ejemplo, el reconocimiento de los cristales de urato por una clase de NLR es la base de la inflamación asociada a la gota (recordar más adelante Tema 16). Estos receptores pueden detectar y responder a lípidos y cristales de colesterol que se depositan en cantidades excesivamente altas en los tejidos; la inflamación resultante puede contribuir a la diabetes de tipo 2 asociada a la obesidad y a la ateroesclerosis, respectivamente. Además de la apoptosis y las diversas formas de necrosis regulada, a menudo se propone una tercera modalidad de muerte celular: la muerte celular autofágica. El nombre es un poco engañoso porque la autofagia es, como mencionamos antes (pág 4-5 de este apunte), un factor crucial en la homeostasis celular y las respuestas adaptativas, sin embargo, también puede convertirse en un mecanismo de muerte celular. Mecanismos de la lesión celular Principios generales de la lesión celular La respuesta celular a los estímulos lesivos depende de la naturaleza, la duración y la gravedad de la lesión. Pequeñas dosis de un producto químico tóxico o breves períodos de isquemia pueden dar lugar a lesión reversible, en tanto que dosis mayores de la toxina o isquemias más prolongadas inducen muerte celular instantánea o desarrollo más lento de lesiones irreversibles que conducen a la muerte de la célula. Las consecuencias de la lesión celular dependen del tipo, el estado y la adaptabilidad de la célula afectada. Algunas células son sensibles, mientras que otras resistentes a los agentes lesivos. Tras un paro cardíaco, que 10 Unidad 1: Fundamentos de Fisiopatología provoca hipoxia en todo el organismo, puede verse que no todas las células son igualmente susceptibles. Las células más sensibles son las neuronas grandes del hipocampo y el cerebelo, que mueren tras solo 2-5 minutos sin oxígeno. Las más resistentes son los fibroblastos, que sobreviven en las zonas de destrucción celular tras la lesión y muerte de todas las células parenquimatosas especializadas. La razón por la que unas células son más sensibles que otras es la diferente capacidad metabólica de cada tipo celular para sobrevivir a la pérdida de ATP, a la entrada de calcio al citosol, y a los daños inducidos por los radicales libres. A veces, células aparentemente similares tienen una capacidad metabólica muy diferente, como es el caso de los hepatocitos de la región periportal en comparación con la centrolobulillar del hígado. Los periportales poseen menores niveles de enzimas generadoras de radicales libres que los centrolobulillares. Es por ello que la necrosis hepática inducida ciertas drogas se limita a hepatocitos centrolobulillares, como es el caso del paracetamol. En la lesión celular están implicados varios mecanismos bioquímicos que actúan sobre diversos componentes celulares esenciales. Los componentes celulares dañados con mayor frecuencia por los estímulos lesivos son las mitocondrias, las membranas celulares, la maquinaria de síntesis y empaquetamiento de proteínas, y el ADN. Cualquier estímulo lesivo puede desencadenar simultáneamente múltiples mecanismos interconectados que dañan la célula. Esta es una de las razones por las que es difícil asignar la lesión celular a una situación particular o a un trastorno bioquímico dominante. Mecanismos bioquímicos que son activados por diversos estímulos lesivos y que contribuyen al desarrollo de lesión y necrosis tisular ➢ Disminuciόn del ATP La reducción de las concentraciones de ATP es una causa fundamental de muerte celular por necrosis. El ATP es producido en dos formas. La vía principal en las células de mamíferos es la fosforilaciόn oxidativa del difosfato de adenosina. La segunda es la vía glucolítica, que puede generar ATP en ausencia de oxígeno utilizando glucosa. El ATP es necesario para prácticamente todos los procesos de síntesis y degradación que tienen lugar en la célula (transporte de membrana, síntesis de proteínas, lipogenia, reacciones de desacilaciόnreacilaciόn, necesarias para el intercambio de fosfolípidos). La disminución de ATP hasta el 5-10% de los niveles normales tiene efectos generalizados sobre muchos sistemas celulares esenciales: • La actividad de la bomba de sodio dependiente de energía de la membrana plasmática (Na+, K+-ATPasa) se reduce. El fallo de este sistema de transporte activo hace que el sodio penetre y se acumule en las células, y que el potasio salga de ellas por difusión. La ganancia neta de soluto va acompañada de una ganancia isoosmόtica de agua, lo que produce edema celular y dilatación del RE. • El metabolismo energético de la célula se ve alterado. Si el aporte de oxígeno a las células se reduce, como sucede en la isquemia, la fosforilaciόn oxidativa cesa, con la consiguiente disminución del ATP celular. Tales cambios inducen aumento de la glucόlisis anaeróbica, que produce acumulación de ácido láctico, con reducción del pH intracelular y la actividad de numerosas enzimas celulares. • El fallo de la bomba de Ca2+ determina la entrada de Ca2+, con efectos nocivos sobre múltiples componentes celulares. • Desorganización del mecanismo de síntesis proteica con desprendimiento de ribosomas del RE rugoso. En última instancia, se produce daño irreversible de las membranas mitocondriales y lisosόmicas, y la célula sufre necrosis. ➢ Daño mitocondrial Las mitocondrias desempeñan un papel fundamental en todas las vías de lesión y muerte celular. Ello resulta previsible, dado que suministran la energía que sirve para el mantenimiento de la vida a través de la producción de ATP. Las mitocondrias se afectan primariamente por la falta de oxígeno (hipoxia) y de glucosa (hipoglucemia) ya que ambos se requieren para la producción mitocondrial de energía (ATP). También pueden 11 Unidad 1: Fundamentos de Fisiopatología resultar dañadas por incremento de calcio o de las especies reactivas de oxígeno, y toxinas. Las principales consecuencias del daño mitocondrial son 1- formación del poro de transición de la permeabilidad mitocondrial. La apertura de este canal determina la pérdida del potencial de membrana mitocondrial, lo que induce insuficiencia de la fosforilaciόn oxidativa y agotamiento progresivo de ATP, que culmina en la necrosis de la célula; 2- fosforilaciόn oxidativa anómala, que induce formación de especies reactivas del oxígeno, con numerosos efectos perjudiciales; 3-salida al citosol de diversas proteínas (citocromo c, caspasas, etc.) inductoras de apoptosis. ➢ Flujo de entrada de calcio y pérdida de la homeostasia del calcio El calcio libre citosólico es un potente agente destructivo. La concentración normal de calcio en el citosol es muy baja y existen mecanismos reguladores muy finos para asegurar que se mantenga bajo. Por lo general, el calcio es rápidamente eliminado del citosol por activas bombas de calcio dependientes de ATP. Normalmente, la concentración de calcio se mantiene baja porque está unido a proteínas tampón como la calbindina, y es confinado en el retículo endoplásmico y en la mitocondria. Hay importantes sistemas de segundos mensajeros que son activados por incrementos transitorios de la concentración de calcio, como son: • Proteína quinasas que fosforilan otras proteínas, entre ellas las transductoras de señales • Fosfolipasas que degradan fosfolípidos localizados en las membranas • Calpaína, una proteasa que puede degradar las proteínas del citoesqueleto • ATPasas, que aceleran el agotamiento de ATP • Endonucleasas, responsables de la fragmentación del ADN y la cromatina Si por aumento de la entrada de calcio desde afuera, o por lesión mitocondrial, aumenta la concentración de calcio en el citosol, y no alcanza la capacidad celular para tamponarlo o para bombearlo fuera del citosol, se producirá una activación descontrolada de esas enzimas. La activación de proteína quinasas lleva a fosforilación no programada de proteínas, la activación de fosfolipasas conduce a lesión de las membranas, y la activación de proteasas termina en la desestructuración del citoesqueleto. ➢ Acumulación de radicales libres derivados del oxígeno (estrés oxidativo) Las especies reactivas del oxígeno (ERO) son producidas normalmente en las células durante la respiración mitocondrial y degradadas y eliminadas por los sistemas de defensa celular. Así pues, las células son capaces de mantener un estado de equilibrio, en el que los radicales libres están presentes de modo transitorio en concentraciones bajas, sin causar daño. El aumento de la producción o la menor eliminación de las ERO determina un exceso de radicales libres, conocido como estrés oxidativo. Dicho estrés se relaciona con una gran variedad de procesos patológicos o degradativos, como lesión celular, cáncer, envejecimiento y algunos trastornos degenerativos, como la enfermedad de Alzheimer. Las ERO también son producidas en grandes cantidades por leucocitos activados, sobre todo neutrófilos y macrófagos, durante reacciones inflamatorias destinadas a destruir microbios y eliminar células muertas y otras sustancias no deseables. Los metabolitos reactivos del oxígeno lesionan a las células. En todas las células se están generando continuamente metabolitos de oxígeno altamente reactivos. Dado que son potencialmente nocivos, son constantemente eliminados por sistemas protectores como antioxidantes (ej. vitamina E); glutatión peroxidasa; superóxido dismutasa; catalasa. Los productos reactivos de oxígeno más importantes son el anión superóxido (O2-), el radical hidroxilo (OH); y el peróxido de hidrógeno (H2O2). La mayor parte de estos metabolitos reactivos se origina cuando el oxígeno se reduce para formar agua en los sistemas de transporte de electrones. La presencia de hierro libre en las células también estimula su formación, y por lo tanto es potencialmente tóxica. Otra fuente importante de productos activos de oxígeno es la xantina, un metabolito del ATP que se acumula cuando éste se degrada durante la hipoxia. Al acumularse, la xantina es oxidada por la xantina oxidasa, que genera productos reactivos de oxígeno. También se pueden producir radicales libres reactivos como intermediarios en el metabolismo de ciertas toxinas como el tetracloruro de carbono y de fármacos como el paracetamol. Otra fuente importante 12 Unidad 1: Fundamentos de Fisiopatología de ellos son los neutrófilos (que como parte del mecanismo de destrucción de bacterias utilizan a estos metabolitos reactivos). El agotamiento de los sistemas endógenos para depurar radicales libres (vitamina E, glutatión peroxidasa, catalasa, etc.) contribuye a que éstos se acumulen. Estos productos altamente reactivos tienen varios efectos lesivos: • Peroxidación de lípidos en las membranas celulares, lo que aumenta su permeabilidad. • Ataque de los grupos tiol (-SH) de las proteínas, entre las que están las bombas de iones de las membranas (Na/K ATPasa). • Fragmentación de las cadenas del ADN. • Agotamiento del NADPH de las mitocondrias y liberación del calcio al citosol. Tras la isquemia, las células quedan exhaustas de energía, pero no hay formación de productos reactivos de oxígeno por no haber oxígeno en los tejidos. El problema se produce cuando los tejidos son perfundidos de nuevo y se aporta dicho oxígeno: se generan grandes cantidades de ellos tanto por las mitocondrias como por la xantinooxidasa. Los mecanismos de depuración dependientes de energía de estos metabolitos reactivos son superados por la falta de ésta, con lesión y muerte celular. Este es el fundamento de la lesión por reperfusión: la necrosis celular no se produce al cesar el riego sanguíneo en sí, sino al reestablecerse. Es por ello que se ha empleado clínicamente al alopurinol, un inhibidor de la xantinooxidasa, para limitar la extensión de la lesión cardíaca tras un infarto de miocardio. ➢ Defectos en la permeabilidad de las membranas La pérdida temprana de permeabilidad selectiva de las membranas, causante en último término de daño celular patente, es un rasgo común a la mayoría de las formas de lesión celular (excepto la apoptosis). La integridad de la membrana celular es esencial para la supervivencia de la célula y su recuperación tras cualquier lesión. Las membranas celulares son lesionadas en forma directa en las lesiones inmunitarias, cuando la activación del complemento hace que el complejo resultante forme poros que atraviesan la membrana de sus células blanco, permitiendo así la entrada masiva de calcio al interior celular. En células exhaustas de energía no es posible la síntesis de nuevos fosfolípidos de membrana para reemplazar a los fosfolípidos preexistentes que habían sido degradados por la activación de las fosfolipasas. Además, las proteasas activadas por el calcio desarman el armazón citoesquelético que normalmente mantiene la organización de los componentes celulares, lo cual convierte a las células en anormalmente frágiles ante un estrés contráctil u osmótico. El armazón citoesquelético puede ser desmontado o desmantelado por destrucción de las proteínas que lo constituyen, debido a la activación de proteasas, lo que convierte a las células en anormalmente frágiles. Las consecuencias del daño de las membranas principalmente afectan a la membrana plasmática, las mitocondriales y las lisosomales: Daño de las membranas mitocondriales: apertura del poro de transición de permeabilidad mitocondrial, con la consiguiente disminución de la generación de ATP y la liberación de proteínas que inducen muerte por apoptosis. Daño de la membrana plasmática: por pérdida del equilibrio osmótico y del aflujo de líquido y iones, así como del contenido celular. Las células pueden asimismo perder metabolitos, esenciales para la reconstitución del ATP, lo que conduce al agotamiento de las reservas de energía. Daño de las membranas lisosόmicas: las enzimas de los lisosomas pasan al citoplasma activándose las hidrolasas acidas en el pH intracelular ácido de la célula lesionada. Los lisosomas contienen ARNasas, ADNasas, proteasas, fosfatasas y glucosidadas. Su activación promueve la digestión enzimática de proteínas, ARN, ADN y glucógeno, por lo que las células mueren por necrosis. ➢ Daño del ADN y las proteínas Las células tienen mecanismos que reparan los daños producidos en el ADN, aunque, cuando la afectaciόn es demasiado grave para ser corregida (por ej., tras exposiciόn a fármacos que dañan el ADN, radiaciόn o estrés 13 Unidad 1: Fundamentos de Fisiopatología oxidativo), la célula inicia un proceso de suicidio programado que concluye con muerte por apoptosis. Una reacción similar es originada por las proteínas inadecuadamente plegadas, que pueden ser consecuencia de mutaciones hereditarias o de desencadenantes adquiridos, como los radicales libres. Debido a su interdependencia, la lesión de un sistema provoca lesiones secundarias en los otros, y se produce la muerte celular cuando se sobrepasa un cierto umbral de lesiones acumuladas. Un ejemplo de ello se ve en las células que sufren isquemia (insuficiencia de riego sanguíneo). Correlaciones clínico – patológicas: ejemplos de lesión y necrosis celulares Lesión isquémica e hipόxica El término hipoxia se refiere a una privación de oxígeno con un flujo de sangre estable, mientras que la isquemia es una reducción considerable o una interrupción del flujo sanguíneo. La hipoxia interfiere con el aporte de oxígeno, mientras la isquemia lo hace con el aporte de oxígeno y de glucosa y con la eliminación de los desechos metabólicos. La isquemia es la lesiόn celular más común en medicina clínica y es consecuencia de la hipoxia inducida por la reducciόn del flujo sanguíneo, habitualmente causada por una obstrucciόn arterial mecánica. También puede obedecer a reducciόn del drenaje venoso. A diferencia de lo que sucede en la hipoxia, durante la cual la producciόn de glucόlisis anaerόbica puede continuar, la isquemia afecta a la disposiciόn de sustratos para la glucόlisis. Así pues, en tejidos isquémicos, no solo se ve afectado el metabolismo aerόbico, sino que la generaciόn de energía anaerόbica también se interrumpe una vez que se han agotado los sustratos glucolíticos, o que la glucόlisis resulta inhibida por acumulaciόn de metabolitos que, de otro modo, serían eliminados por el flujo sanguíneo. Por ello, la isquemia tiende a provocar una lesiόn de células y tejidos más rápida y grave que la hipoxia en ausencia de isquemia. Mecanismos de la lesiόn isquémica La producción de ATP por las mitocondrias depende de un aporte adecuado de oxígeno y de sustratos energéticos, entre ellos la glucosa. Por ello, la función mitocondrial se ve comprometida inmediatamente al faltar el riego sanguíneo, con la consiguiente falta de producción de ATP. A medida que se reduce la tensiόn de oxígeno en el interior de la célula, se observa una disminuciόn de la fosforilaciόn oxidativa y la generaciόn de ATP. La disminuciόn de ATP hace que falle la bomba de sodio, lo que, a su vez, conduce a flujo de salida de potasio, flujo de entrada de sodio y agua, y edema celular. Hay progresiva pérdida de glucόgeno y menos síntesis de proteínas. La falta de ATP también afecta las bombas de membrana, tanto plasmática como interna, que normalmente mantienen muy bajo el nivel de calcio en el citosol. Ello promueve el aumento de la concentración de calcio en el citosol, donde activa varios sistemas enzimáticos destructivos. Entre ellos, se activan proteasas y fosfolipasas. Ello resulta en una lesión generalizada de membranas. Más sodio, más agua y más calcio entrarán a las células. Con ello, hay rotura de lisosomas y liberación de sus enzimas al citoplasma. Los daños estructurales a estructuras como los ribosomas y a membranas como el Golgi, sumados a la falta de ATP, interfieren con las vías biosintéticas básicas, entre ellas la síntesis de proteínas. La falta de ATP conduce a hinchazón mitocondrial y al cambio del metabolismo aeróbico en anaeróbico. Se producen ácidos orgánicos como el láctico, que disminuyen el pH intracelular. Al bajar el pH se activan las potentes enzimas lisosomales liberadas, lo que lleva a una mayor disolución celular. La pérdida de enzimas y otras proteínas intracelulares a través de una membrana plasmática anormalmente permeable y su paso a la sangre son importantes indicadores de muerte celular. Por ejemplo, las concentraciones séricas elevadas de creatina cinasa MB y troponina del músculo cardiaco son signos tempranos de infarto de miocardio, que se pueden detectar antes de que dicho infarto sea detectable morfológicamente. 14 Unidad 1: Fundamentos de Fisiopatología Lesiόn por isquemia – reperfusiόn El restablecimiento del flujo sanguíneo en los tejidos isquémicos puede favorecer la recuperación de las células si están lesionadas de forma reversible, pero, paradójicamente, también es posible que exacerbe la lesión e induzca muerte celular. En consecuencia, en los tejidos reperfundidos puede continuar la perdida de células, añadida a las que están irreversiblemente dañadas al final de la isquemia. Este proceso, llamado lesión por isquemia-reperfusión, tiene importancia clínica porque contribuye al daño de los tejidos en los infartos de miocardio y cerebrales, y tras los tratamientos aplicados para restaurar el flujo sanguíneo. Se han propuestos diversos mecanismos como el estrés oxidativo y la carga de calcio intracelular. Lesión química (tόxica) La lesión química continúa siendo un problema frecuente en la práctica clínica y una limitación importante para la farmacoterapia. Dado que muchos fármacos son metabolizados en el hígado, este órgano se ve a menudo afectado por la toxicidad farmacológica. De hecho, la lesión hepática tόxica es tal vez el motivo más frecuente por el que se interrumpe el uso terapéutico o el desarrollo de un medicamento. Los productos químicos inducen lesión celular mediante uno de los dos mecanismos generales siguientes: -Toxicidad directa. Algunas sustancias químicas causan lesión directa en las células, combinándose con componentes moleculares esenciales. Por ejemplo, en las intoxicaciones por cloruro mercúrico, el mercurio se une a grupos sulfhidrilos de las proteínas de la membrana celular, incrementando la permeabilidad de esta e inhibiendo el transporte e iones. El cianuro ejerce su toxicidad contra la citocromo oxidasa mitocondrial y, por tanto, inhibe la fosforilaciόn oxidativa. -Conversión en metabolitos tóxicos. La mayoría de los productos químicos tóxicos no son biológicamente activos en estado natural, sino que se transforman en metabolitos tóxicos reactivos, que posteriormente actúan sobre las moléculas diana. Esta modificación suele ser efectuada por las oxidasas de función mixta del citocromo P-450 en el RE liso de las células del hígado y otros órganos. Los metabolitos tóxicos producen afectación de la membrana y lesión celular, sobre todo por formación de radicales libres y ulterior peroxidación lipídica. Calcificación patológica Consiste en un deposito anómalo en los tejidos de sales de calcio. Hay dos formas, la calcificación distrόfica, que tiene lugar con independencia de que la concentración sérica de calcio sea normal; y la calcificación metastásica, casi siempre consecuencia de hipercalcemia secundaria a algún trastorno del metabolismo del calcio. La calcificación distrόfica se encuentra en áreas de necrosis. Aunque es posible que sea un simple indicio de lesión celular previa, con frecuencia provoca disfunción orgánica. Tal es el caso de la valvulopatía cálcica y la aterosclerosis. La calcificación metastásica puede afectar a tejidos normales siempre que haya hipercalcemia. Puede ocurrir en todo el cuerpo, pero afecta principalmente al tejido intersticial de la mucosa gástrica, riñones, pulmones, arterias sistémicas y venas pulmonares. 15 Unidad 1: Fundamentos de Fisiopatología REPASO PRÁCTICO DE LESIÓN Y MUERTE CELULAR. ADAPTACIÓN A LA LESIÓN 1. ¿Qué tipo de adaptaciones puede sufrir las células de un tejido? 2. ¿Cuáles pueden ser los estímulos para el desarrollo de una adaptación? 3. Nombre a las adaptaciones que involucran cambios en el número, tamaño y diferenciación celular 4. Qué característica presentan las células diferenciadas capaces de adaptarse mediante hiperplasia? 5. Las células que no pueden desarrollar hiperplasia cómo se adaptan a una mayor demanda funcional? 6. Cuál es el término opuesto a la hiperplasia? 7. Y el opuesto a la hipertrofia? 8. Qué adaptación celular está implicada en cada caso? • Respuesta de las fibras musculares esqueléticas de un atleta al ejercicio. • Aumento del endometrio durante el ciclo menstrual. • Epitelio mamario en el embarazo. • Respuesta de la musculatura del ventrículo izq. en la estenosis de la válvula aórtica. • Reducción de las fibras musculares por inmovilización de una pierna por fractura. • Reducción del miometrio luego del parto. • Esófago de Barret por reflujo gastroesofágico. 9. ¿Qué significan los términos displasia, aplasia, agenesia e hipoplasia? 10. Piense. ¿En se diferencian la apoptosis y la necrosis? ¿En que situaciones ocurre una y la otra? 11. Lesión celular por isquemia. Explicar los mecanismos fisiopatológicos que relacionan los siguientes eventos bioquímicos entre sí: • • • • Disminución del metabolismo oxidativo / pH intracelular ácido Bajos niveles de ATP / Tumefacción celular Tumefacción celular y pH ácido intracelular / Enzimas lisosomales Calcio citosólico / destrucción celular 16 Unidad 1: Fundamentos de Fisiopatología 12. Armá con las siguientes sentencias tu propio diagrama de flujo, estableciendo relaciones causa-efecto, sobre el daño ocasionado por la hipoxia a las células de un tejido. • • • • • • • • • • • • • • • • • Aumenta la producción de ácido láctico Aumentado metabolismo anaeróbico Aumento de iones Na+ intracelulares Daño a estructuras intracelulares Disminuida actividad de Na+/K+ ATPasa Disminuido metabolismo aeróbico Disminuye el pH intracelular Entrada de agua a la célula Enzimas que eran intracelulares aumentan en el plasma La célula pierde proteínas y enzimas intracelulares La célula se hincha Las membranas intracelulares no retienen a las moléculas Las membranas plasmáticas no retienen las moléculas Menos ATP generado Salen enzimas desde los lisosomas al citoplasma Se agotan las reservas de glucógeno Se degradan los componentes celulares 17