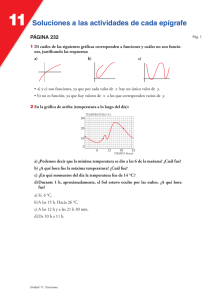
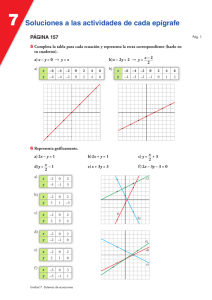
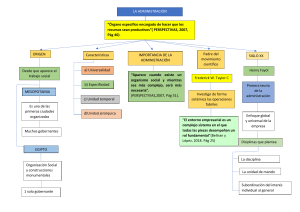
Tema 3 “Fundamentos de la Física atómica y del estado sólido.” En este tema se presentan algunos de los elementos fundamentales que permiten realizar una descripción parcial tanto cuantitativa como cualitativa de los fenómenos cuánticos asociados a: El átomo de hidrógeno. Los átomos multielectrónicos. Los espectros moleculares. Los rayos X. La materia condensada, fundamentalmente algunos aspectos de la Teoría de Bandas de energía para el estado sólido. Objetivos cognoscitivos del tema: 1- Resolver problemas sencillos sobre cuantificación de la energía y del momento angular orbital en el átomo de hidrógeno utilizando los resultados obtenidos de la aplicación de la ecuación de Schrödinger así como la aplicación del modelo de Bohr a este átomo. 2- Aplicar la concepción de diagramas de niveles de energía a problemas sencillos sobre espectros atómicos tanto en el los casos del hidrógeno como en el de los átomos multielectronicos (fundamentalmente de los metales alcalinos) se incluyen las reglas de selección y la elaboración parcial de estos diagramas. 3- Explicar cualitativamente por qué el valor de Zef puede ser fraccionario para los niveles electrónicos de los átomos multielectrónicos. Resolver problemas sencillos donde esté involucrado este concepto. 4- Identificar el principio de exclusión de Pauli como la base de la distribución electrónica en el átomo así como para caracterizar el fundamento de la teoría de bandas de energía en los sólidos . 5- Reconocer cual es el estado fundamental de un átomo o de un ion a partir de realizar la configuración electrónica así como ejemplificar (representándolo en un diagrama de niveles de energía) los estados excitados más próximos al nivel básico. 6- Explicar cualitativamente las diferencias entre los espectros moleculares y los espectros atómicos. 7- Resolver problemas sencillos sobre cálculos de valores de energía asociados a los espectros moleculares. 8- Resolver problemas sencillos donde se apliquen las propiedades fundamentales del espectro de los rayos X y la ecuación de Moseley. 9- Explicar el principio de funcionamiento del láser y las propiedades fundamentales de esta radiación. 10- Resolver problemas sencillos sobre efecto fotoeléctrico interno en semiconductores. 11- Aplicar la distribución de Fermi-Dirac a la solución de ejercicios sencillos sobre bandas de energía en los sólidos, fundamentalmente para el caso de los semiconductores. 12- Caracterizar la conductividad eléctrica en los semiconductores, tanto la conducción intrínseca como la extrínseca. 13- Explicar el principio de funcionamiento de la unión p-n y del diodo emisor de luz (LED). NOTA: Queremos resaltar dos cuestiones: Para el desarrollo del tema 3 este se ha divido en un total de 11 elementos (sub temas) de conocimiento que se exponen en el acápite Sumario a continuación de esta nota. Los contenidos del tema aparecen de manera un tanto dispersa en el texto, por ello, después del Sumario, y con el título “Orientaciones para el trabajo con los subtemas” en esta guía se indica al estudiante puede localizar el contenido (subtema) en el texto y a su vez se han remarcado los aspectos más importantes para el logro de los objetivos asociados a ese elemento del contenido. En ocasiones se sugiere al estudiante que consulte los documentos recogidos en la carpeta “Documentos para guía tema 3”que también está colgada en la nube. Para este curso el tema se desarrollará entre las actividades 8, 10, 11, 12, 13, 14 y 17 de la Secuencia de Actividades. De modo semejante a las guías de estudio precedentes se muestra como el tema se va ajustando a cada una de las actividades programadas. Sumario. 1- Modelo planetario del átomo. Experimento de Rutherford. Postulados de Bohr. Modelo de Bohr para el átomo de Hidrógeno. 2- Solución de la ecuación de Schrödinger para del átomo de H. Modelo mecano cuántico para el H. 3- Spin del electrón. Número cuántico 𝑚𝑠 . Acoplamiento espín-órbita. 4- Átomos multielectrónicos. Principio de exclusión de Pauli. 5- Emisión inducida. Láser. Características ópticas de la emisión láser. (Auto Estudio. Seminario.) 6- Producción de rayos X. Espectros de Rayos X. 7- Espectros moleculares. 8- Fundamentos de la teoría del estado sólido. 9- Bandas de energía en el sólido. 10- Distribución de Fermi-Dirac 11- Fundamentos de la teoría cuántica de la conducción eléctrica en semiconductores. Orientaciones para el trabajo con los subtemas. 1- Modelo planetario del átomo. Experimento de Rutherford. Postulados de Bohr. Modelo de Bohr para el átomo de hidrógeno, H. Este subtema, que en general tributa a casi todos los objetivos del tema 3 e inclusive a objetivos del tema 4, se incluye como contenido de auto estudio y netamente informativo. Se incluye porque ayuda al estudiante a tener una noción de como se han ido formando históricamente las concepciones de la Física Cuántica. El Modelo planetario del átomo se sustenta en lo que se conoce como El Experimento de Rutherford. Para el curso este es un contenido netamente informativo, pero que sirve para sentar las bases de la interpretación de los modelos cuánticos para el átomo que se analizan en el curso. El tema se puede estudiar en el sub epígrafe “Exploración de Rutherford del átomo” pág. 1294 que pertenece al epígrafe 39.2 pág.1292. Consideramos que puede servir como complemento el documento “Modelo planetario del átomo. Experimento de Rutherford” que está recogido en la carpeta “Documentos Complementarios a la Guía de Estudio del Tema 3” Este subtema tributa fundamentalmente a los objetivos 1 y 2. Los postulados de Bohr no aparecen explícitamente en el texto, sin embargo, las ideas esenciales en que estos se fundamentan se abordan en el primer párrafo del epígrafe 39.3 pág. 1297. En 1913 Bohr, propone unas ideas (dos postulados) que servían para sustentar el modelo del átomo propuesto por Rutherford así como, para explicar los llamados espectros de líneas. Este es un contenido también es netamente informativo, pero lo incluimos porque sirvió para sentar las bases de la interpretación de los modelos cuánticos del átomo y para salvar las inconsistencias fundamentales del átomo planetario de Rutherford. ¿Qué dicen los postulados? 1ro- El movimiento de los electrones en los átomos solamente se puede efectuar en un conjunto de órbitas especiales llamadas órbitas estacionarias. Cuando los electrones se mueven en estas órbitas no emiten ondas electromagnéticas. La cantidad de movimiento angular asociada al movimiento del electrón en esas órbitas se calcula como: 𝐿 = 𝑛ℏ donde n=1, 2, 3, · · · ·; esto significa que cada órbita estacionaria se caracteriza por un determinado valor de energía, y por tanto existe 2do- Si un átomo absorbe energía, entonces el electrón puede pasar de una órbita estacionaria de menor energía, Em, a otra órbita de mayor energía, En, posteriormente, el átomo emite un fotón cuando el electrón regresa de esa órbita estacionaria de mayor energía a otra de menor energía. La energía del fotón emitido se puede calcular como: ℎ𝑓 = ℎ𝑐 𝜆 = 𝐸𝑛 − 𝐸𝑚 energía del fotón emitido (ecuación 39.5 pág. 1297) Esto constituyó una ruptura con el pensamiento clásico de la época y contribuyó considerablemente al surgimiento de la mecánica cuántica. Bohr introduce la idea de que los estados del átomo se pueden caracterizar por diagramas de niveles de energía. Los aspectos relacionados con el “Modelo de Bohr para el átomo de hidrógeno, H” abarcan elementos de contenidos tales como: “Las series espectrales del H”, “La cuantificación del momento angular y de la energía” y “Los diagramas de niveles de energía para el H”. Estos contenidos están expuestos en el texto de modo un tanto disperso en los epígrafes 39.2 y 39.3 que se extienden desde la pág. 1292 hasta la pág. 1307. Estudiar el ejemplo resuelto, Ejemplo 39.6 “Exploración del modelo de Bohr” de la pág. 1305 Consideramos que les puede servir de ayuda el documento “Modelo de Bohr para el átomo de H” que está en la carpeta “Documentos para guía tema 3” 2- La ecuación de Schrödinger y el átomo de H. Modelo mecano cuántico del átomo de H” Este subtema tributa fundamentalmente a los objetivo 1 y 2. El contenido de este sub tema se desarrolla a lo largo del epígrafe 41.3 pág. 1372. Enfocar el estudio en los siguientes aspectos tratados en este epígrafe: Cuantificación de la energía, ecuación 41.21 pág. 1373. Cuantificación del momento angular, números cuánticos 𝑙 y 𝑚𝑙 que aparecen respectivamente en las ecuaciones 41.22 pág. 1373 y 41.23 pág. 1374, estudiar la discusión que se establece en el texto sobre los números cuánticos 𝑙 y 𝑚 𝑙 (pág. 1374 y que se ejemplifica en la figura 41.6 de esta misma pág. Analizar los ejemplos resueltos 41.2 y 41.3 pág. 1376. Notación de números cuánticos pág. 1374-1375. Estudiar, con vistas a una comprensión cualitativa, el sub epígrafe “Distribuciones de probabilidad para electrones ” que se desarrolla a partir de la pág. 1376 y se extiende hasta la 1378. Observar los gráficos de la figura 41.8 pág. 1377 y valorar como las probabilidades de localización del electrón para un mismo número cuántico 𝑙 está distribuida a lo largo de su distancia al núcleo, o sea, no se puede asegurar que, para un estado dado del electrón, este se encuentre localizado a una distancia determinada del núcleo, como se supone en el modelo de Bohr. Niveles de energía para el átomo de H y estados degenerados. Este aspecto no está tratado directamente en el texto, se aborda parcialmente en la solución del ejemplo resuelto 41.2. En la tabla 41.1 pág. 1375 se han representado algunos de los estados cuánticos para el átomo de hidrógeno. En esa tabla se colocan “las capas” para este átomo, consideramos necesario precisar que para el átomo de hidrogeno estas capas no tienen mucho significado, pues el hidrógeno solamente tiene un electrón en su órbita y los estados con 𝒏 ≥ 𝟐 son estados excitados donde el electrón pasa muy poco tiempo. El estudiante puede consultar a modo de complemento “Modelo mecano cuántico del átomo de H” que se recoge en la carpeta “Documentos para guía tema 3” 3- Spin del electrón. Número cuántico 𝒎𝒔 Principio de exclusión de Pauli. Este subtema tributa fundamentalmente a los objetivos 2, 3, 4, 5 y 11. El espín es una propiedad esencial y especial de las partículas del micromundo. Esta propiedad no se puede deducir de la solución de la ecuación de Schrödinger. Al mejorarse la resolución de los sistemas experimentales para estudiar los espectros atómicos, se descubrió que la mayoría de las rayas de los espectros estaban compuestas por dos valores de longitudes de ondas muy próximas entre sí, por ejemplo, el doblete del sodio. Justamente se introdujo el concepto del espín para explicar este fenómeno. Este contenido se aborda en el epígrafe 41.5 de la pág. 1383. Formalmente se considera que partículas como los electrones, los protones y los neutrones, entre otras partículas del micromundo, se caracterizan por tener un momento angular propio, conocido como momento de espín y se acostumbra a representar como el vector 𝑆⃗. ⃗⃗ sobre un eje arbitrario Z, se define que la De modo semejante a como se trató la proyección del vector 𝐿 proyección del momento de espín sobre Z se calcula como: 1 𝑆𝑍 = ± ℏ 2 Por analogía el valor del vector 𝑆⃗ se calcula como: 1 1 2 2 𝑆 = ℏ√ (1 + ) Así, para la caracterización del estado de los electrones en el átomo se introduce otro número cuántico, conocido como número cuántico de espín y que convencionalmente se escribe como: 𝑚𝑠 = ± 1 2 Lógicamente la componente 𝑆𝑍 se podrá calcular como: 𝑆𝑍 = 𝑚𝑠 ℏ 4-Átomos multielectrónicos. Principio de exclusión de Pauli. Este subtema tributa fundamentalmente a los objetivos 2, 3, 4 y 5. El tema se aborda en el epígrafe 41.6 pág. 1387. El estudiante debe hacer un esfuerzo y tratar de comprender, al menos cualitativamente, que en los átomos multielectronicos deben producirse fenómenos diferentes a los del átomo de hidrógeno debido a los efectos que pueden producir la existencia de más carga eléctrica en el núcleo y de más electrones orbitando alrededor de este. Tenga presente que los modelos mecanocuánticos se obtienen a partir de la solución de la ecuación de Schrödinger y que a raíz de introducir el número cuántico de espín entonces el estado de cada electrón en el átomo estará caracterizado por cuatro números cuánticos, o sea: 𝜓 = 𝜓(𝑛,𝑙,𝑚𝑙,𝑚𝑠 ) Papel que desempeña el principio de exclusión de Pauli, en las propiedades de los diferent es elementos químicos, sub epígrafe “Principio de exclusión” que comienza en la pág. 1388 4.1- Configuración electrónica. Este subtema tributa fundamentalmente a los objetivos 3, 4 y 5. En los átomos multielectrónicos no se produce la degeneración de los niveles de energía. Cada electrón, de acuerdo a su estado en el átomo, tiene un valor de energía diferente. Tener presente que lo que distingue esencialmente a un elemento químico de otro elemento es lo que se conoce como número atómico, el cual se representa con la letra Z. Para el hidrógeno Z =1, en tanto para el sodio Z = 11, para el hierro Z = 26, y así cada elemento químico se caracteriza por un número atómico diferente. Como se fundamentará más adelante en el curso, este número se corresponde con la cantidad de protones que existe en el núcleo del átomo, y como el átomo es eléctricamente neutro, entonces en el átomo existen Z electrones. A continuación se fundamenta muy someramente, los criterios energéticos que sirven de fundamento a cómo se ubican o distribuyen los electrones en el átomo. La ubicación de los estados energéticos en los diagramas de niveles de energía sigue las siguientes reglas: 1 1- Como el momento de espín se puede orientar de dos formas, 𝑚 𝑠 = ± la que corresponde a 𝑚𝑠 = 1 1 2 − se ubica más bajo que la de 𝑚 𝑠 = . 2 2 2- Para el número cuántico magnético 𝑚𝑙 = 0, ±1, ±2,∙ ∙ , ±𝑙 , de modo semejante al de espín, los niveles se van ubicando de abajo hacia arriba en orden creciente del número 𝑚𝑙 3- Para el número cuántico orbital 𝑙 = 0, 1, 2,∙ ∙ , 𝑛 − 1 , de modo semejante a los dos anteriores, los niveles se van ubicando de abajo hacia arriba en orden creciente del número 𝑙 4- Para los números cuánticos principales, 𝒏 se cumple una regla semejante a las anteriores, pero ocurre que en la medida en que este crece, se hace más efectiva la interrelación entre 𝑛 y 𝑙. Es significativo que el nivel 4s se ubica más bajo que el nivel 3d. A partir de esa combinación de números cuánticos las reglas se complican. Las reglas anteriores constituyen la base de cómo se van ubicando los electrones en las diferentes capas y subcapas de los átomos multielectronicos, a este proceso se le conoce como distribución electrónica en el átomo o configuración electrónica. 4.2- Espectro de los metales alcalinos. Reglas de selección. Este subtema tributa fundamentalmente a los objetivos 3, 4, 5 y 6. En el texto se realiza un breve análisis del espectro del átomo de sodio. Este análisis comienza en la pág. 1391, se extiende hasta introducir la ecuación 41.45 pág. 1392 y concluye con los ejemplos resueltos 41.8 y 41.9 de la pág. 1393. Nótese que en el comentario final del ejemplo 41.9 se sugiere que ese método se puede extender a átomos (iones) que tengan semejanzas con los metales alcalinos, o sea, un único electrón en la subcapa más externa. El tópico “Reglas de selección” se asocia con las regularidades que tiene lugar en el proceso de emisión de los átomos, este se aborda en el sub epígrafe “Reglas de selección” pág. 1382 (este sub epígrafe forma parte del epígrafe 41.4 que comienza en la pág. 1379). Se sugiere al estudiante que consulte el material adjunto “Espectro de los metales alcalinos. Reglas de selección” que se encuentra en la carpeta “Documentos para guía tema 3” 5- Emisión inducida. Láser. Características ópticas de la emisión láser Este subtema tributa fundamentalmente al objetivo 9. Este tema usualmente se orienta como un seminario. Las bases de esta temática se abordan en el epígrafe 39.4 pág. 1307-1310. Los aspectos más importantes a tener en cuenta: Emisión estimulada, bombeo óptico, inversión de la población, aplicación de la distribución de MaxwellBoltzman (39.18 pág. 1307) para caracterizar numéricamente la proporción de átomos excitados en una muestra, estados meta estables, alta coherencia de la emisión láser, aplicaciones del láser. 6- Producción de rayos X. Espectros de Rayos X. Este subtema tributa fundamentalmente al objetivo 8. Esta temática se aborda en dos capítulos del texto y se divide en dos subtemas. El primer subtema, “La producción de rayos X” aparece en el epígrafe 39.2 pág. 1266. En esta primera parte deben concentrar su atención en: El modo en que se produce esta radiación a partir de un aparato como el mostrado en la figura 38.7 pág. 1267, nótese que tiene que aplicarse un voltaje de varios kilovoltios (kV). La imposibilidad de la las leyes de Maxwell para explicar la existencia de una longitud de onda mínima en el espectro continuo de los rayos X, analizar figura 38.8 y la ecuación 38.6 de la pág. 1267. Nótese la dependencia de la longitud de onda mínima respecto al voltaje acelerador. El segundo subtema, “El espectro de rayos X ” aparece en el epígrafe 41.7 pág. 1393, aquí deben concentrar su atención en: La ley de Moseley, ecuación 41.47 pág. 1394, valorar su importancia para la interpretación del número atómico con que se caracterizan a los elementos de la tabla periódica. La forma en que se presenta el espectro característico de los rayos X como se muestra en la figura 41.23 de la pág. 1394. 7- Espectros moleculares. Este subtema tributa fundamentalmente a los objetivos 6 y 7. El tema se trata en el epígrafe 42.2 pág. 1408. El estudiante debe centrar su atención en: Niveles de energía de rotación (pág. 1408-1409) aquí concentrar su atención en cómo se modela una molécula biatómica para calcular su momento de inercia (ecuación 42.6), el número cuántico de rotación 𝑙 (el estudiante no debe confundir este con el “número cuántico orbital 𝒍” que se introdujo anteriormente en el capítulo 41, el texto utiliza el mismo símbolo, pero en el caso del número cuántico orbital este puede tomar los valores 𝒍 = 𝟏, 𝟐,∙ ∙, 𝒏 − 𝟏 en tanto para el número cuántico de rotación este puede tomar infinitos valores tal y como se ver en las ecuaciones 42.2 y 42.3) y los niveles de energía de rotación daos por la ecuación 42.3 y que se muestran en la figura 42.5 pág. 1408. Analizar el ejemplo resuelto 42.2 pág. 1409 Niveles de energía de vibración. Pág. 1410, concentrar su atención en cómo se modela la vibración de una molécula biatómica y su analogía con el oscilador armónico para amplitudes pequeñas comparadas con su radio de equilibrio., analizar las figura 42.6 y 42.7 así como la ecuación 42.7, en esta ecuación no confundir el número cuántico de vibración con el número cuántico principal a pesar de que en el texto están representados por el mismo símbolo. Niveles de energía de rotación y vibración combinados, analizar la figura 42.8 y la ecuación 42.8 pág. 1410. 8- Fundamentos de la teoría del estado sólido. Este subtema tributa fundamentalmente a los objetivos del 10 al 13. El tema se expone a lo largo del epígrafe 42.3 pág. 1412-1415. Para el curso este es un contenido fundamentalmente informativo, donde el estudiante adquiere nociones de la estructura cristalina (de largo alcance) de algunos sólidos. Se familiarizará con el hecho del solape de las envolturas electrónicas tanto en líquidos como en los sólidos y las consecuencias fundamentales que se derivan de este fenómeno, como por ejemplo las llamadas bandas de energía en los sólidos, cuestión que se analiza en el siguiente acápite. Puede resultarle instructivo la solución del ejercicio 42.17 pág. 1434, la cual se expone en el documento “Solución de ejercicio sobre red cristalina” que se encuentra en la carpeta “Documentos para guía tema 3” 9- Bandas de energía en el sólido. Este subtema tributa indirectamente a los objetivos 10 al 13. El tema es abordado en el epígrafe 42.4 pág. 1416. Las ideas básicas en que se sustenta la teoría de Bandas de Energía parten del supuesto de que en un volumen de 1cm 3, para un sólido típico, existen N 1023-1024 átomos. Eso trae como consecuencia que los niveles de energía atómicos que existían para cada átomo aislado se subdividen en N subniveles, veamos a modo de ejemplo el caso del sodio, el nivel básico para el átomo de sodio (aislado) es el 3s 1, pues bien, en el sodio sólido ese estado se divide en alrededor de N estados (niveles de energía) de modo que dos niveles de energías consecutivos apenas difieren en 10-23 eV. A esos grupos formados por aproximadamente 1023 niveles de energías con valores muy próximos entre sí, se les denomina Bandas de Energía. De modo semejante a como ocurre en el átomo asilado, en el sólido existen grupos de valores de energías permitidos y grupos de valores no permitidos, a estos últimos se les conoce como Bandas Prohibidas (BP). Tiene un interés especial la banda de energía permitida para los electrones más externos (electrones de valencia), pues como ya se ha analizado estos son los responsables de los fenómenos químicos y de muchos de los fenómenos físicos. Al grupo de valores de energía permitido a los electrones de valencia se le conoce como Banda de Valencia (BV). Para que los electrones de valencia puedan participar de la conducción de la corriente eléctrica necesitan valores de energías un poco mayores de modo que le permitan liberarse de la interacción con los átomos, a estos grupos de energías necesarios para que se establezca la conducción de la corriente eléctrica se le conoce como Banda de Conducción (BC). En la figura 42.19 pág.1416 aparece el sistema de bandas que caracterizan a los conductores, los semiconductores y a los aislantes o dieléctricos. Necesitamos llamar la atención sobre el hecho de que en dicha figura parece que existe una banda prohibida muy grande para los conductores, pero, lo realmente significativo es que en la banda de valencia, que solamente está ocupada parcialmente) quedan muchos valores de energías disponibles (estados disponibles) y por ello con pequeños campos eléctricos aplicados se consigue que haya conducción de la corriente en la mayoría de los metales. Se sugiere al estudiante que consulte el material adjunto “Bandas de energía en el sólido” que se encuentra en la carpeta “Documentos para guía tema 3” 10- Distribución de Fermi-Dirac. Este subtema tributa fundamentalmente al objetivo 11. El contenido aparece en el sub epígrafe “12- Distribución de Fermi-Dirac” que comienza a desarrollarse a partir de la pág. 1419. Concentrar la atención en la existencia de la llamada energía de Fermi, en la ecuación 42.19 pág. 1419 y en la figura 42.23 (de la misma pág.) que sirve de apoyo para la interpretación de dicha ecuación. Estudiar y analizar el ejemplo resuelto 42.6 pág. 1420. 11- . Fundamentos de la teoría cuántica de la conducción eléctrica en semiconductores. Este subtema tributa fundamentalmente a los objetivos 10, 12 y 13. El tema comienza a tratarse en el epígrafe 42.6 pág. 1422 y 42.7 pág. 1425. Centrar la atención en: Conducción intrínseca, la de los semiconductores puros como el germanio y el silicio, análisis del ejemplo resuelto 42.9 pág. 1423, donde se valora como cambia la conductividad de los semiconductores con la temperatura. Familiarizarse con el concepto de “huecos”, último párrafo de la pág. 1423. Conducción extrínseca: Se comienza a tratar a partir del sub epígrafe “Impurezas” en la pág. 1424. Conocer las diferencias esenciales entre su n semiconductor tipo n y un semiconductor tipo p. Dispositivos semiconductores: Centrar su atención en el principio de funcionamiento de las fotoceldas pág. 1425. Explicar cualitativamente la conducción unidireccional de la unión p-n (diodo semiconductor) pág. 1425-1428. Explicar cualitativamente principio de funcionamiento de un LED, el tema se desarrolla a partir del sub epígrafe “ Dispositivos semiconductores y luz ” pág. 1428. Distribución por Actividades (clases) Actividad 8, C4 “Modelo mecano cuántico del átomo de hidrógeno” Objetivos; Los identificados como 1 y 2. Contenidos. (sub temas 1, 2 y 3 del “sumario”) Número cuántico principal, número cuántico orbital, número cuántico magnético, cuantificación del momento angular orbital. Cuantificación del momento angular de espín, número cuántico de espín. Analizar el ejemplo resuelto: 41.3 pág. 1376; Actividad 9 “Sesión de Prácticas de Laboratorio” Esta actividad se realizará en sesión contraria. Cada grupo se dividirá en parejas. El estudiante dispondrá en formato digital de los documentos conocidos como “Instructivos para el Laboratorio” y del documento “Para estimación de incertidumbres en las mediciones” El profesor organizará la actividad de modo que se realizarán un total de 8 sesiones de laboratorio para el año académico, pero, cada estudiante solamente asistirá a unas sesión de 1 hora 20 minutos. El estudiante se prepara para asistir a su sesión de laboratorio estudiando los correspondientes instructivos. Actividad 10, CP4 “Átomo de hidrógeno” Objetivos; Los identificados como 1 y 2. Contenidos. (sub temas 1, 2 y 3 del “sumario”) Número cuántico principal, número cuántico orbital, número cuántico magnético, cuantificación del momento angular orbital. Cuantificación del momento angular de espín, número cuántico de espín. Diagrama de niveles de energía. Problemas a resolver en clases: 39.30, 39.32 pág. 1322; 41.8, 41.11 y 41.21 pág. 1400 Problemas para consolidación: 39.31 y 39.33 pág. 1322; 41.7, 41.9, 41.10 y 41.13 pág. 1400 Actividad 11, CP*5 “Átomos multielectronicos” Objetivos: Los identificados como 2, 3, 4 y 5. Contenidos. (sub tema 4 del “sumario”) Átomos alcalinos. Reglas de selección. Distribución electrónica. Número atómico efectivo (Zef ). Diagramas de niveles de energía. Problemas a resolver en clases: 41.26 (modificado), 41.30, 41.31 (modificado) y 41. 33 pág. 1401 Problemas de consolidación: 41.27, 41.28, 41.29, 41.32 y 41.34 pág. 1401 Actividad 12, C*5 “Espectros moleculares. Rayos X” Objetivos: Los identificados como 6, 7 y 8. Contenidos. (sub temas 6 y 7 del “sumario”) Moléculas. Modelos moleculares. Masa efectiva. Espectro de rotación. Espectro de vibración. Rayos X. Diagrama característico de rayos X. Ley de Moseley. Diagramas de niveles de energía. Problemas a resolver en clases: sobre rayos X: 38.16 pág. 1282, 41.36 y 41.38 pág. 1401; sobre espectros moleculares 42.8 pág. 1433 y 42.12 pág. 1434 Problemas de consolidación: sobre rayos X: 38.14 y38.15 pág. 1282, 41.37 pág. 1401; sobre espectros moleculares 42.7 y 42.11 pág. 1433 y 42.13 pág. 1434 Actividad 13, C5 “Nociones de la Física del sólido” Objetivos: Los identificados como del 10 al 13. Contenidos. (sub temas del 8 al 11 del “Sumario”) Estructura cristalina. Bandas de energía en los sólidos. Nivel de Fermi. Distribución de FermiDirac. Conducción en metales. Semiconductores, conducción intrínseca y conducción extrínseca. Diodo semiconductor, LEDs. Actividad 14, CP5 “Teoría de Bandas. Semiconductores” Objetivos: Los identificados como del 10 al 13. Contenidos. (sub temas del 8 al 11 del “Sumario”) Bandas de energía en los sólidos. Nivel de Fermi. Distribución de Fermi- Dirac. Semiconductores, conducción intrínseca y conducción extrínseca. Diodo semiconductor, LEDs. Problemas a resolver en clases: 42.21, 42.28, 42.30, pág. 1434 y 42.34 pág. 1435 Problemas de consolidación: 42.19, 42.20, 42.29, 42.31 y 42.32 pág. 1434 y 42.33 pág. 1435