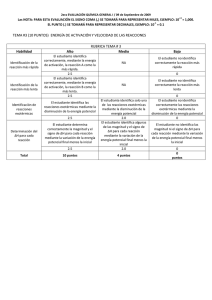
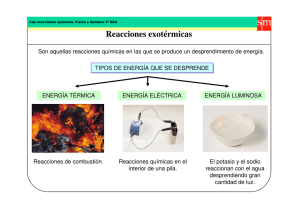
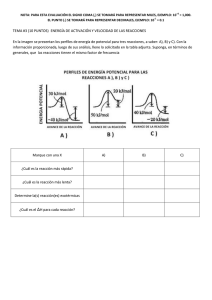
Introducción "La combustión de un combustible es una reacción exotérmica." (Atkins, P. W., et al. Química. 11ª ed. Oxford University Press, 2022). reacción exotérmica es la combustión del metano. En esta reacción, el metano reacciona con el oxígeno para formar dióxido de carbono y agua. La energía que se libera en esta reacción se puede sentir como calor. Otra forma de pensar en una reacción exotérmica es como una reacción en la que el sistema pierde energía. En este caso, el sistema es el conjunto de sustancias que participan en la reacción. Cuando el sistema pierde energía, se calienta. A continuación se muestran algunos ejemplos de reacciones exotérmicas: Combustión de combustibles fósiles Digestión de alimentos Formación de compuestos iónicos Disolución de ácidos en agua Reacciones de oxidación Las reacciones exotérmicas se utilizan en una variedad de aplicaciones, como la generación de energía, la producción de alimentos y la fabricación de productos químicos. Las centrales eléctricas utilizan la combustión de combustibles fósiles para generar electricidad. Las plantas de alimentos utilizan la fermentación para producir alimentos como el yogur y el queso. Las industrias químicas utilizan reacciones exotérmicas para producir una variedad de productos químicos, como el ácido clorhídrico y el níquel. Las reacciones exotérmicas también pueden ser peligrosas. Por ejemplo, las explosiones son causadas por reacciones exotérmicas que ocurren rápidamente. Es importante tener cuidado al trabajar con reacciones exotérmicas. Se da a través………………………….. se le ama