Balanceo de ecuaciones por el método de óxido-reducción Apuntes feb 2023
Anuncio

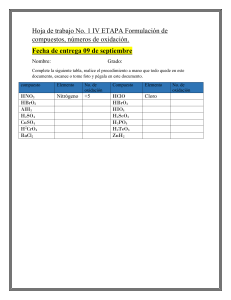
14/02/2023 Balanceo de ecuaciones por el método de óxido-reducción. Reglas para asignar el número de oxidación (Nox) Cualquier elemento en estado libre, tiene número de oxidación cero. Ejemplos: Ca°, H2°, Cl2° Nox =0 Para los iones el número de oxidación es igual a su carga. Ejemplos: ion cloruro Cl-1 Nox = -1 ion magnesio Mg+2 Nox = +2 El número de oxidación del Hidrogeno es 1+, excepto en los hidruros metálicos que es -1. El número de oxidación del oxigeno siempre es 2- excepto en los peróxidos, hiperóxidos y ozónidos que es 1-. Con el Flúor trabaja con 2+, debido a que este elemento es más electronegativo que el oxigeno. 1 14/02/2023 • El número de oxidación de los metales es igual a su valencia iónica. Al formar compuestos con no metales siempre tendrán Nox positivo. Por lo general igual al grupo en que se encuentran en la tabla periódica. • La SUMA algebraica de los números de oxidación de los átomos en un compuesto es igual a cero. Si es un ion, la suma debe ser igual a la carga del ión. • El número Nox positivo o negativo de un elemento en una molécula es relativo, depende de los demás elementos. Donde encontrar la valencia o Nox 2 14/02/2023 Electropositivo + Electronegativo Fe23+O32- (Núm de átomos) X (Nox) Fe = 2 X (3+) = 6+ O= 3 X (2-) = 6- Suma algebraica = (6+)+(-6) = 0 Mg2+S6+O42- (Núm de átomos) X (Nox) Mg = 1 X (2+) = 2+ S= O= 1 X (6+) = 6+ 4 X (2-) = 8- Suma algebraica = (2+)+ (6+)+(-8) = 0 Balanceo de ecuaciones por el método de óxido-reducción. • En un compuesto, cada elemento que lo forma trabaja con un número de oxidación determinado, de tal manera que su suma algebraica debe dar cero, lo que indica que el compuesto es eléctricamente neutro. • Na1+Cl1- en donde (+1) +(-1) = 0 • Al23+O32- en donde (+3)(2)= +6 y (-2)(3)= -6, de manera que (+6)+(-6) = 0 3 14/02/2023 • Para balancear una ecuación por Redox, es importante que tengas presente los siguiente: Elemento químico Se oxida Cuando pierde electrones de su nivel de valencia. Se reduce Cuando gana electrones en su nivel de valencia. Oxidación Cu0 Cu2+ Se pierden 2 e- Reducción N5+ N2+ Se ganan 3e- 4 14/02/2023 Para balancear es recomendable seguir las siguientes instrucciones : 1.Escribir correctamente la ecuación. Fe2O3 + Cu CuO + Fe 2.Se identifican los números de oxidación de cada elemento. Fe2 3+O3 2- + Cu0 Cu2+ O2- + Fe0 3.Se observa los elementos que cambian su Nox y se escriben las semirreacciones. Semirreacción de reducción Fe23+ Fe0 Semirreacción de oxidación Cu0 Cu2+ 4. Se identifican el número de electrones que se ganan y se pierden durante la reacción. Fe23+ +6e- 2Fe0 Cu0 Cu2+ - 2e- 6e- ganados Reducción 2e- perdidos Oxidación 5. Igualar el número de electrones transferidos. 2(Fe2+3 + 6e- 2Fe0 ) 6(Cu0 Cu+2 - 2e- ) 2Fe2+3 + 12e- 4Fe0 6Cu0 6Cu+2 - 12e- 2Fe2+3 + 6Cu0 4Fe0 + 6Cu+2 5 14/02/2023 2Fe2+3 + 6Cu0 4Fe0 + 6Cu+2 6. Finalmente, se escriben los coeficientes en la ecuación general. En caso de no quedar balanceado, se recurre al método de tanteo. 2Fe2O3 + 6Cu 6CuO + 4Fe Reactivos Productos 4______ Fe________4 6______Cu________6 6______O_________6 Si los coeficientes se pueden simplificar en toda la ecuación, se procede a simplificar. Fe2O3 + 3Cu 3CuO + 2Fe Ejercicio KMnO4 + FeO K2O + MnO + Fe2O3 6 14/02/2023 Ejercicio 1+ 7+ 2- 2+ 2- +1 2- 2+ 2- 3+ 2- 2+ 2- +1 2- 2+ 2- 3+ 2- KMnO4 + FeO K2O + MnO + Fe2O3 Ejercicio 1+ 7+ 2- KMnO4 + FeO K2O + MnO + Fe2O3 Semirreacción de reducción Mn7+ Mn2+ Semirreacción de oxidación Fe2+ Fe23+ 7 14/02/2023 Ejercicio 1+ 7+ 2- 2+ 2- +1 2- 2+ 2- 3+ 2- KMnO4 + FeO K2O + MnO + Fe2O3 Semirreacción de reducción Mn7+ Mn2+ Semirreacción de oxidación Fe2+ Fe23+ Mn7+ +5e- Mn2+ Fe3+ - 1e- Fe2 Ejercicio 1+ 7+ 2- 2+ 5e- ganados Reducción 2- +1 2- 1e- perdidos Oxidación 2+ 2- 3+ 2- KMnO4 + FeO K2O + MnO + Fe2O3 Semirreacción de reducción Mn7+ Mn2+ Semirreacción de oxidación Fe2+ Fe23+ Semi ecuaciones Mn7+ +5e- Mn2+ 2Fe2 5e- ganados Reducción Fe23+ - 1e- 1e- perdidos Oxidación 2 (Mn7+ +5e- Mn2+) 5 (2Fe2 Fe23+ -2e-) 8 14/02/2023 Ejercicio 1+ 7+ 2- 2+ 2- +1 2- 2+ 2- 3+ 2- KMnO4 + FeO K2O + MnO + Fe2O3 Semirreacción de reducción Mn7+ Mn2+ Semirreacción de oxidación Fe2+ Fe23+ Mn7+ +5e- Mn2+ Semi ecuaciones 2Fe2 5e- ganados Reducción Fe23+ - 1e- 1e- perdidos Oxidación 2 (Mn7+ +5e- Mn2+) Fe23+ -2e-) 5 (2Fe2 2Mn7+ +10e- 2Mn2+) 5Fe23+ -10e-) 10Fe2 2Mn7+ +10Fe2 2Mn2+ +5Fe23+ Ejercicio 1+ 7+ 2- 2+ 2- +1 2- 2+ 2- 3+ 2- KMnO4 + FeO K2O + MnO + Fe2O3 Semirreacción de reducción Mn7+ Mn2+ Semirreacción de oxidación Fe2+ Fe23+ Semi ecuaciones Mn7+ +5e- Mn2+ 2Fe2 5e- ganados Reducción Fe23+ - 1e- 1e- perdidos Oxidación 2 (Mn7+ +5e- Mn2+) 5 (2Fe2 Fe23+ -2e-) 2Mn7+ +10e- 2Mn2+) 10Fe2 5Fe23+ -10e-) 2Mn7+ +10Fe2 2Mn2+ +5Fe23+ 2KMnO4 + 10FeO K2O + 2MnO + 5Fe2O3 9