Taller de Competencias: Enlaces Químicos y Fuerzas Intermoleculares
Anuncio
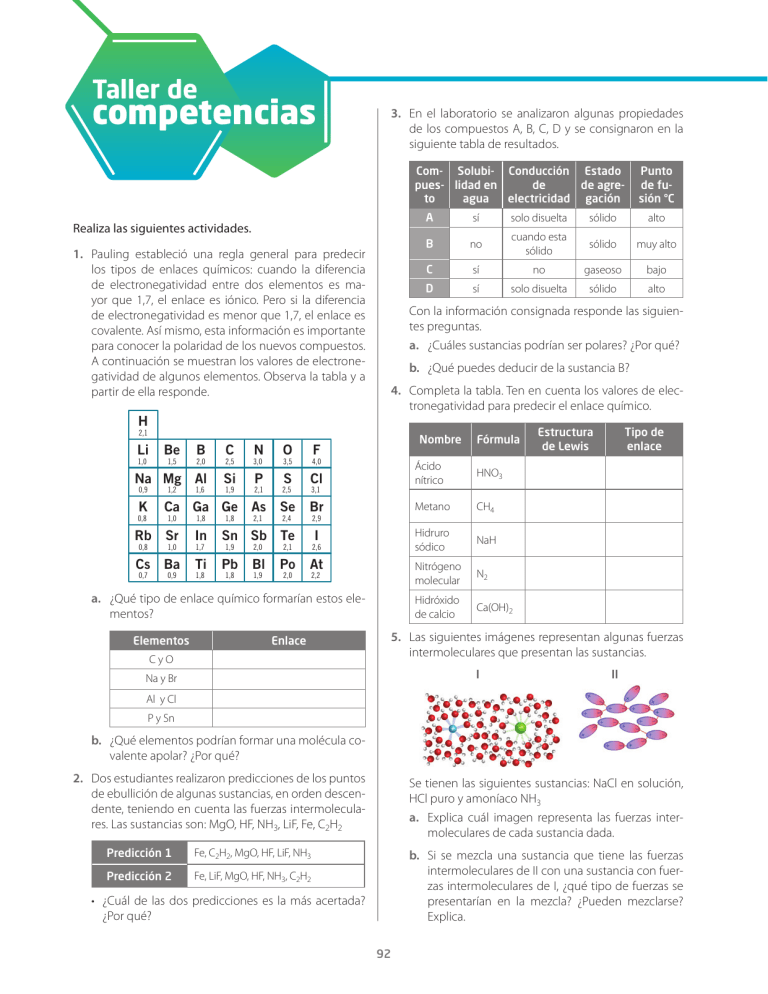
Taller de competencias 3. En el laboratorio se analizaron algunas propiedades de los compuestos A, B, C, D y se consignaron en la siguiente tabla de resultados. Com- Solubi- Conducción Estado pues- lidad en de de agreto agua electricidad gación Realiza las siguientes actividades. 1. Pauling estableció una regla general para predecir los tipos de enlaces químicos: cuando la diferencia de electronegatividad entre dos elementos es mayor que 1,7, el enlace es iónico. Pero si la diferencia de electronegatividad es menor que 1,7, el enlace es covalente. Así mismo, esta información es importante para conocer la polaridad de los nuevos compuestos. A continuación se muestran los valores de electronegatividad de algunos elementos. Observa la tabla y a partir de ella responde. H Be solo disuelta sólido alto B no cuando esta sólido sólido muy alto C sí no gaseoso bajo D sí solo disuelta sólido alto b. ¿Qué puedes deducir de la sustancia B? 4. Completa la tabla. Ten en cuenta los valores de electronegatividad para predecir el enlace químico. Nombre 3,0 N O 3,5 4,0 Na Mg Al Si P S Cl Ácido nítrico HNO3 Se Br Metano CH4 I Hidruro sódico NaH Nitrógeno molecular N2 Hidróxido de calcio Ca(OH)2 0,9 1,2 1,6 1,9 2,1 2,5 F Fórmula 2,5 1,5 C sí 2,0 1,0 B A Con la información consignada responde las siguientes preguntas. a. ¿Cuáles sustancias podrían ser polares? ¿Por qué? 2,1 Li 3,1 K Ca Ga Ge As 1,0 1,8 Rb Sr In Sn Sb Te 1,9 2,0 2,1 2,6 Cs Ba Ti Pb Bl Po At 0,8 0,8 0,7 1,0 0,9 1,7 1,8 1,8 1,8 2,1 1,9 2,4 2,0 2,9 2,2 a. ¿Qué tipo de enlace químico formarían estos elementos? Elementos Enlace CyO Punto de fusión °C Estructura de Lewis Tipo de enlace 5. Las siguientes imágenes representan algunas fuerzas intermoleculares que presentan las sustancias. I Na y Br II Al y Cl P y Sn b. ¿Qué elementos podrían formar una molécula covalente apolar? ¿Por qué? 2. Dos estudiantes realizaron predicciones de los puntos de ebullición de algunas sustancias, en orden descendente, teniendo en cuenta las fuerzas intermoleculares. Las sustancias son: MgO, HF, NH3, LiF, Fe, C2H2 Predicción 1 Fe, C2H2, MgO, HF, LiF, NH3 Predicción 2 Fe, LiF, MgO, HF, NH3, C2H2 Se tienen las siguientes sustancias: NaCl en solución, HCl puro y amoníaco NH3 a. Explica cuál imagen representa las fuerzas intermoleculares de cada sustancia dada. b. Si se mezcla una sustancia que tiene las fuerzas intermoleculares de II con una sustancia con fuerzas intermoleculares de I, ¿qué tipo de fuerzas se presentarían en la mezcla? ¿Pueden mezclarse? Explica. • ¿Cuál de las dos predicciones es la más acertada? ¿Por qué? 92 Sistema de evaluación 6. El gráfico muestra los puntos de ebullición de varios compuestos químicos a una atmósfera de presión. Analízalo y responde las preguntas. • El cloro puede unirse entre sí y formar Cl2, puede constituir ácido clorhídrico HCl y también puede generar una sal como KCl. ¿Qué puede decirse de la polaridad de estos tres compuestos del cloro? Y Punto de ebullición °C 100 HF 0 NH3 H2S -100 -200 8. Las fuerzas intermoleculares son responsables de varios cambio físicos. ¿Cuál es el tipo de fuerza intermolecular responsable de los siguientes sucesos? H 2O PH3 H2Se HBr AsH3 H2Te HI SbH3 SnH4 La sal se disuelve totalmente en agua GeH4 El alcohol se escapa fácilmente del recipiente abierto CH4 2 3 4 Periodo 5 X Congelar un poco de agua a. ¿Qué compuestos tienen mayor punto de ebullición y por qué? 9. Predice la fórmula química del compuesto iónico que se forma entre los siguientes pares de elementos. b. ¿Qué sustancia puede evaporarse más rápido? Explica. Mg y Cl c. ¿Qué tipo de fuerzas intermoleculares crees que presentan PH3, H2S y HI? ¿Por qué? Ca y I 7. La diferencia de electronegatividad puede usarse entre dos átomos para estimar la polaridad de los enlaces químicos. La imagen ilustra este comportamiento. Diferencia de <0,4 electronegatividad molécula homopolar Densidad electrónica Puntos KyS 10. De los siguientes compuestos, subraya aquellos que cumplen la ley del octeto y dibuja las estructuras de Lewis en el cuadro. SF6 Entre 0,4 y 2,0 dipolos CCl4 PCl5 BeF2 AlBr3 ≥2,0 iones Incremento de polaridad Evidencias de aprendizaje Competencias 1 Reconozco la importancia de la electronegatividad para predecir el tipo de enlace. 2 Comprendo la influencia de las fuerzas intermoleculares en los puntos de ebullición. Explicación de fenómenos 3 Conozco las propiedades físicas de los compuestos químicos y planteo argumentos a partir de lo anterior. Explicación de fenómenos 4 Escribo las estructuras de Lewis y predigo el tipo de enlace químico de algunas sustancias. 5 Analizo los tipos de fuerzas intermoleculares y sus propiedades y explico diferentes situaciones a partir de ello. 6 Interpreto gráficos relacionados con las propiedades de las fuerzas intermoleculares. 7 Identifico el momento dipolar de los diferentes tipos de enlace. UCC 8 Establezco la función de las fuerzas intermoleculares en los cambios que experimenta la materia. UCC 9 Predigo las fórmulas químicas de los compuestos iónicos. 10 Señalo la ley del octeto y las estructuras de Lewis para reconocer la estabilidad electrónica de los elementos que participan en el enlace. UCC: Uso comprensivo del conocimiento científico 93 UCC UCC Explicación de fenómenos Indagación Indagación UCC