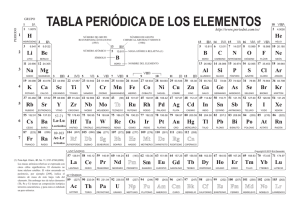
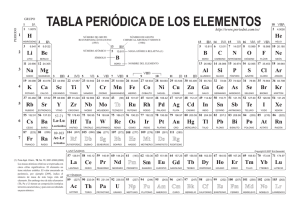
El boro es un elemento químico de la tabla periódica de los elementos que tiene el símbolo B1 y número atómico 5, su masa es de 10,811. Es un elemento metaloide, semiconductor, trivalente que existe abundantemente en el mineral bórax. Hay dos alótropos del boro; el boro amorfo es un polvo marrón, pero el boro metálico es negro. La forma metálica es dura (9,5 en la escala de Mohs) y es un mal conductor a temperatura ambiente. No se ha encontrado libre en la naturaleza. El boro es un elemento con vacantes electrónicas en el orbital; por ello presenta una acusada apetencia de electrones, de modo que sus compuestos se comportan a menudo como ácidos de Lewis, reaccionando con rapidez con sustancias ricas en electrones.23 Entre las características ópticas de este elemento, se incluye la transmisión de radiación infrarroja. A temperatura ambiente, su conductividad eléctrica es pequeña, pero es buen conductor de la electricidad si se encuentra a una temperatura alta. Este metaloide tiene la más alta resistencia a la tracción entre los elementos químicos conocidos; el material fundido con arco tiene una resistencia mecánica entre 1.600 y 2.400 MPa. El nitruro de boro, un aislante eléctrico que conduce el calor tan bien como los metales, se emplea en la obtención de materiales tan duros como el diamante. El boro tiene además cualidades lubricantes similares al grafito y comparte con el carbono la capacidad de formar redes moleculares mediante enlaces covalentes estables. Reactividad En sus compuestos, el boro actúa como un no metal, pero difiere de ellos en que el boro puro es un conductor eléctrico, como los metales y como el grafito (carbono). Al rojo, se combina directamente con el nitrógeno para formar nitruro de boro (BN), y con el oxígeno para formar óxido de boro (B2O3). Con los metales forma boruros, como el boruro de magnesio (Mg3B2). Más extraordinaria es la anómala similitud de los hidruros de boro a los compuestos correspondientes de silicio y el carbono. Existen varios hidruros de boro conocidos con el nombre genérico de boranos, todos ellos tóxicos y de olor muy desagradable. En los ensayos a la llama produce una coloración verde característica. Usos Se usa para fabricar vidrios de borosilicato (p. ej. Pyrex) y esmaltes, principalmente de utensilios de cocina. También se usa para obtener aceros especiales, de gran resistencia al impacto, y otras aleaciones. Debido a su gran dureza se emplea, en forma de carburo, para fabricar abrasivos. El boro tiene varias aplicaciones importantes en el campo de la energía atómica. Se usa en instrumentos diseñados para detectar y contar las emisiones de neutrones. A causa de su gran capacidad de absorción de neutrones, es empleado como amortiguador de control en reactores nucleares y como un material constituyente de los escudos de neutrones. El ácido bórico diluido se utiliza como antiséptico para los ojos y la nariz. Antiguamente se empleaba el ácido bórico para conservar los alimentos, pero se ha prohibido este uso por sus efectos perjudiciales para la salud. El carburo de boro se usa como abrasivo y agente aleador. Aplicaciones El compuesto de boro de mayor importancia económica es el bórax que se emplea en grandes cantidades en la fabricación de fibra de vidrio aislante y perborato de sodio. Otros usos incluyen: Las fibras de boro usadas en aplicaciones mecánicas especiales, en el ámbito aeroespacial, alcanzan resistencias mecánicas de hasta 3600 MPa.4 El boro amorfo se usa en fuegos pirotécnicos por su color verde. El ácido bórico se emplea en productos textiles.5 El boro es usado como semiconductor.6789 Los compuestos de boro tienen muchas aplicaciones en la síntesis orgánica y en la fabricación de cristales de borosilicato. Algunos compuestos se emplean como conservantes de la madera, siendo de gran interés su uso por su baja toxicidad.10 and ReB21112 El B-10 se usa en el control de los reactores nucleares, como escudo frente a las radiaciones y en la detección de neutrones. Los hidruros de boro se oxidan con facilidad liberando gran cantidad de energía por lo que se ha estudiado su uso como combustible.513 En la actualidad, la investigación se está conduciendo en la producción de combustible en forma de hidrógeno con la interacción del agua y de un hidruro de boro (tal como NaBH4). El motor funcionaría mezclando el hidruro de boro con agua para producir el hidrógeno según lo necesitado, de modo que solucionen algunas dificultades de aplicar el hidrógeno con seguridad en el transporte y su correspondiente almacenaje. La investigación se está produciendo en la Universidad de Minessota (Estados Unidos) y en el Instituto de la Ciencia en Rehovot (Israel).1415 Formación Atendiendo a la teoría del Big Bang, en el origen el Universo encontramos como elementos H (hidrógeno), He (helio) y Li-7 (litio-7), pero el B, el quinto elemento de la tabla periódica no tiene presencia apreciable. Por lo tanto en la condensación de las primeras nebulosas, se forman estrellas fundamentalmente de H con una porción de He (helio) y Li-7 (litio-7), en las que se dan los distintos procesos de formación de elementos (Cadena protón-protón, proceso triple a y ciclo CNO). Pero en ninguna de ellas se forma boro como producto, ya que a tales temperaturas (del orden de 107-108k) reacciona a un ritmo mayor del que se forma. Tampoco se forma boro durante el proceso de captura de neutrones, que da como resultado átomos de gran masa atómica. El B se forma en un proceso denominado espalación de rayos cósmicos, que consiste en la rotura de núcleos más pesados que el boro a causa del bombardeo de rayos cósmicos. Al ser tan poco frecuente este proceso, la abundancia cósmica del boro es muy pequeña. Historia Boro. Los compuestos de boro (del árabe buraq y este del persa burah) se conocen desde hace miles de años.16 En el antiguo Egipto la momificación dependía del natrón, un mineral que contenía boratos y otras sales comunes. En China se usaban ya cristales de bórax hacia el 300 a. C., y en la antigua Roma compuestos de boro en la fabricación de cristal. A partir del siglo VIII los boratos fueron usados en procesos de refinería de oro y plata.17 En 1808 Humphry Davy, Gay-Lussac y L. J. Thenard obtuvieron boro con una pureza del 50% aproximadamente, aunque ninguno de ellos reconoció la sustancia como un nuevo elemento, cosa que haría Jöns Jacob Berzelius en 1824.18 El boro puro fue producido por primera vez por el químico estadounidense W. Weintraub en 1909.319 Obtención Cristal de bórax. El boro en su forma circular no se encuentra en la naturaleza. La mayor fuente de boro son los boratos de depósitos evaporíticos, como el bórax y, con menos importancia, la colemanita.2021 El boro también precipita como ácido ortobórico H3BO3 alrededor de algunas fuentes y humos volcánicos, dando sasolitas. También se forman menas de boro naturales en el proceso de solidificación de magmas silicatados; estos depósitos son las pegmatitas. Los yacimientos más importantes de estas menas son los siguientes: yacimientos del bórax se encuentran en California (EE. UU.), Tincalayu (Argentina) y Kirka (Turquía). De colemanita en Turquía y en el Valle de la Muerte (EE. UU.). Sasolitas en lugares geológicamente activos de la región de Larderello (Italia).22232425Se expende en el comercio como Na2B4O7·10 H2O o pentahidratado, se le conoce como Bórax.262728 El boro puro es difícil de preparar; los primeros métodos usados requerían la reducción del óxido con metales como el magnesio o aluminio, pero el producto resultante casi siempre se contaminaba. Puede obtenerse por reducción de halogenuros de boro volátiles con hidrógeno a alta temperatura. El boro presenta multitud de formas alotrópicas que tienen como elemento estructural común un icosaedro regular. La ordenación de los icosaedros puede ser de dos formas distintas: Unión de dos icosaedros por dos vértices, mediante enlaces covalentes normales B - B (figura 1). Unión de tres icosaedros por tres vértices, mediante un enlace de tres centros con dos electrones (figura 2). Figura 1. Figura 2. Dentro de estas posibles uniones, en el boro cristalino los icosaedros pueden asociarse de varias maneras para originar los alótropos correspondientes: Boro tetragonal (T - 50): formado por 50 átomos de boro por celdilla unidad, que son cuatro unidades icosaédricas unidas entre sí por algunos enlaces B - B y de dos boros elementales que actúan como unión tetraédrica entre icosaedros. Posee una densidad de 2,31 g/cm³. Boro romboédrico alfa (R - 12): está formado por láminas de icosaedros unidas paralelamente. Las uniones intralaminares se efectúan por medio de enlaces de tres centros, mientras que las uniones interlaminares se producen mediante enlaces de dos centros. La densidad de este tipo de boro es de 2,46 g/cm³, y presenta un color rojo claro. Boro romboédrico beta (R - 105): formado por doce icosaedros B12 ordenados en forma icosaédrica en torno a una unidad central de B12, es decir, B12(B12)12. Presenta una densidad de 2,35 g/cm³. Abundancia en el universo La abundancia del boro en el universo ha sido estimada en 0,001 ppm, abundancia muy pequeña que junto con las abundancias del litio, el molibdeno y el berilio forma el cuarteto de elementos "ligeros" más escasos en el universo, el resto de elementos de los cuatro primeros periodos — hasta y exceptuando el arsénico— son cuando menos diez veces más abundantes que el boro (exceptuando el escandio y el galio, que son aproximadamente cinco veces más abundantes que el boro). Distribución del boro en el Sistema Solar El boro posee un elevado punto de fusión (2348 K), por lo tanto es un elemento refractario que condensa y se acreciona en las primeras fases de la condensación de una nebulosa. Este hecho lo sitúa en el Sistema Solar Interno, ya que durante la fase del Sol conocida como T-Tauri (fase inicial de la vida de una estrella, durante la cual emite viento solar con una gran intensidad) el viento solar produce un efecto de arrastre sobre las masas de partículas que orbitan alrededor, arrastrando las menos densas hacia el exterior (elementos volátiles) y permaneciendo las más densas (elementos refractarios). Es decir que encontraremos boro en los planetas rocosos que forman el Sistema Solar Interno, pero la abundancia descenderá mucho en los planetas gaseosos del Sistema Solar Externo. Distribución del boro en los meteoritos Los meteoritos (condritas y acondritas) muestran concentraciones de boro alrededor de 0,4 y 1,4 ppm respectivamente. Estas concentraciones son substancialmente mayores que las del universo, ya que otros elementos más volátiles que el boro se encuentran dispersos por el espacio en fase gaseosa (elementos atmófilos cómo el hidrógeno y el helio, que no se encuentran en forma de sólidos ni condensan), o formando "nubes" de gas alrededor de sólidos a causa de un campo gravitatorio, o en forma de fluido atmosférico. La abundancia de estos elementos en fase gaseosa representa una buena parte de la abundancia de materia en el universo, y si consideramos que los meteoritos (ya sean condritas o acondritas), al ser sólidos, no disponen de estos elementos, o no disponen de ellos en abundancia, entonces la abundancia de los otros elementos se verá aumentada. La diferencia entre las abundancias de condritas y acondritas se entiende en el hecho de que el boro es un elemento exclusivamente litófilo, es decir que tiene preferencia a incorporarse a las fases líquidas silicatadas. Las condritas son rocas o muestras de roca extraterrestre que no ha pasado por un proceso de diferenciación, es decir que no ha llegado a fundirse ni a separarse en silicatos, metales y sulfuros. Las acondritas en cambio son muestras de roca silicatada, procedentes de masas diferenciadas, por ello su abundancia de boro es mayor que en las condritas.