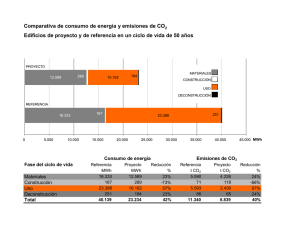
ERRNVPHGLFRVRUJ C A P Í T U L O 29 TRANSPORTE DE OXÍGENO Y DIÓXIDO DE CARBONO EN LA SANGRE Walter F. Boron TRANSPORTE DE O2 La cantidad de O2 disuelto en la sangre es demasiado pequeña para satisfacer las necesidades metabólicas del cuerpo La sangre transporta oxígeno en dos formas. Más del 98% del O2 se une normalmente a la hemoglobina en el interior de los eritrocitos, también conocidos como glóbulos rojos (v. págs. 434-435). Una fracción muy pequeña se disuelve físicamente en las fases acuosas del plasma sanguíneo y del citoplasma de las células sanguíneas (predominantemente los eritrocitos). ¿Cuál es el significado del O2 que está unido a la hemoglobina? Imagínese que exponemos 1 litro de plasma sanguíneo, inicialmente sin O2, a una atmósfera que tiene la misma Po2 que el aire alveolar, 100 mmHg. El oxígeno se desplazará desde la atmósfera hasta el plasma hasta que se alcance el equilibrio, momento en el cual la concentración de O2 disuelto ([O2]Dis) en la sangre sigue la ley de Henry (v. pág. 593): [O2 ]Dis = kO2 ⋅ PO2 (29-1) Si expresamos la Po2 en unidades de mmHg a 37 °C y la [O2]Dis en unidades de (ml de O2 gaseoso)/(dl de sangre), entonces la solubilidad ko2 es ∼0,003 ml de O2/(dl de sangre × mmHg). Para la sangre arterial, 0,003 ml de O2 ⋅100 mmHg 100 ml de sangre ⋅ mmHg = 0,3 ml de O 2 /100 ml de sangre [O2 ]dis = (29-2) ¿Es esta capacidad de transporte de O2 adecuada para aportar O2 a los tejidos del cuerpo? Si estos tejidos pudieran extraer todo el O2 disuelto en la sangre arterial, de manera que no quedara O2 en la sangre venosa, y si el gasto cardíaco (v. pág. 414) fuera de 5.000 ml/min, entonces, de acuerdo con el principio de Fick (v. pág. 423), el aporte de O2 disuelto a los tejidos sería: Aporte de O2 O2 V flujo sanguíneo plasmática de O2 Concentración 5.000 ml de sangre 0,3 ml de O 2 = ⋅ min 100 ml de sangre = 15 ml de O 2 /min (29-3) Sin embargo, el ser humano promedio de 70 kg consume en reposo O 2 a una tasa de ∼250 ml/min. El O 2 disuelto podría satisfacer las necesidades metabólicas del cuerpo solo si el gasto © 2017. Elsevier España, S.L.U. Reservados todos los derechos cardíaco aumentara en un factor de 250/15, o casi 17 veces. Por tanto, el cuerpo no puede utilizar el O2 disuelto como mecanismo de transporte de O2. La hemoglobina está formada por dos subunidades α y dos β, cada una de las cuales tiene un «hemo» que contiene hierro y una «globina» polipeptídica La hemoglobina (Hb) normal del adulto es un tetrámero que tiene un peso molecular de ∼68 kDa; cada monómero está formado por un hemo y una globina (fig. 29-1A). El hemo es un compuesto porfirínico coordinado con un único átomo de hierro. La globina es un polipéptido, que puede ser una cadena α (141 aminoácidos) o una cadena β (146 aminoácidos). La homología entre las cadenas α y β es suficiente porque tienen conformaciones similares, una serie de siete hélices que rodean un único hemo. Por tanto, la molécula de Hb completa tiene la estequiometría [α(hemo)]2[β(hemo)]2 y se puede unir a hasta cuatro moléculas de O2, una por cada átomo de hierro. Los eritroblastos (v. págs. 431-433), que sintetizan la Hb, coordinan de forma estricta la producción de cadenas α, cadenas β y hemo. Hemo es un término general para un ion metálico quelado a un anillo de porfirina. En el caso de la Hb, el metal es hierro en estado Fe2+ o ferroso (v. fig. 29-1B). La porfirina está formada por cuatro anillos pirrólicos unidos entre sí que, a través de sus átomos de nitrógeno, coordinan un único Fe2+ situado en el centro. Como el complejo hierro-porfirina es rico en dobles enlaces conjugados, absorbe fotones de energía relativamente baja (es decir, luz en el intervalo visible). La interacción entre el O2, el Fe2+ y la porfirina hace que el complejo tenga color rojo cuando está totalmente saturado de O2 (es decir, sangre arterial) y color morado cuando está desprovisto de O2 (es decir, sangre venosa). La Hb se puede unir al O2 solo cuando el hierro está en el estado Fe2+. El Fe2+ de la Hb se puede oxidar a hierro férrico (Fe3+), de forma espontánea o bajo la influencia de compuestos como los nitritos y las sulfonamidas. La consecuencia de esta oxidación es la formación de metahemoglobina (metHb), que no se puede unir al O2. Dentro de los eritrocitos, una enzima que contiene hemo, la metahemoglobina reductasa, utiliza la forma reducida del dinucleótido de nicotinamida y adenina (NADH) para reducir la metHb y transformarla de nuevo en Hb, de manera que solo ∼el 1,5% de la Hb total está en estado de metHb. En la infrecuente situación en la que un defecto genético produce una carencia de esta enzima, N29-1 la metHb puede representar el 25% o más de la Hb total. Esta carencia conlleva una disminución de la capacidad de transporte de O2, lo que produce hipoxia tisular. booksmedicos.org 647 扯潫獭敤楣潳牧 CAPÍTULO 29 • Transporte de oxígeno y dióxido de carbono en la sangre 647.e1 N29-1 Metahemoglobinemia Colaboración de Walter Boron en el retículo endoplásmico y en la membrana externa mitocondrial, donde es importante para diversas reacciones (p. ej., síntesis de ácidos grasos y colesterol, metabolismo de fármacos mediado por el citocromo P-450). Una deficiencia en la forma soluble de los eritrocitos (habitualmente causada por mutaciones sustitutivas que reducen la estabilidad de la enzima) produce metahemoglobinemia de tipo I, que habitualmente no es grave. Una deficiencia en la forma unida a la membrana produce metahemoglobinemia de tipo II, que puede producir retraso mental grave y problemas neurológicos. La enfermedad de tipo I se puede tratar con los agentes reductores ácido ascórbico y azul de metileno, en monoterapia o combinados. 3. Oxidación del Fe2+ de la Hb inducida por toxinas. La oxidación del Fe2+ de la Hb a Fe3+ puede producirse por tres mecanismos: (a) oxidación directa, promovida en condiciones hipóxicas; (b) oxidación indirecta en presencia de O2 unido, un mecanismo que es importante en la metahemoglobinemia producida por nitritos, y (c) oxidación inducida por fármacos, en la que los metabolitos de diversos fármacos (p. ej., aminobencenos y nitrobencenos) favorecen la oxidación. BIBLIOGRAFÍA Percy MJ, McFerran NV, Lappin TRJ. Disorders of oxidized haemo­ globin. Blood Rev 2005;19:61-8. Prchal JT, Borgese N, Moore MR, et al. Congenital methemoglobine­ mia due to methemoglobin reductase deficiency in two unrelated American Black families. Am J Med 1990;89:516-22. © Elsevier. Fotocopiar sin autorización es un delito. El aumento de la cantidad de Hb con el hierro en estado oxidado o Fe3+ (es decir, férrico) se conoce como metahemoglobinemia. Como se señala en las páginas 647-648, el problema que surge es que, con Fe3+ en el anillo porfirínico de la Hb, no se puede unir el O2, con la consiguiente reducción de la capacidad de transporte de O2 de la sangre. El hierro Fe2+ (es decir, ferroso) de la Hb se oxida espontáneamente a Fe3+ y una familia de enzimas denominadas metahemoglobina reductasas devuelve normalmente la Hb al estado ferroso. Puede producirse metahemoglobinemia por tres mecanismos: 1. Formas M mutantes de la Hb. Normalmente la porción globínica de la Hb envuelve el anillo porfirínico de tal forma que limita la accesibilidad del O2 al Fe2+. En las formas M de la Hb (de las cuales se han identificado al menos ocho), mutaciones puntuales en las cadenas de las globinas α o β permiten que el O2 se aproxime más al Fe2+ y que lo oxide, en lugar de unirse a él. Esta acción desplaza el equilibrio entre la velocidad, normalmente lenta, de la oxidación y la de la actividad reductásica hacia la formación de Fe3+. 2. Deficiencia genética (autosómica recesiva) de una o de las dos variantes de las enzimas metahemoglobina reductasas. La enzima es la dinucleótido de nicotinamida y adenina reducido (NADH)–citocromo b5 reductasa (cytb5: E.C.1.6.2.2). Están presentes dos variantes de splicing (procesamiento diferencial del ARNm) que difieren en la región N-terminal: (a) una forma soluble con 275 aminoácidos, y (b) una forma unida a la membrana con 300 aminoácidos. La forma unida a la membrana está presente principalmente 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 648 SECCIÓN V • Sistema respiratorio Figura 29-1 Estructura de la hemoglobina. El entorno que ofrece la porción de globina de la Hb es fundamental para la interacción O2-hemo. Para que sea útil, esta interacción debe ser totalmente reversible en condiciones fisiológicas, lo que permite la captación y la liberación repetidas de O2. La interacción del O2 con el Fe2+ libre normalmente produce Fe3+; el ejemplo más sencillo de esta reacción es el óxido. Incluso con hemo aislado, el O2 oxida irreversiblemente el Fe2+ a Fe3+. Sin embargo, cuando el hemo forma parte de la Hb, interacciones con ∼20 aminoácidos envuelven el hemo de la globina, de manera que el O2 se une de forma laxa y reversible al Fe2+. El residuo fundamental es una histidina que se une al Fe2+ y dona una carga negativa que estabiliza el complejo Fe2+-O2. Esta histidina también es fundamental para transmitir, al resto del tetrámero de la Hb, la información de que una molécula de O2 está unida al Fe2+ o no. Cuando los cuatro hemos no están unidos a O2, cada una de las cuatro histidinas tira de su Fe2+ por encima del plano de su anillo porfirínico una distancia de ∼0,06 nm (la conformación azul de la fig. 29-1C), con lo que se distorsiona el anillo porfirínico. Así, el enlace Fe2+-histidina está sometido a tensión en la desoxihemoglobina, tensión que transmite al resto de la subunidad α o β, y desde aquí al resto de la molécula de Hb. Los diversos componentes del tetrámero de Hb están tan estrechamente entrelazados como si estuvieran unidos por un sistema perfectamente encajado de palancas y articulaciones, que nin­ guna subunidad individual puede abandonar este estado tenso (T) salvo que lo abandonen juntas. Como la forma del hemo en el estado T inhibe por mecanismos estéricos el acercamiento del O2, la Hb vacía tiene una afinidad muy baja por el O2. Cuando una molécula de O2 se une a uno de los átomos de Fe2+, el Fe2+ tiende a descender hacia el plano del anillo porfirínico. Si el Fe2+ realmente pudiera moverse, aplanaría el anillo y alivia­ ría la tensión del enlace Fe2+-histidina. Cuando se une un número suficiente de moléculas de O2, se acumula suficiente energía para que las cuatro subunidades de la Hb pasen simultáneamente al estado relajado (R), independientemente de que estén unidas a O2 o no. En este estado R, con el hemo aplanado, la molécula de Hb tiene una afinidad por el O2 que es ∼150 veces mayor que en el estado T. Así, cuando la Po2 es cero, todas las moléculas están en el estado T y tienen una afinidad muy baja por el O2. Cuando la Po2 es muy elevada, todas las moléculas de Hb están en el estado R y tienen una elevada afinidad por el O2. A valores intermedios de Po2 hay un equilibrio entre las moléculas de Hb en los estados T y R. La mioglobina (Mb) es otra proteína de unión al O2 que contiene hemo y que es específica del músculo (v. pág. 249). La porción globínica de la Mb surgió en un fenómeno de duplicación génica a partir de una globina primitiva. Duplicaciones adicionales en la rama no relacionada con la Mb llevaron primero a las cadenas α y β de la Hb, y después a otras cadenas similares a α y β (cuadro 29-1). La Mb actúa como un monómero, homólogo a una cadena α o β de la Hb. Aunque es capaz de unirse a una única molécula de O2, la Mb tiene una afinidad por el O2 mucho mayor que la Hb. 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 CAPÍTULO 29 • Transporte de oxígeno y dióxido de carbono en la sangre 649 CUADRO 29-1 Formas de la hemoglobina L a forma adulta de la hemoglobina normal (α2β2), conocida como HbA, es tan solo una de las diversas formas normales que están presentes durante la vida prenatal y posnatal. Algunas de estas otras hemoglobinas contienen cadenas similares a las cade­ nas α (p. ej., α y ζ) o a las cadenas β (p. ej., β, γ, δ y ε), mientras que otras presentan modificaciones postraduccionales. Los tres genes de las cadenas similares a α (todos codifican 141 aminoácidos) se agrupan en el cromosoma 16: en el extremo 5’ del grupo está el gen de una cadena ζ, seguido por dos para la cadena α. También hay seudogenes para ζ y α. Los cinco genes de las cadenas similares a β (todos los cuales codifican 146 aminoácidos) están agrupados en el cromosoma 11: comenzando en el extremo 5’ hay uno para ε, seguido por dos para γ (γG codifica glicina en la posición 136, y γA alanina), uno para δ y otro para β. También hay un seudogén para β. Una región de control del locus regula la expresión de estas cadenas similares a β durante el desarrollo (v. págs. 80-81). Las cuatro hemoglobinas prenatales (tabla 29-1) están for­ madas por diversas combinaciones de dos cadenas similares a α (p. ej., α y ζ) y dos cadenas similares a β (p. ej., ε y γ). En fases muy tempranas de la vida, cuando la eritropoyesis se produce en el saco vitelino, los productos de la hemoglobina son las tres hemoglobinas embrionarias. Cuando la eritropoyesis pasa a realizarse en el hígado y el bazo, aproximadamente a las 10 semanas de gestación, el producto de hemoglobina es la hemoglobina fetal, o HbF (α2γ2). Los eritrocitos que contienen HbF tienen mayor afinidad por el O2 que los que contienen HbA, debido a las propiedades especiales de las cadenas γ. La sangre del recién nacido contiene HbA y HbF; esta última disminuye gradualmente cuando el lactante tiene 1 año de edad hasta alcanzar las concentraciones mínimas que son caracterís­ ticas del adulto (raras veces >1-2% de la hemoglobina total). Cuando se produce una sobrecarga intensa del sistema eritroide, como en la hemólisis intensa (v. pág. 429), la insuficiencia de la médula ósea o la recuperación después de un trasplante de médula ósea, los precursores eritroides inmaduros pueden verse obligados a madurar antes de que se hayan diferenciado lo suficiente para producir HbA. En estas condiciones pueden aumentar mucho las concentraciones circulantes de HbF. En algunos casos hereditarios la HbF persiste en el adulto, sin consecuencias clínicamente importantes. TABLA 29-1 Estructura de las subunidades de las hemoglobinas prenatales y de componentes minoritarios SUBUNIDAD SIMILAR A α SUBUNIDAD SIMILAR A β Gower 1 ζ ε Embrionaria Gower 2 α ε Embrionaria Portland ζ γ Embrionaria HbF (fetal) α γ Fetal HbA2 α δ Posnatal HbA (adulto) α β Posnatal © Elsevier. Fotocopiar sin autorización es un delito. Hb MOMENTO DE EXPRESIÓN Por tanto, en los capilares la Hb puede transferir su O2 hacia una Mb situada en el interior de una célula muscular; esta Mb a su vez transfiere el O2 hasta la siguiente Mb y así sucesivamente, lo que acelera la difusión del O2 a través de la célula muscular. Debido a la baja solubilidad del O2, esta acción es esencial: hay una cantidad insuficiente de O2 disuelto para establecer un gradiente intracelular de O2 suficientemente grande como para liberar cantidades adecuadas de O2 hacia las mitocondrias. Incluso la sangre del adulto contiene varias hemoglobinas minoritarias normales (tabla 29-2), que suponen el 5-10% de la hemoglobina sanguínea total. En la hemoglobina HbA 2 (∼2,5% de la hemoglobina total), las cadenas δ sustituyen a las cadenas β de la HbA. Aunque se desconoce la importancia fisiológica de la HbA2, las cadenas δ reducen la precipitación de la hemoglobina drepanocítica (v. más adelante). Las otras tres hemoglobinas mino­ ritarias se deben a la glucosilación no enzimática de la HbA. Se forma HbA1a, HbA1b y HbA1c cuando la glucosa-6-fosfato intracelular reacciona con los grupos aminoterminales de las cadenas β de la HbA. En la diabetes mellitus mal controlada, una enfermedad que se caracteriza por disminución de la insulina o de la sensibilidad a la insulina (v. cuadro 51-5) están elevadas las concentraciones sanguíneas de glucosa y, con ellas, las concentraciones intracelulares de glucosa-6-fosfato. En consecuencia, la hemoglobina glucosilada puede representar el 10% o más de la hemoglobina total. Como la glucosilación de la hemoglobina es irreversible, y como el eritrocito tiene una media de vida de 120 días, las concentraciones de estas hemoglobinas glucosiladas tienen utilidad clínica para evaluar el con­ trol a largo plazo de la glucemia en diabéticos. Hay numerosas hemoglobinas anormales, la mayoría de las cua­ les están producidas por sustituciones de un único aminoácido en una de las cadenas polipeptídicas. Una de las que tiene más impor­ tancia clínica es la HbS, o hemoglobina drepanocítica, en la que una valina sustituye al glutamato que normalmente está presente en la posición 6 de la cadena β. Aunque la HbS oxigenada tiene una solubilidad normal, la HbS desoxigenada presenta aproximadamente la mitad de solubilidad que la HbA desoxigenada. En consecuencia, en entornos con poco O2, la HbS puede cristalizar en fibras largas, lo que da a los eritrocitos un aspecto similar a una hoz (drepanocitos o eritrocitos falciformes). Los drepanocitos pueden interrumpir el flujo sanguíneo en vasos pequeños, lo que produce muchos de los sín­ tomas agudos de la «crisis drepanocítica», como dolor, insuficiencia renal, hemorragias retinianas y necrosis ósea aséptica. Además, los drepanocitos son propensos a la hemólisis (media de vida <20 días), lo que produce una anemia hemolítica crónica. TABLA 29-2 Composición de la Hb total de la sangre humana del adulto TIPO DE Hb FRACCIÓN DE LA Hb TOTAL HbA ∼92% HbA1a 0,75% HbA1b 1,5% HbA1c 3-6% HbA2 2,5% Total 100% La curva de disociación de la Hb-O2 tiene forma sigmoidea por la cooperación entre las cuatro subunidades de la molécula de Hb Imagínese que exponemos sangre entera (v. págs. 429-431) a una fase gaseosa con una Po2 que podemos establecer en cualquiera de diversos valores (fig. 29-2). Por ejemplo, podríamos incubar la sangre con una Po2 de 40 mmHg, típica de la sangre venosa mixta, y centrifugar una muestra para separar el plasma de los 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 650 SECCIÓN V • Sistema respiratorio (dl de sangre). El eje de ordenadas de la izquierda muestra los mismos datos expresados como porcentaje de saturación de O2 de la Hb (So2 o «Sat»). Para calcular la So2 es necesario conocer la cantidad máxima de O2 que se puede unir a la Hb a valores extremadamente altos de Po2. Expresado como gramos de proteína Hb, esta capacidad de O2 es ∼1,39 ml de O2/g de Hb, asumiendo que no haya nada de metHb. En la vida real la capacidad de O 2 puede ser más próxima a 1,35 ml de O2/g de Hb porque el O2 no se puede unir a Hb que esté en el estado Fe3+ (p. ej., MetHb) o, como se plantea a continuación, que esté unida a monóxido de carbono. Podemos traducir esta capacidad de O2 en un valor que representa la cantidad máxima de O2 que se puede unir a la Hb presente en 100 ml de sangre. Si el contenido de Hb es 15 g de Hb/dl de sangre (es decir, el valor normal para un varón adulto), entonces Máxima cantidad de O 2 unida a la Hb = (capacidad de O 2 de la Hb) × (contenido de Hb de la sangre) 1,35 ml de O 2 15 g de Hb = ⋅ (29-4) g de Hb dl desangre = ∼ 20,3 (ml de O 2 )/dl de sangre La saturación porcentual de Hb es Figura 29-2 Determinación del contenido de O2 del plasma sanguíneo y los eritrocitos. Figura 29-3 Curva de disociación de la Hb-O2 normal. El eje de ordenadas de la derecha muestra el contenido de O2. Para la curva roja (contenido de O2 de la Hb), asumimos una concentración de 15 g de Hb/dl de sangre y una capacidad de transporte de O2 de 1,35 ml de O2/g de Hb. La curva marrón es la suma de las curvas roja y verde. El eje de ordenadas de la izquierda, que se refiere solo a la curva roja, muestra el porcentaje de saturación de la Hb o So2. eritrocitos, como se haría para medir el hematocrito (v. págs. 102 y 429). A continuación se podría determinar de forma individual el contenido de O2 del plasma (es decir, el O2 disuelto) y los eritrocitos. Si se sabe cuánta agua hay dentro de los eritrocitos, se puede restar la cantidad de O2 disuelto en esta agua del O2 total, obteniéndo­ se la cantidad de O2 unido a la Hb. Si se repite este ejercicio en un intervalo de valores de Po2 se obtiene la curva roja de la figura 29-3. El eje de ordenadas de la derecha muestra el O2 unido a la Hb en las unidades (ml de O2)/ Saturación % de Hb = O2 unido realmente a la Hb ⋅100 capacidad de O2 de la Hb (29-5) Obsérvese que la curva de la figura 29-3 es sigmoidea, o con forma de S, debido a la cooperación entre los cuatro lugares de unión al O2 de la molécula de Hb. A valores bajos de Po2, los aumentos de la Po2 producen aumentos relativamente pequeños de la unión al O2, lo que refleja la afinidad relativamente baja por el O2 de la Hb en el estado T. A valores moderados de Po2, la cantidad de O2 unido aumenta más rápidamente con los aumentos de la Po2, lo que refleja la mayor afinidad por el O2 a medida que más moléculas de Hb pasan al estado R. La Po2 a la que la Hb está saturada a la mitad se conoce como P50. Por último, la curva de Hb-O2 frente a Po2 se aplana a valores muy elevados de Po2, a medida que se satura la Hb. La diferencia de saturación de la Hb entre los valores bajos y los valores altos de Po2 es la base de una importante herramienta clínica, el oxímetro de pulso (cuadro 29-2). A la Po 2 presente en la sangre arterial normal (Pao 2 ), ∼100 mmHg, la saturación de Hb (Sao2) es de ∼97,5%, o 19,7 ml de O2/dl unidos a la Hb (tabla 29-3). El O2 disuelto (la curva morada de la fig. 29-3) añadiría otros 0,3 ml de O2/dl adicionales hasta un contenido total de O2 de 20,0 ml de O2/dl (punto a de la curva marrón de la fig. 29-3). En la sangre venosa mixta, en la que la Po2 (PvO2 ) es ∼40 mmHg, la saturación de la Hb (SvO2 ) es ∼75%, o 15,2 ml de O2/dl unido a la Hb (v. tabla 29-3). El O2 di­ suelto añadiría 0,1 ml de O2/dl hasta un total de 15,3 ml de O2/dl (punto v de la fig. 29-3). La diferencia del contenido total de O2 entre los puntos a y v, la diferencia a-v, es la cantidad de O2 que añaden los pulmones a la sangre en los capilares pulmonares, que es la misma cantidad que extraen los tejidos de la sangre en los capilares sistémicos: Diferencia a − v de contenido total de O2 Contenido de O2 Contenido de O2 la sangre arterial la sangre venosa mixta de de 20,0 ml de O 15,3 ml de O 2 2 ∆C(a − v)O2 = − dl de sangre dl de sangre 4,7 ml de O2 = dl de sangre 扯潫獭敤楣潳牧 (29-6) 扯潫獭敤楣潳牧 CAPÍTULO 29 • Transporte de oxígeno y dióxido de carbono en la sangre 651 CUADRO 29-2 Medición de la saturación de la Hb con oxígeno en la práctica clínica: el oxímetro de pulso L os diferentes colores de la sangre venosa y arterial reflejan la diferencia en la absorción de la luz entre la Hb oxigenada y desoxigenada. Los médicos aprovechan habitualmente estas diferencias para obtener mediciones sencillas y no invasivas de la saturación de O2 arterial (Sao2) de la Hb en los pacientes. El oxímetro de pulso (o pulsioxímetro) tiene una sonda que se fija a la oreja, un dedo de la mano o cualquier parte del cuerpo en la que se pueda acceder desde el exterior a vasos sanguíneos pulsátiles. En un lado del lecho vascular pulsátil el oxímetro de pulso emite luz roja e infra­ rroja; en el otro lado detecta la luz que se transmite a través del lecho capilar y calcula la absorción. Estas absorciones totales tienen dos componentes: (1) un componente no pulsátil que se debe a los tejidos estacionarios, incluyendo la sangre dentro de los capilares y las venas, y (2) un componente pulsátil que se origina en la sangre que hay dentro de las arteriolas y las arterias. La diferencia entre la absorción total y la absorción no pulsátil es, por tanto, el componente pulsátil, que representa únicamente la sangre arterial u oxigenada. Como la Hb oxigenada y la Hb desoxigenada absorben la luz roja e infrarroja de forma diferente, el oxímetro de pulso puede calcular la Sao2 a partir del cociente de luz pulsátil absorbida con las dos longitudes de onda. El oxímetro de pulso realiza esta magia utilizando un microprocesador y un programa informático sofisticados para generar resultados que tienen una elevada concordancia con los que ofrece el análisis de los gases sanguíneos de una muestra de sangre arterial. El oxímetro de pulso mide la saturación de O2 en la sangre arterial. Como los capilares y las venas sistémicos no son pulsátiles, no contribuyen a la medición. Por tanto, un paciente con cianosis peri­ férica (p. ej., puntas de los dedos moradas producidas por vasocons­ tricción inducida por el frío) pueden tener una saturación «central» (es decir, arterial) de oxígeno perfectamente normal. Debe señalarse que la oximetría de pulso no puede detectar la intoxicación por CO porque los espectros de absorción de la Hb-CO y de la Hb-O2 son similares. Los profesionales sanitarios utilizan habitualmente la oximetría de pulso en pacientes hospitalizados, particularmente aquellos que están en unidades de cuidados intensivos, donde es fundamental la monitorización continua de la Sao2. Entre estos pacientes están aquellos conectados a un respirador mecánico y otros con enfer­ medades menos graves que tienen cierto grado de deterioro res­ piratorio. La oximetría de pulso también se ha popularizado como herramienta ambulatoria para detectar la presencia de hipoxemia durante el sueño y, por tanto, para el cribado de la apnea del sueño (cuadro 32-5). Debido a la naturaleza insidiosa de la hipoxia, los pilotos de avionetas han empezado a utilizar oxímetros de pulso para detectar la aparición de hipoxia a grandes altitudes. TABLA 29-3 Resumen de la diferencia a- v en la composición de O2 de la sangre O2 DISUELTO (ml/dl) CONTENIDO DE O2 TOTAL (ml/dl) Po2 (mmHg) SATURACIÓN DE Hb (So2) O2 UNIDO A LA Hb (ml/dl)* a 100 97,5% 19,7 0,3 20,0 v 40 75% 15,2 ∼0,1 15,3 Diferencia a-v 60 22,5% 4,5 ∼0,2 4,7 *Asumiendo un contenido de Hb de 15 g de Hb/dl de sangre y una capacidad de O2 de 1,35 ml de O2/g de Hb. En este caso la Hb totalmente saturada transportaría 20,3 ml de O2/dl de sangre. De la diferencia a-v total de 4,7 ml de O2/dl, la Hb aporta 4,5 ml de O2/dl o casi el 96% del O2 que añaden los pulmones y que extraen de la sangre los tejidos periféricos (v. tabla 29-3). ¿Es esta diferencia a- v del contenido de O2 suficiente para satisfacer las necesidades metabólicas del cuerpo (es decir, ∼250 ml de O2/min)? Utilizando el principio de Fick, como hicimos en la ecuación 29-3, vemos que la combinación de un gasto cardíaco de 5 l/min y una diferencia a- v de 4,7 ml/dl sería casi adecuada: © Elsevier. Fotocopiar sin autorización es un delito. Consumo de O2 por los tejidos O2 V Diferencia a − v Flujo sanguíneo contenido total de O2 de 5.000 ml de sangre 4,7 ml de O 2 = ⋅ min 100 ml de sangre = ∼ 235 ml de O2 /min (29-7) Aumentando el gasto cardíaco ∼6% o reduciendo la Po2 de la sangre venosa mixta, el cuerpo podría satisfacer una necesidad de 250 ml de O2/min. Pasamos la vida moviéndonos sin cesar desde el punto a de la figura 29-3 hasta el punto v (cuando liberamos O2 hacia los tejidos) y de nuevo hacia el punto a (cuando captamos más O2 desde el aire alveolar). Como la representación gráfica de la [O2]Dis en función de la Po2 es lineal (v. fig. 29-3, curva morada), la cantidad de O2 que puede disolverse en el plasma sanguíneo no tiene un máximo teórico. Por tanto, respirar O2 al 100% elevaría la Po2 arterial ∼6 veces, de manera que habría ∼1,8 ml de O2 disueltos en cada decilitro de sangre arterial. Aunque el O2 disuelto haría una contribución cada vez mayor al transporte total de O2 en estas condiciones no fisioló­ gicas, la Hb seguiría transportando la inmensa mayor parte del O2. Por tanto, la disminución del contenido de Hb de la sangre (conocida como anemia) puede reducir mucho la capacidad de transporte de O2. El cuerpo puede compensar la disminución del contenido de Hb de las mismas formas en las que, en el ejemplo anterior, aumentamos la VO2 desde 235 hasta 250 ml de O2/min. Primero, puede aumentar el gasto cardíaco. Segundo, puede aumentar la extracción de O2, con lo que se reduce el contenido de O2 de la sangre venosa mixta. La anemia produce palidez de las membranas mucosas y la piel, lo que refleja la disminución del pigmento rojo, la Hb. La alteración de la liberación de O2 puede producir letargo y astenia. El consiguiente aumento del gasto cardíaco se puede manifestar como palpitaciones y un soplo sistólico. La dificultad respiratoria también puede formar parte del síndrome. Si la disminución de la concentración de Hb es perjudicial, entonces el aumento del contenido de Hb debería aumentar el contenido máximo de O2 y de esta forma ofrecer una ventaja competitiva a los atletas. Incluso en personas normales, la [Hb] en el citoplasma de los eritrocitos ya es muy elevada (v. pág. 434). La hipoxia (p. ej., adaptación a grandes alturas) lleva a un aumento de la producción de eritropoyetina (v. págs. 431-433), N18-2 una hormona que aumenta algo la cantidad de Hb por eritrocito, pero que especialmente aumenta el número de eritrocitos. De hecho, en la prensa internacional se ha dado mucha publicidad a varios casos 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 CAPÍTULO 29 • Transporte de oxígeno y dióxido de carbono en la sangre 651.e1 N29-2 Interacciones de los H+ con la hemoglobina Colaboración de Emile Boulpaep y Walter Boron Ahora dejemos que se desoxigene por completo esta Hb y se devuelve la pK de la His-146 al valor que tenía al comienzo de este ejemplo, ∼8,0. El pH en el interior del eritrocito sigue siendo 7,1. La ecuación 28-5 nos dice que el cociente [R-NH3+]/[R-NH2] será 8:1. Es decir, en 89 de cada 100 moléculas de Hb este grupo His-146 está protonado. Así, por cada 100 moléculas de Hb, se han captado 39 iones de H+ desde la solución para titular 39 grupos R-NH2 para formar 39 grupos R-NH+3 adicionales en el residuo His-146. El ejemplo anterior es un ejemplo extremo porque la Hb no está totalmente desoxigenada en los capilares sistémicos. También es un ejemplo simplificado en la medida en la que múltiples residuos de la Hb contribuyen al efecto Bohr. Sin embargo, el ejemplo ilustra de qué forma la Hb desoxigenada tiene una mayor capacidad de amortiguar el exceso de protones. En los párrafos anteriores hemos insistido en una cara de la moneda fisiológica: la desoxigenación hace que la Hb sea un ácido más débil (y por ello hace que la Hb capte H+). Sin embargo, tal y como se resume en la reacción de la ecuación 29-9, Hb(O2 )4 + 2H+ Hb(H+ )2 + 4O2 (NE29-1) también es cierto lo contrario: la protonación de la Hb reduce la afinidad de la Hb por el O2. © Elsevier. Fotocopiar sin autorización es un delito. Como la mayoría de las proteínas, la Hb tiene muchos grupos titula­ bles. Sin embargo, los que tienen más importancia fisiológica son aquellos cuyos valores de pK son próximos al pH fisiológico. Se puede consultar una discusión general de los amortiguadores en el pasaje que comienza en las páginas 628-633. Tiene un interés particular el párrafo en el que se estudian los amortiguadores en un sistema cerrado (v. págs. 630-633) y la figura 28-2B. Varios grupos titulables de la molécula de Hb contribuyen al efecto Bohr-pH. El grupo único más importante es la histidina del resi­ duo 146 de las cadenas β. Cuando la molécula de Hb está totalmente desoxigenada (estado tenso), la His-146 protonada forma un puente salino con el grupo aspartato, con carga negativa, en la posición 94 de la misma cadena β. Este puente salino estabiliza la forma protonada de la His-146, por lo que tiene una afinidad elevada por los H+ (es decir, tiene un valor relativamente elevado de pK de ∼8,0). Cuando la Hb está totalmente oxigenada (estado relajado), el giro de la molécula de Hb rompe el puente salino y así desestabiliza la forma protonada de la His-146, de manera que tiene una afini­ dad baja por los H+ y, por ende, un valor relativamente bajo de pK de ∼7,1. Esta pK es aproximadamente igual que el pH que hay dentro de los eritrocitos. De acuerdo con la ecuación 28-5, el cociente [R-NH3+]/[R-NH2] debe ser 1:1 (para que este grupo esté protonado en 50 de cada 100 moléculas de Hb). 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 652 SECCIÓN V • Sistema respiratorio en los que atletas de élite se han infundido eritrocitos o se han inyectado eritropoyetina recombinante. Sin embargo, un aumento excesivo del hematocrito (policitemia) tiene el efecto perjudicial de aumentar la viscosidad de la sangre y, por tanto, la resistencia vascular (v. págs. 437-439). Las consecuencias incluyen aumento de la presión arterial en las circulaciones sistémica y pulmonar, y desequilibrio entre ventilación y perfusión en el pulmón. Este de­ sequilibrio ventilación-perfusión produce hipoxia (v. pág. 693) y, en consecuencia, desaturación de la Hb arterial. Así, el hematocrito óptimo (probablemente ∼45%) corresponde al valor que consigue el máximo contenido de Hb, pero con una viscosidad razonable de la sangre. El color púrpura de la Hb desaturada produce el signo físico conocido como cianosis, el color morado de la piel y las membranas mucosas. La cianosis se debe no a la ausencia de Hb saturada u oxigenada, sino a la presencia de Hb desaturada. Así, un paciente anémico con poca Hb saturada podría tener demasiada poca Hb insaturada para que se manifestara como cianosis. La capacidad del médico de detectar cianosis también depende de otros factores, como la pigmentación cutánea del paciente y las condiciones de iluminación para la exploración física. Los aumentos de la temperatura, la [CO2] y la [H+], todos los cuales son característicos de los tejidos metabólicamente activos, hacen que la Hb libere O2 Los tejidos metabólicamente activos no solo tienen un consumo elevado de O2, sino que también están calientes, producen grandes cantidades de CO2 y son ácidos. De hecho, la temperatura elevada, la Pco2 elevada y el pH bajo de los tejidos metabólicamente activos reducen la afinidad de la Hb por el O2 actuando en puntos distintos al hemo para desplazar el equilibrio entre los estados T y R de la Hb hacia el estado T, de baja afinidad. El efecto neto es que los tejidos metabólicamente activos pueden señalizar a la Hb de los capilares sistémicos que liberen más O2 de lo habitual, mientras que los tejidos menos activos pueden indicar a la Hb que libere menos. En los capilares pulmonares (en los que la temperatura es menor que en los tejidos activos, la Pco2 es relativamente baja y el pH es elevado) estas mismas propiedades favorecen la captación de O2 por la Hb. Temperatura El aumento de la temperatura hace que la curva de disociación de la Hb-O2 se desplace hacia la derecha, mientras que la disminución de la temperatura tiene el efecto contrario (fig. 29-4). Si se comparan las tres curvas de disociación de la Hb-O2 de la figura 29-4 a la Po2 de la sangre venosa mixta (40 mmHg), vemos que la cantidad de O2 unida a la Hb es progresivamente menor al aumentar la temperatura. En otras palabras, una temperatura elevada reduce la afinidad de la Hb por el O2 y da lugar a la liberación de O2. Un mecanismo de este efecto de la temperatura pueden ser pequeños cambios en los valores de pK de diversas cadenas laterales aminoacídicas, que producen cambios de la carga neta y, por tanto, un cambio de conformación. La temperatura máxima que se alcanza en el músculo activo es ∼40 °C. Por supuesto, en la piel de las extremidades expuestas a un frío extremo puede haber temperaturas muy bajas. Ácido En 1904, Christian Bohr, un fisiólogo y padre del físico atómico Niels Bohr, observó que la acidosis respiratoria (v. pág. 633) desplaza la curva de disociación de la Hb-O2 hacia la derecha (fig. 29-5A). Esta disminución de la afinidad por el O2 se conoce como efecto Bohr. Fisiológicamente se produce una acidosis respiratoria leve cuando los eritrocitos entran en los capilares sistémicos. Aquí, el aumento de la Pco2 extracelular hace que entre Figura 29-4 Efecto de los cambios de temperatura sobre la curva de diso­ ciación de la Hb-O2. CO2 en los eritrocitos, lo que da lugar a una disminución del pH intracelular (v. pág. 646). Otros metabolitos ácidos también pueden reducir el pH extracelular y, en consecuencia, el pH intracelular. Por tanto, esta acidosis respiratoria intracelular tiene dos componentes, la disminución del pH y el aumento de la Pco2. Ahora reconocemos que ambos contribuyen a la desviación hacia la derecha de la curva de disociación de la Hb-O2 que observó Bohr. El efecto de la acidosis por sí sola sobre la curva de disociación de la Hb-O2 (v. fig. 29-5B) (el efecto Bohr-pH) explica la mayor parte del efecto Bohr total. Se puede demostrar fácilmente el efecto Bohr-pH en una solución de Hb creando una acidosis metabólica (p. ej., reduciendo el pH con una Pco2 fija). No debe ser sorprendente que la Hb sea sensible a los cambios de pH, porque la Hb es un notable amortiguador de H+ (v. pág. 630): Hb + H + Hb − H + (29-8) Aunque la Hb tiene muchos grupos titulables, los que son importantes aquí son aquellos cuyos valores de pK están en el intervalo del pH fisiológico. N29-2 Cuando acidificamos la solución, elevando el cociente [Hb-H+]/[Hb] para los grupos susceptibles, modificamos la conformación de la molécula de Hb, con lo que disminuye su afinidad por el O2: Hb(O2 ) 4 + 2H+ Hb(H+ ) 2 + 4O2 (29-9) Este es un ejemplo extremo en el que hemos añadido suficientes H+ para hacer que la Hb libere todo su O2. En condiciones más fisiológicas, la unión de ∼0,7 moles de H+ hace que la Hb libere 1 mol de O2. Esta propiedad es importante en los tejidos sistémicos, en los que la [H+] es elevada. También ocurre lo contrario: la unión del O2 produce un cambio de conformación en la molécula de Hb, que reduce la afinidad de la Hb por los H+. 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 CAPÍTULO 29 • Transporte de oxígeno y dióxido de carbono en la sangre 653 Figura 29-5 © Elsevier. Fotocopiar sin autorización es un delito. Efecto de la acidosis y la hipercapnia sobre la curva de disociación de la Hb-O2 (efecto Bohr). Dióxido de carbono El efecto aislado de la hipercapnia por sí misma sobre la curva de disociación de la O2 (v. fig. 29-5C) representa una pequeña porción del efecto Bohr total. La demostración de este efecto Bohr-CO2 precisa que estudiemos la afinidad de la Hb por el O2 a un pH fijo, aumentando la Pco2 y el HCO−3 de forma proporcional, un ejemplo de hipercapnia isohídrica (v. pág. 641). A medida que aumenta la Pco2, el CO2 se combina con grupos amino no protonados de la Hb (Hb-NH2) para formar grupos car­ bamino (Hb-NH-COO−). N29-3 Aunque la Hb tiene otros grupos amino, solo los cuatro extremos aminoterminales de las cadenas de globina son susceptibles a una formación apreciable de carbamino, las cadenas β más que las α. Como los grupos amino están en una forma protonada (Hb-NH+3) en equilibrio con una forma no protonada, la reacción del CO2 con la Hb-NH2 tiende a desplazar la Hb desde la forma Hb-NH+3 hacia la forma Hb-NHCOO−: (29-10) El efecto total de la formación de carbamino es, por tanto, un desplazamiento negativo en la carga de una cadena lateral 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 CAPÍTULO 29 • Transporte de oxígeno y dióxido de carbono en la sangre N29-3 Interacciones del CO2 con la hemoglobina Colaboración de Emile Boulpaep y Walter Boron © Elsevier. Fotocopiar sin autorización es un delito. Como se indica en la página 653, el CO2 puede reaccionar rever­ siblemente con los cuatro grupos amino que constituyen los cuatro extremos N-terminales de las cadenas de globina, las dos cadenas α y, especialmente, las dos cadenas β. Como muestra la ecuación 29-10 del texto, la interacción del CO 2 con estos extremos amino-terminales hace que la carga neta del residuo cambie desde una carga positiva (Hb-NH+3 ) hasta una carga nega­ tiva (Hb-NH-COO–). Una consecuencia es la formación de puentes salinos (entre varios residuos de aminoácidos con carga positiva y negativa) que tienden a estabilizar la forma desoxigenada (o ten­ sa) de la Hb. En consecuencia, en los capilares sistémicos el aumento de la concentración de CO2 favorece la forma desoxi­ genada de la Hb, lo que es fundamental para la liberación de O2. En otras palabras, concentraciones elevadas de CO2 hacen que la curva de disociación de la Hb-O2 se desplace hacia la derecha (v. fig. 29-5C). En los pulmones se produce lo contrario, porque la unión del O2 a la Hb produce una torsión de la molécula de Hb cuando pasa del estado tenso al estado relajado. Esta torsión rompe los puentes salinos ya mencionados y desestabiliza el compuesto carbamino. En consecuencia, la molécula de Hb libera CO2, que sale del eritrocito y difunde hacia el espacio aéreo alveolar. 扯潫獭敤楣潳牧 653.e1 扯潫獭敤楣潳牧 654 SECCIÓN V • Sistema respiratorio aminoacídica, lo que produce un cambio de conformación de la Hb, con la consiguiente reducción de su afinidad por el O2: (O2 )4 Hb-NH+3 + CO2 (O2 )3 Hb-NH-COO− + O2 + 2H + (29-11) Así, un aumento de la Pco2 hace que la Hb libere O2, lo cual es importante en los tejidos sistémicos. Por el contrario, el aumento de la Po2 hace que la Hb libere CO2, lo cual es importante en los pulmones. En conclusión, la curva de disociación de la Hb se desplaza hacia la derecha en las condiciones predominantes en los capilares de los tejidos sistémicos metabólicamente activos: aumento de la temperatura (v. fig. 29-4), disminución del pH (v. fig. 29-5B) y aumento de la Pco2 (v. fig. 29-5C). Estos desplazamientos hacia la derecha son sinónimos de disminución de la afinidad por el O2. Por tanto, tasas metabólicas elevadas favorecen la liberación de O2 desde la Hb. Es evidente que la sangre no puede descargar su O2 salvo que la sangre llegue hasta los tejidos. De hecho, en la mayor parte de las arteriolas sistémicas, la hipercapnia y la acidosis locales son también poderosos estímulos para la vasodilatación (v. pág. 556), lo que incrementa la liberación de O2 hacia los tejidos metabólicamente activos. El 2,3-difosfoglicerato reduce la afinidad de la Hb del adulto, pero no de la Hb fetal Figura 29-6 Efecto del 2,3-DPG sobre la afinidad de la Hb por el O2. Después La afinidad de la Hb por el O2 es muy sensible a la presencia del metabolito glucolítico 2,3-difosfoglicerato (2,3-DPG) N29-4 y, en menor medida, de fosfatos orgánicos como el ATP. La concentración de 2,3-DPG es aproximadamente la misma que la de la Hb. De hecho, el 2,3-DPG se une a la Hb con una estequiometría 1:1, interactuando con una cavidad central que forman las dos cadenas β. Al pH fisiológico, el 2,3-DPG tiene un promedio de ∼3,5 cargas negativas, que interactúan con ocho residuos de aminoácido con carga positiva en esta cavidad central. Sin embargo, la unión del O2 modifica la forma de la cavidad central, desestabilizando la Hb unida al DPG. En consecuencia, la Hb desoxigenada tiene una afinidad por el 2,3-DPG 100 veces mayor que la Hb oxigenada. Por el contrario, la unión del 2,3-DPG a la Hb desestabiliza la interacción de la Hb con el O2 y favorece la liberación de O2: Hb(O2 )4 + 2,3-DPG Hb(2,3-DPG) + 4O2 (29-12) La consecuencia es la desviación hacia la derecha de la curva de disociación de la Hb-O2 (fig. 29-6). Este efecto del 2,3-DPG sobre la afinidad de la Hb por el O2 es importante tanto en la hipoxia como para comprender la fisiología de la Hb fetal. La reducción de la Po2 de los eritrocitos estimula la glucólisis, que da lugar a mayores concentraciones de 2,3-DPG. De hecho, la hipoxia crónica, la anemia y la aclimatación a grandes alturas se asocian a aumento de las concentraciones de 2,3-DPG y, por tanto, a menor afinidad de la Hb por el O2. La reducción de la afinidad es una espada de doble filo. A la Po2 relativamente elevada de los alvéolos, en los que la curva de disociación de la Hb-O2 es bastante plana, esta disminución de la afinidad por el O2 reduce la captación de O2, pero solo ligeramente. A la baja Po2 de los tejidos sistémicos, en los que la curva de disociación de la Hb-O2 es muy pendiente, esta disminución de la afinidad por el O2 aumenta mucho la liberación de O2. El efecto neto es una mayor liberación de O2 hacia los tejidos que están realizando el metabolismo, lo que es más importante que la Po2 en sí misma. de que personas procedentes de tierras bajas pasarán aproximadamente 2 días a una altura de ∼4.500 m, su [2,3-DPG] citosólica aumentó ∼50%, lo cual desplazó hacia la derecha la curva de disociación de la Hb-O2. En la figura 29-7, la curva de disociación de la Hb-O2 de color azul verdoso representa la Hb pura o «desnuda» (es decir, en ausencia de CO2, 2,3-DPG y otros fosfatos orgánicos). La afinidad de la Hb pura por el O2 es bastante elevada, como manifiesta la desviación de la curva hacia la izquierda. La adición a la solución únicamente de CO2 (curva naranja) o únicamente de 2,3-DPG (curva verde) desplaza la curva algo hacia la derecha, y la adición de ambos da la curva marrón, que es indistinguible de la curva roja de los eritrocitos intactos en condiciones fisiológicas. La hemoglobina fetal (HbF) de los eritrocitos fetales (v. pág. 649) tiene mayor afinidad por el O2 que la Hb que hay dentro de los eritrocitos del adulto (HbA). Esta diferencia es fundamental para el feto, cuya sangre debe extraer O2 de la sangre materna que hay en la placenta (v. pág. 1137). Sin embargo, la diferencia de afinidades por el O2 no representa diferencias en las afinidades por el O2 de la HbA y la HbF puras, que son prácticamente idénticas. La diferencia crucial es que las cadenas γ de la HbF se unen al 2,3DPG con menos avidez que las cadenas β de la HbA. Con menos 2,3-DPG unido, la curva de disociación de la HbF está desplazada hacia la izquierda, de forma similar a la curva de la HbA marcada como «Hb + CO2» en la figura 29-7. El O2 no es el único gas que se puede unir al Fe2+ de la Hb; el monóxido de carbono (CO), el óxido nítrico (NO) y el H2S pueden unirse también a la Hb y desplazarla hacia el estado R. N29-5 En la intoxicación por CO (v. págs. 1224-1225), el CO se une a la Hb con una afinidad ∼200 veces mayor que la afinidad por el O2. Por tanto, la capacidad máxima de transporte de O2 disminuye en la medida en la que el CO se une a la Hb. Sin embargo, el principal motivo por el que el CO es tóxico es que, cuando desplaza la Hb hacia el estado R, el CO incrementa la afinidad de la Hb por el O2 y desplaza muy a la izquierda la curva de disociación de la Hb-O2. 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 CAPÍTULO 29 • Transporte de oxígeno y dióxido de carbono en la sangre 654.e1 N29-4 2,3-DPG Colaboración de Emile Boulpaep y Walter Boron El 2,3-difosfoglicerato (2,3-DPG), también conocido como 2,3-bis­ fosfoglicerato (2,3-BPG), es un producto intermedio en una de las últimas reacciones de la glucólisis (fig. 58-6A). La reacción en cues­ tión es 3-fosfoglicerato (3-PG) → 2-fosfoglicerato (2-PG), catalizada por la fosfoglicerato mutasa (PGM): En la reacción real catalizada por la mutasa, esta enzima activada transfiere el grupo fosfato al 2-PG, formándose 2,3-DPG: 3-PG + PGM-P → 2,3-DPG + PGM Por último, la enzima puede aceptar un grupo fosfato a partir del 2,3-difosfoglicerato, formándose 2-PG: PGM 2-PG → 3-PG El mecanismo real es interesante. Inicialmente una cinasa especí­ fica activa la PGM transfiriendo un grupo fosfato desde la posición 2 del 2,3-DPG a un residuo de histidina de la enzima, creando PGM-P y 3-PG: 2,3-DPG + PGM → 2-PG + PGM-P Por tanto, el 2,3-DPG es un cofactor en la reacción de la mutasa. También se forma y consume continuamente. © Elsevier. Fotocopiar sin autorización es un delito. cinasa 2,3-DPG + PGM → 3-PG + PGM-P 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 654.e2 SECCIÓN V • Sistema respiratorio N29-5 Otros gases que se unen a la hemoglobina Colaboración de Arthur DuBois, Emile Boulpaep y Walter Boron El texto analiza con cierto detalle la interacción del O2 y el CO2 con la Hb, revisa brevemente la interacción del CO con la Hb y menciona las interacciones del NO y el H2S con la Hb. Monóxido de carbono Como se indica en el texto, la afinidad de la Hb por el CO es ∼200 veces mayor que por el O2. Así, cuando una molécula de Hb totalmente oxigenada, Hb(O 2)4, está expuesta incluso a una concentración baja de CO, una molécula de CO desplaza a una de las moléculas de O2 de algunas de las moléculas de Hb, lo que da lugar a Hb(O2)3(CO). Si el único efecto de la intoxicación por CO fuera hacer ineficaz uno de los cuatro puntos de unión al O2, entonces los síntomas no serían peores que una reducción del hematocrito del 25% (p. ej., del 40% al 30%) o que la perfusión de las arterias con sangre venosa mixta (que también tiene una saturación de Hb-O 2 del 75%). Sin embargo, en la práctica, si una única molécula de CO se une al 40% de las moléculas de Hb de la sangre, el paciente experimentará síntomas, como se detalla a continuación. ¿Por qué? Base de la toxicidad del CO El CO es tóxico por dos motivos. Primero, reduce el número de puntos de unión disponibles para el transporte de O2. Segundo, la unión del CO estabiliza la molécula de Hb en su estado relajado, lo que desplaza la curva de disociación de la Hb-O2 muy a la izquierda y hace que la Hb tenga más dificultad para liberar O2 de los capilares sistémicos. Cálculo de la saturación de CO de la Hb Para calcular la concentración de HbCO se debe recordar que, cuan­ do la Hb está expuesta a CO, la [HbCO] será igual a la [HbO2] cuando la Hb está expuesta a O2 a una concentración 210 veces mayor que la [CO] en cuestión. Por ejemplo, la Hb está saturada al 50% con O2 (en equilibrio) cuando la Po2 es 28 mmHg. La concentración de HbCO del 50% se alcanzará en estado de equilibrio con 28/210 mmHg de CO, que serían tan solo 0,133 mmHg de CO. Como una atmósfera de presión es 760 mmHg, 0,133 mmHg de CO equivalen a 0,133/760, o 0,000175 atmósferas de CO, o 175 ppm de monóxido de carbono. Esta concentración de CO incapacitaría gravemente o mataría a una persona expuesta a ella durante un período prolongado. Sin embargo, como se tardan 4 horas en llegar a la mitad de la concen­ tración en equilibrio final de HbCO, una exposición de 4 horas de duración a 175 ppm de CO alveolar daría lugar a una concentración de HbCO de 50%/2, o 25% de HbCO. Esta concentración produciría en la persona cefalea e interferiría con sus funciones mentales. En 2 horas de exposición la HbCO sería 1/4 de la saturación del 50%, o 12,5% de HbCO. Esta menor concentración interferiría con la visión nocturna y, debido a cierta interferencia con el transporte de O2, elevaría el riesgo de angina en una persona con reducción del flujo sanguíneo coronario. Síntomas y tratamientos Los síntomas de la intoxicación leve por CO pueden comenzar cuando la saturación de la Hb con CO alcanza el 10%, es decir, cuando el 40% de las moléculas de Hb se unen a un CO (25% de los sitios de una molécula de Hb × 40% de moléculas de Hb = saturación del 10%). Estos síntomas, que no son muy específicos, pueden incluir cefalea, náuseas y vómitos. En la intoxicación leve por CO el tratamiento es simplemente eliminar el agente causal, lo que deja al cuerpo con una vida media de ∼4 horas (es decir, el CO se disocia muy lentamente de la Hb, tiene una velocidad de desaparición baja). En la intoxicación por CO más grave el tratamiento recomendado es hacer que el paciente respire O2 al 100%, lo que aumenta la probabilidad de que el O2 desplace al CO de la Hb (es decir, aumenta la velocidad de desaparición) y de esta forma se acelera la eliminación de CO en un factor de ∼4 (vida media 60 minutos). Cuando la saturación de la Hb con CO llega al 20-25% (es decir, cuando en promedio el 80-100% de las moléculas de Hb están unidas cada una a una molécula de CO) los síntomas son graves e incluyen confusión, dolor torácico e inconsciencia. El tratamiento es O2 al 100% hiperbárico —oxígeno administrado a alta presión (OAP)— que tiene dos efectos positivos. Primero, el O2 hiperbárico (es decir, a mayor Po2) acelera aún más el desplazamiento del CO desde la Hb. Respirar O2 hiperbárico al 100% a 2,5 atmósferas de presión reduce la vida media de eliminación a 20 minutos. Segundo, el tratamiento con O2 hiperbárico puede aumentar la concentración de O2 disuelto hasta tal punto que este O2 disuelto en la sangre puede liberar suficiente O2 para satisfacer las necesidades metabóli­ cas del cuerpo (v. ecuaciones 29-1 a 29-3). El CO alcanza una concentración letal con una saturación de Hb de ∼50%. Debe señalarse que la hiperventilación no es un tratamiento eficaz de la intoxicación por CO. Un motivo de esta falta de eficacia puede ser que la hiperventilación elimina CO2 y reduce la Pco2 arterial (v. págs. 679-680). De acuerdo con el efecto Bohr, concentraciones bajas de CO2 (p. ej., causadas por hiperventilación) desplazarían la curva de disociación de la Hb-O2 hacia la izquierda, lo que empeoraría el efecto de la intoxicación por CO. De hecho, Yandell Henderson mostró que el uso de CO2 al 5% en O2 al 95% reducía el pH plas­ mático, lo que aceleraba el desplazamiento del CO de la HbCO, además de aumentar la Po2 de los tejidos mediante el efecto Bohr (comunicado por Arthur DuBois). Óxido nítrico La Hb también se une al NO. Esta interacción puede ayudar a garan­ tizar que los efectos del NO sean paracrinos en lugar de endocrinos, es decir, que los efectos del NO estén restringidos a los lugares en los que se libera. La diana fisiológica del NO es la guanilato-ciclasa soluble (v. págs. 66-67), que se une al NO a través de un grupo hemo, igual que la Hb. 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 CAPÍTULO 29 • Transporte de oxígeno y dióxido de carbono en la sangre 655 Figura 29-7 Efecto de la adición de CO2 o 2,3-DPG a Hb pura. Las curvas de color azul verdoso, naranja, verde y marrón son curvas de disociación de la Hb-O2 para Hb pura (2 mM) en soluciones artificiales. La «Hb pura» está desprovista de CO2 y 2,3-DPG. Cuando la solución tenía CO2 o 2,3-DPG, la Pco2 era 40 mmHg y la [2,3-DPG] era 2,4 mM. El citosol de los eritrocitos sanguíneos (curva roja) tenía la misma composición que las soluciones artificiales. Por tanto, cuando la Hb llega a los capilares sistémicos en la intoxicación por CO, su tenacidad por el O2 es tan elevada que la sangre de color rojo brillante no puede liberar suficiente O 2 hacia los tejidos. TRANSPORTE DE CO2 © Elsevier. Fotocopiar sin autorización es un delito. La sangre transporta el «CO2 total» principalmente en forma de HCO−3 La sangre transporta CO2 y otros compuestos relacionados en cinco formas: N29-6 1. Dióxido de carbono disuelto. La [CO2]Dis sigue la ley de Henry (v. pág. 593) y está en el intervalo milimolar tanto en el plasma sanguíneo como en las células sanguíneas. Supone solo ∼5% del CO2 total de la sangre arterial (porción dorada de la barra más izquierda de la fig. 29-8). 2. Ácido carbónico. Se puede formar H2CO3 a partir de CO2 y H2O, o a partir de H+ y HCO−3 (v. pág. 630). Como la constante de equilibrio que rige la reacción CO2 + H 2O H 2CO3 es ∼0,0025, la [H2CO3] es solo 1/400 de la [CO2]. Por tanto, el H2CO3 no es cuantitativamente importante para el transporte de CO2. 3. Bicarbonato. El HCO−3 se puede formar de tres maneras. Primero, el H2CO3 se puede disociar en HCO−3 y H+. Segundo, el CO2 se puede combinar directamente con OH− para formar HCO−3 , que es la reacción catalizada por la anhidrasa carbónica. N18-3 Tercero, se forma HCO−3 cuando el carbonato se combina con H+. En la sangre arterial la [HCO−3 ] es ∼24 mM, de modo que el HCO−3 representa ∼90% del CO2 total (porción morada de la barra más izquierda de la fig. 29-8). 4. Carbonato. El CO2− 3 se forma a partir de la disociación del + bicarbonato: HCO−3 → CO2− 3 + H . Como la pK de esta reacción es muy elevada (∼10,3), la [CO2− 3 ] es solo ∼1/1.000 el valor Figura 29-8 Componentes del «CO2 total de la sangre». La barra de la izquierda (a) representa la sangre arterial; la barra del centro (v ), la sangre venosa mixta, y la barra de la derecha, el incremento de CO2 que capta la sangre en los capilares sistémicos. del HCO−3 a pH 7,4. Por tanto, igual que en el caso del H2CO3, el CO2− 3 no es cuantitativamente importante para el transporte de CO2. 5. Compuestos carbamino. Con mucho, el compuesto carbamino más importante es la carbaminohemoglobina (Hb-NH-COO−), que se forma de manera rápida y reversible cuando el CO2 reacciona con grupos amino libres de la Hb (v. pág. 653). En la sangre arterial los compuestos carbamino constituyen ∼5% de la porción (azul) del CO2 total de la barra más izquierda de la figura 29-8. El motivo por el que agrupamos con el término CO2 total los cinco compuestos relacionados con el CO2 que se han señalado previamente es que el método que introdujo Van Slyke N29-7 en la década de 1920, y que sigue siendo la base para la determinación del HCO−3 sanguíneo en los modernos laboratorios clínicos, no puede distinguir entre los cinco compuestos. El transporte de CO2 depende de forma crítica de la anhidrasa carbónica, el intercambiador de Cl-HCO3 y la Hb La concentración total de CO2 en la sangre arterial es de ∼26 mM, o ∼48 ml de CO2 gaseoso/dl (medido en condiciones STP). El HCO−3 constituye ∼90% de estos 48 ml/dl y el CO2 y los compuestos carbamino suponen ∼5% cada uno de ellos (barra a en la fig. 29-8). A medida que la sangre atraviesa los lechos capilares sistémicos, capta ∼4 ml/dl de CO2, de manera que el CO2 total de la sangre venosa mixta es ∼52 ml/dl (barra v en la fig. 29-8). ¿En qué forma transporta la sangre este incremento de 4 ml/dl de CO2 hasta los pulmones? Aproximadamente el 10% de este incremento de CO2 se desplaza como CO2 disuelto, ∼69% como HCO−3 y ∼21% como compuestos carbamino (las dos barras a la derecha de la fig. 29-8). Por tanto, el CO2 disuelto y el CO2 unido a compuestos carbamino son mucho más importantes para transportar hacia los pulmones el incremento de CO2 de lo que se podría pensar, a la vista de su contribución al CO2 total en la sangre arterial. 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 CAPÍTULO 29 • Transporte de oxígeno y dióxido de carbono en la sangre 655.e1 N29-6 CO2 total Colaboración de Walter Boron La eTabla 29-1 que se presenta a continuación complementa a la figura 29-8. eTABLA 29-1 Componentes del «CO2 total» SANGRE ARTERIAL (Pco2 = 40 mmHg) COMPONENTE CONCENTRACIÓN Dióxido de carbono disuelto físicamente CO2 Ácido carbónico Bicarbonato SANGRE VENOSA MIXTA (Pco2= 46 mmHg) CONTRIBUCIÓN FRACCIÓN AL CO2 TOTAL DEL CO2 (ml/dl) TOTAL (%) 1,2 mM 2,4 5 H2CO3 3 µM ∼0 ∼0 HCO−3 24 mM 43,2 CONCENTRACIÓN CONTRIBUCIÓN FRACCIÓN AL CO2 TOTAL DEL CO2 (ml/dl) TOTAL (%) 1,4 mM 2,8 5,3 ∼3,5 µM ∼0 ∼0 90 25,6 mM 46,0 88,5 30 µM ∼0 ∼0 Carbonato CO 30 µM ∼0 ∼0 Compuestos carbamino R-NH-COO− 1,2 mM 2,4 5 1,6 mM 3,2 6,2 26,4 mM 48 100 28,6 mM 52 100 2− 3 Total N29-7 Método manométrico de Van Slyke para determinar el CO2 total Colaboración de Emile Boulpaep y Walter Boron En 1924, Van Slyke y Neill introdujeron una técnica para determinar lo que actualmente se conoce como el «CO2 total» de la san­ gre N29-6 y de otras soluciones. Esta técnica pasó rápidamente a ser el método estándar para determinar el CO2 total en los labora­ torios de química clínica. Además, el método de Van Slyke es el fundamento incluso de los modernos métodos automáticos para determinar el CO2 total. Aunque el método original exige una precisión meticulosa en el laboratorio para obtener resultados fiables, el principio fundamental es un proceso bastante sencillo en dos fases. Primero, se utiliza un ácido (Van Slyke y Neill utilizaron ácido láctico 1 N) para titular prácti­ camente toda la carbamino-Hb, el carbonato (CO32−) y el bicarbonato (HCO3−) a dióxido de carbono (CO2), que entra en la fase gaseosa. Segundo, se utiliza un manómetro para medir la presión (P) de un volumen (V) conocido de este CO2 gaseoso. La ley de los gases ideales nos dice que: © Elsevier. Fotocopiar sin autorización es un delito. PV = nRT (NE 29-2) Aquí, n es el número de moléculas, R es la constante universal de los gases y T es la temperatura absoluta. Así, con las corres­ pondientes correcciones por la no idealidad, se puede calcular el número de moléculas de CO2. Ahora analizaremos las reacciones de titulación con un poco más de detalle. Para la titulación de la carbamino-Hb por los H+ del ácido láctico, se producen dos reacciones en serie: Hb-NH-COO + H → Hb-NH2 + CO2 Hb-NH2 + H+ → Hb-NH3+ − + (NE 29-3) Estas reacciones son las opuestas a las que se muestran en la ecuación 29-10. La titulación del CO32− por los H+ del ácido láctico permite obtener HCO−3 : CO23− + H+ → HCO3− (NE 29-4) Por último, la titulación de este HCO3− recién formado, además del HCO−3 preexistente (que es una cantidad mucho mayor en con­ diciones fisiológicas), por los H+ del ácido láctico da ácido carbónico (H2CO3), que a su vez permite obtener CO2 y H2O: HCO3− + H+ → H2CO3 → CO2 + H2O (NE 29-5) Como la pK que rige el equilibrio CO2 + H2O H2CO3 es ∼2,6, >99,7% del H2CO3 recién formado pasa a transformarse en CO2. En la práctica, la técnica utilizada para generar el gas CO2 también extrae una cantidad variable de O2 de la solución. En otras palabras, en la fase gaseosa el CO2 está mezclado con una cantidad de O2 que es difícil de predecir. Por tanto, Van Slyke y Neill introdujeron un paso adicional en su análisis: añadieron NaOH 1 N para convertir todo el CO2 total en CO32−, lo que elimina el CO2 de la fase gaseosa. Este último paso les permitía obtener, con precisión, la cantidad de CO2 gaseoso en la fase gaseosa y de esta forma calcular la cantidad de CO2 total que había estado en su muestra. BIBLIOGRAFÍA Simoni RD, Hill RL, Vaughan M. The determination of gases in blood and other solutions by vacuum extraction and manometric mea­ surement. I. [Classics: A paper in a series reprinted to celebrate the centenary of the JBC in 2005]. J Biol Chem 2002;277:e16. Van Slyke DD, Neill JM. The determination of gases in blood and other solutions by vacuum extraction and manometric measurement. I. J Biol Chem 1924;61:523-73. [Disponible online en the JBC web­ site by accessing the commentary in the reference above.]. 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 656 SECCIÓN V • Sistema respiratorio Figura 29-9 Transporte de CO2 desde los capilares sistémicos hasta los pulmones. La figura 29-9 resume los fenómenos que se producen cuando el incremento de CO2 entra en los capilares sistémicos. A medida que las oxidaciones biológicas en las mitocondrias producen CO2, este gas difunde fuera de las células, pasando por el espacio extracelular, a través del endotelio capilar y hacia el plasma sanguíneo. Parte de este incremento de CO2 (∼11%) permanece en el plasma sanguíneo durante el trayecto hasta los pulmones, pero la mayor parte (∼89%), al menos inicialmente, entra en los eritrocitos. Aproximadamente el 11% del incremento de CO2 en el plasma viaja de tres formas: 1. CO2 disuelto. Aproximadamente el 6% del incremento del CO2 se mantiene disuelto en el plasma sanguíneo (para un hematocrito del 40%). 2. Compuestos carbamino. Una cantidad insignificante forma compuestos carbamino con las proteínas plasmáticas. 3. Bicarbonato. Aproximadamente el 5% del incremento del CO2 forma HCO −3 en el plasma y se mantiene en el plasma: CO2 + H2O → H2CO3 → H+ + HCO3−. La cantidad de HCO−3 que sigue este trayecto depende fundamentalmente de la capacidad de los amortiguadores distintos a HCO−3 (v. págs. 637-638), que es muy baja en el plasma (∼5 mM/unidad de pH). El ∼89% restante del incremento del CO2 entra en los eritrocitos, predominantemente a través de dos «canales de gases», la acuaporina 1 (AQP1) y el complejo Rh. N29-8 Este CO2 también tiene tres destinos: 1. CO2 disuelto. Aproximadamente el 4% del incremento de CO2 se mantiene disuelto dentro de los eritrocitos. 2. Compuestos carbamino. Aproximadamente el 21% del incremento de CO2 forma compuestos carbamino con la Hb. ¿Por qué viaja tanto CO2 como compuestos carbamino dentro de los eritrocitos, mientras que lo hace tan poco en el plasma sanguíneo? Primero, la concentración de Hb dentro de los eritrocitos (∼33 g/dl) es mucho mayor que la de la albúmina y las globulinas en el plasma (∼7 g/dl). Segundo, la Hb forma compuestos carbamino con mucha más facilidad que las princi­ pales proteínas plasmáticas. Además, la Hb forma compuestos carbamino con mucha más facilidad cuando pierde el O2 en los capilares sistémicos (inverso del efecto Bohr-CO2). Por último, la Hb es un amortiguador mucho mejor que las proteínas plasmáticas para los H+ que se producen en la formación de compuestos carbamino y se convierte en un amortiguador aún mejor cuando pierde O2 en los capilares sistémicos (inverso del efecto Bohr-pH). 3. Bicarbonato. Aproximadamente el 64% del incremento de CO2 forma HCO−3 . ¿Por qué se forma mucho más HCO−3 a partir del CO2 en los eritrocitos que en el plasma? Primero, los eritrocitos contienen una concentración elevada de anhidrasa carbónica (v. pág. 434), N18-3 que acelera mucho la conversión de CO2 en HCO−3 . En ausencia de esta enzima, apenas se formaría algo de HCO−3 dentro de los eritrocitos durante el breve período que la célula pasa en su tránsito a través de un capilar sistémico típico. Segundo, el intercambiador de Cl-HCO 3 AE1 (v. págs. 124-125 y 434-435) transporta algo del HCO−3 recién formado hacia el exterior de la célula, favoreciendo la producción de más HCO−3 . Esta captación de Cl− intercambiándolo con HCO−3 se conoce como desplazamiento de cloruro o efecto Hamburger. Tercero, la amortiguación de los H+ por la Hb (v. punto 2 más arriba) también desplaza la reacción hacia la derecha. Los efectos combinados de los fenómenos intracelulares y extracelulares descritos hacen que ∼10% del incremento de CO2 que se forma en los tejidos sistémicos sea transportado hacia los 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 CAPÍTULO 29 • Transporte de oxígeno y dióxido de carbono en la sangre 656.e1 N29-8 Canales de gases Colaboración de Walter Boron se desplaza principalmente a través del poro central tanto de AmtB como de RhAG. Es interesante señalar que los canales de gases muestran selectividad para los gases de la misma manera que los canales iónicos tienen selectividad para los iones. Por ejemplo, AQP4 (que se expresa en niveles elevados en la barrera hematoencefálica) y AQP5 (que se expresa en niveles elevados en los neumocitos alveolares de tipo I) son casi totalmente selectivos para CO2 respecto a NH3. AQP1 (que se expresa a niveles elevados en los eritrocitos) tiene una selectividad intermedia para CO2/NH3, AmtB está desplazado más hacia la selectividad por el NH 3, y RhAG (que se expresa a niveles elevados en los eritrocitos) está aún más desplazado hacia la selectividad por el NH3 respecto del CO2. Este trabajo es la primera prueba de la selectividad de un canal proteico por diferentes gases (Musa-Aziz y cols., 2009). BIBLIOGRAFÍA Cooper GJ, Boron WF. Effect of PCMBS on CO 2 permeability of Xenopus oocytes expressing aquaporin 1 or its C189S mutant. Am J Physiol 1998;275:C1481-6. Cooper GJ, Zhou Y, Bouyer P, et al. Transport of volatile solutes through AQP1. J Physiol 2002;542:17-29. Endeward V, Cartron JP, Ripoche P, Gros G. RhAG protein of the Rhesus complex is a CO2 channel in the human red cell mem­ brane. FASEB J 2008;22:64-73. Endeward V, Musa-Aziz R, Cooper GJ, et al. Evidence that aquaporin 1 is the major pathway for CO2 transport in the human erythrocyte membrane. FASEB J 2006;20:1974-81. Musa-Aziz R, Chen LM, Pelletier MF, Boron WF. Relative CO2/NH3 selectivities of AQP1, AQP4, AQP5, AmtB, and RhAG. Proc Natl Acad Sci U S A 2009;106:5406-11. Nakhoul NL, Davis BA, Romero MF, Boron WF. Effect of expressing the water channel aquaporin-1 on the CO2 permeability of Xenopus oocytes. Am J Physiol 1998;274:C543-8. Singh SK, Binder HJ, Geibel JP, Boron WF. An apical permeability barrier to NH3/NH4+ in isolated, perfused colonic crypts. Proc Natl Acad Sci U S A 1995;92:11573-7. Uehlein N, Lovisolo C, Siefritz F, Kaldenhoff R. The tobacco aquaporin NAQP1 is a membrane CO2 pore with physiological functions. Nature 2003;425:734-7. Waisbren SJ, Geibel JP, Modlin IM, Boron WF. Unusual permeability properties of gastric gland cells. Nature 1994;368:332-5. Wang Y, Cohen J, Boron WF, et al. Exploring gas permeability of cellular membranes and membrane channels with molecular dynamics. J Struct Biol 2007;157:534-44. © Elsevier. Fotocopiar sin autorización es un delito. Tradicionalmente se consideraba que todos los gases atraviesan todas las membranas celulares simplemente disolviéndose en la fase lipídica de la membrana. La primera prueba de que se debía revisar este dogma de los gases fue la observación de que las membranas apicales de las células de las glándulas gástricas son impermeables al CO2 y al NH3 (Waisbren y cols., 1994) y las membranas apicales de las criptas colónicas son impermeables al NH3 (Singh y cols., 1995). La baja permeabilidad a los gases y al H2O puede ser una propiedad general de las membranas que se encuentran en entornos inhós­ pitos (Cooper y cols., 2002), incluyendo las agresiones mecánicas que sufren los eritrocitos y las células del endotelio capilar. Las células expuestas a estos entornos hostiles pueden haber adquirido durante la evolución membranas robustas especializadas con una composición lipídica específica o con revestimientos de proteínas u oligosacáridos en la superficie de la membrana. La segunda observación que puso en duda el dogma de los gases fue el descubrimiento de que el CO2 pasa por el canal de agua AQP1 (Cooper y cols., 1998; Nakhoul y cols., 1998). Peter Agre compartió el Premio Nobel de química de 2003 por descubrir las AQP y su permeabilidad al H2O. N5-7 La función fisiológica de las AQP trasciende al agua. Por ejemplo, AQP7 y AQP9 transportan glicerol. ¿Podría tener importancia fisiológica la permeabilidad al CO2 de AQP1? La primera prueba en ese sentido fue la demostración de que una AQP tiene una participación fundamental en la captación de CO2 para la fotosíntesis en las hojas del tabaco (Uehlein y cols., 2003). Endeward y cols. (2008) demostraron que aproximadamente la mitad del CO2 que entra en los eritrocitos humanos pasa a través del canal AQP1. Las AQP forman homotetrámeros, y cada monómero tiene un poro para el H2O. Simulaciones de dinámica molecular indican que el CO2 podría pasar a continuación del H2O a través de cada uno de los cuatro acuaporos, así como a través del poro central entre los cuatro monómeros (Wang y cols., 2007). Estudios preliminares con inhibidores realizados en el laboratorio de Boron confirman esta predicción e indican que ∼40% del CO2 que pasa por AQP1 se des­ plaza a través de los cuatro acuaporos, mientras que el 60% restante pasa por el poro central. Las simulaciones de dinámica molecular indican que prácticamente todo el O2 pasa por el poro central. Una segunda familia de canales de gases es la formada por las proteínas Rh. La proteína bacteriana homóloga de Rh, AmtB, forma un homotrímero y cada monómero parece tener un poro para NH3. La proteína RhAG del complejo Rh humano en los eritrocitos es permea­ ble al NH3 y al CO2 (Endeward y cols., 2008). Trabajos preliminares del laboratorio de Boron indican que el NH3 se mueve exclusivamente a través de uno de los tres poros de amoníaco, mientras que el CO2 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 CAPÍTULO 29 • Transporte de oxígeno y dióxido de carbono en la sangre 657 Figura 29-10 Curvas de disociación del CO2 (efecto Haldane). pulmones en forma de CO2 disuelto, el 6% en el plasma y el 4% dentro de los eritrocitos (porción dorada de la barra de la derecha en la fig. 29-8). Aproximadamente el 21% se desplaza en forma de compuestos carbamino, casi exclusivamente dentro de los eritrocitos en forma de carbamino-Hb (porción azul de la barra a la derecha en la fig. 29-8). Por último, ∼69% del incremento de CO2 se desplaza en forma de HCO−3 , el 5% que se forma en el plasma y el 64% que se forma en el interior de los eritrocitos (porción morada de la barra a la derecha en la fig. 29-8). Como durante la formación de HCO−3 entra H2O en la célula, los eritrocitos se hinchan cuando pasan por los capilares sistémicos. Cuando la sangre venosa mixta (con una Pco2 de ∼46 mmHg) llega a los capilares pulmonares (rodeados por alvéolos con una Pco2 de solo ∼40 mmHg), el CO2 pasa de los eritrocitos y el plasma sanguíneo hacia el espacio aéreo alveolar. Se invierten entonces todas las reacciones que se han indicado previamente. En este proceso salen de los eritrocitos Cl− y H2O, y las células se contraen. © Elsevier. Fotocopiar sin autorización es un delito. La elevada Po2 en los pulmones hace que la sangre libere CO2 El transporte de CO2 total en la sangre depende de los tres parámetros que se miden en una gasometría: la Pco2, el pH plasmático y la Po2. Las tres gráficas de la porción principal de la figura 29-10 son las curvas de disociación del CO2. Cada gráfica muestra la manera en la que los cambios de la Pco2 afectan al contenido total de CO2 de la sangre. Aunque el pH en sí mismo no aparece en este diagrama, el pH disminuye cuando la Pco2 aumenta a lo largo del eje de abscisas (es decir, acidosis respiratoria; v. pág. 833). La gráfica azul es la curva de disociación del CO2 cuando la Po2 es cero (So2 0% Hb). Las dos gráficas siguientes son las curvas de disociación del CO2 para valores de Po2 de 40 mmHg (So2 75%; curva morada) y 100 mmHg (So2 97,5%; curva roja). La línea verde de la parte inferior de la figura 29-10 muestra que el componente disuelto del CO2 total aumenta tan solo ligeramente cuando aumenta la Pco2. Deben reseñarse tres características de las curvas de disociación del CO2 de la figura 29-10: 1. Relación casi lineal en el intervalo fisiológico de valores de Pco2 y Po2 (v. fig. 29-10, recuadro). Por el contrario, la curva de disociación del O2 es prácticamente no lineal en su intervalo fisiológico (es decir, de 40 a 100 mmHg). 2. Desplazamiento hacia arriba de la curva al disminuir la Po2. Para cualquier Pco2, el contenido total de CO2 aumenta a medida que disminuye la Po2 (o la saturación de Hb), el efecto Haldane. N29-9 Por tanto, cuando la sangre entra en los capilares sistémicos y libera O2, la capacidad de transportar CO2 aumenta para que la sangre capte más CO2. Por el contrario, cuando la sangre entra en los capilares pulmonares y fija O2, la capacidad de transporte de CO2 disminuye, para que la sangre libere más CO2 (tabla 29-4). El efecto Haldane es el reverso de la moneda de los efectos Bohr-pH y Bohr-CO2. Primero, de la misma manera que la unión a H+ reduce la afinidad de la Hb por el O2 (v. ecuación 29-9), la unión al O2 desestabiliza la hemoglobina protonada (Hb-H+), lo que favorece la liberación de H+. Por un mecanismo de acción de masas, estos H+ reducen la capacidad de transporte de CO2 al favorecer la formación de CO2 a partir de carbamino-Hb y HCO−3 (v. fig. 29-9). Segundo, de la misma manera que la formación de un compuesto carbamino reduce la afinidad de la Hb por el O2 (v. ecuación 29-11), la unión de O2 desestabiliza la carbamino-Hb (Hb-NH-COO–), favoreciéndose la liberación de CO2. 3. Pendiente de la curva. Como las curvas de disociación del CO2 (v. fig. 29-10) tienen mucha más pendiente que las curvas de disociación del O2 (v. fig. 29-3), la Pco2 debe aumentar desde 40 mmHg en la sangre arterial hasta solo 46 mmHg en la sangre venosa mixta para aumentar el contenido de CO2 en la cifra de ∼4 ml/dl de CO2 necesaria para eliminar CO2 tan rápidamente como lo producen las mitocondrias. Por el contrario, la Po2 debe disminuir desde 100 hasta 40 mmHg para liberar suficiente O2 para satisfacer las necesidades metabólicas. 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 CAPÍTULO 29 • Transporte de oxígeno y dióxido de carbono en la sangre N29-9 John Scott Haldane Colaboración de Emile Boulpaep y Walter Boron John Scott Haldane (1860–1936) nació en Edimburgo, donde se licenció en medicina en 1884. Comenzó su carrera académica en el Queen’s College de Dundee, antes de mudarse a Oxford. Se atribuyen a Haldane varios descubrimientos notables: • Mostró que concentraciones sanguíneas elevadas de CO2 son un estímulo más potente para la respiración que concentraciones bajas de O2 (1905). • Desarrolló un método para la descompresión escalonada de los buceadores a grandes profundidades para evitar la enfermedad por descompresión cuando los buceadores volvían a la superficie. Publicó las primeras tablas de descompresión para buceadores (1908). • Junto con Christiansen y Douglas, mostró que el contenido de CO2 de la sangre disminuye al aumentar la Po2, fenómeno conocido como efecto Haldane (1914). Este efecto es responsable de aproximadamente la mitad del intercambio de CO2 en la sangre. Si se desea más información sobre Haldane, se pueden visitar las siguientes páginas web: 1. http://www.geo.ed.ac.uk/scotgaz/people/famousfirst1349.html. 2. http://www.diegoweb.com/diving/cards/page2.html. BIBLIOGRAFÍA © Elsevier. Fotocopiar sin autorización es un delito. Christiansen J, Douglas CG, Haldane JS. The absorption and dissociation of carbon dioxide by human blood. J Physiol 1914;48:244-77. 扯潫獭敤楣潳牧 657.e1 扯潫獭敤楣潳牧 658 SECCIÓN V • Sistema respiratorio TABLA 29-4 Factores que afectan a la cantidad de CO2 total transportado por la sangre PARÁMETRO EFECTOS DEL AUMENTO DEL PARÁMETRO Pco2 Aumento de la [CO2]Dis (ley de Henry) Aumento de la formación de HCO−3 (CO2 + H2O → HCO−3 + H+) Aumento de la formación de carbamino (CO2 + Hb-NH+3 → Hb-NH-COO– + 2H+) [Proteínas plasmáticas] Aumento de la capacidad de amortiguación del plasma. La mayor capacidad de consumo de H+ favorece indirectamente la formación de HCO−3 pH plasmático Aumento de la formación de HCO−3 en el plasma (ecuación de Henderson-Hasselbalch) Aumento del pH dentro del eritrocito, lo que favorece la formación de HCO−3 y carbamino-Hb [Hb] Aumento de la formación de carbamino-Hb (directo) Aumenta la capacidad de amortiguación en el interior del eritrocito. La mayor capacidad de consumir H+ favorece indirectamente la formación de HCO−3 y carbamino-Hb Po2 Disminución de la capacidad de amortiguación de la Hb (inverso del efecto Bohr-pH). La menor capacidad de consumir H+ reduce indirectamente la formación de HCO−3 y carbamino-Hb Disminución de la formación de carbamino-Hb (inverso del efecto Bohr-CO2) Figura 29-11 Diagrama de O2-CO2. En el recuadro de la figura 29-10, el punto a de la curva roja representa la sangre arterial, con una Pco2 de 40 mmHg y una Po2 de 100 mmHg (So2 97,5%). El punto v de la curva morada representa la sangre venosa mixta, con una Pco2 de 46 mmHg, pero con una Po2 de tan solo 40 mmHg (So2 75%). La diferencia entre los contenidos de CO2 total que representan los dos puntos (es decir, 52 y 48 ml/dl) representa los 4 ml/dl de CO2 que capta la sangre cuando atraviesa los capilares sistémicos. Si no fuera por el efecto Haldane, la sangre permanecería en la curva roja y el aumento de la Pco2 haría que el contenido de CO2 aumentara tan solo ∼2,7 ml/dl. Así, a una Pco2 de 46 mmHg, la disminución de la Po2 que se produce cuando la sangre fluye por los capilares sistémicos permite que la sangre capte ∼50% más CO2 (es decir, 4, en lugar de 2,7 ml/dl). Visto de otra forma, si no fuera por el efecto Haldane, la Pco2 de la sangre venosa mixta tendría que aumentar hasta ∼49 mmHg para que la sangre transportara 4 ml/dl de CO2. La tabla 29-4 resume la manera en la que los cambios en los parámetros sanguíneos pueden influir en la cantidad de CO2 total que puede transportar la sangre. El diagrama de O2-CO2 describe la interacción entre la Po2 y la Pco2 en la sangre Hemos visto que la Hb tiene una función fundamental en el transporte de O2 desde los pulmones hasta los tejidos periféricos, en el transporte de CO2 en la dirección contraria y en la amortiguación de los H +. Todas estas funciones están íntimamente interrelacionadas: la Pco2 y el pH influyen en la curva de disociación de la Hb-O2 (efectos Bohr; v. fig. 29-5), y la Po2 influye en la curva de disociación del CO2 (efecto Haldane; v. fig. 29-10). Una forma útil de ilustrar esta dependencia mutua es el dia­ grama de O2-CO2, que revisaremos de nuevo en la página 691 para comprender las diferencias regionales entre la Po2 y la Pco2 alveolares. 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 CAPÍTULO 29 • Transporte de oxígeno y dióxido de carbono en la sangre correspondiente a 48 ml/dl. De forma similar, la sangre venosa mixta (punto v ) está en la isopleta correspondiente a 52 ml/dl. Si se sigue esta isopleta de 52 ml/dl desde una Po2 de 40 mmHg (punto v ) hasta, por ejemplo, 100 mmHg, se vería que la sangre podría transportar los mismos 52 ml/dl de CO2 solo si se aumentara la Pco2 desde 46 hasta casi 50 mmHg. Por tanto, a medida que aumenta la Po2, el contenido de CO2 de la sangre disminuye (efecto Haldane). Si no fuera por el efecto Haldane, todas las curvas rojas serían líneas horizontales. La sangre equilibrada con el aire inspirado (punto I) tendría un contenido de CO2 de cero. En la figura 29-11, la curva verde que conecta los puntos v , a e I representa todas las combinaciones posibles de Po2 y Pco2en los pulmones normales. BIBLIOGRAFÍA La lista de referencias está disponible en www.StudentConsult.com. © Elsevier. Fotocopiar sin autorización es un delito. En un sistema de coordenadas con la Pco2 en el eje de ordenadas y la Po2 en el eje de abscisas, cada una de las curvas de la figura 29-11 representa una isopleta de contenido de O2 idéntico en la sangre entera (del griego isos [igual] + pletein [estar lleno]). Por ejemplo, la sangre arterial (punto a) está en la isopleta correspondiente a un contenido de O2 de 20,0 ml/dl, con coordenadas de Po2 = 100 mmHg y Pco2 = 40 mmHg. Si se sigue esta isopleta desde una Pco2 de 40 mmHg (punto a) hasta, por ejemplo, 46 mmHg, vemos que la sangre podría transportar los mismos 20,0 ml/dl de O2 solo si se aumenta la Po2 desde 100 hasta casi 105 mmHg. Por tanto, a medida que aumenta la Pco2, el contenido de O2 de la sangre disminuye (efecto Bohr). Si no fuera por el efecto Bohr, todas las curvas azules serían líneas verticales. La sangre venosa mixta (punto v ) está en la isopleta de contenido de O2 correspondiente a 15,3 ml/dl, a una Po2 de 40 mmHg y una Pco2 de 46 mmHg. Si la sangre estuviera equilibrada con el aire inspirado (punto I), tendría una Po2 de 150 mmHg y una Pco2 de cero. Cada una de las curvas rojas es una isopleta de contenido de CO2 idéntico. La sangre arterial (punto a) está en la isopleta 659 扯潫獭敤楣潳牧 扯潫獭敤楣潳牧 CAPÍTULO 29 • Transporte de oxígeno y dióxido de carbono en la sangre BIBLIOGRAFÍA Winslow RM, Rossi-Bernardi L. Oxygen-hemoglobin dissociation curve. In: Crystal RG, West JB, editors. The Lung. New York: Lippincott-Raven 1991; p. 1225-31. Artículos de revista Arnone A. X-ray diffraction study of binding of 2,3-diphosphoglycerate to human deoxyhaemoglobin. Nature 1972;237:146-9. Arnone A. X-ray studies of the interaction of CO2 with human deoxyhaemoglobin. Nature 1974;247:143-5. Benesch R, Benesch RE. Intracellular organic phosphates as regulators of oxygen release by haemoglobin. Nature 1969;221:618-22. Endeward V, Musa-Aziz R, Cooper GJ, et al. Evidence that aquaporin 1 is a major pathway for CO2 transport across the human erythrocyte membrane. FASEB J 2006;20:1974-81. Perutz MF, Kilmartin JV, Nishidura K, et al. Identification of residues contributing to the Bohr effect of human haemoglobin. J Mol Biol 1980;138:649-70. Perutz MF, Lehmann H. Molecular pathology of human haemoglobin. Nature 1968;219:902-9. © Elsevier. Fotocopiar sin autorización es un delito. Libros y revisiones Bauer C. Structural biology of hemoglobin. In: Crystal RG, West JB, editors. The Lung. New York: Lippincott-Raven; 1991. p. 1215-23. Baumann R, Bartels H, Bauer C. Blood oxygen transport. In: Fishman AP, Fisher AB, editors. Handbook of Physiology, Section 3, The Respiratory System, vol 1, Circulation and Nonrespiratory Functions. Bethesda, MD: American Physiological Society 1985; p. 147-72. Jelkmann W. Erythropoietin: Structure, control of production, and function. Physiol Rev 1992;72:449-87. Kilmartin JV, Rossi-Bernardi L. Interactions of hemoglobin with hydrogen ion, carbon dioxide and organic phosphates. Physiol Rev 1973;53:836-90. Klocke RA. Carbon dioxide. In: Crystal RG, West JB, editors. The Lung. New York: Lippincott-Raven 1991; p. 1233-9. Percy MJ, McRerran NV, Lappin TRJ. Disorders of oxidized haemoglobin. Blood Rev 2005;19:61-8. 659.e1 扯潫獭敤楣潳牧