ENERGIA QUIMICA
Anuncio

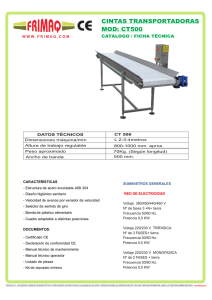
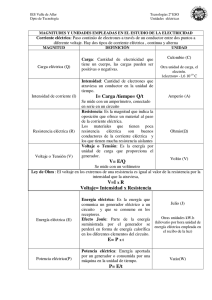
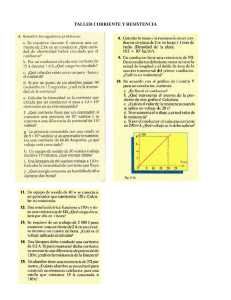
INSTITUCIÓN EDUCATIVA LA MILAGROSA SEDE LABORATORIO INTEGRADO DE CIENCIAS AREA CIENCIAS NATURALES GRADO SÉPTIMO PRÁCTICA No.2 noviembre de 2022 ENERGÍA QUÍMICA. ELABORACIÓN DE UNA PILA ELECTRICA LOGROS: Reconocer que en las reacciones químicas se producen cambios de energía los cuales pueden manifestarse en forma de una corriente eléctrica. INTRODUCCIÓN: En las reacciones químicas los átomos pierden o ganan electrones con relativa facilidad, mientras que los protones y neutrones permanecen fijos en el núcleo. Como los electrones poseen carga negativa, cuando un átomo pierde un electrón automáticamente adquiere una carga positiva, por el contrario si gana un electrón adquiere carga negativa. En muchas reacciones químicas sucede que mientras unos átomos pierden electrones otros los ganan. Como la electricidad es simplemente un flujo de electrones desde un polo negativo hacia un polo positivo, estas reacciones pueden ser utilizadas para producir electricidad. Una disposición de este tipo para la producción de corriente eléctrica se llama célula galvánica o electroquímica o simplemente pila o batería. En la siguiente reacción el Zn pierde 2 electrones los cuales son ganados por el Cu: Lo que le sucede a cada átomo es lo siguiente: En esta práctica construiremos algunas celdas electroquímicas (con este nombre se designa cualquier sistema químico que genere una corriente eléctrica). Para ello utilizaremos dos electrodos, uno de cobre y otro de cinc, cables, pinzas y un medidor de voltaje, vaso de precipitados, una papa, un limón u otra fruta y diversas sustancias químicas disueltas en agua. ACTIVIDADES: llaga un montaje como el de la figura No. I. Con el voltímetro mida el voltaje de la celda. ¿Este voltaje permanece constante a medida que transcurre el tiempo? ¿Por qué? ¿Si acerca los electrodos se produce alguna variación en el voltaje? Reporte en su cuaderno el voltaje de la celda electroquímica. Tome un limón e introdúzcale los electrodos como aparece en la figura No. 2. Registre cualquier cambio de voltaje. Repita este mismo procedimiento con el limón u otra fruta ¿Se podrán construir celdas electroquímicas con otros materiales? Dé algunos ejemplos. CONCLUSIONES: ______________________________________________________________________ ______________________________________________________________________ ______________________________________________________________________ ______________________________________________________________________