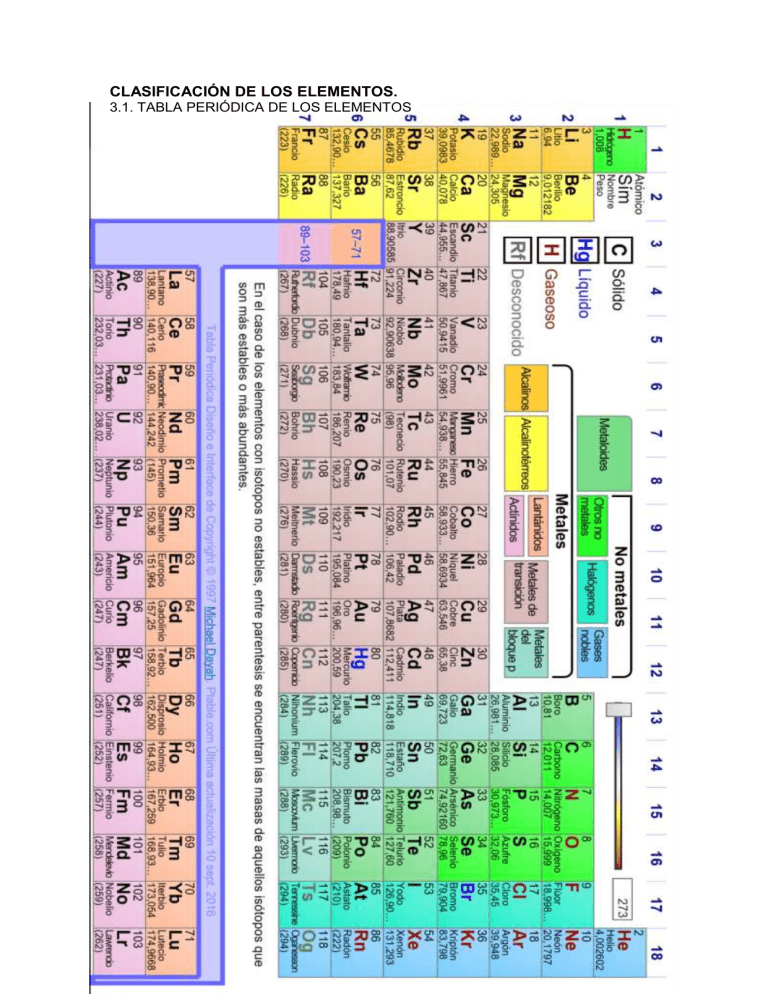
CLASIFICACIÓN DE LOS ELEMENTOS. 3.1. TABLA PERIÓDICA DE LOS ELEMENTOS Nomeclatura :Se llama nomenclatura química a un sistema de reglas que permite dar nombre a los diferentes compuestos químicos según el tipo y número de elementos que los componen. La nomenclatura permite identificar, clasificar y organizar los compuestos químicos. ion: es un átomo o molécula que no tiene una carga eléctrica neutra. Se denomina catión un ion con carga eléctrica positiva, y anión un ion con carga eléctrica. La ionización es el fenómeno mediante el cual, un átomo pierde o gana uno o más electrones. Los aniones. Los aniones son iones que tienen carga negativa. Iones negativos. A si vez, son atraídos por los ánodos. Los cationes. Los cationes son iones con carga positiva. Iones positivos. En esta ocasión, son atraídos por los cátodos. . Tabla periódica y configuración electrónica La estructura de la tabla periódica está relacionada con la configuración electrónica de cada elemento. Los elementos se agrupan en la tabla periódica de acuerdo con el subnivel (s, p, d, f) donde queda su electrón diferencial o, en otras palabras, el subnivel donde termina su configuración electrónica. Por ejemplo, la configuración electrónica del bromo Br es: Esta configuración termina en el subnivel p5, lo cual concuerda con posición del bromo en la tabla periódica. Los elementos de los bloques s y p (verde y rojo) se denominan elementos representativos. Los elementos del bloque d (amarillo) se denominan elementos de transición. Loe elementos del bloque f (azul) se denominan elementos de transición interna. Bloques de la configuracion electronica de los elementos. Es esta tabla de los elementos quimicos, se muestran en que bloque de la configuracion electronica pertenece cada elemento. como se mostro en el tema de configuracion electronica,el bloque S es para los elementos que tienen de 1 a 2 electrones el numero de veces que tiene antes la S, asi mismo para el P que es el siguiente pero el cual tiene de 1 a 6, despues del bloque P nos pasamos al Bloque D en el cual es de 1 a 10 electrones como maximo y por ultimo el bloque de los elementos F que este es de 1 a 14 electrones como maximo en su ultimo orbital. 3.2. CLASIFICACIÓN DE LOS ELEMENTOS QUÍMICOS Metales. Son elementos sólidos a temperatura ambiente (excepto el mercurio), densos y muy buenos conductores de calor y electricidad. Generalmente son brillantes, es decir, reflejan la luz. Se clasifican a su vez en actínidos, lantánidos, metales de transición, alcalinos, alcalino-térreos y otros metales. No metales. Son elementos que no son buenos conductores de calor ni de electricidad y son demasiado débiles para poder laminarse o estirarse como ocurre con los metales. En su mayoría, son esenciales para los sistemas biológicos (compuestos orgánicos). Metaloides. Son elementos que corresponden a una clasificación intermedia entre metales y no metales, y que reúnen características de ambos grupos. Se los conoce como semimetales. Halógenos. Es un grupo de seis elementos que tienden a formar moléculas diatómicas muy activas químicamente, debido a su electronegatividad: suelen formar iones (moléculas cargadas eléctricamente) mononegativos. Los halógenos son altamente oxidantes, por lo que estos elementos suelen ser cáusticos y corrosivos. Gases nobles. Es un grupo de siete elementos cuyo estado natural es el gaseoso. Existen, por lo general, en su forma monoatómica de muy baja reactividad y por eso se los conoce también como gases inertes. Comparten la mayoría de sus propiedades físicas y son sumamente estables. La tabla periódica de los elementos fue creada por Dmitri Mendeléyev en 1869, para ordenar visualmente los elementos químicos conocidos en base a sus propiedades y características. 3.3. COMPUESTOS QUÍMICOS Un compuesto químico es una sustancia formada por la combinación química de dos o más elementos de la tabla periódica.1 Los compuestos son representados por una fórmula química. Por ejemplo, el agua (H2O) está constituida por dos átomos de hidrógeno y uno de oxígeno. Los elementos de un compuesto no se pueden dividir ni separar por procesos físicos (decantación, filtración, destilación), sino solo mediante procesos químicos. Los compuestos están formados por moléculas o iones con enlaces estables que no obedece a una selección humana arbitraria. Por lo tanto, no son mezclas o aleaciones como el bronce o el chocolate.23 Un elemento químico unido a un elemento químico idéntico no es un compuesto químico, ya que solo está involucrado un elemento, no dos elementos diferentes. Hay cuatro tipos de compuestos, dependiendo de cómo se mantienen unidos los átomos constituyentes: Moléculas unidas por enlaces covalentes Compuestos iónicos unidos por enlaces iónicos Compuestos intermetálicos unidos por enlaces metálicos Ciertos complejos que mantienen unidos por enlaces covalentes coordinados Muchos compuestos químicos tienen un identificador numérico único asignado por el Chemical Abstracts Service (CAS): su número CAS. Definiciones Cualquier sustancia que consista en dos o más tipos diferentes de átomos (elementos químicos) en una proporción estequiométrica fija puede denominarse compuesto químico. Clasificación Se pueden clasificar de acuerdo al tipo de enlace químico o a su composición. Atendiendo al tipo de enlace químico, se pueden dividir en: Moléculas Compuestos iónicos Compuestos intermetálicos Complejos or su composición, se pueden dividir en dos grandes grupos:13 Compuestos inorgánicos:14 Óxidos básicos. También llamados óxidos metálicos, que están formados por un metal y oxígeno. Ejemplos: el óxido plúmbico, óxido de litio. Óxidos ácidos. También llamados óxidos no metálicos, formados por un no metal y oxígeno. Ejemplos: óxido hipocloroso,óxido selenioso. Hidruros, que pueden ser tanto metálicos como no metálicos. Están compuestos por un elemento e hidrógeno. Ejemplos: hidruro de aluminio, hidruro de sodio. Hidrácidos, son hidruros no metálicos que, cuando se disuelven en agua, adquieren carácter ácido. Por ejemplo, el ácido iodhídrico. Hidróxidos, compuestos formados por la reacción entre un óxido básico y el agua, que se caracterizan por presentar el grupo oxidrilo (OH). Por ejemplo, el hidróxido de sodio, o sosa cáustica. Oxácidos, compuestos obtenidos por la reacción de un óxido ácido y agua. Sus moléculas están formadas por hidrógeno, un no metal y oxígeno. Por ejemplo, ácido clórico. Sales binarias, compuestos formados por un hidrácido más un hidróxido. Por ejemplo, el cloruro de sodio. Oxisales, formadas por la reacción de un oxácido y un hidróxido, como por ejemplo el hipoclorito de sodio. Compuestos orgánicos:15 Compuestos alifáticos, son compuestos orgánicos constituidos por carbono e hidrógeno cuyo carácter no es aromático. Compuestos aromáticos, es un compuesto orgánico cíclico conjugado que posee una mayor estabilidad debido a la deslocalización electrónica en enlaces π. Compuestos heterocíclicos, son compuestos orgánicos cíclicos en los que al menos uno de los componentes del ciclo es de un elemento diferente al carbono.16 Compuestos organometálicos, es un compuesto en el que los átomos de carbono forman enlaces covalentes, es decir, comparten electrones, con un átomo metálico. Polímeros, son macromoléculas formadas por la unión de moléculas más pequeñas llamadas monómeros. 3.4. ELECTRONEGATIVIDAD La electronegatividad es un concepto químico más bien que una propiedad de los elementos aunque, por supuesto, el valor de dicha magnitud depende de su comportamiento químico. La electronegatividad (EN) mide la mayor o menor atracción -y, por tanto, desplazamiento- que un átomo ejerce sobre el par de electrones de un enlace con otro átomo. Al ser un concepto químico no tiene unidades y su valor se realiza a partir de una escala. La escala que más se utiliza es la de Pauling, en la que, de forma arbitraria, el F tiene EN 4,0 y el Cs 0,7. Densida atómica: La densidad atómica es una propiedad física que involucra tanto a la masa del objeto como al volumen que éste ocupa. La electronegatividad: La electronegatividad es la fuerza, el poder de un átomo de atraer a los electrones hacia sí mismo. 4. MOVIMIENTO DE LOS ÁTOMOS EN LOS MATERIALES. 4.1. ESTABILIDAD DE LOS ÁTOMOS Los átomos no suelen permanecer en la naturaleza aislados, sino que tienden a agregarse entre sí formando unas estructuras más complejas. Se unen porque aislados no son estables, y el unirse a otros átomos les permite pasar a una situación de menor energía, lo que supone también mayor estabilidad. ¿Cómo se logra la estabilidad de un átomo? Un núcleo es estable cuando existe un equilibrio entre las fuerzas que actúan, o las fuerzas atractivas son mayores que las repulsivas. Es decir, la interacción nuclear fuerte que experimentan los neutrones y protones son mayores que las fuerzas de repulsión eléctrica de los protones. 4.2. MECANISMO DE DIFUSIÓN La difusión puede ser definida como el mecanismo por el cual la materia es transportada a través de ella misma. Los átomos de gases, líquidos y sólidos están en constante movimiento y se desplazan en el espacio con el transcurso del tiempo. Existen dos mecanismos de difusión: por vacantes y por intersticial. La difusión intersticial suele ser más rápida. En el estado estacionario, el perfil de concentración de las sustancias que se difunden es independiente del tiempo y el flujo o velocidad es proporcional al valor negativo del gradiente de concentración. Difusión por vacantes Cuando los átomos difunden, las vacantes cambian de posición, y la difusión de los átomos en una dirección corresponde al movimiento de las vacantes en la dirección opuesta. La autodifusión y la interdifusión se producen por este mecanismo 4.3. ENERGIA DE ACTIVACION PARA LA DIFUSIÓN La energía de activación suele utilizarse para denominar la energía mínima necesaria para que se produzca una reacción química dada. Para que ocurra una reacción entre dos moléculas, estas deben colisionar en la orientación correcta y poseer una cantidad de energía mínima 4.4. VELOCIDAD DE DIFUSIÓN (PRIMERA LEY DE FICK) En una única dimensión (espacial), la ley toma la forma: ) es proporcional a la velocidad de difusión al cuadrado de las partículas que están difundiendo, la cual depende de la temperatura, viscosidad del fluido y del tamaño de las partículas de acuerdo a la relación de Einstein-Stokes. 4.5. PERFIL DE COMPOSICIÓN (SEGUNDA LEY DE FICK) Perfil de Composición (Segunda Ley de Fick) Esta segunda Ley de Fick nos habla de la difusión dinámica, o en estado no estacionario de los átomos. En otras palabras es la difusión de átomos en la superficie de un material.









