documento de lectura previa
Anuncio
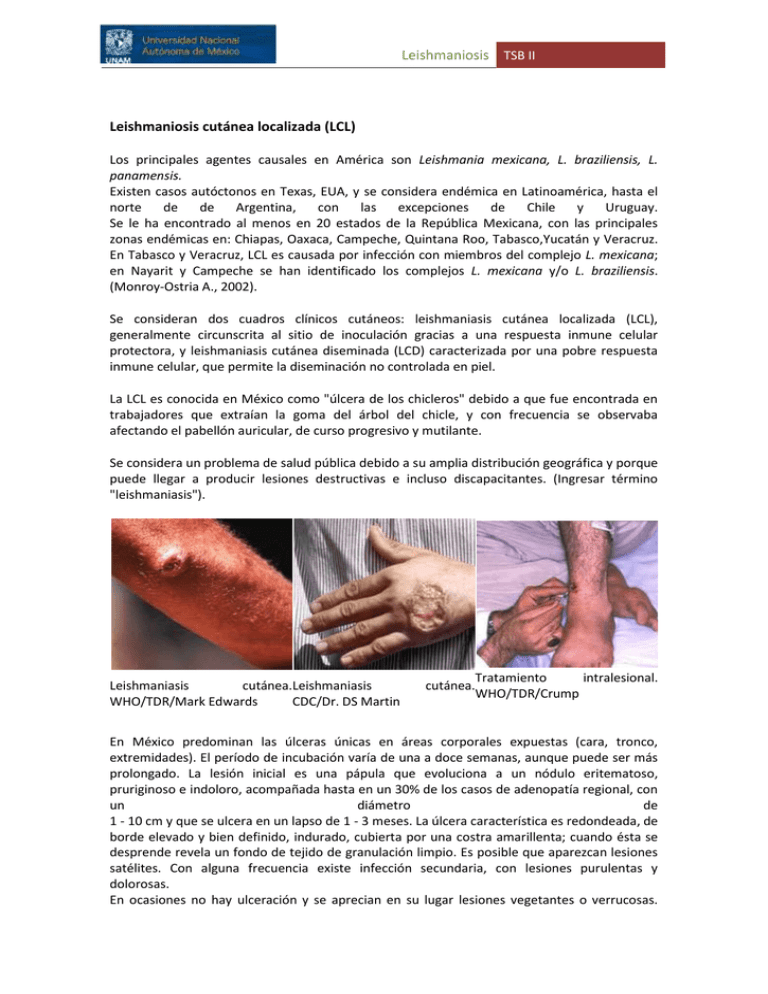
Leishmaniosis TSB II Leishmaniosis cutánea localizada (LCL) Los principales agentes causales en América son Leishmania mexicana, L. braziliensis, L. panamensis. Existen casos autóctonos en Texas, EUA, y se considera endémica en Latinoamérica, hasta el norte de de Argentina, con las excepciones de Chile y Uruguay. Se le ha encontrado al menos en 20 estados de la República Mexicana, con las principales zonas endémicas en: Chiapas, Oaxaca, Campeche, Quintana Roo, Tabasco,Yucatán y Veracruz. En Tabasco y Veracruz, LCL es causada por infección con miembros del complejo L. mexicana; en Nayarit y Campeche se han identificado los complejos L. mexicana y/o L. braziliensis. (Monroy-Ostria A., 2002). Se consideran dos cuadros clínicos cutáneos: leishmaniasis cutánea localizada (LCL), generalmente circunscrita al sitio de inoculación gracias a una respuesta inmune celular protectora, y leishmaniasis cutánea diseminada (LCD) caracterizada por una pobre respuesta inmune celular, que permite la diseminación no controlada en piel. La LCL es conocida en México como "úlcera de los chicleros" debido a que fue encontrada en trabajadores que extraían la goma del árbol del chicle, y con frecuencia se observaba afectando el pabellón auricular, de curso progresivo y mutilante. Se considera un problema de salud pública debido a su amplia distribución geográfica y porque puede llegar a producir lesiones destructivas e incluso discapacitantes. (Ingresar término "leishmaniasis"). Leishmaniasis cutánea.Leishmaniasis WHO/TDR/Mark Edwards CDC/Dr. DS Martin Tratamiento intralesional. cutánea. WHO/TDR/Crump En México predominan las úlceras únicas en áreas corporales expuestas (cara, tronco, extremidades). El período de incubación varía de una a doce semanas, aunque puede ser más prolongado. La lesión inicial es una pápula que evoluciona a un nódulo eritematoso, pruriginoso e indoloro, acompañada hasta en un 30% de los casos de adenopatía regional, con un diámetro de 1 - 10 cm y que se ulcera en un lapso de 1 - 3 meses. La úlcera característica es redondeada, de borde elevado y bien definido, indurado, cubierta por una costra amarillenta; cuando ésta se desprende revela un fondo de tejido de granulación limpio. Es posible que aparezcan lesiones satélites. Con alguna frecuencia existe infección secundaria, con lesiones purulentas y dolorosas. En ocasiones no hay ulceración y se aprecian en su lugar lesiones vegetantes o verrucosas. Leishmaniosis TSB II El cuadro tiende a curar espontáneamente a corto o largo plazo, dejando como secuela una cicatriz visible como una placa atrófica y discrómica con telangiectasias. Es importante hacer notar que cuando afecta pabellones auriculares (forma cutáneo-condral) produce una úlcera crónica,progresiva, de fondo exudativo, generalmente indolora, mutilante. Leishmaniosis cutánea difusa (LCD) Leishmaniasis cutánea difusa o diseminada. WHO/TDR/Crump. Forma polar anérgica. Se ha reportado en Oaxaca, Campeche, Tabasco, Veracruz, Michoacán, Tamaulipas. Se caracteriza por lesiones nodulares con gran número de parásitos, diseminadas prácticamente en todo el tegumento, con excepción del cuero cabelludo, regiones inguinal y axilar, genitales externos, plantas y palmas, aunque se han reportado excepciones. La enfermedad es de curso crónico, se presentan resistencias a los tratamientos. Se asocia a recaídas, infecciones bacterianas secundarias. La respuesta inmune predominante, no protectora, es de tipo Th2. En la biopsia de la lesión, se identifican macrófagos vacuolados con abundantes amastigotes. Leishmaniosis TSB II Leishmaniosis mucocutánea (LMC) Este síndrome es conocido como espundia en Sudamérica. Las manifestaciones clínicas se presentan muchos meses o años después de haberse resuelto la enfermedad cutánea; se deben a metástasis de lesiones cutáneas, aunque en un porcentaje de los casos no es posible identificar la lesión primaria. Las lesiones se inician principalmente en mucosa nasal, simulando en el inicio una rinitis. Se aprecia inflamación de la mucosa e hipertrofia vascular, con ulceración posterior que llega a comprometer el tabique nasal cartilaginoso. El progreso de la enfermedad es crónico. Puede involucrar el labio superior, paladar, pilares, úvula, epiglotis, cuerdas vocales, hipofaringe, laringe y tráquea. Los cuadros severos se asocian a dificultad para respirar, deglutir; también se presenta disfonía, afonía e incluso asfixia. La infección secundaria es frecuente y complica el cuadro. Presenta resistencia a la quimioterapia específica. No es usual en niños, pero cuando ocurre la mortalidad es alta. Las lesiones presentan escasos parásitos. La respuesta inmune predominante es de tipo Th1. Leishmaniosis TSB II Leishmaniosis dérmica post-kala-azar (PKDL) Post kala-azar. WHO/TDR Esta complicación, reconocida en India y Sudán, suele presentarse entre los 6 meses y 3 años posteriores al tratamiento en el 10% de los casos de leishmaniosis visceral. Las lesiones consisten en una erupción macular, maculopapular y nodular. Habitualmente inicia en cara y se disemina a tronco y extremidades, de acuerdo a su severidad. En ocasiones se autolimita, pero en una buena parte de los casos requiere tratamiento, ya que puede persistir por años. Su alta mortalidad se relaciona con el inmucompromiso e infecciones secundarias. Diagnóstico. Para considerar un diagnóstico presuntivo se deben tener en cuenta el cuadro clínico y los antecedentes epidemiológicos (residencia o visita a zonas endémicas). En la LV, los amastigotes se encuentran en aspirados de médula ósea, biopsia de bazo e hígado, procedimientos que implican trauma importante y requieren de hospitalización. En la LCL y LMC se realizan raspado, biopsia, improntas y extendidos de las lesiones y ganglios linfáticos. En ocasiones el número de amastigotes presentes es escaso, sobre todo en lesiones de larga evolución, con reacción granulomatosa. En cambio, en la LCD las lesiones son abundantes en parásitos. La visualización de amastigotes se realiza al microscopio después de tinción con la técnica Giemsa. En diferentes estudios se reportan resultados variables mediante cultivo en medios NNN, RPMI-1640 o Schneider. Entre las pruebas inmunológicas cabe considerar a la prueba de ELISA, IFA (Indirect fluorescence antibody), inmunofluorescencia directa y la prueba de aglutinación directa (DAT). La prueba de ELISA es positiva en etapas tempranas de la enfermedad y permite evaluar niveles de anticuerpos. Los pacientes con hipergammaglobulinemia presentan títulos elevados de IgG e IgM. La utilización de IFA se encuentra restringida a unos cuantos centros de estudio, con una sensibilidad de 87–100% y especificidad de 77–100%. En la leishmaniasis cutánea y mucocutánea los niveles de anticuerpos son bajos. La intradermorreación de Montenegro, prueba de hipersensibilidad celular a antígenos de Leishmania es un método indirecto, utilizado en estudios epidemiológicos. Es positiva en las formas LCL y LMC, después de unos 30 - 90 días de haber adquirido la infección y se mantiene Leishmaniosis TSB II indefinidamente. En los casos de LV es negativa durante la enfermedad activa, y solamente se positiviza con el tratamiento, por lo que es útil, en forma conjunta con los anticuerpos, en el monitoreo de la evolución durante el tratamiento. En la enfermedad cutánea difusa (LCD) también es negativa. Para la discriminación entre especies, se requiere una bateria de métodos de identificación. Se han empleado el cultivo de promastigotes con anticuerpos monoclonales y perfiles isoenzimáticos. Se utiliza la técnica de PCR (reacción en cadena de la polimerasa) para el diagnóstico y distinción de género y especie; desafortunadamente, se encuentra restringida a algunos centros de investigación y de referencia diagnóstica (Boelaert M, et al. 2007; Fagundes Aline, et al. 2010). Diagnóstico diferencial. En el caso de la leishmaniosis visceral, se debe descartar: paludismo, tuberculosis miliar, brucelosis, fiebre tifoidea, histoplasmosis, esplenomegalia tropical, desnutrición, linfoma, leucemia, entre otros. Por otra parte, impétigo, picaduras infectadas de mosquitos, lupus vulgar, lepra, sífilis, cáncer de piel, lesiones causadas por amibas de vida libre y otras patologías, pueden simular un cuadro de leishmaniosis cutánea. Tratamiento. Los tratamientos convencionales contemplan a los antimoniales pentavalentes: antimoniato de meglumina (Glucantime) y estibogluconato de sodio (Pentostam). Constituyen los fármacos de elección a pesar de su elevado costo, falta de efectividad en muchos casos, resistencias y diversos efectos secundarios: alteraciones en la función hepática, pancreatitis bioquímica, aplanamiento de ondas T en el ECG, mialgias, artralgias, trombocitopenia y otros. Otros fármacos sistémicos utilizados son: Anfotericina B, Anfotericina B liposomal (AmBisome), pentamidina, paromomicina y sitamaquina (en evaluación clínica). Entre los fármacos orales, se emplean: Miltefosine, un antineoplásico con efecto teratogénico, aceptado en India para tratamiento de la leishmaniosis visceral (desde 2002) y en América para tratar lesiones cutáneas y mucocutáneas, ketoconazol e itraconazol. Los fármacos mencionados son tóxicos, con la excepción de AmBisome que presenta menos efectos adversos, y tienen un alto costo. Asimismo, se han identificado fármacorresistencias. En los casos de LCL, se considera a los antimoniales sistémicos o intralesionales como el tratamiento de elección. Algunos métodos físicos son eficaces en lesiones pequeñas: crioterapia, calor controlado (ondas de radio) - 50 °C / 30 seg / 1 dosis, ungüento de paromomicina, e imiquimod (antiviral con características inmunomoduladoras), empleado conjuntamente con antimoniales. Varios antígenos son candidatos potenciales en el desarrollo de vacunas. También se están realizando estudios con proteínas recombinantes. Virbac, laboratorio farmacéutico dedicado exclusivamente a la salud animal, lanzó en España la única vacuna contra la leishmaniosis canina en Europa (Europapress.es, enero 2012). Leishmaniosis TSB II Epidemiología. La leishmaniosis se encuentra distribuída en unos 100 países, en trópicos, subtrópicos y regiones templadas. Se considera que 350 millones de personas en el mundo están en riesgo de infección. La prevalencia estimada es de 12 millones de casos. Ambiente Edwards propicio. WHO/TDR/Mark La forma más frecuente en América es la cutánea. La enfermedad se asocia principalmente con la penetración o residencia cercana de grupos humanos en regiones selváticas; se han reportado casos en México, Centroamérica, Sudamérica, Texas, con la excepción de Chile, Uruguay e islas del Caribe. En México, la leishmaniosis se ha identificado al menos en 20 entidades federativas, entre ellas Coahuila, Nuevo León, Tamaulipas, Veracruz, Tabasco, Campeche, Yucatán, Quintana Roo, Chiapas, Oaxaca, Guerrero, Michoacán, Jalisco, Nayarit, San Luis Potosí, Morelos, Puebla e Hidalgo. (Monroy et al., 2002; Sanchez et al., 2010). La leishmaniosis afecta a ambos sexos, aunque se reporta con mayor frecuencia en sujetos del sexo masculino, con aumento en la incidencia a partir de los 9 años de edad (Dirección de Epidemiología, 2006). Es una patología subregistrada. En el año 2008, se reportaron 710 de casos en el Anuario de Morbilidad del CENAVECE, SSA, México. Las zonas geográficas situadas por debajo de los 1 750 m sobre el nivel del mar, con clima cálido, humedad relativa alta y temperatura media entre 25 - 30 °C presentan las condiciones adecuadas para la transmisión de la enfermedad cutánea y la proliferación de focos en bosques tropicales donde aún es frecuente la presencia de reservorios y vectores, en tanto que los bosques secos tropicales son el hábitat preferido para la leishmaniosis visceral. Actúan como reservorios los marsupiales, roedores, zorros, animales peridomésticos; los perros tienen gran importancia por su estrecha relación con el humano (leishmaniosis visceral). Los flebotomos se desplazan a "saltos", a cortas distancias de sus criaderos; se ubican en el suelo, troncos de árboles, hojas de pequeños arbustos, madrigueras de mamíferos, cerca de arroyos y ríos; también es posible encontrarlos en las paredes húmedas de viviendas, en gallineros, chiqueros. La infección es adquirida sobre todo en estación de lluvias, a causa del incremento en la densidad de los transmisores, cuando el hombre entra o reside en las áreas ecoepidemiológicas adecuadas. Factores de riesgo en zonas endémicas son la exposición debida a actividades laborales (campesinos, militares, chicleros, madereros, arqueólogos); la instalación de viviendas cerca de Leishmaniosis TSB II focos de transmisión y de ciudades cercanas a bosques y/o selvas tropicales. Los perros son muy susceptibles y constituyen hospederos importantes de la infección causada por L. infantum. En zonas de Europa en las que se ha reportado leishmaniasis canina (CanL) también se han identificado gatos y caballos infectados. (Gramiccia. 2011). Asimismo, la infección en caninos se ha identificado plenamente en Latinoamérica. La coinfección con VIH+ se ha asociado a un incremento muy importante de la leishmaniosis visceral en zonas endémicas. Leishmaniasis canina. En: Filipe Dantas. Canine vector-borne diseases in Brazil. Parasit Vectors. 2008;1:25 Control. Es fundamental la educación de las comunidades en riesgo sobre las características de la enfermedad, sus formas de presentación clínica, los insectos transmisores, la importancia de su control y en el empleo de métodos de protección, tales como el uso de ropa protectora y repelentes. Los grupos médicos y paramédicos deben tener los recursos mínimos para la identificación rápida del parásito; asimismo, las autoridades locales deben estar conscientes de la tarea de eliminación de reservorios domésticos, adecuación de las viviendas al entorno e implantantación de medidas básicas de sanidad. En algunos sitios se ha implementado la vacunación de perros con resultados alentadores. La colonización de áreas enzoóticas, la movilización de tropas, la explotación de los recursos naturales, los hábitos relacionados con la enfermedad, aumentan las probabilidades de infección debido a la interacción del hombre con reservorios y vectores. Las acciones encaminadas a la protección para evitar el contacto del hombre y transmisor, y el acceso oportuno al tratamiento adecuado son los principales condicionantes para el control de la enfermedad. Vínculos. - Rafael Ramiro de Assis, et al. Glycoconjugates in New World species of Leishmania: Polymorphisms in lipophosphoglycan and glycoinositolphospholipids and interaction with hosts. Biochimica et Biophysica Acta (BBA) General Subjects. Sept 2012;1820(9): 1354–1365. - M. Gramiccia. Recent advances in leishmaniosis in pet animals: Epidemiology, diagnostics and anti-vectorial prophylaxis. Vet Parasitol, 8 Sept 2011;181(1): 23-30. - Pastor-Santiago JA, Chávez-López S, Guzmán-Bracho C, Flisser A, Olivo-Díaz A. American visceral leishmaniasis in Chiapas, Mexico. Am J Trop Med Hyg. 2012 Jan;86(1):108-14. - Fernández-Figueroa EA, Rangel-Escareño C, Espinosa-Mateos V, Carrillo-Sánchez K, Salaiza-Suazo N, et al. Disease Severity in Patients Infected with Leishmania mexicana relates to IL-1B. PLoS Negl Trop Dis, 2012;6(5): e1533. - Vargas MF, Torres G, Arenas R, Quintanilla CMR. Leishmaniasis en México. Med Cutan Iber Lat Am 2011; 39 (4). Leishmaniosis TSB II - Beltrán SSL, Martínez-Domínguez R, Enríquez-Gallegos M, Santos-Preciado JI. Leishmaniasis visceral: veinte años de experiencia clínica en población pediátrica en un hospital de referencia en Chiapas. Bol Med Hosp Infant Mex 2011; 68 (2) - Schnian G,Kuhls K,Mauricio IL. Molecular approaches for a better understanding of the epidemiology and population genetics of Leishmania. Parasitology, April 2011;138(4):405-425. - Sánchez-García L, Berzunza-Cruz M, Becker-Fauser I, Rebollar-Téllez EA. Sand flies naturally infected by Leishmania (L.) mexicana in the peri-urban area of Chetumal city, Quintana Roo, México. T Roy Soc Trop Med H, Jun 2010;104(6):406-411. doi:10.1016/j.trstmh.2010.01.010



