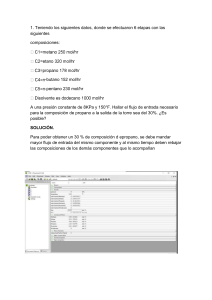
3.1 Masa molecular y masa formular: Definición de Masa Molecular de una Sustancia: Es la suma de las masas atómicas de todos los átomos en una molécula de la sustancia. Es decir, es la suma de las masas atómicas las que vienen junto con el elemento en la tabla periódica de todos los átomos en una molécula de la sustancia a trabajar. Por ejemplo, la masa molecular del Agua: 3.2 Concepto de mol: Los químicos han adoptado el concepto de mol como una manera conveniente para tratar con los enormes números de moléculas o iones en las muestras con las que trabajan. Definición de Mol y Masa Molar: La masa molar es la cantidad de masa que una sustancia contiene en un mol. Un mol se define como 6.022 x10 23 partículas. La masa de un mol de sustancia (llamada masa molar) es equivalente a la masa atómica o molecular (según se haya considerado un mol de átomos o de moléculas) expresada en gramos. Entonces el mol es igual a la masa atómica pero expresada en gramos. Entonces la diferencia radica en el peso de cada mol, podemos decir que en un mol de hidrogeno hay la misma cantidad de átomos que en un mol de oxigeno pero un mol de hidrógeno pesara 1g en cambio 1 mol de oxigeno pesara 16g Cuando se utiliza el termino mol, es importante especificar la formula de la unidad para evitar una equivocación. Por ejemplo, un mol de átomos de Oxigeno (Con la formula O) contiene el número de Avogadro átomos de O. Pero un mol de MOLECULAS de oxígeno (formula O2) contiene 2 veces el número de Avogadro átomos de O. 3.3 Porcentajes en masa a partir de la formula: Los químicos han adoptado el concepto de mol como una manera conveniente para tratar con los enormes números de moléculas o iones en las muestras con las que trabajan. Definición de Composición Porcentual: esto es: como los porcentajes en masa de cada elemento del compuesto Formula empírica a partir de la composición: Formula molecular a partir de la formula empírica 3.6 Interpretación molar de una ecuación química 3.7 Cantidades de sustancias en una reacción química 3.8 Reactivo limitante; rendimientos teóricos y porcentuales Definición de Reactivo Limitante: Es el que se consume por completo cuando se completa una reacción, al reactivo que no se consume por completo se le refiere con frecuencia como reactivo en exceso. Definición de Rendimiento teórico: Es la cantidad máxima de producto que puede obtenerse por medio de una reacción a partir de cantidades dadas de los reactivos 4.1 Teoría iónica de las disoluciones y reglas de solubilidad: En 1884 el joven químico sueco Svante Arrhenius propuso la teoría iónica de las disoluciones para explicar esta conductividad. Dijo que ciertas sustancias producen iones que se mueven libremente cuando se disuelven en agua y conducen la corriente eléctrica en una disolución acuosa Electrolito: Un electrolito es una sustancia que se disuelve en agua para producir una disolución de conduzca la electricidad. No Electrolito: Es una sustancia que se disuelve en agua para producir una disolución no conductora o una muy mala conductora. Electrolito Fuerte: Existe en disolución casi por completo en la forma de iones Electrolito Débil: Se disuelve en agua para dar un porcentaje relativamente pequeño de iones. Reglas de solubilidad 4.4 Reacciones oxido-base Reacciones oxido-base. Una sustancia acida reacciona con una sustancia llamada base. Dichas reacciones involucran la transferencia de un protón (+) (el que se encuentra en el núcleo del átomo) entre los reactivos.