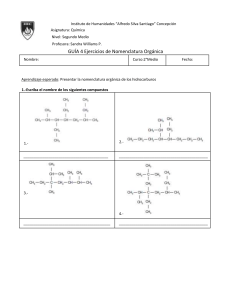
Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA NOMENCLATURA Y FORMULACIÓN EN QUÍMICA INORGÁNICA1 1Notas del libro “Nomenclatura y Formulación de Química Inorgánica y Orgánica”. Antonio Martínez Lorenzo, Sebastián Garau Marqués y Jorge Peidró Martínez. Editorial Bruño. Marqués de Mondéjar 32, 28028. Madrid. 1 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA Compuestos binarios: Óxidos. Hidruros. Sales binarias. Óxidos. Los óxidos son combinaciones del oxígeno con los metales (óxidos básicos) y con los no metales (óxidos ácidos) . En estas combinaciones el oxígeno actúa con número de oxidación, - 2. Óxidos básicos. Los óxidos básicos o metálicos tienen de fórmula general: X2On donde X es el metal y n es la valencia con que actúa. 2 es la valencia del oxígeno. Como en todas las combinaciones binarias se intercambian las valencias. Para los metales alcalinos, n = 1 y sus óxidos serán por ejemplo: K2O, Na2O, etc... Para los metales alcalinotérreos, n = 2 y sus óxidos serán por ejemplo: Ca2O2 = CaO, Mg2O2 = MgO, etc... Para los metales térreos, n = 3 y sus óxidos serán por ejemplo: Al2O3, etc... Muchos metales de transición forman varios óxidos, así del hierro se conocen: FeO y Fe2O3. Del manganeso con valencias, 2, 3, 4, 6 y 7 se tienen los óxidos: MnO, Mn2O3, MnO2, MnO3 y Mn2O7. Nomenclatura. 2 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA a) Nomenclatura tradicional. Cuando el metal forma un solo óxido, se nombran los óxidos con la palabra óxido seguida del nombre del metal precedida de la preposición de, o bien sin preposición, terminando el nombre del metal en -ico. Ejemplos. Na2O CaO óxido de sodio ó sódico óxido de calcio ó cálcico Si el metal forma dos óxidos, el nombre del metal termina en -oso cuando éste actúa con la valencia menor y en -ico cuando actúa con la valencia mayor. Ejemplos. CoO Co2O3 óxido cobaltoso óxido cobáltico b) Nomenclatura de Stock. Los óxidos se nombran con la palabra óxido, seguida del nombre del metal (o no-metal), y a continuación el número de oxidación del elemento con números romanos entre paréntesis. Ejemplos. FeO Fe2O3 óxido de hierro (II) óxido de hierro (III) c) Nomenclatura sistemática. Según esta nomenclatura, las proporciones en que se encuentran los elementos en los óxidos se indican mediante prefijos griegos (mono-, di-, tri-, tetra-, penta-, hexa-, hepta-, etc..) para 1, 2, 3 , 4 etc.. átomos, pudiendose utilizar los prefijos hemi- (1/2) y sesqui- (2/3). Ejemplos. MnO monóxido de manganeso 3 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA Mn2O3 MnO2 MnO3 Mn2O7 trióxido de dimanganeso dióxido de manganeso trióxido de manganeso heptaóxido de dimanganeso Óxidos ácidos. Los óxidos ácidos tienen de fórmula general: Y2On donde Y es el no-metal y n es la valencia con que actúa. 2 es la valencia del oxígeno. Como en todas las combinaciones binarias se intercambian las valencias. Nomenclatura. Se denominan de acuerdo con la nomenclatura descrita anteriormente. Peróxidos. Los peróxidos son óxidos en los cuales existe el enlace peroxo (-O-O-), o enlaces simples oxígeno-oxígeno. Nomenclatura. Se denominan con la palabra peróxido seguida del nombre del metal. Ejemplos: K2O2 ZnO2 peróxido de potasio peróxido de cinc Hidruros. 4 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA Los hidruros son combinaciones binarias del hidrógeno con los metales y con los no metales. Hidruros metálicos. Los hidruros metálicos tienen de fórmula general: XHn donde X es el metal y n es el número de oxidación con que actúa. (1) es la valencia del hidrógeno. Nomenclatura. Los hidruros metálicos se nombran con la palabra hidruro seguida del nombre del metal, con la valencia entre paréntesis, si tiene varias. En la nomenclatura sistemática, preceden a la palabra hidruro los prefijos mono-, di-, tri-, tetra-, etc.. según los átomos de hidrógeno que tengan. Ejemplos. NaH CuH2 hidruro de sodio hidruro de cobre (II) ó dihidruro de cobre Hidruros no-metálicos. Los hidruros no-metalicos tienen de fórmula general: HnY donde Y es el no metal y n es el número de oxidación con que actúa. (+1) es la valencia del hidrógeno. Nomenclatura. Los hidruros no-metalicos se nombran con la terminación uro añadida al nombre del no-metal de los grupos del oxígeno y halógenos. Los elementos boro, carbono, silicio, y los del grupo del nitrógeno conservan sus nombres tradicionales en las 5 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA combinaciones binarias con el hidrógeno. Ejemplos. HF HI H2S fluoruro de hidrógeno yoduro de hidrógeno sulfuro de hidrógeno CH4 AsH3 tetrahidruro de carbono trihidruro de arsénico Sales binarias. Sales haloideas. Son compuestos binarios de un metal con un halógeno (F, Cl, Br, I). Su fórmula general es: MXn donde M es el metal, X el halógeno (F, Cl,Br, I) y n es la valencia del metal. Nomenclatura. Se nombran estos compuestos haciendo terminar el nombre del halógeno en -uro, seguido del nombre del metal. En la nomenclatura sistemática se indican con prefijos las proporciones de los elementos del compuesto, como en los hidruros. Ejemplos. CaF2 FeCl3 AgI fluoruro de calcio ó difluoruro de calcio cloruro férrico cloruro de hierro (III) tricloruro de hierro yoduro de plata 6 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA Combinaciones binarias de no-metal con metal. Las combinaciones de los metales con los no-metales de los grupos 6b (S), 5b (N, P, As), 4b (C, Si) y (B) dan lugar a sales binarias cuya nomenclatura es análoga a la antes indicada para las sales haloideas. La nomenclatura hace terminar en -uro el nombre del nometal seguido del nombre del metal. Ejemplos. MnS2 sulfuro mangánico sulfuro de manganeso (IV) disulfuro de manganeso Mg3P2 fosfuro de magnesio difosfuro de trimagnesio Combinaciones binarias entre no-metales. Estas combinaciones se nombran de igual modo que las anteriores haciendo terminar en -uro el elemento que figure delante en la serie siguiente: F, Cl, Br, I, S, Se, Te, N, P, As, Sb, C, Si, B. Así el compuesto CS2 se debe nombrar sulfuro de carbono (no carburo de azufre) Ejemplos. BrCl NCl3 B2S3 cloruro de bromo cloruro de nitrógeno (III) ó tricloruro de nitrógeno sulfuro de boro ó trisulfuro de diboro 7 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA Compuestos ternarios: Hidróxidos. Oxácidos. Hidróxidos. Los hidróxidos son compuestos ternarios formados por la combinación de un catión metálico con iones OH-. Se llaman también bases. Los hidróxidos tienen de fórmula general: X(OH)n donde X es el metal y n es la valencia con que actúa. Muchos de ellos pueden obtenerse al disolver en agua los óxidos básicos correspondientes. Nomenclatura. Se nombran con la palabra hidróxido seguida del nombre del 8 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA metal, indicando su valencia según la nomenclatura de Stock. En la nomenclatura sistemática se indican con prefijos numerales las proporciones que intervienen. Ejemplos. NaOH Pb(OH)2 hidróxido de sodio ó sódico hidróxido plumboso hidróxido de plomo (II) dihidróxido de plomo Oxácidos. Son compuestos ternarios que tienen por fórmula general: HaXbOc donde X es de ordinario un no-metal, pero también puede ser un metal de transición como el Mn, Cr ó Mo cuando actúan con valencia o número de oxidación superior a 4. a) Los oxácidos pueden suponerse formados al combinarse los óxidos ácidos con el agua. Así: SO3 + H2O = H2SO4 N2O5 + H2O = H2N2O6 = 2 HNO3 Se admite las terminaciones -oso e -ico que provienen de los óxidos ácidos correspondientes, cambiando el nombre de la función óxido por la de ácido. b) Cuando el óxido ácido reacciona con una, dos o tres moléculas de agua, el ácido que se obtiene lleva los prefijos meta, piro y orto, respectivamente. Así: P2O5 + H2O = 2 HPO3 (ácido metafosfórico) P2O5 + 2 H2O = H4P2O7 (ácido pirofosfórico) 9 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA P2O5 + 3 H2O = 2 H3PO4 (ácido ortofosfórico) a) Nomenclatura tradicional. Además de los sufijos -oso e -ico empleados para indicar el ácido en el cual el no-metal actúa con valencia o estado de oxidación menor y mayor, respectivamente, se utilizan los prefijos hipo- y percuando el elemento puede actuar con mas de dos valencias o estados de oxidación. b) Nomenclatura funcional. En esta nomenclatura se indica la función ácido seguida del específico que termina en -ico precedido de las partículas di-, tri-, tetra- (para indicar el número de oxígenos que contiene) y concluye con el número de oxidación del no-metal, según la expresión de Stock. Ejemplos. HIO3 ácido trioxoyódico (V) H2SO3 ácido trioxosulfúrico (IV) H2S2O7 ácido heptaoxodisulfúrico (VI) c) Nomenclatura sistemática. Esta nomenclatura sistematiza la nomenclatura de los ácidos, pues los equipara a las sales. Así, H3PO4 tetraoxofosfato (V) de hidrógeno H2SO4 tetraoxosulfúrato (VI) de hidrógeno 10 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA Peroxoácidos. Son los ácidos que llevan el enlace peroxo (-O-O-) en su molécula. En la nomenclatura tradicional se añade el prefijo peroxo al ácido del que proceden. H2SO5 o H2SO3(O2) ácido peroxosulfurico Oxácidos con enlace carbono-nitrógeno. El ácido representativo es el ácido cianhídrico (HCN) o cianuro de hidrógeno. Sus sales se llaman cianuros (KCN, cianuro potásico). Aniones y Cationes: Aniones. Cationes. Aniones ácidos. Aniones básicos. Se entiende por ion cualquier átomo o grupo de átomos que poseen carga eléctrica. 11 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA Aniones. Los aniones son las especies químicas cargadas negativamente. Los aniones monoatómicos se forman cuando un elemento electronegativo capta uno o mas electrones. Cl + 1 e = ClS + 2 e = S2N + 3 e = N3Los aniones monoatómicos se nombran con la palabra ion seguida del nombre del elemento terminado en -uro. Cl- ion cloruro S2- ion sulfuro N3- ion nitruro Los aniones poliatómicos se pueden considerar formados al perder uno o mas iones hidrógeno (H+, protones) el ácido correspondiente. El anión mas sencillo es el ion hidroxilo OH- que podemos suponer que procede del agua por perdida de un ion hidrógeno. Los aniones procedentes de los ácidos por pérdida del H+ se nombran con la palabra ion seguida del nombre del ácido del que proceden terminado en -ito o -ato, según que el ácido termine en oso o ico respectivamente. Ejemplos. NO3- ion nitrato; SO32- ion sulfito; ClO- ion hipoclorito También puede emplearse la nomenclatura sistemática, NO3SO32- ion trioxonitrato (V) ion trioxosulfato (IV) 12 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA ClO- ion monoxoclorato (I) Cationes. Los cationes son las especies químicas cargadas positivamente. Los cationes monoatómicos se forman cuando un elemento poco electronegativo pierde uno o mas electrones. Na - 1 e = Na+ Al - 3 e = Al+++ Los cationes metálicos se nombran con la palabra ion seguida del nombre del metal y su valencia o según la nomenclatura tradicional con las terminaciones -oso o -ico. Ni++ ion niquel (II) o niqueloso Ni+++ ion niquel (III) o niquelico Cuando algún compuesto que tiene electrones libres como el NH3 se une a un ion hidrógeno, se forman cationes en -onio, NH3 + H+ = NH4+ (ion amonio) Aniones ácidos. Cuando un ácido con varios hidrogenos pierde parte de los mismos aparecen iones ácidos que se nombran con la palabra hidrógeno antepuesta al anión correspondiente, H2S - H+ = HS- ion hidrogenosulfuro H2SO4 - H+ = HSO4- ion hidrogenosulfato H3PO4 - H+ = H2PO4- ion dihidrogenofosfato Aniones básicos. Son iones que contienen el ion hidróxido ademas de otros aniones. La carga del ion resultante es igual a la suma de la carga del anión mas los grupos OH- que haya. En la nomenclatura sistemática se nombra, en primer lugar, el grupo de hidroxilos con la palabra 13 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA hidroxi y los prefijos di, tri, tetra... si contienen 2, 3, 4..., seguida del anión que los acompaña. (OH)Cl- es [(OH)Cl]2- anión hidroxicloruro (OH)2CO32- es [(OH)2CO3]4- anión dihidroxicarbonato Sales de los oxácidos. Sales neutras. 14 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA Sales ácidas. Sales básicas o hidroxisales. Sales dobles. Sales neutras. Son compuestos que proceden de sustituir los hidrógenos de los ácidos por cationes metálicos. Son cuerpos de carácter iónico. Ejemplo. H2SO4 ----> MgSO4 ----> Mg2+ + SO42En la nomenclatura tradicional los oxácidos que terminan en oso dan la sal en ito, y los que terminan en ico dan la sal en ato. Si el elemento forma mas de dos ácidos, se emplean los prefijos hipo y per como en los ácidos correspondientes. En la nomenclatura sistemática todas las sales terminan en ato y si en anión entra 2, 3, 4, 5... veces, se emplean los prefijos: bis, tris, tetraquis, pentaquis.... respectivamente. Ejemplo. Al(BrO3)3 tristrioxobromato (V) de aluminio Pt(CO3)2 bistrioxocarbonato de platino Sales ácidas. Son compuestos que proceden de sustituir no todos los hidrógenos de los ácidos por cationes metálicos. Asi los aniones HS-, HSO4-, H2PO4-, HPO42-, son aniones que aún conservan algún hidrógeno sustituible, las sales que forman se llaman sales ácidas. 15 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA Se nombran anteponiendo el prefijo hidrógeno, dihidrógeno, etc ... al nombre de la sal correspondiente. KHSO4 hirogenosulfato de potasio NaH2PO4 dihidrogenofosfato sódico Sales básicas o hidroxisales. Son compuestos que contienen iones hidróxido además de otros aniones. Se nombran primero los iones hidróxido con la partícula hidroxi- seguidos del nombre de la sal según la nomenclatura funcional. Ejemplos. CaCl(OH) hidroxicloruro de calcio FeCO3(OH) hidroxicarbonato de hierro (III) Pt(NO3)2(OH)2 dihidroxidinitrato de platino (IV) Sales dobles. Son las sales que se obtienen cuando se sustituyen los hidrógenos de un ácido por dos o mas metales o cationes. La suma de las valencias de los metales debe ser igual al total de los hidrógenos sustituidos. KLiCO3 carbonato doble de potasio y litio 16 Dr. Gonzalo Pérez Melián. Profesor Emérito. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA 17