Institución Educativa
José Eustasio Rivera
Jornada Tarde
Guía
Grado 8° Periodo 1
Compuestos
Docente Adriana Polanco González
[email protected]
COMPUESTOS QUÍMICOS
Un compuesto químico es una sustancia pura, formada por la
combinación química de dos o más elementos, en proporciones
definidas. Por ejemplo, 1 g de cloruro de sodio siempre contiene 0,4 g de
sodio y 0,6 g de cloro, combinados químicamente. Los compuestos se
representan por medio de fórmulas. Una fórmula química muestra los
símbolos de los elementos que forman el compuesto, y la proporción que
existe entre ellos, es decir, señalan su composición química. Por ejemplo,
la fórmula del agua es H2O, lo que indica que está constituida por dos
átomos de hidrógeno y uno de oxígeno.
Los compuestos se pueden clasificar en dos grandes grupos:
■ Los compuestos orgánicos: son aquellos que tienen al carbono como elemento principal combinado con
elementos como el hidrógeno, oxígeno y nitrógeno. Los carbohidratos, los lípidos y las proteínas son ejemplos de
compuestos orgánicos.
■ Los compuestos inorgánicos: son aquellos que no tienen al carbono como elemento principal. Por ejemplo, el
agua (H2O).
EL NÚMERO O ESTADO DE OXIDACIÓN
El número de oxidación es el número de electrones que un átomo puede perder o ganar para formar
compuestos. Este valor es negativo, si gana electrones y positivo, si los cede o pierde. Para determinar
el número de oxidación de un átomo en un compuesto, se deben tener en cuenta las siguientes
normas generales:
Norma
Ejemplo
El número de oxidación de cualquier elemento en El número de oxidación del oxígeno diatómico (O2) es
estado libre siempre es cero.
cero.
El oxígeno actúa con número de oxidación – 2.
Agua H2O
Número de oxidación de hidrógeno: +1
Número de oxidación de oxígeno: -2
El hidrógeno actúa con número de oxidación +1.
Agua H2O
Número de oxidación de hidrógeno: +1
Número de oxidación de oxígeno: -2
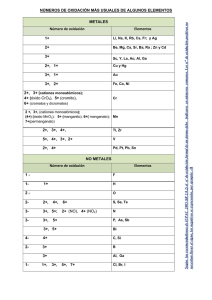
Los metales de los grupos IA, IIA y IIIA siempre tienen
números de oxidación de +1, +2 y +3, respectivamente.
Los metales de transición presentan, por lo regular
varios números de oxidación positivos, según el
número de electrones que entreguen.
Un compuesto siempre está formado por unos
elementos que actúan con número de oxidación
positivo y otros con número de oxidación negativo.
Al escribir la fórmula del compuesto, se colocan
primero los elementos que actúan con número de
oxidación positivo.
En todo compuesto, la suma algebraica de los números
de oxidación de sus elementos multiplicados por los
subíndices correspondientes debe ser igual a cero.
Cuando todos los subíndices de una fórmula son
múltiplos de un mismo número, se pueden dividir entre
este número, para obtener así la fórmula simplificada
del compuesto.
La suma algebraica de los números de oxidación de los
elementos multiplicados por sus subíndices en un ion
poliatómico debe ser igual a la carga del ion.
Número de oxidación de sodio: +1
Número de oxidación de calcio: +2
Número de oxidación de aluminio: +3
Por ejemplo, el cobre tiene dos números de oxidación
+1 y +2.
Ácido sulfúrico H2SO4
Número de oxidación de azufre: +6
Número de oxidación de oxígeno: -2
Número de oxidación de hidrógeno: +1
Óxido férrico Fe2O3
Número de oxidación de hierro: +3
Número de oxidación de oxígeno: -2
Óxido de aluminio AI2O3
Número de oxidación de aluminio: +3
Número de oxidación de oxígeno: -2
Número de oxidación de la molécula: Al (+3 x 2) + O (2 x 3) = 0
H2N2O6 se debe escribir HNO3
Ion sulfato SO4-2
Numero de oxidación de azufre: +6
Número de oxidación de oxígeno: -2
Numero de oxidación ion poliatómico: S (+6 x 1)+ O (2 x 4) = -2
Ejemplo: ¿cuál es el estado o número de oxidación de los átomos que forman el compuesto H 2SO4?
Primero leemos las normas y de acuerdo con ellas, asignamos los números de oxidación a los
elementos que forman el compuesto: número de oxidación de hidrógeno: +1 y número de
oxidación de oxígeno: -2.
Como el azufre tiene varios números de oxidación y teniendo en cuenta que la suma algebraica
de los números de oxidación de los elementos multiplicados por los subíndices
correspondientes debe ser igual a cero, se elige como número de oxidación para el azufre +6:
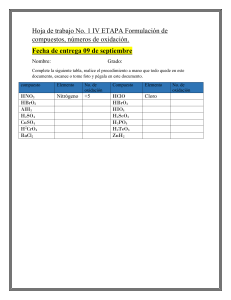
ACTIVIDAD 1. Resuelve en el cuaderno. Indica los números de oxidación de los elementos que
conforman los siguientes compuestos: a)NH3
b) K2Cr2O7
c) K2SO4
d) Ca(OH)2
e) SO3
1