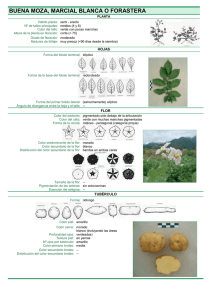
2.2 Monitoreo de plagas. Técnicas de muestreo. 2.1.2 Estratificación de la planta hospedera TERCIO ALTO TERCIO MEDIO TERCIO BAJO 2.1.3 Observaciones de monitoreo de plagas Estratos donde sean observados y registrados Observación: Registro La unidad de muestreo Tipo de registro: Depredadores Phytoseiulus adulto medio folio conteo batón, alta, baja, agobio Ammblyseius adulto medio folio conteo batón, alta, baja, agobio Ninfas medio folio conteo batón, alta, baja, agobio Huevos medio folio conteo batón, alta, baja, agobio Móviles medio folio conteo batón, alta, baja, agobio Huevos medio folio conteo batón, alta, baja, agobio Trip botón(o foliolo) conteo batón, alta Daño botón(o foliolo) presencia batón, alta presencia botón, alta, baja, agobio Ácaros Trips Orugas Áfidos Mosca Blanca Adulto Orugas estrato completo conteo botón, alta, baja, agobio Huevos estrato completo conteo botón, alta, baja, agobio Agujeros estrato completo presencia botón, alta, baja, agobio Ventanillas estrato completo presencia alta, baja, agobio Soltero estrato completo conteo botón, alta, baja, agobio Colonias estrato completo conteo botón, alta, baja, agobio Adultos solteros estrato completo presencia botón, alta, baja, agobio Adultos snube estrato completo presencia botón, alta, baja, agobio Ninfas estrato completo conteo botón, alta, baja, agobio Huevos estrato completo conteo botón, alta, baja, agobio 2.1.4 Muestreo de plagas Ácaros (Tetranychus urticae) Método de muestreo Móviles hace referencia tanto a ninfas como a adultos. Móviles y huevo son contados por separado en la mitad de un foliolo en cada estrato del cultivo; alto, bajo y agobio. Manchas amarillas no son muestreadas en el protocolo, porque la mancha puede ser histórica, es decir, se puede observar manchas amarillas, pero los ácaros han sido fumigados o comidos. Sin embargo, revisar las manchas amarillas, es importante porque es alta la probabilidad de encontrar ácaros cerca de la hoja. Un buen monitoreo del cultivo de rosa no debe permitir que la plaga alcance niveles altos de infestación. Si esto ocurre, un alto conteo de ácaros indicará la severidad del problema. Condiciones favorables Los ácaros prefieren climas cálidos y secos, y condiciones de sequía. Como ejemplo, una generación (huevo a huevo) es completa en 36.4, 16.6 y 7.3 días con 15, 20 and 30 °C, respectivamente. Las condiciones de mayor temperatura son mejores para el desarrollo de los ácaros. Importancia del daño Los ácaros causan manchas amarillas en las hojas de la planta, lo cual da como resultados la desecación de la hoja y la disrupción de la fotosíntesis, disminuyendo grandemente la producción de nutrientes de la planta hospedera. Las rosas con ácaros o con daño de ácaro con daño de ácaros no son comercializables. Sin embargo, la principal preocupación del producto, es la velocidad exponencial con la cual la población puede incrementarse y ser llegada a ser inmanejable. Trips (Frankliniella occidentalis) Método de muestreo El número de trips observado en un botón o en un folio cerca de este es contado o registrado. La presencia de ‘’daño de trip’’ es un registrado en el botón y/o foliolo. Soplando en el botón se puede provocar que provocar que el trip salga de este. No toque el botón de rosa al momento que ellos estén saliendo, pueden causar daño en la calidad del botón. Los trips puede también ser monitoreo con pegante, de color azul(o amarillas).Hemos aprendido de productores en Israel que con un buen monitoreo del cultivo se puede ver el trip o su daño en el cultivo antes que en las trampas. Sin embargo, los trips y su daño son difíciles de detectar. Por lo tanto, los mapas producidos basados en la información de trips y sus daños pueden solo ser guías. Los trips deben ser sometidos a aplicaciones generalizadas, no con tratamientos focalizados. Condiciones favorables Los trips gustan del calor y se desarrollan mayor con temperaturas entre 18-30°C. Cuando los árboles de acacias colindan con los invernaderos por ejemplo, los trips son abundantes e ingresan al invernadero en mayor cantidad. Las familias Compositae e Hibicus son ejemplos de plantas donde los trips son frecuentemente abundantes en las flores. Importancia del daño Los trips típicamente se alimentan de los botones o delas hojas jóvenes cercanas a los botones. Ambos estadíos, juveniles y adultos se alimentan extrayendo fluidos de las células de las plantas. Alimentándose descoloren los botones flores causando vetas de color marrón amarillo, pequeñas manchas oscuras o golpes en los pétalos, daños en los bordes de los pétalos y/u hojas, flecos platinados en los pétalos y hojas jóvenes. Botones de color amarillo, blanco y pastel son más susceptibles. Por un lado, el daño antiestético es ocasionado a los botones y hojas. La distorsión que causa los adultos comiendo los pétalos de las flores y los sépalos es responsable del mayor daño. Daños severos resultan en deformaciones en las flores o botones no abiertos. Por otro lado, las lesiones en pétalos causa das por trips también preparan el camino para futuras infecciones por botritis. Pulgon (Macrosiphum rosae) Método de muestreo Los áfidos pueden producirse como pocos individuos, que pueden ser llamados "solteros", o en grandes grupos, que pueden llamarse colonias". Es fácil contar los áfidos individuales, entonces se puede registrar cuando son "solteros" (de 1 a 14 individuos). Cuando se agrupan en colonias es un poco difícil contar áfidos individuales, es preferible contar el número de colonias (grupos mayores a 14 individuos) en una planta y registrar ese número. Puede haber más de una colonia (grupo) de los áfidos en la misma planta. Algunos productores cuentan áfidos en trampas amarillas. Esto no es un método fiable de exploración, ya que sólo los áfidos alados, serán atrapados en las trampas. Condiciones favorables La temperatura opcional para la mayoría de áfidos es 24°C. El periodo de desarrollo, varía dependiendo de las especies de áfidos, planta hospedera y temperatura. Importancia del daño Tanto adultos como áfidos inmaduros se alimentan del floema de la planta. Al igual que la mosca blanca, que excretan mielecilla, que causa rigidez, hollín negro y disminuye la fotosíntesis. El negro hace fumagina provocando que las flores sean inservibles. Las pieles blancas de los pulgones derramadas con frecuencia están pegadas a la superficie de las plantas por mielecilla y además resta la apariencia de la planta. La savia de los áfidos puede provocar fuerte reacciones alérgicas, tales como malformaciones y la torsión de las zonas de crecimiento. La alimentación puede ocasionar que el follaje se convierta amarillento. Las plantas en desarrollo translocan más recursos Los áfidos tienen una enorme capacidad reproductiva aunque por partenogénesis vivípara, una población de áfidos puede acumularse rápidamente llegando a altas densidades y pudiendo causar daños graves velozmente. Los afidos también pueden ser vectores de virus (transmisión en las plantas), pero esto no es un problema de las rosas de corte en el este de África. Mosca Blanca (Bemisia tabasi) Método de muestreo Las ninfas (incluyendo pupas) de mosca blanca y los huevos son contados por separados en la mitad del folíolo en cada estrato del cultivo: alto, medio y base. Al caminar a través del cultivo se dará cuenta de moscas blancas adultas. Si observa una, dos o tres moscas blancas adultas, usted los registrará como “Adultos solteros”. Si usted ve más que eso, usted los registrará como “Adultos Nubes”. Una “nube de adultos” suele ser cuando se toca las plantas y una “nube” de adultos de mosca blanca se despegan de debajo de las hojas. Usted va a registrar mosca blanca aun cuando solo “solteros”, no hay necesidad de usar trampas pegajosas amarillas para el monitoreo. La presencia de hollín negro también debe registrarse. Condiciones favorables Mosca blanca prefiere temperaturas cálidas y se desarrollan rápidamente en temperatura entre 16 – 32°C. El desarrollo de los huevos hasta la reproducción de los adultos puede ocurrir en menos de tres semanas si las condiciones son ideales. Tabla 1. Tiempo de desarrollo (días , huevos a adultos, de dos especies de mosca blanca ( Tsueda and Tsuchila, 1998). Temperatura 20°C 30°C 32.0 26.2 Mosca blanca Bermisia( Bermisia tabaci) 39.1 17.0 Mosca blanca Trialeurodes( Trialeuroce vaporarioum) Importancia del daño Los adultos de mosca blanca y los estadios inmaduros se alimentan del floema. La savia de las plantas contiene pocas proteínas, pero son ricas en azúcares. Por lo tanto, los insectos tienen que succionar bastante savia, a fin de obtener suficiente proteínas. Como consecuencia, el exceso de azúcar es secretado en forma de exudado, siendo una sustancia pegajosa que hace poco brillante y permitiendo el crecimiento de hollín negro que dificulta la fotosíntesis, retardando el crecimiento de las plantas y con frecuencia causando la caída de las hojas. El hollín negro también reduce la calidad de la flor. La alimentación de esta plaga puede dar una apariencia de manchado, causar amarillamiento y eventualmente causar la muerte de las plantas hospederas. Mosca blanca Bemisia también puede transmitir virus a las plantas. ORUGAS (Spodoptera littoralis) Método de muestreo El número de orugas y/o observados en un estrato de toda la cosecha se cuentan y registran. En cuanto a las polillas adultas o daños de orugas, sólo se registra si está presente. A veces el daño puede ser observado, ya que algunas especies de orugas se pueden encontrar solo en la noche. Por lo tanto, las zonas donde se ha observado daño deben tratarse de igual forma. Aunque las trampas pueden ayuden ayudar a detectar las plagas, las polillas en las trampas pueden ayudar a detectar las plagas, las polillas en las trampas no son prueba definitiva de que cerca de los cultivos estén infestados de orugas. La cosecha debe ser inspeccionada visualmente por los daños, las orugas y los huevos como se describió anteriormente. Condiciones favorables Las orugas prefieren climas cálidos (25 30°C), y parecen surgir en gran número y entran en los invernaderos después de las lluvias. Importancia del daño Las orugas se alimentan de hojas y brotes dejando huecos grandes con formas irregulares. Pero casi siempre alejada del margen de la hoja o el margen de los pétalos. Otras especies de orugas se vuelven en las hojas. 2.3 Monitoreo y pronóstico de enfermedades en relación a la oportunidad de tratamiento para el manejo de patógenos. 2.1.2 Estratificación de la planta hospedera TERCIO ALTO TERCIO MEDIO TERCIO BAJO 2.1.3 Observaciones de monitoreo de enfermedades Observación: Mildeo polvoso Mildeo velloso Botritis de botón Roya Mancha negra Coniothyrium Botritis de tallo Agrobacterium Registro Vivo Seco Vivo Seco Tallo Botritis de botón Vivo Seco Mancha negra Coniothyrium Botritis de tallo Vivo Seco La unidad de muestreo foliolo( o botón) foliolo( o botón) foliolo foliolo estrato completo botón foliolo foliolo foliolo estrato completo estrato completo estrato completo estrato completo Tipo de registro: puntaje puntaje puntaje puntaje presencia presencia puntaje puntaje presencia presencia presencia presencia presencia Estratos donde sean observados y registrados botón, alta, baja, agobio botón, alta, baja, agobio alta,baja,agobio alta,baja,agobio alta,baja,agobio botón alta,baja,agobio alta,baja,agobio alta,baja,agobio alta,baja,agobio tallo tallo tallo 2.1.4 Muestreo de enfermedades Mildeo polvoso o Oidio Agente causal (Spaerotheca pannosa) Método de muestreo Mildeo polvoso vivo y mildeo polvoso seco son registrados por separado, ambos con un puntaje de una escala de 1 a 5. Valor 1: Una mancha de polvoso observada en un foliolo. Valor 2: la infección del polvoso cubre 1/6 (≈15%) de la superficie del foliolo. Valor 3: La infección del polvoso cubre 1/3 (≈30%) de la superficie del foliolo. Valor 4: La infección del polvoso cubre 2/4 (≈60%) de la superficie del foliolo. Valor 5: Casi la totalidad del foliolo está cubierto con la infección del polvosos (≥80%). Condiciones favorables En general, un brote es favorecido por El mildeo polvoso es una enfermedad que humedades de moderada a alta, quiere de condiciones humedad seguidas temperaturas cálidas, bajo flujo del aire por condiciones de calor y sequía. La y baja intensidad de luz. enfermedad puede presentarse cuando las noches son frías y humedad; los días son Importancia del daño cálidos y secos. Más específicamente, el mildeo polvoso se desarrolla en condiciones favorables cuando la humedad relativa (HR) es mayor a 90% en las noches y entre 40 – 70% durante el día. Un período consecutivo mayor a seis horas con una temperatura de 20 – 30°C es también requerido para hacer posible la germinación de las esporas. Epidemias pueden ocurrir cuando hay repetidos ciclos de día/noche como este. Si el tratamiento aplicado es erróneo, las hojas empezarán a ser cubiertas completamente con manchas de mildeo polvoso y las hojas jóvenes empezarán a distorsionarse. Los nuevos brotes deberán protegerse ya que ellos pueden retrasar severamente su crecimiento y no podrán recuperarse de una infección agresiva. Ante la presencia de una infección agresiva las hojas afectadas se tornan púrpura rojiza en el borde del crecimiento del polvos blanco, finalmente se torna amarillo antes que ellas se sequen y caigan (defoliación).Las hojas maduras pueden también ser infectados pero usualmente mantienen su forma normal y se desarrollan alrededor de las áreas irregulares cubiertas por mildeo polvoso. Esto no mata la hoja pero la marca reduce la calidad de ventana. Botones florales infectados pueden verse afectados al no tener una apertura adecuada y los pétalos pueden tornarse descoloridos. Los tallos florales con presencia de polvoso pueden retardar su crecimiento normal y contar su período de vida. Mildeo velloso Agente causal (Peronospora sparsa) Método de muestreo Mildeo velloso Vivo (manchas angulares y esporulación en el envés del foliolo y en el tejido joven algunas veces no se presenta la esporulación) y Mildeo velloso Seco (únicamente manchas angulares con textura acaronadas) son registradas por separado, las dos con una escala de valoración entre 1-5 Puntaje 1: Cuando se presenta una pequeña área del foliolo con los síntomas de velloso. Puntaje 2: Los síntomas del velloso cubren 1/6(≈15%) de la superficie del foliolo. Puntaje 3: Los síntomas del velloso cubren 1/3(≈30%) de la superficie del foliolo. Puntaje 4: Los síntomas del velloso cubren 2/3(≈60%) de la superficie del foliolo Puntaje 5: Casi la totalidad del foliolo está cubierta con los síntomas de velloso (≥80%) con mus escasa áreas. Figura 1. Escala de evaluación de síntomas de Pernoosporas sparsa en foliolos de rosa: a) foliolos jóvenes y b) foliolos maduros. La temperatura óptima para la germinación de las esporas es 18°C, pero pueden germinar entre rangos de 5-27°C. Importancia del daño Condiciones favorables Mildeo velloso se desarrolla favorablemente en condiciones de humedad y frío. El agua es requerida para que ocurra la infección y una humedad relativa mayor a 85% es requerida para la esporulación. El mildeo vellosos se diseminarse muy rápido y puede diseminarse a todo el cultivo entre 1-3 días bajo condiciones favorables. El mildeo velloso puede ocasionar una agresiva defoliación y la muerte de los tallos. El mildeo velloso puede convertirse en sistémico y causar un retraso en el crecimiento del cultivo. Una intervención inmediata es requerida cuando se detecta la presencia de la enfermedad. Botritis de botón Agente causal (Botrytis cinerea) Método de muestreo Simplemente se registra la presencia de botritis en el botón. Condiciones favorables Botritis es una enfermedad de condiciones de humedad y frío. Los rangos de temperatura óptima van de 15-20°C. Altas condiciones de humedad son requeridas para el crecimiento del hongo. El hongo usualmente requiere una herida para invadir el tejido, por lo cual, los daños de trips pueden venir acompañados por botritis de botón .Altos niveles de humedad en cajas de empaque proporcionan condiciones ideales para el desarrollo de la enfermedad. Importancia del daño El daño más severo a menudo ocurre en el almacenamiento y tránsito de la flor. Las infecciones suelen no ser visibles al tiempo de la cosecha rápidamente si se encuentra las condiciones adecuadas (humedad y frío) durante el periodo de almacenamiento en los cuartos fríos o en durante su transporte al cliente. Mientras que la mancha de botritis de botón es difícil detectar en el invernadero antes de la cosecha, esta se vuelve fácil cuando se mira la pequeña mancha inicial y la decoloración cuando las cabezas de las flores están juntas en un ramo después de la cosecha. Botritis de tallo Agente causal (Botrytis cinerea) Método de muestreo Se registra simplemente la presencia de botritis. Roya Agente causal (Phragmidium spp. ) Método de muestreo Se selecciona un foliolo con roya y se registra el puntaje de infección Este procedimiento se repite en los estratos relevantes del cultivo. Roya Viva (esporulada) y Roya Seca son registradas por separado, ambas con un puntaje dentro de una escala de 1-5 como el de polvoso. Valor 1: Una mancha muy pequeña de roya observada en un foliolo. Valor 2: La infección del roya cubre 1/6 (≈15%) de la superficie del foliolo. Valor 3: La infección de roya cubre 1/3(≈30%) de la superficie del foliolo. Valor 4: La infección de roya cubre 2/3(≈60%) de la superficie del foliolo. Valor 5: Casi la totalidad del foliolo está cubierto con la infección de roya (≥80%) Condiciones favorables La temperatura óptima para el desarrollo de la enfermedad está entre 18-21°C y es esencial una humedad continua de 2 horas para el establecimiento de una infección. Mancha negra Agente causal (Diplocarpun rosae) Método de muestreo Cuando se observa mancha, se la registra únicamente como presencia, en los estratos: alto, bajo y agobio de la planta. Condiciones favorables Las hojas son más susceptibles durante su expansión (6-4 días de edad). Las conidias deben estar mojadas durante la germinación por lo menos por cinco minutos aún la humedad relativa del 100%. La infección de las conidias es óptima entre 19-21 °C y los síntomas pueden desarrollarse dentro de 3-4 días a 22-30 °C. El desarrollo de la enfermedad es óptimo a 24 °C. La infección no se produce si la superficie de la hoja está seca durante 7 horas después de la inoculación a temperaturas entre 15-24°C. Coniothyrium Agente causal (Coniothyrium wernsdorffiae) Método de muestreo Cuando se observa coniothryium, se registra únicamente como presencia, en los estratos: altos, bajo y agobio de la planta. Agrobacterium Agente causal (Agrobacterium tumefaciens) Importancia del daño Método de muestreo Cuando agrobacterium es observada, esta es simplemente registrada como presente después de distinguir si las agallas de agrobacterium están “vivas” (color vede claro, banco, o marrón claro y blando) o ‘seco’ (marrón oscuro y leñoso). El agrobacterium vivo y seco es registrado separadamente dentro del denominado ‘Tallo’, no importa si este ha sido observado en la parte alta, media o baja de la planta. Se cree que agrobacterium reduce la productividad en el cultivo de rosas entre un 10-30% a través de la perdida de energía que va hacia la agalla desarrollando un daño gradual en la planta. Infecciones severas, especialmente en plantas jóvenes, puede causar la muerte de la planta. Una infección severa puede retrasar el desarrollo de la planta hospedera, la batería puede permanecer en el suelo por varios años. 2.3 Registros de monitoreos 2.4 Registros de monitoreos ANÁLISIS DE LA INFORMACIÓN Se deben totalizar el número de sitios afectados por blancos biológico y sacar el porcentaje de incidencia por plaga y/o enfermedad, usando la fórmula. Número de sitios Afectados % Incidencia = --------------------------------------------------- X 100 Número total de sitios Monitoreados Número de cuadrados afectados ------------------------------------------------- X 100 Número total de cuadrados monitoreados SITIOS A MONITOREAR: En todos las camas se monitorearan el sitio 1 y 3 y se encontró que en 3 sitios hubo presencia de Pulgón ¿Calcular el % incidencia? MONITOREO EN CAMPO Gráficos y Tabla de ubicación de bloques de monitoreo n n n n n n • Superficie: 1000 m • N° de camas: 20 • Longitud camas: 15 m n n n • N° sitios monitoreos: 60 n n n n n n n n n n n n n n n n n n n n n n n n n n n SITIOS A MONITOREAR: En todos las camas se monitorearan el cuadro 1 y 8 y se encontró que en 5 sitios hubo infección de Belloso ¿Calcular el % incidencia? Recorrido monitor Semana par 9 || 8 || 7 || 6 || 5 || 4 || 3 || 2 || 1 1 || || || || || || || || || || || || || || || || || || || || || || || || 4 5 6 7 8 9 || 2 3 4 5 6 7 || 3 || 1 || 2 8 || || || || || || || || || || || || || || || || || || || || || || || || || || || || || || || || || || || ||