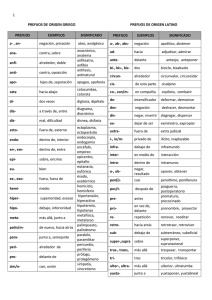
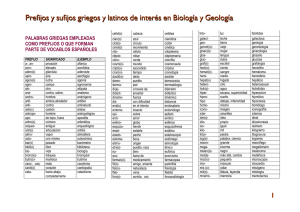
EXAMEN FORMULACIÓN FYQ Propiedades de los metales Se pueden cortar, se pueden moldear, son conductores de la corriente eléctrica y del calor. Son sólidos a temperatura ambiente excepto el mercurio. Son opacos y poseen de un brillo característico. Propiedades de los no metales No poseen brillo metálico, no son conductores del calor y la electricidad. A temperatura ambiente son sólidos, líquidos o gases. Suelen tener puntos de fusión bajos. Estos elementos en la naturaleza suelen estar unidos entre sí a través del enlace químico. Enlace químico: Es la unión entre átomos iguales o diferentes para adquirir y formar compuestos (moléculas) con mínima energía y máxima estabilidad. Hay tres tipos. Enlace covalente: unión de átomos no metálicos iguales o difundidos -covalente molecular: C02 (g) F2 (g) -covalente de red atómica: diamante, cuarzo Enlace iónico: unión de un metal (catión) con un no metal -forma redes iónicos NaCl, MgS Enlace metálico -forma redes metálicos Cu (s) Fe (s) Prefijos 1. mono 2. di 3. tri 4. tetra 5. penta 6. sexa FORMULACION DE COMPUESTOS BINARIOS (FORMADOS POR 2 ELEMENT.) ÓXIDOS Son los compuestos formados por un elemento con estado de oxidación positivo. Se pone un elemento que puede ser metal o no metal y el oxígeno (en estado de oxidación -2) -Pasos para formular: 1. Se escribe primero el símbolo del elemento con estado de oxidación positivo, seguido del oxígeno con estado de oxidación negativo, -2. (Al principio los estados de oxi están arriba) Ejemplo: Fe3 O-2 2. Se intercambian los estados de oxidación y se ponen como subíndice sin signo (se ponen abajo) Ejemplo: Fe3 O-2: Fe2 3. Se reduce si es necesario. -Nomenclatura para nombrar óxidos Nomenclatura de prefijos Se nombra 1º el oxígeno con la palabra “oxido” poniendo delante de esta los prefijos (mono, di…), que indican el número de átomos de oxigeno que hay. Luego se pone la preposición “de” y a continuación se nombra el elemento en positivo (el que sobra) poniendo delante los prefijos, que indican el número de átomos del elemento. Ejemplo: Fe2 O3 trióxido de dihierro Nomenclatura en nº romanos Se nombra 1º el oxígeno con la palabra “oxido” (sin prefijos), después se pone la preposición “de” y a continuación se nombra el elemento con estado de oxidación positivo y entre paréntesis se pone Ejemplo: Fe2 O3 óxido de hierro (III) HIDROGENO -Combinación de Hidrogeno con metales Nomenclatura de prefijos Se nombra primero el último elemento de la formula, el hidrogeno con la palabra “hidruro”, poniendo antes los prefijos, que indican el número de átomos de hidrogeno que hay. Luego se pone la preposición “de” y a continuación el nombre del elemento en positivo, que es un metal en la combinación del hidrogeno con metales. Nomenclatura en nº romanos Se nombra primero el elemento negativo, el último de la formula con la palabra “hidruro” seguido de la preposición “de” y a continuación se pone el nombre del metal y entre paréntesis el estado de oxidación del metal en nº romanos. (Se pone el estado de oxi en números romanos cuando tiene varios estados de oxidación) -Combinación de Hidrogeno con no metales Nomenclatura de prefijos Se nombra primero el elemento no metálico acabado con la terminación “-uro” seguido de la preposición “de” y a continuación la palabra hidrogeno precedida con los prefijos. Nomenclatura en disolución acuosa Se nombra primero el hidrogeno con la palabrea acido seguido del nombre del elemento no metálico acabado con la terminación “hídrico” Ejemplo: H S-2: sulfuro de di hidrogeno y ácido sulfhídrico SALES BINARIAS Formado por un metal y un no metal (enlace iónico) diferentes al oxígeno y al hidrogeno (no hay) Nomenclatura de prefijos Se nombra primero el último elemento de la formula con la terminación “uro” y delante los prefijos. Luego se pone la preposición “de”. Después de la preposición se nombra el primer elemento, el metal, con el prefijo correspondiente.