Espina bífida: una revisión de la genética, fisiopatología y Terapias celulares emergentes
Anuncio

Machine Translated by Google Diario de De desarrollo Biología Revisar Espina bífida: una revisión de la genética, fisiopatología y Terapias celulares emergentes Abd-Elrahman Said Hassan 1,2,*, Yimeng Lina Du 2 , Su Yeon Lee 1,2, Aijun Wang 1,2 y Diana Lee Farmer 1,2* 1 División de Cirugía Pediátrica General, Torácica y Fetal, Centro Médico de la Universidad de California, Sacramento, CA 95817, EE. UU.; [email protected] (SYL); [email protected] (AW) 2 Centro de Bioingeniería Quirúrgica, Departamento de Cirugía, Universidad de California Davis, Sacramento, CA 95817, EE. UU.; [email protected] * Correspondencia: [email protected] (A.-ESH); [email protected] (DLF) Resumen: La espina bífida es el defecto congénito más común del sistema nervioso central que puede presagiar una discapacidad de por vida para los afectados. Si bien los fundamentos completos de esta enfermedad aún no se comprenden por completo, ha habido grandes avances en los fundamentos genéticos y moleculares de esta enfermedad. Además, el tratamiento de la espina bífida ha tenido grandes avances, desde el cierre quirúrgico del defecto después del nacimiento hasta la reparación intrauterina de última generación. Esta revisión abordará la genética, la embriología y la fisiopatología y concluirá con una discusión sobre la terapia actual, así como el primer ensayo clínico aprobado por la FDA que utiliza células madre como tratamiento para la espina bífida. Palabras clave: cirugía pediátrica; cirugía fetal; Células madre Cita: Hassan, A.-ES; Du, YL; Lee, SY; Wang, A.; Agricultor, DL Espina bífida: una revisión de la 1. Introducción La espina bífida (SB) es el defecto congénito más común del sistema nervioso central. Si bien se puede sobrevivir, el defecto presagia una discapacidad de por vida para todos los afectados. El genética, la fisiopatología y las mielomeningocele (MMC) es la forma más grave de SB y se caracteriza por una médula espinal extruida contenida terapias celulares emergentes. J. Dev. dentro de un saco de líquido cefalorraquídeo. Los defectos del tubo neural cerrado (NTD), un defecto mucho Biol. 2022, 10, 22. https://doi.org/10.3390/ jdb10020022 Editores académicos: Julia Thom Oxford y Makenna Hardy Recibido: 16 diciembre 2021 Aceptado: 23 de mayo de 2022 Publicado: 6 junio 2022 menos grave, existen y a menudo se asocian con una morbilidad más baja que la propia espina bífida [1]. Estudios recientes han demostrado una tasa de incidencia de aproximadamente 3,63 por 10 000 nacidos vivos en los Estados Unidos y una tasa de incidencia de 18,6 por 10 000 en todo el mundo [2,3]. Además, aunque la tasa de mortalidad se ha reducido a aproximadamente el 8% para los bebés nacidos vivos con SB, todavía es más de 10 veces más alta que el promedio nacional de todos los nacimientos en los EE . UU . [4,5]. Los que sobreviven padecen deterioro motor, disfunción intestinal y vesical, así como secuelas neurológicas. En particular, las malformaciones de Arnold-Chiari II (el desplazamiento hacia abajo del vermis cerebeloso y las amígdalas) están asociadas con la SB y se sabe que tienen efectos sobre las funciones motoras, de los nervios Nota del editor: MDPI se mantiene neutral craneales y cognitivas, todo lo cual afecta la calidad de vida de los pacientes con SB. y sus familias. con respecto a reclamos jurisdiccionales en mapas publicados y afiliación institucional aciones. Copyright: © 2022 por los autores. Licenciatario MDPI, Basilea, Suiza. Este artículo es un artículo de acceso abierto distribuido bajo los términos y Nuestra comprensión de los defectos del tubo neural ha mejorado drásticamente en las últimas décadas, pero quedan preguntas sobre el mecanismo de formación, las medidas preventivas y los tratamientos curativos. Se ha implicado una intrincada relación entre factores ambientales, genéticos y maternos en la etiología y patogenia de esta malformación congénita [6,7]. Actualmente, se cree que el componente genético contribuye a aproximadamente el 60-70 % del riesgo de defectos del tubo neural y, como tal, la identificación de loci genéticos adicionales en humanos es un área de estudio en curso [8]. Esto se ve subrayado por los aproximadamente 250 genes identificados en el modelo murino de defectos del tubo neural solos, que van desde variaciones espontáneas, inducidas químicamente y eliminatorias [6]. condiciones de Creative Commons Licencia de atribución (CC BY) (https:// En esta revisión, analizaremos la genética y la embriología involucradas en la BS y los NTD, exploraremos creativecommons.org/licenses/by/ el metabolismo del folato, abordaremos brevemente la fisiopatología y las opciones de reparación quirúrgica, y 4.0/). revisaremos el trabajo anterior y actual en terapias basadas en células madre. J. Dev. Biol. 2022, 10, 22. https://doi.org/10.3390/jdb10020022 https://www.mdpi.com/journal/jdb Machine Translated by Google 2 de 17 J. Dev. Biol. 2022, 10, 22 2. Embriología El tubo neural es una estructura transitoria que se forma durante el desarrollo de un embrión; es el precursor del sistema nervioso central, que está compuesto por el cerebro y la médula espinal. En los embriones humanos, todo este proceso ocurre entre los días 17 y 28 después de la fecundación [7]. Las actividades requeridas para formar un tubo neural normal incluyen la apoptosis, la migración de la cresta neural, la proliferación neuroepitelial, la contracción de los microfilamentos del citoesqueleto apical y la flexión en los puntos de flexión dorsolateral [8]. Cualquier aberración durante la embriogénesis puede resultar en una falla del tubo neural y un defecto del tubo neural resultante. El cierre del tubo neural se puede resumir sucintamente mediante el plegamiento, la elevación, el cierre y la fusión secuenciales del tubo neural a lo largo de la línea media dorsal, lo que permite la separación funcional del tejido no neuronal del propio tubo neural. Todo este proceso y secuencia de eventos se denomina neurulación, que se puede subdividir en neurulación primaria y secunda Durante la neurulación primaria, se forman el cerebro y la médula espinal, específicamente los segmentos que se extienden desde el bulbo raquídeo hasta el ensanchamiento lumbar medio. La neurulación primaria es responsable de la formación, plegamiento y fusión de la placa neural a lo largo de la línea me En embriones de ratón, el acto de neurulación primaria se inicia en el límite entre la columna cervical y el futuro cerebro posterior. El cierre se extiende bidireccionalmente desde este punto. Un segundo sitio de origen del cierre surge en el límite del prosencéfalo y el mesencéfalo; este cierre también se propaga bidireccionalmente. Un tercer evento de cierre también se origina en el extremo rostral del prosencéfalo. El cierre entre estos tres sitios de iniciación conduce a la finalización de la neurulación craneal y espinal, lo que proporciona un neuroporo anterior, posterior y posterior cerrado [9]. Se sugiere que estos eventos, como se observan en ratones, son similares en embriones humanos con algunas diferencias clave [10,11]. En particular, la existencia de un segundo evento de cierre (Cierre 2) sigue siendo incierta y la formación de cerebro puede ocurrir como una progresión directa de la neurulación desde los sitios de inicio del Cierre 1 al Cierre 3 [12]. Esto puede deberse a las diferencias en la posición del Cierre 2 en las poblaciones humanas, como se ve entre las cepas de ratones, o que los primates han evolucionado para no requerir un sitio de inicio del Cierre 2 dado un cerebro más pequeño en la etapa correspondiente en comparación con los ratones [12, 13]. Las aberraciones en el cierre del tubo neural durante la neurulación primaria pueden provocar una gran cantidad de defectos del tubo neural, incluido el SB. La naturaleza discontinua de la neurulación conduce a defectos específicos, dependiendo de dónde ocurran las fallas y de qué parte del tubo neural quede sin fusionar. Como se señaló, la suma de los tres sitios de cierre da como resultado una neurulación craneal y espinal completa y, por lo tanto, un neuroporo anterior, posterior y rombencéfalo cerrado. Las fallas en el sitio de cierre inicial conducen a defectos a lo largo del mesencéfalo hasta la parte inferior de la columna, creando una condición conocida como craneorraquisquisis (ausencia del cerebro y la bóveda craneal con un defecto óseo contiguo de la columna). La anencefalia (ausencia de porciones importantes del encéfalo, el cráneo y el cuero cabelludo) se debe a fallas o anomalías en el proceso de neurulación craneal. La espina bífida es el resultado de una neurulación caudal incompleta [1]. La neurulación secundaria es responsable de la porción inferior de la médula espinal, que incluye la médula lumbar distal, el cono medular y el filum terminale. Este proceso se compone de canalización y diferenciación regresiva. La canalización es el proceso por el cual el tubo neural se alarga caudalmente hacia el neuroporo posterior. A medida que se fusionan la notocorda y el epitelio neural, se forma una masa celular caudal. Dentro de esta masa celular, múltiples microquistes se fusionan y forman una estructura tubular revestida de epéndimo, que luego se fusiona con el tubo neural desde arriba, creando un tubo neural primario continuo [7,14]. En humanos, el desarrollo y cierre del tubo neural se completa 28 días después de la concepción. Después del día 38, hay necrosis celular controlada a lo largo del tubo neural caudal, lo que da como resultado la formación de cordón lumbar distal, cono medular y filum terminale. Este proceso de diferenciación regresiva es responsable de eliminar gran parte de la masa celular caudal; a diferencia de los humanos, en los ratones, la yema de la cola se desarrolla para la eventual formación de una cola [14]. Los trastornos de la neurulación secundaria también pueden dar lugar a otras lesiones congénitas, como agenesia caudal, quistes presacros, anomalías del intestino posterior, lipomas caudales y una miríada de anomalías anorrectales y genitourinarias [15,16]. Una lesión nombrada más recientemente, la médula medular retenida (RMC), descrita como una estructura alargada similar a la médula espinal que continúa Machine Translated by Google 3 de 17 J. Dev. Biol. 2022, 10, 22 al fondo de saco, se ha atribuido a una detención total o parcial de la neurulación secundaria [15,17]. Aparece como un cono bajo, pero con un componente que no funciona. Si bien originalmente se pensó que eran raros, se encuentran con mayor frecuencia en el entorno clínico y pueden estar asociados con las lesiones congénitas mencionadas anteriormente. Los pacientes con trastornos de la neurulación secundaria suelen presentar incontinencia, infecciones frecuentes del tracto urinario, vejiga neurógena y anomalías urodinámicas, así como déficits neurológicos [16]. Existen dos mecanismos propuestos para las ETD. Primero, el tubo neural no se cierra debido a anormalidades en el comportamiento celular (proliferación ineficiente, muerte celular desorganizada y movimiento celular colectivo deficiente). En segundo lugar, el tubo neural cerrado se vuelve a abrir, posiblemente debido a una ruptura en las uniones de adhesión célula-célula críticas [18,19]. 3. Genética A pesar de que la historia familiar es un factor de riesgo para el desarrollo de SB, los patrones de recurrencia no se atribuyen a un solo locus genético. En cambio, SB es un rasgo complejo causado por una combinación de variantes en múltiples loci e involucra múltiples genes [20]. 3.1. Defectos del tubo neural en modelos animales Se han identificado más de 240 mutantes y cepas de defectos del tubo neural en ratones [6]. De los NTD de ratones , se han identificado algunos procesos celulares, incluida la vía de polaridad celular plana (PCP) , la apoptosis celular, la transcripción de ADN y la vía canónica Wnt/beta-catenina. La polarización apical-basal de las células es crítica para la morfogénesis y función de los tejidos maduros. VANGL1 y VANGL2 son homólogos de mamíferos de un gen de Drosophila necesario para que la PCP desarrolle los tejidos de los ojos, las alas y las patas [21,22]. Los genes VANGL1 y VANGl2 se expresan en las porciones dorsales del tubo neural y son esenciales para la morfogénesis de los vertebrados [23]. Canción et al. demostraron que la PCP es crucial para vincular la información del patrón anteroposterior con la asimetría izquierda-derecha de la notocorda antes del flujo nodal hacia la izquierda a través de la notocorda posterior [23]. Por lo tanto, las células de la notocorda que carecen de la expresión de VANGL1 y VANG2 tienen una distribución de cilios aleatoria, lo que conduce a un flujo nodal turbulento y una simetría interrumpida [24]. Torbán et al. también demostraron que solo los ratones heterocigotos para las mutaciones VANGL1 y VANGL2 mostraban profundos defectos de desarrollo, incluida la craneorraquisquisis grave [25]. El establecimiento de PCP implica la vía Wnt/Frizzled-PCP. En el modelo de drosófila , las proteínas incluyen cadherina Flamingo, proteína transmembrana Frizzled (Fz) y proteínas citoplasmáticas Disheveled (Dsh), Diego (Dgo) y Prickle (Pk). Las mutaciones en estas proteínas conducen a la pérdida de polaridad y al reordenamiento del citoesqueleto [26]. Además, se ha demostrado que los homólogos de ratón de Flamingo (CELSR), Disheveled (DVL), Frizzled (FZD) y Prickle (Pk) contribuyen a la etiología de los defectos del tubo neural [27]. Los efectores específicos de tejido PCP no centrales también juegan un papel importante en el desarrollo de NTD. El gen Fuzzy planar cell polarity (FUZ), un efector específico de tejido, está involucrado en el movimiento direccional de las células y es esencial para la formación del tubo neural en ratones y humanos [24]. Un estudio demostró que los ratones Fuzzy knockout presentaban defectos del tubo neural y propuso que las mutaciones en el gen FUZ pueden explicar los defectos del tubo neural humanos. Humphries et al.; el grupo introdujo la mutación de mamíferos en Drosophila y reveló diferentes comportamientos fenotípicos y funcionales defectuosos, lo que sugiere una relación causal entre la PCP y los defectos del tubo neural [28]. Otras mutaciones que conducen a SB en ratones involucran la transcripción de ADN y la apoptosis. Específicamente, se sugiere que el factor de transcripción Foxc2 (MFH-1) media la extensa esqueletogénesis en células derivadas de la cresta neural y el mesodermo [29]. El gen Traf4 está implicado en la apoptosis. Las mutaciones en este gen conducen a la incapacidad de las proteínas de ensamblaje del nucleosoma para unirse a la cromatina en condensación en la apoptosis y la desregulación de la proliferación de células neuronales [30]. Por último, las mutaciones genéticas en la vía canónica Wnt/beta-catenina se han estudiado en el modelo de ratón SB y se ha demostrado que están implicadas en SB humana. Reguladores para hueso Machine Translated by Google 4 de 17 J. Dev. Biol. 2022, 10, 22 La formación durante el crecimiento y la remodelación del esqueleto incluye la proteína 6 relacionada con el receptor de lipoproteínas (LRP6) en la vía canónica Wnt/beta-catenina. Está implicado en el crecimiento del esqueleto axial y las estructuras del tubo neural [31]. Ley et al. han descubierto que varias variantes de un solo nucleótido en LRP6 predisponen a los embriones a defectos del tubo neural [32]. También se sabe que el complejo mediador (MED) tiene efectos reguladores significativos en la señalización de WNT y está asociado con el cierre del tubo neural [33]. Estudios recientes que utilizan la tecnología CRISPR/Cas9 para generar modelos de ratones knock-in proporcionaron una fuerte evidencia entre las variantes funcionales de los genes MED y algunas etiologías de NTD [34]. La señalización canónica de Wnt también está implicada en la regulación de la expresión de PAX3 y como objetivo de PAX3. La mutación del factor de transcripción PAX3 conduce a defectos en el cierre del tubo neural y se puede prevenir con ácido fólico [35]. Estudios recientes muestran que la ganancia de función de la beta catenina y la pérdida de función de PAX3 producen efectos aditivos en los defectos del tubo neural debido a sus interacciones [36]. 3.2. Genética Humana Dependiendo del gen afectado, los patrones de herencia de SB varían en humanos. Los estudios han indicado una herencia autosómica dominante de SB y otros NTD en múltiples loci, incluido el gen VANGL1, el gen VANGL2, el gen FUZ, el gen CELSR1 y el gen TBXT [32,37–39]. A pesar de la identificación de los genes individuales, es importante señalar que cada vez más evidencia reciente apunta hacia un modelo omnigénico de espina bífida, lo que sugiere que la espina bífida humana es causada por una serie de variantes genéticas y su interacción con factores ambientales [40, 41]. Se han identificado varias mutaciones sin sentido heterocigotas del gen VANGL1 y se han asociado con varios defectos del tubo neural en humanos [39]. En una revisión de Marello et al., se sugirió una fuerte asociación entre las variantes raras de VANGL1 y los defectos del tubo neural. Además, Lei et al. y Kibar et al. secuenció el gen VANGL2 en poblaciones con diversas formas de defectos del tubo neural y sugirió que las mutaciones en el gen VANGL2 pueden predisponer a los fetos humanos a los defectos del tubo neural [32,37]. Otros estudios propusieron mutaciones indirectas que afectan la función VANGL2 asociadas con los defectos del tubo neural. La mutación heterocigótica del marco de lectura del gen CELSR1 se encuentra asociada con SB en un estudio de 192 pacientes en California [32]. Su mecanismo se basa en la interacción entre la proteína CELSR1 y el gen VANGL2, ya que la mutación provoca un menor reclutamiento de VANGL2 para el contacto célula a célula. Se han identificado otras mutaciones heterocigóticas sin sentido en el gen FUZ y se han relacionado con defectos del tubo neural en la población italiana; el equipo de investigación encontró cinco mutaciones sin sentido en el gen FUZ que interfieren con la generación de cilios, el movimiento direccional de las células o ambos [42]. Otros genes mutantes que son factores de riesgo para la espina bífida incluyen el gen CCL2. El gen CCL2 controla los niveles de exportación de proteína quimiotáctica 1 (MCP) de monocitos después del tratamiento con interleucina-1-beta in vitro [43]. Los estudios de investigación han demostrado que la hipertermia del primer trimestre se asocia con un aumento del doble de la espina bífida [44]. Por lo tanto, la inflamación y la temperatura corporal elevada, especialmente la señalización de moléculas como las quimiocinas, pueden estar involucradas en la causa de la espina bífida. Jensen et al. encontraron que el polimorfismo del promotor CCL2 A(-2518)G está asociado con la espina bífida y se especula que esto se debe a la respuesta sistémica y local menos intensa de los alelos a la infección [45]. Además, un gen mutante TBXT, específicamente la variante alélica de transmisión TIVS7-2 [38], también se ha relacionado con el meningomielocele. TBXT está codificado por el gen T y es vital para la formación y diferenciación del mesodermo posterior y el desarrollo axial en vertebrados. Aunque estudios posteriores demostraron que el mutante TIVS7-2 está asociado con un mayor riesgo de SB, el mecanismo patogénico sigue sin estar claro [46,47]. Dado que se ha demostrado que la suplementación con folato previene hasta el 70 % de los defectos del tubo neural en humanos, las mutaciones genéticas de las enzimas involucradas en el metabolismo de la homocisteína-folato también se han estudiado ampliamente en humanos [48,49]. Estas enzimas metabólicas incluyen metilentetrahidrofolato reductasa (MTHFR), metionina sintasa (MS), síntesis de cobalamina coenzima y cistationina b-sintasa (CBS). El polimorfismo SNP R653Q en el gen MTHFR1 se ha observado en defectos del tubo neural en poblaciones irlandesas e italianas [50–52]. Otros estudios han demostrado que MTHFR 1298 AC combinado con alternancia de MTHFR 677 CT aumenta la Machine Translated by Google 5 de 17 J. Dev. Biol. 2022, 10, 22 riesgo de espina bífida [53]. Se han observado efectos similares en el polimorfismo de la MS y la 5metiltetrahidrofolato-homocisteína metiltransferasa reductasa (MTRR). Doolin et al. concluyó que las variantes en el polimorfismo MS 2756A-G y el polimorfismo MTRR 66A-G aumentan el riesgo de espina bífida según el genotipo materno [54]. También se ha considerado la interacción entre genes y nutrientes . Christensen et al. encontró que el polimorfismo MTHFR y el estado bajo de folato combinados se asocian con un mayor riesgo de defectos del tubo neural que cualquiera de las variables por sí sola [55]. También se demostró que el polimorfismo 66A-G en el gen MTRR combinado con niveles bajos de B12 en suero en madres y niños aumenta el riesgo de espina bífida [56]. La secuenciación del exoma completo (NGS) de próxima generación permitió la identificación de variantes en nuevos genes candidatos que anteriormente no estaban implicados en SB en humanos. A través de NGS, las variantes de novo con pérdida de función de los genes SHROOM3, PAX3, GRHL3 y MYO1E están vinculadas al desarrollo de defectos del tubo neural; sus mecanismos propuestos incluyen la generación de variantes de truncamiento de proteínas y defectos del factor de transcripción [57–59]. Recientemente, también se descubrió que variantes raras y novedosas de novo en los genes RXRÿ, DTX1 y COL15A1 y variantes recesivas ligadas al cromosoma X ARHGAP36, TKTL1, AMOT, GPR50 y NKRF contribuyen a los defectos del tubo neura Además, con la secuenciación del exoma, más evidencia vincula los genes de la vía PCP con el desarrollo de SB y craneorraquisquisis. Los genes identificados incluyen CELSR1, PRICKLE1, FZD6, SCRIB, PTK7, VANGL1 y los nuevos genes FREM2 y DISP2 [61–65]. Debido a las complejidades genéticas y la naturaleza omnigénica de los defectos del tubo neural, los objetivos genéticos clínicamente significativos variarán de un individuo a otro. Por lo tanto, la secuenciación del genoma es un paso crucial hacia una mejor comprensión de las implicaciones genéticas en las NTD y la medicina de precisión para la BS. 4. Factores no genéticos 4.1. Factores maternos Tanto la diabetes como la obesidad materna se han relacionado con un mayor riesgo de defectos del tubo neural [66,67]. Se cree que los efectos teratogénicos de la hiperglucemia y la hiperinsulinemia contribuyen al aumento de la muerte celular en el neuroepitelio de la placa neural [68]. Hay un aumento de 2 a 10 y de 1,5 a 3,5 veces en el riesgo de madres con diabetes y obesidad, respectivamente; el riesgo parece aumentar a medida que aumenta el índice de masa corporal de la madre [1]. Además, este riesgo no solo surge en los hijos de diabetes tipo 2 (insulinorresistentes), sino que también está presente para los hijos de madres con diabetes tipo 1 (insulinodependientes); el asesoramiento y la atención prenatales son cruciales en esta población [69,70]. Además, el estado nutricional materno inadecuado se ha asociado con un mayor riesgo de defectos del tubo neural; las deficiencias de folato, zinc y B12 han sido todos factores de riesgo implicados; sin embargo, la deficiencia de folato tiene el mayor apoyo [71–74]. El consumo de alcohol y cafeína también fueron factores de riesgo potenciales [75,76]. Como se señaló anteriormente, se ha planteado la hipótesis de que la hipertermia materna , ya sea por fiebre o por factores ambientales, tiene un efecto teratogénico sobre el embrión en desarrollo [44]. Una revisión sistemática y metanálisis de Moretti et al. encontraron un cociente de probabilidades significativamente mayor de 1,92 (IC del 95 % = 1,61–2,29) para los defectos del tubo neural en embarazos afectados por hipertermia materna [77]. Si bien la fuente de calor varió desde fiebre materna hasta saunas o incluso ejercicio, el riesgo elevado se mantuvo consta 4.2. medicamentos El fármaco más conocido responsable de los defectos del tubo neural es el valproato (ácido valproico), un fármaco antiepiléptico (FAE). Esto fue informado por primera vez por Robert et al., quienes notaron una asociación con mujeres que estaban siendo tratadas por su trastorno convulsivo con valproato y la aparición de espina bífida en esos embarazos [78]. Se cree que el mecanismo es secundario a la acción del valproato como inhibidor de la histona desacetilasa, que interrumpe el equilibrio de acetilación y desacetilación de proteínas, lo que lleva a la falla de la neurulación. Se cree que el mecanismo de esto se debe a una interrupción en la vía de señalización de Wnt [79]. Estudios adicionales han investigado otros AED (carbamazepina, fenitoína y lamotrigina) y han encontrado que el valproato sigue teniendo el perfil de riesgo más grave para el desarrollo de Machine Translated by Google 6 de 17 J. Dev. Biol. 2022, 10, 22 feto; el riesgo parece depender de la dosis, con la recomendación de evitar el valproato, si es posible, o de lo contrario limitar su dosis [80-83]. 5. Metabolismo del folato Los folatos son compuestos de ácido fólico que se refieren a una clase de vitaminas esenciales solubles en agua, que se encuentran principalmente en frutas y verduras de hoja verde [84]. El ácido fólico es un compuesto sintético, utilizado principalmente en productos farmacéuticos y suplementos dietéticos, debido a su estabilidad química. El término general "folato" se refiere a todos estos compuestos, ya sean naturales o sintéticos. El ácido fólico (pteroilglutamato) es la forma de folato más oxidada y debe someterse a una reducción para ser biológicamente activo. Este proceso ocurre en dos pasos a través de la misma enzima (dihidrofolato reductasa), primero a dihidrofolato, luego a su forma activa, tetrahidrofolato. Todas las células proliferativas utilizan folato de esta manera [84]. La adición de una sola unidad de carbono y los pasos de reducción producen 5-metiltetrahidrofolato (5-MTHF), que es la forma predominante que se encuentra en el plasma [8]. El mecanismo exacto de cómo la suplementación con folato rescata los defectos del tubo neural no está claro, pero una hipótesis se centra en su capacidad para recuperar una alteración en el crecimiento celular en el neuroepitelio de la placa neural y el pliegue neural [82]. Dada la rapidez con la que crece el neuroepitelio, hay una alta tasa de síntesis de ácido nucleico que debe cumplirse para facilitar este crecimiento. La forma activa de folato, 5-MTHF, es un componente fundamental en la síntesis de ácidos nucleicos y se genera mediante la conversión de tetrahidrofolato en 5-MTHF a través del sistema de escisión de glicina (GCS) [83]. El GCS es una serie de enzimas que forman parte de las vías catabólicas de glicina y serina más destacadas y de la generación de 5 -MTHF, uno de los pocos donantes de C1 en la biosíntesis de vertebrados; también se expresa en gran medida en el neuroepitelio [83,85]. Una de las funciones principales del folato en el metabolismo es transportar grupos de un solo carbono [86]. Estos intercambios de grupos de carbono se utilizan para la modificación o biosíntesis de una variedad de moléculas y procesos biosintéticos, incluida la síntesis de ADN y la modificación de ADN y ARN; el folato actúa como donante o aceptor de unidades de un carbono y funciona como una coenzima involucrada en estos procesos [84]. Estas reacciones se clasifican como metabolismo de un carbono mediado por folato, reacciones clave que ocurren a través de vías interconectadas entre el citosol, el núcleo y las mitocondrias [86]. En los mamíferos, el folato es absorbido del plasma (como 5-MTHF) por los receptores de folato hacia el citosol a través de la endocitosis. Una vez en la célula, se añaden más residuos de glutamato adicionales (poliglutamación), lo que evita que esta forma de folato abandone la célula [8]. FOLR1, un gen responsable de codificar una proteína implicada en el transporte de folato a las células neuroepiteliales y de la cresta neural, se ha estudiado en el modelo murino; la proteína en sí se expresa principalmente en las células epiteliales del plexo coroideo, riñón, ovarios y placenta. Se observaron defectos en el cráneo, el tubo neural y el tejido cardíaco en el contexto de la inactivación funcional de FOLR1 [87,88]. Sin embargo, estos defectos se salvaron cuando los embriones heterocigotos se complementaron con folato, siempre que la disminución de la capacidad para absorber 5-MTHF pudiera suplantarse proporcionando folato adicional [89]. Además, se cree que la suplementación con folato previene los defectos del tubo neural mediante la modulación de procesos epigenéticos, como la metilación del ADN [90,91]. El papel de la metilación es particularmente importante dada la extensa metilación de la cromatina que ocurre durante la embriogénesis temprana [92]. Además, en el modelo murino, el trabajo anterior ha demostrado un aumento de las tasas de defectos del tubo neural con la interrupción de la metilación [93–95]. Las interrupciones en el ciclo de metilación pueden conducir a niveles alterados de Sadenosilmetionina y S-adenosilhomocisteína. En el ciclo de metilación, la S-adenosilmetionina es el donante clave del grupo metilo; La S-adenosilhomocisteína se genera por la pérdida de un grupo metilo de la S-adenosilmetionina [96,97]. Los niveles elevados de S-adenosilhomocisteína son un fuerte inhibidor de las metiltransferasas y se eliminan mediante la conversión a homocisteína [8]. Si la proporción de S-adenosilmetionina y S adenosilhomocisteína se empuja hacia S-adenosilmetionina, entonces la célula ya no está preparada para la metilación continua [8]. Linden et al. demostraron el ensanchamiento del neuroporo anterior en embriones de pollo cuando se trataron con inhibidores de la metilación [98]. Toriyama y sus colegas demostraron que la interrupción de la metilación también comprome Machine Translated by Google 7 de 17 J. Dev. Biol. 2022, 10, 22 cierre del tubo neural y puede estar relacionado con la disfunción en la ciliogénesis, un proceso citoesquelético clave implicado en el cierre del tubo neural [99]. Los efectos de la interferencia de la metilación en la neurulación y vías adicionales todavía están bajo investigación. Como se señaló, las transferencias de fracciones de 1 carbono dan como resultado subproductos metabólicos que deben eliminarse, como la homocisteína. Steegers-Theunissen et al. demostraron que un grupo de mujeres con embarazos anteriores afectados por defectos del tubo neural tenían concentraciones plasmáticas elevadas de homocisteína, a pesar de los niveles normales de folato, lo que quizás indica que los niveles de homocisteína son un marcador del metabolismo disfuncional del folato [100]. Una mutación específica, C677 T, en el gen de la metilentetrahidrofolato reductasa es una causa conocida de las concentraciones plasmáticas elevadas de homocisteína; se ha observado que este polimorfismo es más frecuente en madres de hijos con defectos del tubo neural que en los controles [101]. Sin embargo, no se ha demostrado que la incidencia de defectos del tubo neural sea elevada en ciertos modelos murinos de hiperhomocisteinemia [102,103]. Para aclarar aún más el papel de la homocisteína, Yang et al. realizó una revisión sistemática y un metanálisis ; notaron un nivel ligeramente más alto de homocisteína en el plasma materno en madres con hijos afectados por defectos del tubo neural. Sin embargo, notaron que la heterogeneidad del tiempo de muestreo de sangre, así como la presencia o ausencia de suplementos de folato, eran factores de confusión que debían tenerse en cuenta [104]. La verdadera contribución relativa del metabolismo de la homocisteína a la aparición de NTD permanece y se justifica un mayor estudio. Hoy en día, la disminución de la incidencia de defectos del tubo neural se debe en gran parte a la prevención de la deficiencia de folato , un factor de riesgo que estuvo implicado ya en la década de 1960, pero que no se apreció por completo hasta finales de la década de 1980 y principios de la de 1990 [105]. Numerosos estudios demostraron una relación entre niveles más bajos de folato materno y una menor incidencia de defectos del tubo neural; Ensayos clínicos aleatorizados adicionales ayudaron a establecer la recomendación de 4 mg/día para madres de alto riesgo, definidas como mujeres con un embarazo anterior complicado por un defecto del tubo neural [106–111]. Los métodos disponibles para aumentar el consumo de folato fueron a través de alteraciones en los hábitos dietéticos, el uso de suplementos y la fortificación de los alimentos. En 1996, la Administración de Alimentos y Medicamentos (FDA) autorizó el enriquecimiento con folato y, en 1998, lo exigió [112]. A partir de 2021, más de 78 países han exigido la fortificación con ácido fólico en su harina [113]. A pesar de la creciente evidencia de una menor incidencia de defectos del tubo neural con suplementos de folato, todavía hay muchos países que renuncian a la fortificación y continúan teniendo un número significativo de partos complicados por defectos del tubo neural [113]. Si bien se ha demostrado que la deficiencia de folato es una causa de los defectos del tubo neural, existen modelos de ratones, así como poblaciones humanas, que desarrollan defectos del tubo neural a pesar de la suplementación con folato, lo que nuevamente subraya la compleja relación genética y ambiental involucrada en este proceso [114]. 6. Fisiopatología Como se señaló anteriormente, la lesión primaria en SB se debe al trastorno en la neurulación primaria. Con este proceso interrumpido, la médula espinal, que normalmente estaría protegida, ahora está expuesta al entorno fetal. En una serie de experimentos con fetos de ratas y cerdos, Heffez et al. describió la hipótesis de la lesión de "dos golpes" para la destrucción y el daño de la médula espinal como la teoría predominante sobre cómo la médula expuesta finalmente sucumbe a la discapacidad neurológica [115,116]. Inicialmente, el neuroepitelio expuesto se diferenciará y se desarrollará correctamente, pero los "segundos golpes" de la exposición al líquido amniótico y el trauma mecánico del cordón expuesto en el útero finalmente conducen a la muerte y pérdida de células neuronales. El trabajo de Stiefel et al. en modelos de ratones mutantes ha respaldado esta hipótesis, además de las observaciones clínicas de pérdida neonatal rápida de la función motora, a pesar de la presencia de movimiento de apariencia normal en el útero [117-119]. Este modelo para la etiología de los defectos funcionales neurológicos observados en los defectos del tubo neural provocó intentos de cierre de la lesión durante el desarrollo fetal con la esperanza de mejorar los efectos del trauma mecánico y amniótico. Además, los estudios en un modelo de cordero fetal que sugirieron que la hernia del cerebro posterior asociada con la malformación de Chiari podría revertirse mediante el cierre del defecto abierto de la médula espinal respaldaron aún más la idea de que los defectos funcionales podrían recuperarse mediante reparación en el útero [120]. Machine Translated by Google 8 de 17 J. Dev. Biol. 2022, 10, 22 7. Gestión No existe un tratamiento médico o quirúrgico único que pueda mejorar o recuperar por completo la constelación de síntomas y déficits que se desarrollan asociados con SB y MMC. Sin embargo, muchas intervenciones pueden mejorar la calidad de vida de estos pacientes. El tratamiento inicial implica la estabilización/reanimación básica (es decir, mantener caliente al lactante, proporcionar oxígeno y limpiar las fosas nasales si es necesario), con cuidado para evitar un mayor daño de la médula espinal expuesta (si no se cerró antes del parto) [121,122]. La atención al posible compromiso de los nervios craneales y la protección de las vías respiratorias es primordial. La causa más común de muerte neonatal es el compromiso de las vías respiratorias debido a la incapacidad para tragar en aquellos con malformaciones de Chiari II graves. 7.1. Chiari II e hidrocefalia El MMC generalmente se asocia con una malformación de Chiari II, que es cuando una parte del cerebelo y el tronco encefálico se empujan hacia el foramen magnum [114]. La malformación resulta del defecto MMC abierto que crea un efecto similar a una tracción del tronco encefálico desde el defecto abierto debajo. Esto da como resultado una médula, un tronco encefálico y un cuarto ventrículo alargados. La circulación alterada del líquido cefalorraquídeo (LCR) aumenta la presión dentro de los ventrículos y conduce a una hidrocefalia secundaria (acumulación de líquidos dentro de los ventrículos del cerebro). Sin embargo, la hidrocefalia puede ocurrir con SB no asociada con MMC o malformación de Chiari II. Debido a la interrupción de la circulación del LCR, la mayoría de los pacientes requerirán una derivación ventrículo peritoneal (procedimiento para eliminar el exceso de líquido cefalorraquídeo de los ventrículos del cerebro mediante la derivación de líquido hacia el abdomen) para aliviar el aumento de la presión. La necesidad de derivación parece vagamente relacionada con el nivel de la lesión, siendo más probable que las lesiones cefálicas necesiten intervención [123]. La infección y el mal funcionamiento de la derivación requieren muchas revisiones y reemplazos operativos de la derivación, y el mal funcionamiento de la derivación no tratado o no reconocido puede provocar hidrocefalia grave y lesiones cerebrales asociadas. 7.2. Intestino, vejiga y disfunción sexual Dependiendo de los niveles de la médula espinal afectados, muchos pacientes con SB sufren disfunción intestinal y vesical además de parálisis de las extremidades inferiores. La función urinaria tiene un enfoque múltiple, desde el uso de medicamentos para mejorar la continencia, la cirugía para crear continencia y el cateterismo intermitente simple y limpio para vaciar la vejiga de manera simple y efectiva [124]. El manejo de la vejiga no tratado y mal manejado puede provocar hidronefrosis y, en última instancia, provocar disfunción renal y la necesidad de diálisis y trasplante de riñón. En cuanto a la función intestinal, los recién nacidos, los bebés y los niños requerirán un control intestinal dedicado e intenso que, en su forma más simple, implica laxantes, enemas y supositorios, pero también puede implicar una intervención quirúrgica para proporcionar medios adecuados de vaciamiento intestinal y, ocasionalmente, necesidad de colostomía. Dada la mayor esperanza de vida de las personas que viven con SB, existe una necesidad cada vez mayor de comprender los problemas de salud relacionados con los adultos. En cuanto a la disfunción sexual, existen datos limitados sobre el efecto de SB en la salud y la actividad sexual. Dos revisiones sistemáticas de Streur et al. y Hughes et al. observó una tendencia clara en la disfunción sexual para hombres y mujeres [125,126]. En particular, aunque algunos hombres (56-96%) pueden lograr una erección, es posible que no sea adecuada para la penetración y, cuando existe, la eyaculación a menudo es goteante o retrógrada (como lo demuestra el semen en la orina). Solo entre el 20% y el 67% de los hombres también informan la capacidad de alcanzar el orgasmo . En las mujeres, el deseo sexual parece menos afectado, pero hay una variedad de personas con dispareunia (dolor en el área genital o la pelvis durante las relaciones sexuales), probablemente relacionado con el prolapso de órganos pélvicos [127]. También se reduce la capacidad de alcanzar el orgasmo. Por supuesto, los estudios que intentan caracterizar la salud sexual en la población de pacientes con SB están limitados por sus pequeños tamaños de muestra y la utilización de cuestionarios no validados en esta población; existe la necesidad de entablar un diálogo sobre salud sexual a una edad más temprana para ayudar a normalizar la actividad sexual y la salud sexual [125,126,128]. Machine Translated by Google 9 de 17 J. Dev. Biol. 2022, 10, 22 7.3. Función motora de las extremidades Se sabe que el deterioro de la función motora ocurre en pacientes con espina bífida; sus deficiencias físicas van desde deficiencias motoras y sensoriales hasta dificultades con la postura y la deambulación. El nivel de la función motora está directamente relacionado con el nivel de la lesión espinal, y la capacidad para deambular disminuye con las lesiones más proximales [129,130]. Los déficits motores tienden a progresar con la edad y el peso del niño. La mayoría de los pacientes con lesiones cervicales y torácicas no sobreviven hasta la edad adulta; aquellos con lesiones en L2 y por encima casi siempre dependen de una silla de ruedas [129]. En cuanto a las lesiones en el nivel lumbar inferior (L5) y sacro, estos pacientes suelen tener una mejor fuerza motora y pueden seguir deambulando hasta la edad adulta [131,132]. Además, aproximadamente el 75 % de los que nacen con espina bífida sobreviven hasta la edad adulta. Las deformidades de los pies, como los acropaquias, también se asocian con la espina bífida y los especialistas ortopédicos deben tratarlas pronto. En general, el manejo complejo de pacientes con SB requiere un equipo multidisciplinario que involucre muchas subespecialidades pediátricas (fisiatras expertos en rehabilitación, cirugía general, neurocirugía, urología, ortopedia y gastroenterología) y personal auxiliar crítico, incluidos fisioterapeutas, trabajadores sociales y cuidadores. coordinadores. También se debe enfatizar mucho el papel de la familia en el manejo de todos los aspectos físicos y sociales de esta enfermedad. 7.4. Intervención Fetal Durante el último siglo, el tratamiento inicial de la BS ha sido el cierre quirúrgico dentro de las primeras 48 h del nacimiento [114,133]. El objetivo de la cirugía posnatal es el cierre del defecto abierto para minimizar el riesgo de infección. Desafortunadamente, en este enfoque, gran parte del daño preexistente de la médula espinal, que resulta de lesiones secundarias en el útero, no se puede revertir. Los primeros esfuerzos para reparar estos defectos en el paciente fetal eventualmente llevaron a un ensayo aleatorizado, el Estudio de Manejo del Mielomeningocele (MOMS), para evaluar si la reparación intrauterina del mielomeningocele entre las semanas 19 y 25 de gestación era superior a la reparación posnatal estándar [134– 137]. En diciembre de 2010, la Junta de Monitoreo y Seguridad de Datos detuvo la inscripción después de 183 de los 200 pacientes planificados debido a la eficacia de la cirugía fetal. El ensayo MOMS demostró una reducción significativa en la colocación de derivaciones ventriculoperitoneales al año de edad después de la cirugía fetal (grupo prenatal: 40%; grupo posnatal 82%). Se observó una mejora general de la función neuromotora, demostrada por el hallazgo de una mejora de dos o más niveles de la función motora que condujo a una deambulación independiente en el 42 % del grupo de cirugía fetal, en comparación con el 21 % del grupo de cirugía posnatal. Un seguimiento de 30 meses corroboró los hallazgos originales. Además, en comparación con la reparación posnatal, la reparación prenatal de pacientes con MMC demostró una puntuación mejorada en una combinación de función mental y motora. Los resultados secundarios, incluida la función motora y la probabilidad de caminar por sí mismos, mejoraron [138]. Los resultados a los 6 años de los ensayos MOMS fueron revisados en un análisis secundario por Houtrow et al.; demostraron que los niños con reparación prenatal tenían una mejor calidad de la marcha, podían realizar habilidades de movilidad de mayor nivel y tenían menos probabilidades de tener un nivel de función motora peor que su nivel anatómico [139]. La evaluación continua de los resultados a largo plazo de los pacientes en el ensayo MOMS será crucial para determinar la longevidad de los resultados observados hasta el momento, pero también para estudiar la mejora potencial en la calidad de vida de estos pa Actualmente, existen varias opciones para manejar un embarazo complicado por SB, incluida la interrupción del embarazo, la cesárea seguida de reparación posnatal o la reparación fetal de última generación para pacientes elegibles. Si bien la terapia fetal proporciona una mejora significativa en los efectos de la malformación de Chiari, las mejoras en la función neurológica de la extremidad distal, aunque prometedoras, dejan espacio para la mejora, con el 58% de los niños afectados que aún no pueden caminar de forma independiente. Además, todavía existen muchos centros en el país que carecen de la infraestructura, la capacitación y el personal de apoyo necesarios; por lo tanto, si bien la intervención fetal ofrece esperanza, sigue siendo una intervención altamente especializada con una difusión global limitada. Machine Translated by Google 10 de 17 J. Dev. Biol. 2022, 10, 22 Las indicaciones, contraindicaciones y técnicas para la reparación fetal están más allá del alcance de esta discusión. Sin embargo, es de interés una discusión sobre nuevos tratamientos prometedores, específicamente la inclusión de células madre para la terapia fetal. 7.5. Terapias Celulares In Utero La terapia celular ha generado un interés significativo en las últimas dos décadas como un aumento potencial de la reparación prenatal de MMC. Los experimentos iniciales con células madre comenzaron con células madre embrionarias humanas, células madre de la cresta neural, células madre pluripotentes inducidas, células madre de líquido amniótico humano y, más recientemente, células madre mesenquimales. Gran parte de este trabajo se centró en modelos murinos, ovinos y aviares. Las células madre embrionarias humanas (hESC) fueron introducidas por primera vez por Lee et al. [140]. Utilizaron un modelo de embrión de pollo de MMC e inyectaron hESC en la cavidad amniótica de un NTD abierto en la columna creado quirúrgicamente, tanto inmediatamente como 24 h después de la incisión [141]. Los investigadores encontraron que los defectos del tubo neural inducidos quirúrgicamente se volvieron a cerrar significativamente más en el grupo tratado con células madre en comparación con los grupos de control y vehículo. Propusieron que los posibles mecanismos de las hESC sean las moléculas que promueven la reparación de estructuras o el retorno de la función, incluidos los factores de crecimiento o los transmisores neurales, y el pegamento mecánico y el efecto puente en lugar del reemplazo celular directo. Utilizando el mismo modelo en 2010, el grupo evaluó una línea de células madre neurales (F3) y células madre de médula ósea human Descubrieron que las células madre de la médula ósea mejoran la recuperación de los defectos del tubo neural. Por el contrario, la línea de células madre neurales (F3) carecía de capacidades de reconexión debido a la baja tasa de supervivencia de las células madre. Las células madre neurales prenatales (NSC) para la reparación fetal de SB fueron introducidas por Fauza et al. [143]. Las NSC ejercen un efecto protector con sus factores neurotróficos y neuroprotectores, promoviendo así la supervivencia y la regeneración de los elementos neurales. Usando el modelo de cordero fetal, encontraron que las NSC retienen un estado indiferenciado y producen factores neurotróficos después del parto en la médula espinal fetal. Saadai et al. [144]. Descubrieron que las células madre de la cresta neural derivadas de células madre pluripotentes inducidas por humanos tenían una viabilidad superior al 95 % y demostraron diferenciación neuronal in vitro. Las células madre iPSC de la cresta neural sobrevivieron, se integraron y se diferenciaron en el linaje neuronal en el modelo de cordero fetal de MMC. Las células madre pluripotentes inducidas por humanos, derivadas del líquido amniótico, también se aplicaron a la piel artificial en un modelo de rata de MMC y mostraron diferenciación en queratinocitos al agregar Y-27632 y factor de crecimiento epidérmico (EGF) [145]. Las células estromales mesenquimales (MSC) de una variedad de fuentes se han mostrado prometedoras más recientemente. La terapia de MSC derivada del líquido amniótico se introdujo como una posible terapia prenatal para un modelo de MMC en ratas por Abe et al. [146]. El mecanismo propuesto es la secreción del factor de crecimiento de los hepatocitos que conduce a la cobertura de la médula espinal. En un modelo de conejo, Shieh et al. mostró que una inyección intraamniótica concentrada de MSC o una terapia con células madre transamnióticas (TRASCET) podría ser una opción prometedora para el manejo prenatal de la SB [147]. Sus estudios muestran una cobertura similar a la piel parcial o completa de SB en roedores y conejos en comparación con los grupos de control. Las células madre mesenquimales derivadas de la médula ósea (BM-MSC, por sus siglas en inglés) también han llevado a un mejor cierre de la médula espinal en modelos de ratas con SB, que se cree que están asociadas con la expresión del factor neurotrófico derivado del cerebro (BDNF, por sus siglas en inglés) y el factor de crecimiento neural (NGF, por sus siglas en inglés). [148]. Estudios posteriores de Li et al. mostró un aumento del factor de crecimiento epidérmico (EGF) y del factor de crecimiento de fibroblastos (FGF) en las células trasplantadas [149]. Finalmente, nuestro grupo ha demostrado que el tratamiento in utero con células estromales mesenquimales derivadas de placenta (PMSC) mejoró la función motora y aumentó la preservación de neuronas grandes dentro de la médula espinal en modelos MMC fetales ovinos [150,151]. Más recientemente, un primer ensayo clínico de fase 1/2a aprobado por la FDA en humanos está aplicando PMSC de grado clínico, sembradas en una matriz extracelular aprobada por la FDA, para aumentar la cirugía fetal y la reparación de MMC. La Terapia Celular para la Reparación In Utero del Mielomeningocele Machine Translated by Google 11 de 17 J. Dev. Biol. 2022, 10, 22 (CuRe) Trial es el primer ensayo clínico que utiliza células madre para la reparación fetal de MMC. La capacidad regenerativa del entorno fetal y las EMSP pueden proporcionar el siguiente paso para mejorar los resultados de los niños afectados por esta devastadora enfermedad. 8. Conclusiones El defecto congénito sobreviviente más común del sistema nervioso central, SB, continúa empujándonos a comprender los mecanismos celulares del desarrollo embriológico. Si bien ha habido grandes avances en la comprensión de los pasos de la neurulación, todavía nos falta nuestra capacidad para corregir los déficits que conducen a los defectos del tubo neural. Nuestra esperanza actual es que las terapias novedosas y el manejo médico y quirúrgico optimizado proporcionen mejores resultados y calidad de vida para estos pacientes, hasta que se entiendan tan bien los fundamentos biológicos completos del desarrollo embrionario que la prevención, y no la intervención, sea el tratamiento. de elección. Contribuciones de los autores: Conceptualización, A.-ESH; redacción—preparación del borrador original, A.-ESH y YLD; redacción —revisión y edición, A.-ESH, YLD, SYL, AW y DLF; adquisición de fondos, A.-ESH, AW y DLF Todos los autores han leído y están de acuerdo con la versión publicada del manuscrito. Financiamiento: Este trabajo fue financiado en parte por las subvenciones NIH (5RO1NS100761 y 1RO1NS115860), las subvenciones del Instituto de Medicina Regenerativa de California (CIRM) (CLIN1-11404 y CLIN2-12129), las subvenciones de investigación de los Hospitales Shriners para Niños (85108-NCA-19 y 85135-NCA-21). El proyecto también fue apoyado por el Centro Nacional para el Avance de las Ciencias Traslacionales, Institutos Nacionales de Salud, a través de la subvención número UL1 TR001860 para el autor A.-ESH El contenido es responsabilidad exclusiva de los autores y no representa necesariamente las opiniones oficiales de los NIH . Agradecimientos: Los autores desean agradecer a Nora Lelivelt y Alexandra Iavorovschi por su apoyo con la redacción científica y la edición. Conflictos de interés: Los autores declaran no tener ningún conflicto de interés. Referencias 1. Avagliano, L.; Massa, V.; Jorge, TM; Qureshy, S.; Bulfamante, médico de cabecera; Finnell, RH Descripción general de los defectos del tubo neural: desde Desarrollo a las Características Físicas. Res. de defectos de nacimiento 2019, 111, 1455–1467. [Referencia cruzada] [PubMed] 2. Blencowe, H.; Kancherla, V.; Moorthie, S.; Darlison, MW; Modell, B. Estimaciones de la prevalencia mundial y regional del tubo neural Defectos para 2015: un análisis sistemático. Ana. Academia de Nueva York. ciencia 2018, 1414, 31–46. [Referencia cruzada] [PubMed] 3. Mayo, CT; Isenburg, JL; Canfield, MA; Meyer, RE; Correa, A.; Alverson, CJ; Lupo, PJ; Riehle-Colarusso, T.; Cho, SJ; Aggarwal, D.; et al. Estimaciones nacionales basadas en la población para defectos congénitos importantes, 2010–2014. Res. de defectos de nacimiento 2019, 111, 1420–1435. [Referencia cruzada] 4. Wang, Y.; Liu, G.; Canfield, MA; Mayo, CT; Gilboa, SM; Meyer, RE; Anderka, M.; Copeland, GE; Kucik, JE; Nembhard, WN; et al. Diferencias raciales/étnicas en la supervivencia de los niños estadounidenses con defectos de nacimiento: un estudio basado en la población . J. Pediatría. 2015, 166, 819–826.e2. [Referencia cruzada] 5. Matthews, TJ; MacDorman, MF; Estadísticas de mortalidad infantil de Thoma, ME del período 2013 Datos vinculados de nacimientos/muertes infantiles Colocar. nacional Estado Vital. Rep. 2015, 64, 1–30. [PubMed] 6. Harris, MJ; Juriloff, DM Actualización de la lista de ratones mutantes con defectos de cierre del tubo neural y avances hacia una perspectiva genética completa del cierre del tubo neural. Res. de defectos de nacimiento Parte Clin. mol. Teratol. 2010, 88, 653–669. [Referencia cruzada] [PubMed] 7. Volpe, JJ Formación del tubo neural y desarrollo prosencefálico. en Neurología del Recién Nacido; Saunders: Londres, Reino Unido, 2008; Volumen 889, págs. 5–8. ISBN 9781416039952. 8. Blom, HJ; Shaw, gerente general; den Heijer, M.; Finnell, RH Defectos del tubo neural y folato: caso lejos de cerrarse. Nat. Rev. Neurosci. 2006, 7, 724–731. [Referencia cruzada] 9. Schoenwolf, GC; Smith, JL Mecanismos de neurulación: punto de vista tradicional y avances recientes. Desarrollo 1990, 109, 243–270. [Referencia cruzada] 10. Nakatsu, T.; Uwabe, C.; Shiota, K. El cierre del tubo neural en humanos se inicia en múltiples sitios: evidencia de embriones humanos e implicaciones para la patogenia de los defectos del tubo neural. Anat. Embrión. 2000, 201, 455–466. [Referencia cruzada] [PubMed] 11. O'Rahilly, R.; Müller, F. Los dos sitios de fusión de los pliegues neurales y los dos neuroporos en el embrión humano. Teratología 2002, 65, 162–170. [Referencia cruzada] [PubMed] 12. Copp, AJ Neurulación en la región craneal: normal y anormal. J. Anat. 2005, 207, 623–635. [Referencia cruzada] Machine Translated by Google J. Dev. Biol. 2022, 10, 22 12 de 17 13. Macdonald, KB; Juriloff, DM; Harris, MJ Estudio de desarrollo del cierre del tubo neural en un stock de ratones con una alta incidencia de exencefalia. Teratología 1989, 39, 195– 213. [Referencia cruzada] 14. Detrait, ER; Jorge, TM; Grabadores, HC; Gilbert, JR; Vekemans, M.; Speer, MC Defectos del tubo neural humano: desarrollo Biología, Epidemiología y Genética. neurotoxicol. Teratol. 2005, 27, 515–524. [Referencia cruzada] 15. Kim, KH; Lee, JY; Wang, K.-C. Defectos secundarios de la neurulación-1: Cordón medular retenido. J. Neurocirugía coreana. Soc. 2020, 63, 314–320. [Referencia cruzada] [PubMed] 16. Pang, D.; Chong, S.; Wang, K. Libro de texto de neurocirugía pediátrica. En Defectos Secundarios De La Neurulación-1: Filum Terminale Engrosado, Cordón Medular Retenido; Rocco, CD, Pang, D., Rutka, JT, Eds.; Springer: Cham, Suiza, 2020; págs. 1–18. ISBN 978-3-319-72167-5. 17. Pang, D.; Zovickian, J.; Moes, GS Cordón medular retenido en humanos Detención tardía de neurulación secundaria. Neurocirugía 2011, 68, 1500–1519. [Referencia cruzada] [PubMed] 18. Padmanabhan, R. Etiología, patogenia y prevención de los defectos del tubo neural. congénito anónimo 2006, 46, 55–67. [Referencia cruzada] [PubMed] 19. Yamaguchi, Y.; Shinotsuka, N.; Nonomura, K.; Takemoto, K.; Kuida, K.; Yosida, H.; Miura, M. Live Imaging of Apoptosis in a Novel Transgenic Mouse destaca su papel en el cierre del tubo neural. J. Cell Biol. 2011, 195, 1047–1060. [Referencia cruzada] [PubMed] 20. Mitchell, LE; Adzick, NS; Melchionne, J.; Pasquariello, PS; Sutton, LN; Whitehead, AS espina bífida. Lancet 2004, 364, 1885–1895. [Referencia cruzada] 21. Kibar, Z.; Vogan, KJ; Groulx, N.; Justicia, MJ; Underhill, DA; Gros, P. Ltap, un homólogo de mamífero de Drosophila Strabis mus/Van Gogh, está alterado en la cola de bucle mutante del tubo neural del ratón. Nat. Gineta. 2001, 28, 251–255. [Referencia cruzada] [PubMed] 22. Murdoch, JN; Doudney, K.; Paternotte, C.; Copp, AJ; Stanier, P. Defectos severos del tubo neural en el resultado del ratón de cola de bucle de la mutación de Lpp1, un nuevo gen involucrado en la especificación de la placa del piso. Tararear. mol. Gineta. 2001, 10, 2593–2601. [Referencia cruzada] 23. Canción, H.; Hu, J.; Chen, W.; Elliott, G.; André, P.; Gao, B.; Yang, Y. La polaridad de las células planas rompe la simetría bilateral mediante el control del posicionamiento ciliar. Naturaleza 2010, 466, 378–382. [Referencia cruzada] 24. Gris, RS; Abitua, PB; Wlodarczyk, BJ; Szabo-Rogers, HL; Blanchard, O.; Lee, I.; Weiss, GS; Liu, KJ; Marcotte, EM; Wallingford, JB; et al. El efector de polaridad de células planas Fuz es esencial para el tráfico de membranas específicas, la ciliogénesis y el desarrollo embrionario de ratones. Nat. Biol celular. 2009, 11, 1225–1232. [Referencia cruzada] [PubMed] 25. Torbán, E.; Patenaude, A.-M.; Leclerc, S.; Rakowiecki, S.; Gauthier, S.; Andelfinger, G.; Epstein, DJ; Gros, P. La interacción genética entre miembros de la familia Vangl causa defectos del tubo neural en ratones. proc. nacional Academia ciencia EE . UU. 2008, 105, 3449–3454. [Referencia cruzada] [PubMed] 26. Humphries, AC; Mlodzik, M. De la instrucción al resultado: Señalización Wnt/PCP en el desarrollo y el cáncer. actual Opinión Biol celular. 2018, 51, 110–116. [Referencia cruzada] [PubMed] 27. Juriloff, D.; Harris, M. Una consideración de la evidencia de que los defectos genéticos en la polaridad celular plana contribuyen a la etiología de Defectos del tubo neural humano. Res. de defectos de nacimiento Parte A Clínica. mol. Teratol. 2012, 94, 824–840. [Referencia cruzada] 28. Humphries, AC; Narang, S.; Mlodzik, M. Las mutaciones asociadas con los defectos del tubo neural humano muestran un planar interrumpido Polaridad celular en Drosophila. Elife 2020, 9, e53532. [Referencia cruzada] 29. Iida, K.; Koseki, H.; Kakinuma, H.; Kato, N.; Mizutani-Koseki, Y.; Ohuchi, H.; Yoshioka, H.; Noji, S.; Kawamura, K.; Kataoka, Y.; et al. Funciones esenciales del factor de transcripción de hélice alada MFH-1 en el patrón y la esqueletogénesis del arco aórtico. Desarrollo 1997, 124, 4627–4638. [Referencia cruzada] [PubMed] 30. Régnier, CH; Masson, R.; Kedinger, V.; Textoris, J.; Stoll, I.; Chenard, MP-P.; Dierich, A.; Tomasetto, C.; Río, M.-C. Deterioro del cierre del tubo neural, malformaciones del esqueleto axial y ruptura del anillo traqueal en ratones con deficiencia de TRAF4. proc. nacional Academia ciencia EE . UU. 2002, 99, 5585–5590. [Referencia cruzada] 31. Kokubu, C.; Heinzmann, U.; Kokubu, T.; Sakai, N.; Kubota, T.; Kawai, M.; Wahl, MB; Galcerán, J.; Grosschedl, R.; Ozono, K.; et al. Defectos esqueléticos en ratones mutantes Ringelschwanz revelan que se requiere Lrp6 para la somitogénesis y la osteogénesis adecuadas. Desarrollo 2004, 131, 5469–5480. [Referencia cruzada] 32. Lei, Y.; Zhu, H.; Yang, W.; Ross, ME; Shaw, gerente general; Finnell, RH Identificación de nuevas mutaciones CELSR1 en espina bífida. por favor UNO 2014, 9, e92207. [Referencia cruzada] 33. Rocha, PP; Bleiss, W.; Schrewe, H. La expresión en mosaico de Med12 en ratones hembra conduce a exencefalia, espina bífida y Craneorraquisquisis. Res. de defectos de nacimiento Parte Clin. mol. Teratol. 2010, 88, 626–632. [Referencia cruzada] 34. Tian, T.; Cao, X.; Chen, Y.; Jin, L.; Li, Z.; Han, X.; Lin, Y.; Wlodarczyk, BJ; Finnell, RH; Yuan, Z.; et al. Variantes somáticas y de línea germinal de novo de MED en defectos del tubo neural humano. Frente. Desarrollo celular Biol. 2021, 9, 641831. [Referencia cruzada] [PubMed] 35. Sudiwala, S.; Palmer, A.; Massa, V.; quemaduras, AJ; Dunlevy, LPE; de Castro, SCP; Savery, D.; Leung, K.-Y.; Copp, AJ; Greene, NDE Mecanismos celulares que subyacen a los defectos del tubo neural relacionados con Pax3 y su prevención con ácido fólico. Dis. Modelo Mec. 2019, 12, dmm042234. [Referencia cruzada] 36 Palmer, AJ; Savery, D.; Massa, V.; Copp, AJ; Greene, NDE Interacción genética de la mutación Pax3 y la señalización canónica de Wnt Modula los defectos del tubo neural y las anomalías de la cresta neural. Génesis 2021, 59, e23445. [Referencia cruzada] 37. Kibar, Z.; Torbán, E.; McDearmid, JR; Reynolds, A.; Berghout, J.; Mathieu, M.; Kirillova, I.; Marco, PD; Merello, E.; Hayes, JM; et al. Mutaciones en VANGL1 asociadas con defectos del tubo neural. N. ingl. J.Med. 2007, 356, 1432–1437. [Referencia cruzada] [PubMed] Machine Translated by Google J. Dev. Biol. 2022, 10, 22 13 de 17 38. Morrison, K.; Papapetrou, C.; Atwood, J.; Hol, F.; Lynch, SA; Sampath, A.; Hamel, B.; Quemar, J.; Sowden, J.; Stott, D.; et al. Mapeo genético del homólogo humano (T) de T de ratón (Brachyury) y búsqueda de asociación alélica entre T humana y espina bífida. Tararear. mol. Gineta. 1996, 5, 669–674. [Referencia cruzada] 39. Bartsch, O.; Kirmes, I.; Thiede, A.; Lechno, S.; Gocan, H.; Florián, ES; Haaf, T.; Zechner, U.; Sabova, L.; Horn, F. Nuevas mutaciones del gen VANGL1 en 144 pacientes eslovacos, rumanos y alemanes con defectos del tubo neural. mol. sindromol. 2012, 3, 76–81. [Referencia cruzada] 40. Chen, Z.; Lei, Y.; Zheng, Y.; Aguiar-Pulido, V.; Ross, ME; Peng, R.; Jin, L.; Zhang, T.; Finnell, RH; Wang, H. Umbral para el riesgo de defecto del tubo neural por variantes acumuladas de pérdida de función de Singleton. Resolución celular 2018, 28, 1039–1041. [Referencia cruzada] 41. Boyle, EA; Li, YI; Pritchard, JK Una visión ampliada de los rasgos complejos: de poligénicos a omnigénicos. Celda 2017, 169, 1177–1186. [Referencia cruzada] [PubMed] 42. Seo, JH; Zilber, Y.; Babayeva, S.; Liu, J.; Kyriakopoulos, P.; Marco, PD; Merello, E.; Capra, V.; Gros, P.; Torban, E. Las mutaciones en el gen de polaridad de células planas, Fuzzy, están asociadas con defectos del tubo neural en humanos. Tararear. mol. Gineta. 2011, 20, 4324–4333. [Referencia cruzada] 43. Rovin, BH; Lu, L.; Saxena, R. Un nuevo polimorfismo en la región reguladora del gen MCP-1 que influye en la expresión de MCP-1. Bioquímica Biografía. Res. común 1999, 259, 344–348. [Referencia cruzada] 44. Cámaras, CD; Johnson, KA; Dick, LM; Félix, RJ; Jones, KL Fiebre materna y resultado del nacimiento: un estudio prospectivo. Teratología 1998, 58, 251–257. [Referencia cruzada] 45. Jensen, LE; Etheredge, AJ; Marrón, Kansas; Mitchell, LE; Whitehead, AS El genotipo materno para el polimorfismo promotor de la proteína 1 A(-2518)G del quimioatrayente de monocitos está asociado con el riesgo de espina bífida en la descendencia. Soy. J.Med. Gineta. A 2006, 140A, 1114–1118. [Referencia cruzada] 46. Escudos, DC; Ramsbottom, D.; Donoghue, C.; Pinjón, E.; Kirke, PN; Molloy, AM; Edwards, YH; Molinos, JL; Mynett-Johnson, L.; vertedero, DG; et al. Asociación entre frecuencias históricamente altas de defectos del tubo neural y el homólogo T humano de T de ratón (Brachyury). Soy. J.Med. Gineta. 2000, 92, 206–211. [Referencia cruzada] 47. Jensen, LE; Barbaux, S.; Hoess, K.; Fraterman, S.; cabeza blanca, AS; Mitchell, LE El locus T humano y el riesgo de espina bífida. Tararear. Gineta. 2004, 115, 475–482. [Referencia cruzada] 48. Blencowe, H.; Cousens, S.; Modell, B.; Lawn, J. Ácido fólico para reducir la mortalidad neonatal por trastornos del tubo neural. En t. j Epidemiol. 2010, 39, i110–i121. [Referencia cruzada] [PubMed] 49. Rosenthal, J.; Casas, J.; Tarén, D.; Alverson, CJ; Flores, A.; Frias, J. Defectos del tubo neural en América Latina y el impacto de la fortificación: una revisión de la literatura. Salud Pública Nutr. 2014, 17, 537–550. [Referencia cruzada] 50. Brody, LC; Conley, M.; Cox, C.; Kirke, PN; McKeever, parlamentario; Molinos, JL; Molloy, AM; O'Leary, VB; Parle-McDermott, A.; Scott, JM; et al. Un polimorfismo, R653Q, en la enzima trifuncional metilentetrahidrofolato deshidrogenasa/meteniltetrahidrofolato ciclohidrolasa/formiltetrahidrofolato sintetasa es un factor de riesgo genético materno para defectos del tubo neural: Informe del Grupo de investigación de defectos congénitos. Soy. J. Hum. Gineta. 2002, 71, 1207–1215. [Referencia cruzada] [PubMed] 51. de Marco, P.; Merello, E.; Calevo, MG; Mascelli, S.; Raso, A.; Cama, A.; Capra, V. Evaluación de un polimorfismo de metilentetrahidrofolato deshidrogenasa 1958G>A para el riesgo de defectos del tubo neural. J. Hum. Gineta. 2006, 51, 98–103. [Referencia cruzada] [PubMed] 52. Parle-McDermott, A.; Kirke, PN; Molinos, JL; Molloy, AM; Cox, C.; O'Leary, VB; Pangilinan, F.; Conley, M.; Cleary, L.; Brody, LC; et al. Confirmación del polimorfismo R653Q de la enzima trifuncional C1-sintasa como riesgo materno de defectos del tubo neural en la población irlandesa. EUR. J. Hum. Gineta. 2006, 14, 768–772. [Referencia cruzada] 53. Akar, N.; Akar, E.; Deda, G.; Arsan, S. Espina bífida y mutaciones comunes en la ruta del metabolismo de la homocisteína. clin. Gineta. 2000, 57, 230–231. [Referencia cruzada] 54. Doolin, M.-T.; Barbaux, S.; McDonnell, M.; Hoess, K.; cabeza blanca, AS; Mitchell, LE Efectos genéticos maternos, ejercidos por genes involucrados en la remetilación de la homocisteína, influyen en el riesgo de espina bífida. Soy. J. Hum. Gineta. 2002, 71, 1222–1226. [Referencia cruzada] 55. Christensen, B.; cenador, L.; Tran, P.; Leclerc, D.; Sabbaghian, N.; Platt, R.; Gilfix, BM; Rosenblatt, DS; grava, AR; Forbes, P.; et al. Polimorfismos genéticos en metilentetrahidrofolato reductasa y metionina sintasa, niveles de folato en glóbulos rojos y riesgo de defectos del tubo neural. Soy. J.Med. Gineta. 1999, 84, 151–157. [Referencia cruzada] 56. Wilson, A.; Platt, R.; Wu, Q.; Leclerc, D.; Christensen, B.; Yang, H.; grava, AR; Rozen, R. Una variante común de la metionina sintasa reductasa combinada con niveles bajos de cobalamina (vitamina B12) aumenta el riesgo de espina bífida. mol. Gineta. metab. 1999, 67, 317–323. [Referencia cruzada] [PubMed] 57. Lemay, P.; Marco, PD; Traverso, M.; Merello, E.; Dionne-Laporte, A.; Spiegelman, D.; Henrion, É.; Diallo, O.; Audiberto, F.; Michaud, JL; et al. La secuenciación del exoma completo identifica nuevos genes predisponentes en los defectos del tubo neural. mol. Gineta. genoma Medicina. 2018, 7, e00467. [Referencia cruzada] 58. Lemay, P.; Marco, PD; Emond, A.; Spiegelman, D.; Dionne-Laporte, A.; Laurent, S.; Merello, E.; Accogli, A.; Rouleau, Georgia; Capra, V.; et al. Las variantes deletéreas raras en GRHL3 están asociadas con la espina bífida humana. Tararear. Mutat. 2017, 38, 716–724. [Referencia cruzada] [PubMed] 59. Lemay, P.; Guyot, M.-C.; Tremblay, É.; Dionne-Laporte, A.; Spiegelman, D.; Henrion, É.; Diallo, O.; Marco, PD; Merello, E.; Massicotte, C.; et al. Las mutaciones de novo con pérdida de función juegan un papel importante en los defectos graves del tubo neural humano. J.Med. Gineta. 2015, 52, 493. [Referencia cruzada] Machine Translated by Google J. Dev. Biol. 2022, 10, 22 14 de 17 60. Azzarà, A.; Rendeli, C.; Crivello, AM; Brugnoletti, F.; Rumor, R.; Ausilí, E.; Sangiorgi, E.; Gurrieri, F. Identificación de nuevos genes candidatos para la espina bífida a través de la secuenciación del exoma. Nervio del Niño. sist. 2021, 37, 2589–2596. [Referencia cruzada] [PubMed] 61. Lei, Y.; Zhu, H.; Duhon, C.; Yang, W.; Ross, ME; Shaw, gerente general; Finnell, las mutaciones de RH en el gen de polaridad de células planas SCRIB son Asociado a espina bífida. PLoS ONE 2013, 8, e69262. [Referencia cruzada] 62. Lei, Y.; Finnell, RH Nuevas Técnicas para el Estudio de los Defectos del Tubo Neural. Adv. tecnología Biol. Medicina. 2016, 4, 157. [Referencia cruzada] 63. Lei, Y.; Kim, S.; Chen, Z.; Cao, X.; Zhu, H.; Yang, W.; Shaw, gerente general; Zheng, Y.; Zhang, T.; Wang, H.; et al. Variantes identificadas en PTK7 Asociado con defectos del tubo neural. mol. Gineta. genoma Medicina. 2019, 7, e00584. [Referencia cruzada] 64. Robinson, A.; Escuín, S.; Doudney, K.; Vekemans, M.; Stevenson, RE; Greene, ECM; Copp, AJ; Stanier, P. Las mutaciones en los genes de polaridad de células planas CELSR1 y SCRIB están asociadas con el defecto severo del tubo neural craneorraquisquisis. Tararear. Mutat. 2012, 33, 440–447. [Referencia cruzada] [PubMed] 65. Beaumont, M.; Akloul, L.; Carré, W.; Quélín, C.; Diario, H.; Pasquier, L.; Fradín, M.; Odent, S.; Hamdi-Roze, H.; Watrin, E.; et al. La secuenciación de panel dirigida establece la implicación de la vía de polaridad de células planas e involucra a nuevos genes candidatos en trastornos de defectos del tubo neural. Tararear. Gineta. 2019, 138, 363–374. [Referencia cruzada] [PubMed] 66. Hendricks, KA; Nuño, OM; Suárez, L.; Larsen, R. Efectos de la hiperinsulinemia y la obesidad sobre el riesgo de defectos del tubo neural entre los mexicoamericanos. Epidemiología 2001, 12, 630–635. [Referencia cruzada] [PubMed] 67. Anderson, JL; Waller, DK; Canfield, MA; Shaw, gerente general; Watkins, ML; Werler, MM Obesidad materna, diabetes gestacional y defectos congénitos del sistema nervioso central. Epidemiología 2005, 16, 87–92. [Referencia cruzada] [PubMed] 68. Yazdy, MM; Mitchell, AA; Liu, S.; Werler, MM Ingesta glucémica dietética materna durante el embarazo y el riesgo de nacimiento defectos pediatra perinato Epidemiol. 2011, 25, 340–346. [Referencia cruzada] 69. Taylor, R.; Davison, JM Diabetes tipo 1 y embarazo. BMJ 2007, 334, 742. [Referencia cruzada] 70. Evers, IM; de Valk, HW; Visser, GHA Riesgo de complicaciones del embarazo en mujeres con diabetes tipo 1: a nivel nacional Estudio Prospectivo en los Países Bajos. BMJ 2004, 328, 915. [Referencia cruzada] 71. Suárez, L.; Hendricks, K.; Felkner, M.; Gunter, E. Niveles de B12 en suero materno y riesgo de defectos del tubo neural en Texas-México Población Fronteriza. Ana. Epidemiol. 2003, 13, 81–88. [Referencia cruzada] 72. Ray, JG; Blom, HJ Insuficiencia de vitamina B12 y el riesgo de defectos del tubo neural fetal. QJM Int. J.Med. 2003, 96, 289–295. [Referencia cruzada] 73. Vélie, EM; Bloque, G.; Shaw, gerente general; Samuels, SJ; Schaffer, DM; Kulldorff, M. Ingesta materna suplementaria y dietética de zinc y la aparición de defectos del tubo neural en California. Soy. J. Epidemiol. 1999, 150, 605–616. [Referencia cruzada] [PubMed] 74. GRUPO, MVSR Prevención de defectos del tubo neural: resultados del estudio de vitaminas del Consejo de Investigación Médica. lanceta 1991, 338, 131–137. [Referencia cruzada] 75. Schmidt, RJ; Romitti, Pensilvania; quemaduras, TL; Browne, ML; Druschel, CM; Olney, RS; Estudio, NBDP Consumo de Cafeína Materna y riesgo de defectos del tubo neural. Res. de defectos de nacimiento Parte Clin. mol. Teratol. 2009, 85, 879–889. [Referencia cruzada] 76. Grewal, J.; Carmichael, SL; Mac.; Lammer, EJ; Shaw, GM Tabaquismo materno periconcepcional y consumo de alcohol y riesgo de anomalías congénitas seleccionadas. Res. de defectos de nacimiento Parte Clin. mol. Teratol. 2008, 82, 519–526. [Referencia cruzada] 77. Moretti, ME; Bar-Oz, B.; Frito, S.; Koren, G. Hipertermia materna y el riesgo de defectos del tubo neural en la descendencia. Epidemiología 2005, 16, 216–219. [Referencia cruzada] 78. Roberto, E.; Guibaud, P. Ácido valproico materno y defectos congénitos del tubo neural. Lancet 1982, 320, 937. [Referencia cruzada] 79. Jeanette, W. Modo de acción: inhibición de histona desacetilasa, alteración de la expresión génica dependiente de WNT y regulación de Beta-catenina: efectos sobre el desarrollo del ácido valproico. crítico Rev. Toxicol. 2005, 35, 727–738. [Referencia cruzada] 80. Meador, KJ; Baker, Georgia; Finnell, RH; Kalayjian, LA; Liporace, JD; Loring, DW; Mawer, G.; Pennell, PB; Smith, JC; Wolff, MC Exposición intrauterina a fármacos antiepilépticos. Neurología 2006, 67, 407–412. [Referencia cruzada] 81. Weston, J.; Bromley, R.; Jackson, CF; Adab, N.; Clayton-Smith, J.; Greenhalgh, J.; Hounsome, J.; Mc Kay, AJ; Smith, CT; Marson, AG Tratamiento de monoterapia de la epilepsia en el embarazo: resultados de malformaciones congénitas en el niño. Sistema de base de datos Cochrane. Rev. 2016, 11, CD010224. [Referencia cruzada] [PubMed] 82. Sato, K. ¿Por qué el folato es eficaz para prevenir los defectos de cierre del tubo neural? Medicina. Hipótesis. 2020, 134, 109429. [Referencia cruzada] [PubMed] 83. Ichinohe, A.; Kure, S.; Mikawa, S.; Ueki, T.; Kojima, K.; Fujiwara, K.; Iinuma, K.; Matsubara, Y.; Sato, K. Sistema de escisión de glicina en Regiones Neurogénicas. EUR. J. Neurosci. 2004, 19, 2365–2370. [Referencia cruzada] 84. Naderi, N.; House, JD Desarrollos recientes en la nutrición con folato. Adv. Nutrición alimentaria Res. 2018, 83, 195–213. [Referencia cruzada] [PubMed] 85. Beaudin, AE; Stover, PJ Información sobre los mecanismos metabólicos subyacentes a los defectos del tubo neural que responden al folato: una minirevisión. Res. de defectos de nacimiento Parte Clin. mol. Teratol. 2009, 85, 274–284. [Referencia cruzada] 86. Lan, X.; Campo, EM; Stover, PJ Regulación del ciclo celular del metabolismo de un carbono mediado por folato. Wiley Interdiscip. Rev. Sist. Biol. Medicina. 2018, 10, e1426. [Referencia cruzada] 87. Piedrahíta, JA; Oetama, B.; Bennett, GD; van Waes, J.; Kamen, BA; Richardson, J.; Lacey, SO; Anderson, RGW; Finnell, RH Los ratones que carecen de la proteína de unión al ácido fólico Folbp1 son defectuosos en el desarrollo embrionario temprano. Nat. Gineta. 1999, 23, 228–232. [Referencia cruzada] 88. Taparía, S.; Waes, JG; Rosenquist, TH; Finnell, RH Importancia de la homeostasis de folato-homocisteína durante la etapa embrionaria temprana Desarrollo. clin. Laboratorio de química. Medicina. 2007, 45, 1717–1727. [Referencia cruzada] [PubMed] Machine Translated by Google J. Dev. Biol. 2022, 10, 22 15 de 17 89. Zhao, R.; Russell, RG; Wang, Y.; Liu, L.; Gao, F.; Kneitz, B.; Edelmann, W.; Goldman, ID El rescate de la letalidad embrionaria en ratones deficientes en portadores de folato reducidos mediante suplementos de ácido fólico materno revela una falla neonatal temprana de los órganos hematopoyéticos. J. Biol. química 2001, 276, 10224–10228. [Referencia cruzada] [PubMed] 90. Copp, AJ; Stanier, P.; Greene, ND Defectos del tubo neural: avances recientes, preguntas sin resolver y controversias. Lancet Neurol. 2013, 12, 799–810. [Referencia cruzada] 91. Greene, ECM; Stanier, P.; Moore, GE El papel emergente de los mecanismos epigenéticos en la etiología de los defectos del tubo neural. Epigenética 2011, 6, 875–883. [Referencia cruzada] 92. Borgel, J.; Guibert, S.; Li, Y.; Chiba, H.; Schübeler, D.; Sasaki, H.; Forne, T.; Weber, M. Objetivos y dinámica del ADN promotor Metilación durante el desarrollo temprano del ratón. Nat. Gineta. 2010, 42, 1093–1100. [Referencia cruzada] 93. Dunlevy, LPE; Burren, KA; Chitty, LS; Copp, AJ; Greene, NDE El exceso de metionina suprime el ciclo de metilación e inhibe el cierre del tubo neural en embriones de ratón. FEBS Lett. 2006, 580, 2803–2807. [Referencia cruzada] 94. Afman, LA; Blom, HJ; Drittij, M.-J.; Brouns, MR; Straaten, HWM van La inhibición de la transmetilación altera la neurulación en Embriones de pollo. desarrollo Res. cerebral. 2005, 158, 59–65. [Referencia cruzada] [PubMed] 95. Dunlevy, LPE; Burren, KA; Molinos, K.; Chitty, LS; Copp, AJ; Greene, NDE La integridad del ciclo de metilación es esencial para Cierre del tubo neural de los mamíferos. Res. de defectos de nacimiento Parte Clin. mol. Teratol. 2006, 76, 544–552. [Referencia cruzada] 96. Clarke, S.; Banfield, K. S-adenosilmetionina-dependiente de metiltransferasas; Prensa de la Universidad de Cambridge: Cambridge, Reino Unido, 2001; págs. i-xvii. 97. Jacob, S. Metabolismo de la homocisteína. año Rev. Nutr. 1999, 19, 217–246. 98. van der Linden, IJM; Heil, SG; van Egmont Petersen, M.; van Straaten, HW; den Heijer, M.; Blom, HJ Inhibición de la metilación y cambios en la expresión génica en relación con los defectos del tubo neural. Res. de defectos de nacimiento Parte Clin. mol. Teratol. 2008, 82, 676–683. [Referencia cruzada] 99. Toriyama, M.; Toriyama, M.; Wallingford, JB; Finnell, RH La metilación dependiente de folato de septinas gobierna la ciliogénesis durante Cierre del tubo neural. FASEB J. 2017, 31, 3622–3635. [Referencia cruzada] [PubMed] 100. Brouwer, IA; van Düsseldorp, M.; Tomás, CMG; van der Put, Nueva Jersey; Gaytant, MA; Eskes, TKAB; Hautvast, JGAJ; Steegers-Theunissen, RPM Metabolismo de la homocisteína y efectos de la suplementación con ácido fólico en pacientes afectados por espina bífida. Neuropediatría 2000, 31, 298–302. [Referencia cruzada] [PubMed] 101. Kirke, PN; Molinos, JL; Molloy, AM; Brody, LC; O'Leary, VB; Daly, L.; Murray, S.; Conley, M.; Mayne, PD; Smith, O.; et al. Impacto del polimorfismo MTHFR C677T en el riesgo de defectos del tubo neural: estudio de casos y controles. BMJ 2004, 328, 1535. [Referencia cruzada] 102. Bennett, GD; Van Waes, J.; Moser, K.; Chaudoin, T.; Starr, L.; Rosenquist, TH Fracaso de la homocisteína para inducir el tubo neural Defectos en un modelo de ratón. Res. de defectos de nacimiento Desv. parte B reprod. Toxicol. 2006, 77, 89–94. [Referencia cruzada] 103. Greene, Dakota del Norte; Dunlevy, LP; Copp, AJ La homocisteína es embriotóxica pero no causa defectos del tubo neural en embriones de ratón. Anat. Embrión. 2003, 206, 185–191. [Referencia cruzada] 104. Yang, M.; Li, W.; Wan, Z.; Du, Y. Niveles elevados de homocisteína en madres con defectos del tubo neural: una revisión sistemática y Metanálisis. J. Matern. Feto Neonatal Med. 2016, 30, 2051–2057. [Referencia cruzada] [PubMed] 105. Crider, KS; Bailey, LB; Berry, RJ Fortificación de alimentos con ácido fólico: su historia, efecto, preocupaciones y direcciones futuras. Nutrientes 2011, 3, 370–384. [Referencia cruzada] 106. Schorah, C. Dick Smithells, Folic Acid, and the Prevention of Neural Tube Defectos. Res. de defectos de nacimiento Parte Clin. mol. Teratol. 2009, 85, 254–259. [Referencia cruzada] [PubMed] 107. Baya, RJ; Li, Z.; Erickson, JD; Li, S.; Moore, California; Wang, H.; Mulinare, J.; Zhao, P.; Wong, LY; Gindler, J.; et al. Prevención de defectos del tubo neural con ácido fólico en China. Proyecto de colaboración entre China y EE. UU. para la prevención de defectos del tubo neural. N. ingl. j Medicina. 1999, 341, 1485–1490. [Referencia cruzada] 108. Czeizel, AE; Dudas, I.; Paput, L.; Bánhidy, F. Prevención de defectos del tubo neural con ácido fólico periconcepcional, metilfolato, o multivitaminas? Ana. Nutrición metab. 2011, 58, 263–271. [Referencia cruzada] [PubMed] 109. Smithells, RW; Shepard, S.; Schorah, CJ; Vendedor, MJ; Nevin, Carolina del Norte; Harris, R.; Leer AP; Fielding, DW Prevención aparente de los defectos del tubo neural mediante suplementos vitamínicos periconcepcionales. Arco. Dis. Niño. 1981, 56, 911. [Referencia cruzada] 110. Wals, PD; Tairou, F.; Allen, MIV; Uh, S.-H.; Lowry, RB; Sibbald, B.; Evans, JA; den Hof, MCV; Zimmer, P.; Crowley, M.; et al. Reducción de los defectos del tubo neural después de la fortificación con ácido fólico en Canadá. N. ingl. J.Med. 2007, 357, 135–142. [Referencia cruzada] [PubMed] 111. Williams, LJ; Mayo, CT; Edmonds, LD; Shaw, gerente general; Kirby, RS; Hobbs, California; Severo, LE; Miller, LA; Meaney, FJ; Levitt, M. Prevalencia de espina bífida y anencefalia durante la transición a la fortificación obligatoria con ácido fólico en los Estados Unidos. Teratología 2002, 66, 33–39. [Referencia cruzada] 112. Administración, Estándares alimentarios FD: Modificación de los estándares de identidad para productos de granos enriquecidos para requerir la adición de ácido fólico. 1996; págs. 8781–8797. Disponible en línea: https://www.govinfo.gov/app/details/FR-1996-08-05/96-19803 (consultado el 16 de diciembre de 2021). 113. Morris, JK; Addor, M.-C.; Ballardini, E.; Barisic, I.; Barrachina-Bonet, L.; Braz, P.; Cavero-Carbonell, C.; Hond, ED; Garne, E.; Gatt, M.; et al. Prevención de los defectos del tubo neural en Europa: un fracaso de la salud pública. Frente. pediatra 2021, 9, 647038. [Referencia cruzada] 114. Copp, AJ; Adzick, NS; Chitty, LS; Fletcher, JM; Holmbeck, GN; Shaw, GM espina bífida. Nat. Dis. rev. cartillas 2015, 1, 15007. [Referencia cruzada] Machine Translated by Google J. Dev. Biol. 2022, 10, 22 16 de 17 115. Heffez, DS; Aryanpur, J.; Hutchins, GM; Freeman, JM La parálisis asociada con mielomeningocele: clínica y Datos experimentales que implican una lesión prevenible de la médula espinal. Neurocirugía 1990, 26, 987–992. [Referencia cruzada] [PubMed] 116. Heffez, DS; Aryanpur, J.; Rotellini, NA; Hutchins, GM; Freeman, JM Reparación intrauterina de disrafismo experimental creado quirúrgicamente. Neurocirugía 1993, 32, 1005–1010. [Referencia cruzada] 117. Stiefel, D.; Copp, AJ; Meuli, M. Espina bífida fetal en un modelo de ratón: pérdida de la función neural en el útero. J. Neurocirugía. pediatra 2007, 106, 213–221. [Referencia cruzada] [PubMed] 118. Sival, DA; van Weerden, TW; Vles, JSH; Timmer, A.; den Dunnen, WFA; Staal-Schreinemachers, AL; Hoving, EW; Sollie, KM; Kranen-Mastenbroek, VJM; Sauer, PJJ; et al. Pérdida Neonatal de la Función Motora en la Espina Bífida Aperta Humana. Pediatría 2004, 114, 427–434. [Referencia cruzada] 119. Sival, DA; Begeer, JH; Staal-Schreinemachers, AL; Vos-Niël, JME; Beekhuis, JR; Prechtl, HFR Comportamiento motor perinatal y resultado neurológico en la espina bífida Aperta. Hum temprano. desarrollo 1997, 50, 27–37. [Referencia cruzada] 120. Paek, BW; Agricultor, DL; Wilkinson, CC; Albanese, CT; pavo real, W.; Harrison, MR; Jennings, RW La hernia del cerebro posterior se desarrolla en el mielomeningocele creado quirúrgicamente, pero está ausente después de la reparación en los corderos fetales. Soy. J. Obstet. ginecol. 2000, 183, 1119–1123. [Referencia cruzada] 121. Perlman, JM; Wyllie, J.; Kattwinkel, J.; Wyckoff, MH; Aziz, K.; Guinsburg, R.; Kim, H.-S.; Liley, HG; Mildenhall, L.; Simón, WM; et al. Parte 7: Reanimación Neonatal. Circulación 2015, 132, S204–S241. [Referencia cruzada] [PubMed] 122. Wyckoff, MH; Aziz, K.; Escobedo, MB; Kapadia, VS; Kattwinkel, J.; Perlman, JM; Simón, WM; Weiner, GM; Zaichkin, JG Parte 13: Reanimación Neonatal. Circulación 2015, 132, S543–S560. [Referencia cruzada] 123. Rintoul, NE; Sutton, LN; Hubbard, AM; Cohen, B.; Melchionni, J.; Pasquariello, PS; Adzick, NS Una nueva mirada a los mielomeningoceles: nivel funcional, nivel vertebral, derivación y las implicaciones para la intervención fetal. Pediatría 2002, 109, 409–413. [Referencia cruzada] 124. Bauer, SB El manejo del niño mielodisplásico: un cambio de paradigma. Internacional BJU 2003, 92, 23–28. [Referencia cruzada] 125. Streur, CS; Corona, L.; Smith, JE; Lin, M.; Wiener, JS; Wittmann, DA Función sexual de hombres y mujeres con espina bífida: A Revisión de la literatura de alcance. Sexo. Medicina. Rev. 2021, 9, 244–266. [Referencia cruzada] 126. Hughes, TL; Simmons, KL; Tejwani, R.; Barton, KD; Wiener, JS; Purves, JT; Routh, JC Función y Disfunción Sexual en Individuos con espina bífida: una revisión sistemática. Urología 2021, 156, 308–319. [Referencia cruzada] [PubMed] 127. Choi, EK; Kim, SO; Ji, Y.; Lim, S.; Han, SW Función sexual y calidad de vida en mujeres con espina bífida: ¿las mujeres con espina bífida están satisfechas con su actividad sexual? Neurourol. Urodinam. 2018, 37, 1785–1793. [Referencia cruzada] 128. Choi, EK; Ji, Y.; Han, SW Función sexual y calidad de vida en hombres jóvenes con espina bífida: ¿Podrían ser aspectos descuidados? en la práctica clínica? Urología 2017, 108, 225–232. [Referencia cruzada] [PubMed] 129. Hirose, S.; Agricultor, DL; Albanese, CT Cirugía fetal por mielomeningocele. actual Opinión obstetra ginecol. 2001, 13, 215–222. [Referencia cruzada] 130. Coniglio, SJ; Anderson, SM; Ferguson, JE, II. Resultado motor funcional en niños con mielomeningocele: correlación con el nivel anatómico en la ecografía prenatal. desarrollo Medicina. Niño. Neurol. 1996, 38, 675–680. [Referencia cruzada] [PubMed] 131. Bowman, RM; McLone, DG; Subvención, JA; Tomita, T.; Ito, JA Resultados de la espina bífida: una perspectiva de 25 años. pediatra neurocirugía 2001, 34, 114–120. [Referencia cruzada] 132. Dicianno, BE; Karmarkar, A.; Houtrow, A.; Crytzer, TM; Cushanick, KM; McCoy, A.; Wilson, P.; Chinarian, J.; Neufeld, J.; Smith, K.; et al. Factores asociados con los resultados de movilidad en un registro nacional de pacientes con espina bífida. Soy. J. física. Medicina. rehabilitación 2015, 94, 1015–1025. [Referencia cruzada] 133. Sharrard, WJW; Zachary, RB; Lorber, J. 18 Evaluación a largo plazo de un ensayo de cierre inmediato y tardío de espina bífida quística. clin. Orthop. Relativo Res. (1976–2007) 1967, 50, 197–202. [Referencia cruzada] 134. Adzick, NS; Thom, EA; esponja, CY; Brock, JW; Madrigueras, PK; Johnson, parlamentario; Howell, LJ; Farrell, JA; Dabrowiak, ME; Sutton, LN; et al. Un ensayo aleatorizado de reparación prenatal versus posnatal de mielomeningocele. N. ingl. J.Med. 2011, 364, 993–1004. [Referencia cruzada] 135. Sutton, LN; Adzick, NS; Bilaniuk, LT; Johnson, parlamentario; Crombleholme, TM; Flake, AW Mejora en la hernia del cerebro posterior demostrada por imágenes de resonancia magnética fetal en serie después de la cirugía fetal por mielomeningocele. JAMA 1999, 282, 1826–1831. [Referencia cruzada] 136. Adzick, NS; Sutton, LN; Crombleholme, TM; Flake, AW Cirugía fetal exitosa para la espina bífida. Lancet 1998, 352, 1675–1676. [Referencia cruzada] 137. Bruner, JP; Tulipán, N.; Pascual, RL; Boehm, FH; Walsh, WF; Silva, SR; Hernanz-Schulman, M.; Lowe, LH; Reed, GW Cirugía fetal para mielomeningocele y la incidencia de hidrocefalia dependiente de derivación. JAMA 1999, 282, 1819–1825. [Referencia cruzada] [PubMed] 138. Agricultor, DL; Thom, EA; Brock, JW; Madrigueras, PK; Johnson, parlamentario; Howell, LJ; Farrell, JA; Gupta, N.; Adzick, NS; Gestión de los investigadores del estudio de mielomeningocele. Estudio sobre el manejo del mielomeningocele: resultados pediátricos de cohorte completa a los 30 meses . Soy. J. Obstet. ginecol. 2018, 218, 256.e1–256.e13. [Referencia cruzada] 139. Houtrow, AJ; MacPherson, C.; Jackson-Coty, J.; Rivera, M.; Flynn, L.; Madrigueras, PK; Adzick, NS; Fletcher, J.; Gupta, N.; Howell, LJ; et al. Reparación prenatal y funcionamiento físico entre niños con mielomeningocele. JAMA Pediatría. 2021, 175, e205674. [Referencia cruzada] Machine Translated by Google J. Dev. Biol. 2022, 10, 22 17 de 17 140. Lee, D.-H.; Parque, S.; Kim, EY; Kim, S.-K.; Chung, Y.-N.; Cho, B.-K.; Lee, YJ; Lim, J.; Wang, K.-C. Mejora de la capacidad de cierre mediante la inyección intraamniótica de células madre embrionarias humanas en defectos del tubo neural abierto espinal inducidos quirúrgicamente en embriones de pollo. Neurosci. Letón. 2004, 364, 98–100. [Referencia cruzada] 141. Lee, D.-H.; Kim, EY; Parque, S.; Phi, JH; Kim, S.-K.; Cho, B.-K.; Lim, J.; Wang, K.-C. Recierre de defectos del tubo neural abierto espinal inducidos quirúrgicamente mediante la inyección intraamniótica de células madre embrionarias humanas en embriones de pollo 24 horas después de la inducción de la lesión. J. Neurocirugía. pediatra 2006, 105, 127–133. [Referencia cruzada] 142. Lee, D.-H.; Phi, JH; Kim, S.-K.; Cho, B.-K.; Kim, SU; Wang, K.-C. Cierre mejorado de defectos del tubo neural abierto espinal inducidos quirúrgicamente en embriones de pollo mediante la inyección de células madre de médula ósea humana en la cavidad amniótica. Neurocirugía 2010, 67, 129–135. [Referencia cruzada] [PubMed] 143. Fauza, DO; Jennings, RW; Teng, YD; Snyder, EY Entrega de células madre neurales a la médula espinal en un modelo ovino de feto Cirugía de espina bífida. Cirugía 2008, 144, 367–373. [Referencia cruzada] [PubMed] 144. Saadai, P.; Wang, A.; No, YS; Downing, TL; Lofberg, K.; Beattie, MS; Bresnahan, JC; Li, S.; Farmer, DL Células madre de la cresta neural derivadas de células madre pluripotentes inducidas por humanos se integran en la médula espinal lesionada en el modelo de cordero fetal de mielomeningocele. J. Pediatría. Cirugía 2013, 48, 158– 163. [Referencia cruzada] 145. Kajiwara, K.; Tanemoto, T.; Wada, S.; Karibe, J.; Ihara, N.; Ikemoto, Y.; Kawasaki, T.; Oishi, Y.; Samura, O.; Okamura, K.; et al. Modelo de terapia fetal de mielomeningocele con piel tridimensional utilizando células madre pluripotentes inducidas derivadas de células de líquido amniótico . Provenir. Representante celular 2017, 8, 1701–1713. [Referencia cruzada] [PubMed] 146. Abe, Y.; Ochiai, D.; Masuda, H.; Sato, Y.; Otani, T.; Fukutake, M.; Ikenoue, S.; Miyakoshi, K.; Okano, H.; Tanaka, M. La terapia con células madre del líquido amniótico in utero protege contra el mielomeningocele a través de la cobertura de la médula espinal y la secreción del factor de crecimiento de hepatocitos. Provenir. Traducción de celda Medicina. 2019, 8, 1170–1179. [Referencia cruzada] 147. Shieh, HF; Tracy, SA; Hong, Costa Rica; Chalphin, AV; Ahmed, A.; Rohrer, L.; Zurakowski, D.; Fauza, DO Terapia transamniótica con células madre (TRASCET) en un modelo de conejo con espina bífida. J. Pediatría. Cirugía 2019, 54, 293–296. [Referencia cruzada] [PubMed] 148. Li, H.; Gao, F.; Ma, L.; Jiang, J.; Miao, J.; Jiang, M.; Abanico, Y.; Wang, L.; Wu, D.; Liu, B.; et al. Potencial terapéutico del trasplante de células madre mesenquimales (MSC) en el útero en fetos de rata con espina bífida abierta. J. Célula Mol. Medicina. 2012, 16, 1606–1617. [Referencia cruzada] [PubMed] 149. Li, H.; Miao, J.; Zhao, G.; Wu, D.; Liu, B.; Wei, X.; Cao, S.; Gu, H.; Zhang, Y.; Wang, L.; et al. Diferentes Patrones de Expresión de Factores de Crecimiento en Fetos de Rata con Espina Bífida Aperta después de Trasplante de Células Estromales Mesenquimales In Utero. Citoterapia 2014, 16, 319–330. [Referencia cruzada] 150. Wang, A.; Marrón, EG; Lankford, L.; Keller, BA; Pivetti, CD; Sitkin, NA; Beattie, MS; Bresnahan, JC; Farmer, DL Células del estroma mesenquimatoso placentario Rescate deambulación en mielomeningocele ovino. Provenir. Traducción de celda Medicina. 2015, 4, 659–669. [Referencia cruzada] [PubMed] 151. Kabagambe, S.; Keller, B.; Becker, J.; Goodman, L.; Pivetti, C.; Lankford, L.; Chung, K.; Lee, C.; Chen, YJ; Kumar, P.; et al. Las células del estroma mesenquimatoso placentario sembradas en una matriz extracelular de grado clínico mejoran la deambulación en el mielomeningocele ovino. j pediatra Cirugía 2017, 53, 178–182. [Referencia cruzada]



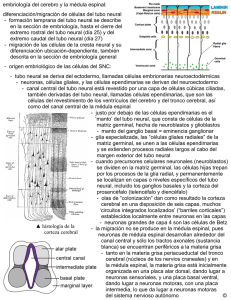

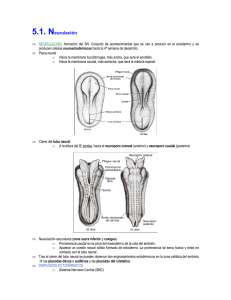


![120 Flujo Luminoso [Lm]: 12450 / 11687 / 10387 Vida Útil [H]](http://s2.studylib.es/store/data/005361285_1-61baece436beb3c64c4dcd17a4d82b1d-300x300.png)