Equilibrio Químico: Práctica de Laboratorio Industrial
Anuncio

INSTITUTO POLITECNICO NACIONAL
UNIDAD PROFESIONAL INTERDISCIPLINARIA DE INGENIERÍA Y CIENCIAS SOCIALES Y ADMINISTRATIVAS
LABORATORIO DE QUÍMICA INDUSTRIAL
Horario: Jueves de 8:00 am a 10:00 a.m.
Practica No.5:
“Equilibrio químico”
Secuencia : 2IM32
Equipo 2:
Integrantes:
Firmas:
o Colín Reveles Pablo
o Escalante Madrigal Fernando
o Gómez Pérez Emiliano
Fecha de realización: 08 de Diciembre del 2022
Fecha de entrega: 15 de Diciembre del 2022
1
ÍNDICE
Objetivos ………………………………………………………………………………………2
Introducción ……………………………………………………………………………………2
Procedimiento………………………………………………………………………………….3
Tabla de reactivos….………………………………………………………………………….3
Datos experimentales………………………………………………………………………….3
Algoritmo de cálculos…………………………………………………………………………..3
Tabla de resultados………………………………………………………………………….…5
Cuestionario…………………………………………………………………………………..…5
Análisis de resultados………………………………………………………………………….6
Conclusiones……………………………………………………………………………………6
Bibliografía...…………………………………………………………………………..………..6
OBJETIVO
1) Medir el grado de acidez o basicidad de soluciones elctrolíticas fuertes y débiles, por medio de un procedimiento
potenciométrico.
2) Calcular el grado de disociociación de un electrólito débil (α), y la constante de ionización (Ka), a partir del pH obtenido
experimentalmente.
3) Conocer la aplicación del efecto del ión común en una solución.
Objetivos partículares: Determinar el pH de distintas sustancias vistas en las reacciones de este desarrollo experimental y conocer sus
aplicaciones en la industria.
INTRODCUCCIÓN
2
PROCEDIMIENTO
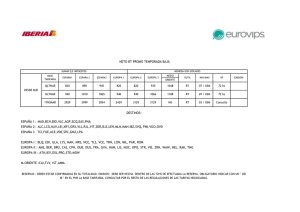
TABLA DE REACTIVOS
Sustancia
HCL
NaOH
Masa molecular (g/mol)
36.5
40
HCl y CH& 𝐶𝑂𝑂𝐻
0.3M, 0.03M y 0.3M
%Peso
36
97
Densidad (g/mL)
1.19
NaOH
0.3M, 0.03M
ALGORITMO DE CÁLCULOS
EJERCICIO 1:
Calcular Co y pH de la base NH2 OH, cuyo 𝐾𝑏 = 1.75𝑥10:; y %𝛼 = 2.6%
𝐶𝑜 =
𝐾𝑏 =
(𝑋)(100) (𝑋)(100)
=
= 38.46𝑋
(%𝛼)
2.6%
(𝑋)(𝑋)
𝑥G
𝑥G
=
=
= 0.0267𝑥
(𝐶𝑜 − 𝑋) (38.46𝑥 − 𝑥) 37.46𝑥
𝑥=
𝐾𝑏
1.75𝑥10:;
=
= 6.55𝑥10:2
0.0267
0.0267
𝑝𝑂𝐻 = − log[𝑥] = − log[6.55𝑥10:2 ] = 3.1837
𝑝𝐻 = 14 − 𝑝𝑂𝐻 = 14 − 3.1837 = 10.8163
𝐶𝑜 = 𝑎𝑋 = 38.46(6.55𝑥10:2 ) = 0.0252
EJERCICIO 2:
Cálculo del pH teórico:
Para el HCL 0.3M y 0.03M
3
𝑝𝐻 = −𝑙𝑜𝑔[𝐻P ] = −𝑙𝑜𝑔[0.3] = 0.5
𝑝𝐻 = −𝑙𝑜𝑔[𝐻P ] = −𝑙𝑜𝑔[0.03] = 1.5
Para NaOH 0.3M y 0.03M
𝑝𝑂𝐻 = −𝑙𝑜𝑔[𝑂𝐻: ] = −𝑙𝑜𝑔[0.3] = 0.5
𝑝𝐻 = 14 − .5 = 13.5
𝑂𝐻 = −𝑙𝑜𝑔[𝑂𝐻: ] = −𝑙𝑜𝑔[0.03] = 1.5
𝑝𝐻 = 14 − 1.5 = 12.5
EJERCICIO 3:
Concentración del HCl:
𝐶Q =
𝑔
𝑔
(10)
428.4 𝐿
𝑚𝑜𝑙
𝑚𝑜𝑙 U
=
𝑔
𝑔 = 11.74 𝐿 = 11.74𝑀
36.5 𝑚𝑜𝑙
36.5 𝑚𝑜𝑙
(36%) R1.19
Despejando 𝐶Q 𝑉Q = 𝐶G 𝑉G
𝑉Q =
𝐶G 𝑉G (0.3𝑀)(0.1𝐿)
=
= 2.555𝑥10:& 𝐿 = 2.555𝑚𝐿
𝐶Q
11.74𝑀
Volumen para HCl 0.03M
𝑉Q =
𝐶G 𝑉G (0.03𝑀)(0.1𝐿)
=
= .01𝐿 = 10𝑚𝐿
𝐶Q
(0.3𝑀)
Masa de NaOH 0.3M
𝑀YZ[\ =
(𝑚𝑎𝑠𝑎YZ[\ )
𝑚𝑜𝑙
𝑔
𝐷𝑒𝑠𝑝𝑒𝑗𝑒; 𝑚𝑎𝑠𝑎YZ[\ = g0.3
U (0.1𝐿) = 1.2𝑔
h R40
(𝑃𝑀)(𝑉_`ab )
𝐿
𝑚𝑜𝑙
100%
𝑚𝑎𝑠𝑎YZ[\ = 1.2𝑔 g
h = 1.237𝑔
97%
Volumen de NaOH 0.03M
𝑉Q =
𝐶G 𝑉G (0.03𝑀)(0.1)
=
= 0.01𝐿
𝐶Q
0.3𝑀
pH para electrolitos débiles
:
P
1 𝐶𝐻& 𝐶𝑂𝑂𝐻(Zi) ↔ 1 𝐶𝐻3 𝐶𝑂𝑂(Zi)
+ 1 𝐻(Zi)
Moles
Iniciales
Reaccionan
Equilibrio
Kamnopqrs = 1.8𝑥10:;
Ácido acético
0.3
X
0.3
𝐾Z =
(𝑥)(𝑥)
(0.3 − 𝑋 )
1.8𝑥10:; =
𝑋G
(0.3 − 𝑋)
Ion acetato
Ion hidronio
X
X
X
X
5.4𝑥10:t − 1.8 𝑥10:; 𝑋 = 𝑋 G
𝑋 G + 1.8𝑥10:; 𝑋 − 5.4𝑥10:t = 0
𝑋 = [𝐻P ] = 5.382𝑥10:&
𝑝𝐻 = −𝑙𝑜𝑔[𝐻P ] = − log[5.382𝑥10:& ] = 2.269
∝=
(𝑋)
5.382𝑥10:&
∗ 100 =
∗ 100 = 1.794%
(𝐶` )
0.3
4
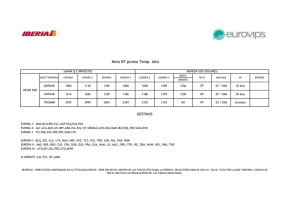
TABLA DE RESULTADOS
Tabla Ejercicio 2
Solución
HCl 0.3M
HCl 0.03M
Tabla Ejercicio 3
pH teórico
0.5
1.5
NaOH 0.3M
NaOH 0.03M
𝐶𝐻& 𝐶𝑂𝑂𝐻
100mL 0.3M
100mL 0.03M
Volumen (mL)
2.555𝑚𝐿
10𝑚𝐿
Masa(g) NaOH 97%
1.237𝑔
0.01𝐿
13.5
12.5
2.269
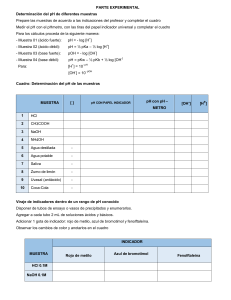
CUESTIONARIO
1) Cálcule el pH que teóricamente espera obtener para cada una de las soluciones.
R= Ver cálculos.
2) Compare el resultado experimental con el dato teórico y explique una razón en caso de existir diferencia entre uno y otro valor.
R= La diferencia que hay entre el dato teórico y el experimental se debe a las cantidades de las sustancias agregadas para
formar las soluciones ya que no sabemos si fueron exactas las medidas o también puede ser debido a una causa en la
comparación al medir el pH en la escala.
3) ¿Cuál es el porcentaje de ionización del ácido acético 0.1 M en el experimento?
R= 𝜶 =
[\ x ]
y.Q
⋅ 100 =
;.&{G|Qy}~
y.Q
⋅ 100 = 0.0538 ⋅ 100 = 5.38%
4) Calcule el valor de la constante Ka experimental para el ácido acético 0.1 M a partir del valor obtenido de su pH.
•;.&{G|Qy}~ ‚
•€
€
R= 𝐾𝑎 = (y.Q:•) = (y.Q:;.&{G|Qy}~ ) =
G.{ƒt;|Qy}„
y.yƒ2t
= 3.0618𝑥10:2
5) Calcule el porcentaje de diferencia entre el valor teórico y el obtenido experimentalmente para Ka.
R= %𝑒 =
Q.{|Qy}„ :&.ytQ{|Qy}…
Q.{|Qy}„
⋅ 100 = 1601%
6) ¿Qué es una solución buffer, tampón o reguladora?
R= Es un sistema de disolución que se caracteriza por mantener contante el pH dentro de ciertos límites.
7) ¿Cómo se prepara y para qué se utiliza?
R= Se prepara con la mezcla de un ácido débil y una sal, esto para mantener un pH ácido, o bien con la mezcla de una base
débil y sal, esto para mantener un pH básico alcalino prestándose el efecto de ión común.
8) Calcule el pH para cada uno de los siguientes casos:
a) Solución 0.2M de KOH 𝐾𝑂𝐾(Zi) → 𝐾(Zi) + 𝑂𝐻(Zi)
𝑝𝑂𝐻 = − log[𝑂𝐻] = − log[0.2] = 0.69
𝑝𝐻 = 14 − 0.69 = 13.31
b) Ver cálculos.
9) ¿Qué volumen de ácido sulfúrico (𝐻G 𝑆𝑂2 ) concentrado de 98% de pureza y densidad 1.84 g/mL se requiere para separar 2 L
de solución con un pH=1.5? Reacción: 𝐻G 𝑆𝑂2 (Zi) → 2𝐻(Zi) + 𝑆𝑂2 (Zi)
R=𝑝𝐻 = − log[𝐻P ]
[𝐻P ] =
1
= 0.0316𝑀
10Q.;
5
98𝑔
𝑚𝐻G 𝑆𝑂2 = 0.0316𝑀 g
h (2𝐿) = 6.1979𝑔
𝑚𝑜𝑙
𝑉\€‰[… =
100
6.1979𝑔 R 98 U
1.84
= 3.85𝑚𝐿
10) ¿Qué importancia tiene desde un punta de vista industrial el estudio del pH? Cite algunos ejemplos específicos.
R= Es de suma importancia, por ejemplo en la industria de petróleo y gas, las mediciones de pH se emplean en una serie de
aplicaciones, para optimizar el proceso de separación empleado en la desalinización y, al mismo tiempo, reducir la probabilidad
de que las aguas residuales presenten oxidación.
ANALISIS DE RESULTADOS
En esta práctica calculamos los pH de las bases y ácidos con los que se experimentaron, teóricamente se obtuvo el pH del Ácido
Clorhídrico y Hidróxido de Sodio a una concentración de 0.3 y 0.03M para las dos sustancias. Fácilmente se observó e que el pH de los
acidos es alrededor de 1-2 dependiendo la concentración y el pH de los baces es mucho mayor. Para poder observar el experimento
con mas detalle falto realizar la comparación experimental, para saber el porcentaje de error que se presenta.
CONCLUSIONES
Los pH obtenidos de los electrolitos fuertes fueron: Ácido Clorhídrico 0.3M-0.5, 0.03-1.5, el volumen que se ocupo fue de 2.55L y 10L.
El Hidroxido de Sodio 0.3 – 13.5, 0.03-12.5 de ph y la masa y volumen utilizados fue de 1.237𝑔 𝑦 0.01𝐿1.237g y 0.01L. El pH de el
electrolito débil fue de 2.269 para el CH3COOHCH3COOH.
BIBLIOGRAFÍA
https://guao.org/sites/default/files/Equilibrio%20i%C3%B3nico%2C%20teor%C3%ADa%20%C3%A1cidobase%2C%20pH%20y%20pO
H.pdf
https://exa.unne.edu.ar/quimica/quimgeneral/temas_parciales/unidad_10_Electroquimica2007.pdf
6