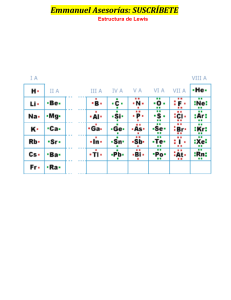
• Es el conjunto de fuerzas que mantienen unidos a los átomos, iones y moléculas cuando se forman distintas agrupaciones estables TIPOS DE ENLACE ENLACE IÓNICO ENLACE COVALENTE NO POLAR POLAR Una teoría de enlace debe explicar… 1. El porqué las moléculas presentan diferentes formas geométricas. 2. Por qué los compuestos poseen fórmulas definidas. 3. Cómo se forman los diferentes enlaces… ELECTRONEGATIVIDAD Capacidad de un átomo para atraer hacia sí los electrones de valencia. Tipos de enlace químicos ENLACE IONICO Es el enlace que se forma por la trasferencia de uno o más electrones de un átomo a otro, al compuesto resultante se le llama iónico. Se presentan entre átomos que poseen baja energía de ionización con elementos de alta afinidad electrónica (un metal y un no metal) Se da por la unión electrostática de iones de carga opuesta. Para determinarlo la diferencia de electronegatividad entre los átomos participantes debe ser mayor a 1.7 ¿Existe enlace iónico entre el litio y el fluor? F= 4 (electronegatividad) Li = 1 (electronegatividad) 4-1 = 3 La diferencia de EN es mayor a 1.7. Entonces si existe Propiedades de los compuestos iónicos • Todos son sólidos a temperatura ambiente. • Tienen elevados puntos de fusión y están por encima de los 350°C. • Ejemplo el cloruro de sodio NaCL se funde a los 801ºC • Son duros pero frágiles • La mayoría son solubles en agua (compuesto polar) e insolubles en disolventes orgánicos como el alcohol (compuestos no polares). • Son buenos conductores de electricidad en disolución y fundidos. Enlace covalente Es un enlace donde dos electrones son compartidos por dos átomos, los compuestos covalentes son formados por este tipo de enlace. El par de electrones se representan con una línea. Cl Cl Represente el siguiente compuesto llamado Metano (CH4)en forma de enlace covalente Electrones de valencia C = 4 e (familia 4A) H = 1 e (familia 1A) Otro ejemplo de enlace covalente Pares no enlazantes = libres Se presenta entre átomos no metálicos, con una alta y parecida afinidad electrónica y EN. Los átomos se unen por medio de un enlace dirigido de un átomo a otro. Para determinarlo la diferencia de electronegatividad entre los átomos participantes debe ser de 0 a 1.7 ¿Se puede formar un enlace covalente para el amoniaco NH3 ? N = 3 (Electronegatividad) H = 2.1 (Electronegatividad) La diferencia de EN es 0.9 Menor a 1.7 R: Si ¿Qué ocurre con la cantidad de electrones en la última capa en los átomos? Estructura de Lewis: • Es la representación de los enlaces mediante puntos y líneas. • Un punto representa un electrón y una línea representa el enlace de dos electrones Regla del octeto de Lewis • La formación de moléculas y compuestos es tal que estos se enlazan de tal manera que tienden a completar 8 electrones en su última capa o nivel de energía para alcanzar la estabilidad (llenar sus subniveles por completo) Represente a través de la estructura de Lewis para el metano (CH4 ) para el sulfuro de hidrógeno (H2S) Propiedades de los compuestos covalentes (moleculares) • A temperatura ambiente incluyen los tres estados. • La mayor parte son solubles en compuestos orgánicos. • No conducen la corriente eléctrica. • La mayoría tienen puntos de fusión bajo los 350 °C • Casi todos son combustibles e inflamables. • Los sólidos son suaves y cristalinos. Tipos de enlace covalente • Por número de enlace • Simple Múltiples • Doble • Triple Por polaridad • No polar o puro: Se presenta en elementos de igual electronegatividad. En este caso los electrones están igualmente compartidos por los dos átomos. Como ejemplo se encuentran: H2 , Cl2 , O2 , N2 , F2 y otras moléculas diatómicas. Estas moléculas son de carácter no polar; no hay • Enlace polar: se presenta entre átomos de diferente electronegatividad, el enlace resultante es polar. Si la diferencia de electronegatividad es alta el enlace es de tipo iónico. El carbono y el oxígeno presentan diferente electronegatividad la cual no es marcada ya que ambos son no metales, esto permite que se forme un enlace covalente polar. Energía de enlace y longitud de enlace • Energía: energía que se libera al disociarse un enlace. • Longitud: distancia que existe entre dos átomos. Coordinado o dativo • Cuando el par de electrones compartidos pertenece solo a uno de los átomos se presenta un enlace covalente coordinado o dativo. El átomo que aporta el par de electrones se llama donador y el que los recibe receptor o aceptor.