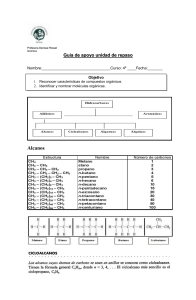
AREA: CIENCIA Y TECNOLOGIA. DOCENTE: ANAHI MARIBEL MORENO GARCIA. CICLO Y GRADO: VII – 3°A-B FICHA VIRTUAL: “RECONOCIENDO LOS ALCANOS” PROPÓSITO Identifican las características, propiedades y fórmulas de los alcanos mediante una batería de ejercicios. INDICACIONES: Recuerda enviar la resolución de la ficha a través de la plataforma IDUKAY, para ser evaluada. ACTIVIDADES PREVIAS: https://www.youtube.com/watch?v=GgUPT2lu6W4 https://www.youtube.com/watch?v=rckV-kI17Cw https://www.youtube.com/watch?v=yzKev2SWIpY https://www.youtube.com/watch?v=3TmTDYyQBjo ELABORAN BATERIA DE EJERCICIOS. FICHA INFORMATIVA: LOS ALCANOS Los alcanos son compuestos orgánicos que consisten completamente en átomos de carbono e hidrógeno unidos por enlaces simples y carecen de otros grupos funcionales. Los alcanos tienen la fórmula general Cn H2n + 2 y pueden subdividirse en los siguientes tres grupos: -Alcanos lineales o de cadena lineal -Alcanos ramificados -Cicloalcanos Los alcanos también son hidrocarburos saturados y son la especie de hidrocarburos más simple y menos reactiva. Son comercialmente muy importantes, siendo el principal constituyente de la gasolina y los aceites lubricantes y se emplean en gran medida en la química orgánica; aunque el papel de los alcanos puros (como los hexanos) se delega principalmente a los solventes. La característica distintiva de un alcano, que lo distingue de otros compuestos que también contienen exclusivamente carbono e hidrógeno, es su falta de insaturación. Es decir, no contiene enlaces dobles o triples, que son altamente reactivos en química orgánica. Aunque no están totalmente desprovistos de reactividad, su falta de esta, en la mayoría de las condiciones de laboratorio los convierte en un componente relativamente poco interesante, aunque muy importante de la química orgánica. La energía confinada dentro del enlace carbono- carbono y el enlace carbono-hidrógeno es bastante alta y su rápida oxidación produce una gran cantidad de calor, generalmente en forma de fuego. NOMENCLATURA. Ya sea que los carbonos estén o no unidos entre sí de extremo a extremo en un anillo (llamados alcanos cíclicos o cicloalcanos) o si contienen cadenas laterales y ramas, el nombre de cada cadena de carbono-hidrógeno que carezca de dobles enlaces o grupos funcionales terminará con el sufijo -ano. Los alcanos con cadenas de carbono no ramificadas se denominan simplemente por el número de carbonos en la cadena. Los primeros cuatro miembros de la serie (en términos de número de átomos de carbono) se nombran de la siguiente manera: CH4 = metano = 1 carbono saturado de hidrógeno C2H6 = etano = 2 carbonos saturados de hidrógeno C3H8 = propano = 3 carbonos saturados de hidrógeno C4H10 = butano = 4 carbonos saturados de hidrógeno Los alcanos con cinco o más átomos de carbono se nombran agregando el sufijo -ano al multiplicador numérico apropiado, excepto que el terminal -a se elimina del término numérico básico. Por lo tanto, C5H12 se llama pentano, C6H14 se llama hexano, C7H16 se llama heptano y así sucesivamente. Los alcanos de cadena recta a veces se indican con el prefijo n- (para normal) para distinguirlos de los alcanos de cadena ramificada que tienen el mismo número de átomos de carbono. Aunque esto no es estrictamente necesario, el uso todavía es común en los casos en que existe una diferencia importante en las propiedades entre los isómeros de cadena lineal y de cadena ramificada: por ejemplo, El n-hexano es una neurotoxina, mientras que sus isómeros de cadena ramificada no lo son. PROPIEDADES FÍSICAS. Los alcanos no son muy reactivos y tienen poca actividad biológica; todos los alcanos son incoloros e inodoros. El Punto de Ebullición Los cicloalcanos tienen puntos de ebullición que son aproximadamente 20 K más altos que el correspondiente alcano de cadena lineal. No hay una diferencia de electronegatividad significativa entre el carbono y el hidrógeno, por lo tanto, no hay una polaridad de enlace significativa. Las moléculas en sí también tienen muy poca polaridad. Una molécula totalmente simétrica como el metano es completamente no polar, lo que significa que las únicas atracciones entre una molécula y sus vecinas serán las fuerzas de dispersión de Van der Waals. Estas fuerzas serán muy pequeñas para una molécula como el metano, pero aumentarán a medida que las moléculas crezcan. Por lo tanto, los puntos de ebullición de los alcanos aumentan con el tamaño molecular. Cuando hay isómeros, cuanto más ramificada está la cadena, más bajo suele ser el punto de ebullición. Las fuerzas de dispersión de Van der Waals son más pequeñas para las moléculas más cortas y solo operan en distancias muy cortas entre una molécula y sus vecinas. Es más difícil que las moléculas cortas y gruesas (con muchas ramificaciones) se encuentren tan juntas como las moléculas largas y delgadas. Solubilidad Los alcanos (tanto los alcanos como los cicloalcanos) son prácticamente insolubles en agua, pero se disuelven en disolventes orgánicos. Sin embargo, los alcanos líquidos son buenos disolventes para muchos otros compuestos orgánicos no iónicos. Solubilidad en agua Cuando una sustancia molecular se disuelve en agua, debe ocurrir lo siguiente: Romper las fuerzas intermoleculares dentro de la sustancia. En el caso de los alcanos, estas son las fuerzas de dispersión de Van der Waals. Rompe las fuerzas intermoleculares en el agua para que la sustancia pueda encajar entre las moléculas de agua. En el agua, las principales atracciones intermoleculares son los enlaces de hidrógeno. Romper cualquiera de estas atracciones requiere energía, aunque la cantidad de energía para romper las fuerzas de dispersión de Van der Waals en algo como el metano es relativamente insignificante; esto no es cierto de los enlaces de hidrógeno en el agua. Como una especie de simplificación, una sustancia se disolverá si se libera suficiente energía cuando se hacen nuevos enlaces entre la sustancia y el agua para compensar lo que se usa para romper las atracciones originales. Las únicas atracciones nuevas entre el alcano y las moléculas de agua son las fuerzas de Van der Waals. Estas fuerzas no liberan una cantidad suficiente de energía para compensar la energía requerida para romper los enlaces de hidrógeno en el agua; El alcano no se disuelve. La descripción solo de energía de la solvatación es una simplificación excesiva porque los efectos entrópicos también son importantes cuando las cosas se disuelven. Solubilidad en disolventes orgánicos. En la mayoría de los solventes orgánicos, las principales fuerzas de atracción entre las moléculas del solvente son Van der Waals, ya sea fuerzas de dispersión o atracciones dipolodipolo. Por lo tanto, cuando un alcano se disuelve en un disolvente orgánico, las fuerzas de Van der Waals se rompen y son reemplazadas por las nuevas fuerzas de Van der Waals. Los dos procesos se cancelan más o menos energéticamente; Por lo tanto, no hay barrera a la solubilidad. EJERCICIOS 1.- ¿Cuál de los siguientes compuestos (formulas globales) no son alcanos? a) C5H9 b) C4H10 c) C3H8 c) C1H2 d) C7H16 e) C10H24 2.- Efectuar la nomenclatura de los siguientes alcanos: a) 2 – metilbutano b) 2,3 – dimetilhexano c) 3,3, – dimetilpentano d) 3 – etilheptano e) 2 metil, 3 etil - nonano